不同楸树品种对茎腐病的抗性差异研究


收稿日期Received:2022-03-06""" 修回日期Accepted:2022-04-19
基金项目:江苏省农业科技自主创新资金项目(CX(19)2038); 江苏省林业科技创新与推广项目(LYKJ(20019)05)。
第一作者:祝艳艳(3151680171@qq.com)。
*通信作者:王良桂(wlg@njfu.com.cn),教授。
引文格式:
祝艳艳,贾瑞瑞,付钰,等. 不同楸树品种对茎腐病的抗性差异研究. 南京林业大学学报(自然科学版),2024,48(2):155-165.
ZHU Y Y,JIA R R,FU Y, et al. Differences in resistance of Catalpa bungei cultivars to stem rot. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(2):155-165.
DOI:10.12302/j.issn.1000-2006.202203017.
摘要:【目的】探究不同品种和不同繁殖方式楸树(Catalpa bungei)苗对烟草疫霉(Phytophthora nicotianae)(菌株QS.1)侵染的抗性差异,为楸树引种栽培、抗病育种提供依据。【方法】以‘洛楸1号’组培苗(LQ-Z)、‘金丝楸’(JSQ)、‘楸杂1号’(QZ)、‘豫楸1号’(YQ)的1年生组培苗,以及‘洛楸1号’扦插苗(LQ-Q)、‘楸树5-8’(Q5-8)、‘楸树8-1’(Q8-1)的1年生扦插苗,6个生产上推广的楸树品种为试验材料,用烟草疫霉(菌株QS.1)进行侵染,测定楸树相关渗透物质含量、保护酶活性和光合气体参数等变化,分析不同处理楸树幼苗感染烟草疫霉(菌株QS.1)后的生理指标变化。【结果】菌株QS.1侵染后2~4 d,供试的各楸树品种均感病。楸树品种组培苗中,‘楸杂1号’和‘豫楸1号’对菌株QS.1侵染的抗性最弱,‘金丝楸’的抗病力最强;楸树品种扦插苗中,‘楸树5-8’和‘楸树8-1’对菌株QS.1侵染抗性较强;‘洛楸1号’扦插苗抗病性大于组培苗,除‘金丝楸’外,楸树品种的扦插苗较组培苗具有更高的抗性。【结论】不同楸树品种在接菌后感染致病存在差异,不同楸树品种的抗烟草疫霉(菌株QS.1)致病能力与光合性能的维持及防御相关酶活性的调节有关。
关键词:楸树品种;烟草疫霉(菌株QS.1);抗性差异;生理指标;繁殖方式
中图分类号:S763.7""""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)02-0155-11
Differences in resistance of" Catalpa bungei cultivars to stem rot
ZHU Yanyan,JIA Ruirui,FU Yu,CHANG Lin,YUE Yuanzheng,YANG Xiulian,WANG Lianggui*
(College of Landscape Architecture, Nanjing Forestry University,Jiangsu Provincial Key Laboratory of Landscape Architecture,Nanjing 210037,China)
Abstract: 【Objective】 To investigate the differences in resistance to Phytophthora nicotianae (strain QS.1) infestation by Catalpa bungei cultivars and breeding methods, providing basis for C. bungei introduction and cultivation and disease resistance breeding. 【Method】 The annual seedlings of ‘Jinsiqiu’ (JSQ),‘Qiuza 1 hao’ (QZ),‘Yuqiu 1 hao’ (YQ),‘Luoqiu 1 hao’ (LQ-Z)tissue cultured seedlings,and" cutting seedling‘Luoqiu 1 hao’(LQ-Q),‘Qiu5-8’(Q5-8), ‘Qiu 8-1’(Q8-1),six C. bungei cultivars were used as experimental materials and infested with P. nicotianae strain QS.1 to determine relevant osmotic substance content,protective enzyme activity and photosynthetic gas parameters. 【Result】 After infection 2-4 d by strain QS.1,all C. bungei cultivars tested were susceptible to the disease and in the case of seedlings ‘Qiuza 1 hao’ and ‘Yuqiu 1 hao’ had the weakest resistance to the disease caused by the strain QS.1,while ‘Jinsiqiu’ had the strongest resistance to the disease; as far as the cuttings of C. bungei cultivars were concerned,Q5-8 and Q8-1 were more resistant to the infection of strain QS.1; ‘Luoqiu 1 hao’ cuttings were more resistant to the disease than the histoculture seedlings,and the cuttings of other species had stronger resistance to QS.1 infection than the histoculture seedlings,except for‘JSQ’.【Conclusion】There were differences in infection pathogenesis among different C. bungei cultivars after inoculation. The pathogenic ability of different C. bungei cultivars against P. nicotianae strain QS.1 is related to the maintenance of photosynthetic performance and the regulation of defense-related enzyme activities.
Keywords:Catalpa bungei cultivars; Phtophthora nicotianae (strain QS.1); resistance difference; physiological index;propagation method
楸树(Catalpa bungei)原产于我国,是珍贵用材树种,其树姿俊秀,主干笔直,花多盖冠,材性优良,是优良的用材树和园林绿化观赏树种。近年来,楸树的繁殖栽培日益扩大,栽培中发现部分楸树出现不明原因的全树枯死,Chang等从感病植株和根际土壤中鉴定出病原为烟草疫霉(Phtophthora nicotianae)菌株QS.1。烟草疫霉可以感染90个科的255种植物,具有广泛的寄主范围,在各种作物中引起严重的疾病,如烟草黑胫病、柑橘流胶病、樱桃茎腐病等,造成严重的经济损失。烟草疫霉是一种典型的土传病原菌,由于长期存活的休眠结构和隐藏的初始感染部位,很难预防。
烟草疫霉菌株QS.1能够引起楸树茎部溃疡,典型的感病症状包括在茎干上形成大小不等的深褐色不规则凹陷溃疡。感病部位的茎干韧皮部和木质部呈深棕色,木质部的坏死比韧皮部大,病变茎的横截面部分坏死从而影响楸树苗木的质量。随着楸树栽植面积和栽植量的增加,茎腐病对楸树生长存在潜在威胁,影响楸树产业的发展。因此,本研究以生产上推广的6个楸树品种的1年生苗为试材,接种烟草疫霉菌株QS.1,通过生理指标和植株表观形态,分析不同品种和不同繁殖方式的楸树幼苗对烟草疫霉菌株QS.1的抗病性差异,筛选出抗病性强的品种,为楸树引种栽培、抗病育种提供理论依据。
1" 材料与方法
1.1" 试验材料
供试菌株:烟草疫霉(P. nicotianae),菌株QS.1,由本课题组分离纯化并保存。
供试楸树品种:‘洛楸1号’组培苗(LQ-Z)、‘金丝楸’(JSQ)、‘楸杂1号’(QZ)、‘豫楸1号’(YQ)4种1年生组培苗各30棵,由河南省农业科学院提供;‘洛楸1号’扦插苗(LQ-Q)、‘楸树5-8’(Q5-8)、‘楸树8-1’(Q8-1)3种1年生扦插苗各30棵,由江苏滨淮农场提供。所有苗木盆栽培养,常规管理。
1.2" 菌株制备及接种
试验于2021年8月在南京林业大学园林试验示范中心进行。选取健康、长势一致的楸树品种,接种时,预先用体积分数75%酒精擦洗要接种的茎段部位、无菌水冲洗,然后用灭菌冲头(直径4 mm)去除茎皮后,将分离物预先定殖QS.1菌株的琼脂块(直径4 mm)接种到茎上,菌丝体面向木质部,每株2个接种点,间隔10 cm左右,并用封口膜包裹接种点。试验采用空白无菌琼脂(PDA)培养基接种作为对照。每个品种空白对照接种5株,共计35株;接种菌株QS.1处理时,每个楸树品种接种25株,共计175株。
1.3" 样品采集
菌株接种后的第4、7、14天观察茎干发病情况,用游标卡尺测定病斑长度,进行病害分级及病情指数的计算;在接种后的第0、2、4、6、8、14天,选取感病楸树幼苗自顶部向下的第3~4片成熟叶,洗净晾干,剪去叶柄,将叶片剪成约1.0 cm×1.5 cm大小,分别迅速称质量后放入超低温冰箱冷冻保存备用,用于测定防御酶活性和其他生理指标。每个品种每次各取1株,作为3个生物学重复。
1.4" 测试方法
1.4.1" 发病率及病情指数
以发病最严重的‘楸杂1号’(QZ)和‘豫楸1号’(YQ)及接无菌琼脂块的对照组作为参考,确定病害分级标准。0、1、2、3、4分别代表明显症状、病斑长度(1.0,3.0〗cm、病斑长度(3.0,6.0〗 cm、病斑长度(6.0,9.0〗 cm、病斑长度gt;9.0 cm。根据感病指数的计算结果并结合病斑的扩张大小,将抗病品种等级划分为:感病指数为高抗;感病指数(30,50〗为中抗;感病指数(50,60〗为中感;感病指数gt;60为高感。发病率及感病指数计算公式如下:
p=m/n1×100%;
r=∑(ma×a)/(n2×t)×100%。
式中:p为发病率;m为发病植株数;n1为调查总株数;r为感病指数;ma为各病级株数;a为该级代表数值;n2为接种总株数;t为最高发病等级。
1.4.2" 防御酶和其他生理指标测定方法
电导率(REC)采用电导率仪法测定,脯氨酸(Pro)含量测定采用酸性茚三酮法,可溶性糖(SS)含量测定采用蒽酮比色法,可溶性蛋白(SP)测定采用考马斯亮蓝法,超氧化物歧化酶(SOD)活性测定采用氮蓝四唑还原法,过氧化物酶(POD)活性测定采用愈创木酚法,过氧化氢酶(CAT)活性测定采用过氧化氢法。
1.4.3" 光合参数测定方法
采用CIRAS-3便携式光合仪,在上午9:00—11:00设定有效光辐射为1 200 μmol/(m2·s),CO2摩尔分数380~420 mol/mol,叶室温度25 ℃、湿度为80%。选取每株接菌处理幼苗自顶部向下第3~4片的成熟叶,测定接菌后第0、2、8、14天的叶片净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)和叶绿素a、b含量等参数,光和色素测定采用丙酮-乙醇浸取法。
1.5" 数据处理
采用Microsoft Excel 2010和SPSS 26.0进行统计分析,采用Duncan法进行差异显著性分析。
2" 结果与分析
2.1" 接菌后楸树品种发病率和病情指数
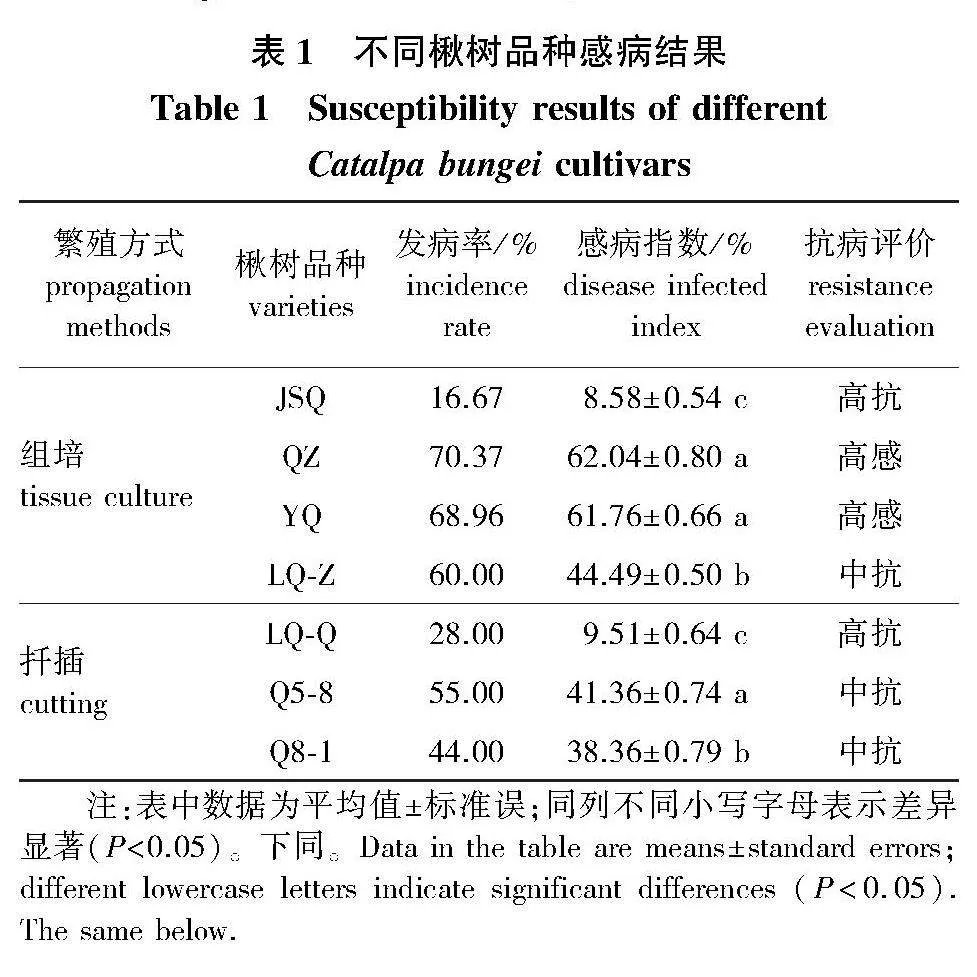
供试的各楸树品种接种烟草疫霉菌株QS.1后均感病,不同品种的楸树均出现褐色病斑,而对照不发病(图1)。在接种2~3 d后,楸树茎干出现褐色病斑,叶子依旧保持新鲜绿色,接菌6 d后部分品种叶片开始萎蔫。JSQ和LQ-Q在接种后4 d出现轻微褐色病斑,其他品种在接种后2 d发病;所有供试品种在接种后第14天病斑停止扩展。楸树品种组培苗中,QZ和YQ的发病率较高,病情指数达60以上;LQ-Z,JSQ的发病率较低,病情指数为8.58%;楸树品种扦插苗中,Q5-8、Q8-1较LQ-Q病斑扩展更大,LQ-Q的发病率最低,病情指数为9.51%(表1),对照未发病。根据抗病等级划分标准,结合感病指数,将供试楸树品种划分为3个抗性级别,楸树组培苗中JSQ为高抗品种,LQ-Z为中抗品种,QZ、YQ为高感品种;楸树扦插苗中LQ-Q为高抗品种,Q5-8和Q8-1为中抗品种。
2.2" 菌株QS.1对不同楸树品种电导率和渗透调节物质的影响
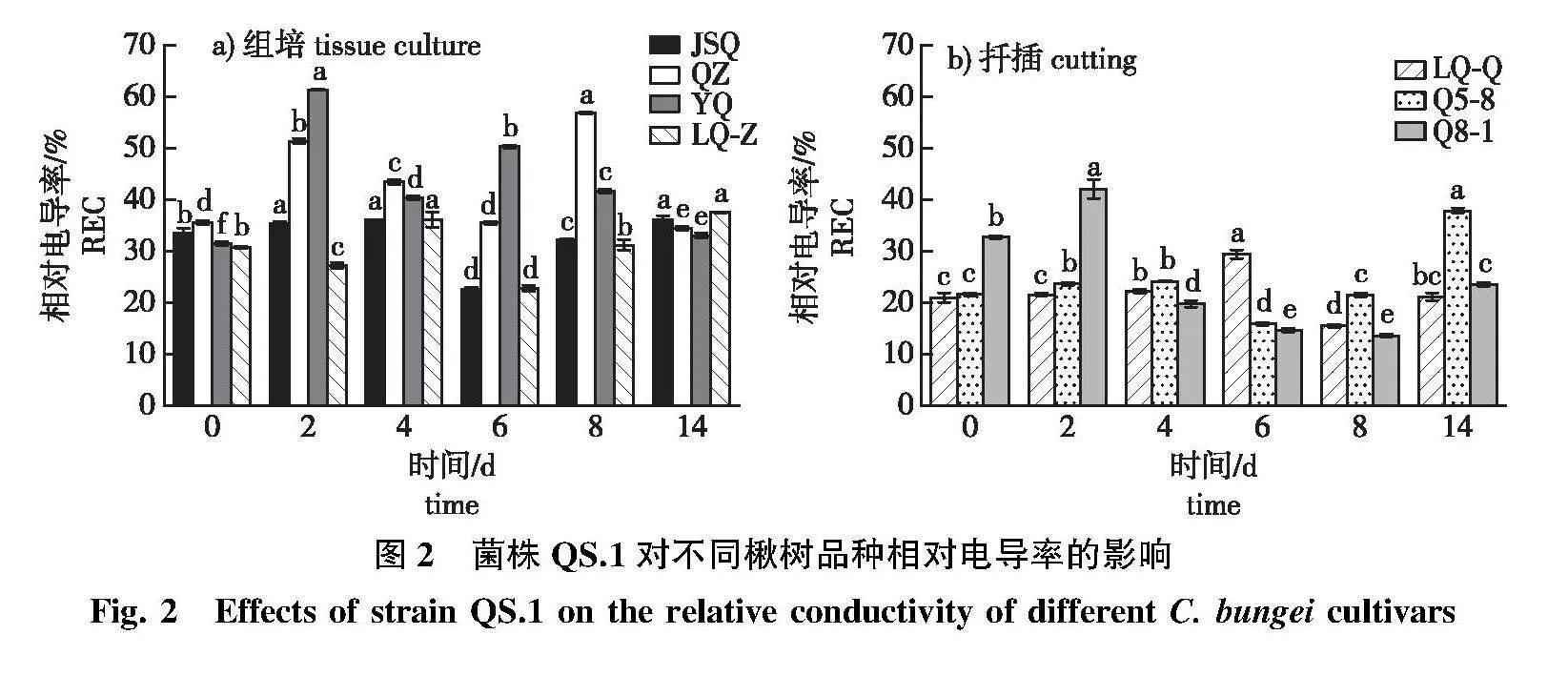
2.2.1" 电导率变化
组培苗感病品种QZ和YQ的相对电导率均呈升—降—升—降波动变化的趋势(图2a),峰值与对照相比显著上升60.28%、94.92%。抗病品种JSQ、LQ-Z的相对电导率在接菌2、4、6、8 d后均低于感病品种。
扦插苗LQ-Q、Q5-8、Q8-1的相对电导率呈先上升后下降再上升的变化(图2b)。LQ-Q在感病前期相对电导率变化不显著,第6天达到峰值,较对照显著增加40.37%;中抗品种Q5-8在接菌前期相对电导率上升较慢,在接菌后第14天较对照显著上升74.60%;Q8-1在接菌后第2天,较对照显著上升,感病后期显著低于对照。
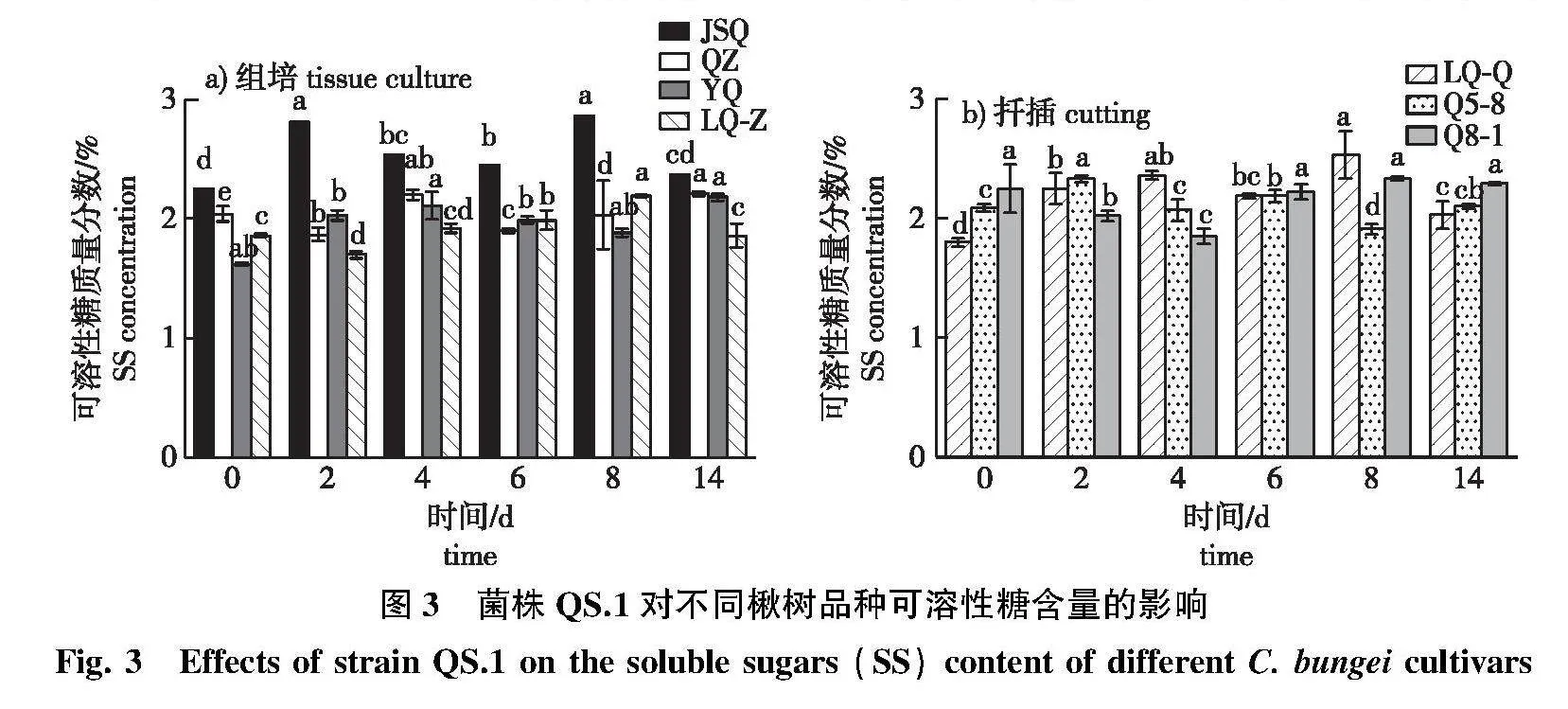
2.2.2" 可溶性糖含量变化
接菌后不同楸树品种的可溶性糖(SS)含量整体呈波动升降。抗病品种JSQ的可溶性糖含量在接菌后第2、8天的峰值,显著高于对照;感病品种YQ的可溶性糖含量变化较对照差异不显著,LQ-Z接菌后第2天与感病后期可溶性糖含量变化差异显著。抗病品种JSQ在各个时期的可溶性糖含量均高于感病品种QZ、YQ和LQ-Z(图3a)。
LQ-Q在接菌后第8天可溶性糖含量达到峰值,较对照显著上升;中抗品种Q5-8接菌后第2天达到峰值,较对照上升11.48%,在感病后期呈下降趋势。中抗品种Q8-1的可溶性糖含量接菌后呈先下降后上升变化,在第4天降到最低值,感病后期变化不显著(图3b)。
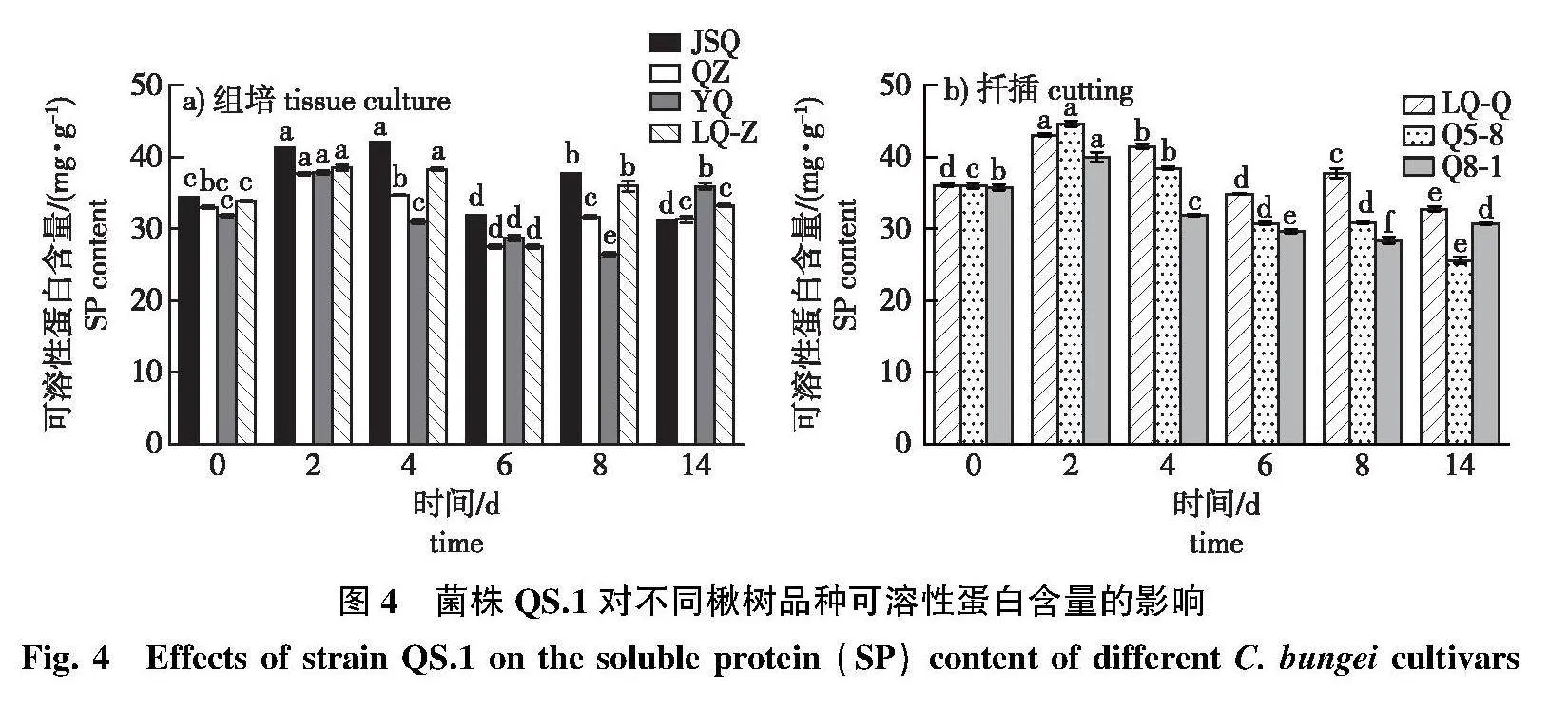
2.2.3" 可溶蛋白含量变化
在接菌后QZ和YQ的可溶性蛋白(SP)含量均呈先上升后下降再上升变化,而其余品种的组培苗呈波动性变化(图4a)。抗病品种JSQ的可溶性蛋白含量在感病前期保持在较高含量,较对照显著上升22%;感病品种QZ、YQ在接菌后第2天较对照上升幅度低于JSQ;接菌后第14天,感病品种QZ与对照差异不显著,而YQ显著高于对照。
由图4b可见,感病前期,中抗品种Q5-8、Q8-1和高抗品种LQ-Q较对照的可溶性蛋白含量增加显著;在感病后期,中抗品种Q5-8的可溶性蛋白含量迅速下降,LQ-Q和中抗品种Q8-1的可溶性蛋白含量的降幅低于Q5-8。
2.2.4" 脯氨酸含量变化
在病菌胁迫时间水平上,QZ和YQ的脯氨酸(Pro)含量呈升—降—升变化,JSQ呈波动性变化(图5a)。在接菌后第2天,抗病品种JSQ脯氨酸含量达到峰值,较对照迅速上升1.47倍;感病品种QZ和YQ在接菌后第4天的峰值高于JSQ。LQ-Z的脯氨酸含量在接菌后第8天达到峰值后,第14天迅速下降38.27%。
LQ-Q和中抗品种Q5-8的脯氨酸含量在接菌后第4天达到峰值,分别较对照上升3.19和3.70倍;接菌后第6天,中抗品种Q8-1的脯氨酸含量达到峰值,较对照上升2.80倍,LQ-Q和中抗品种Q5-8的峰值高于Q8-1(图5b)。
2.3" 菌株QS.1对不同楸树品种防御酶活性的影响
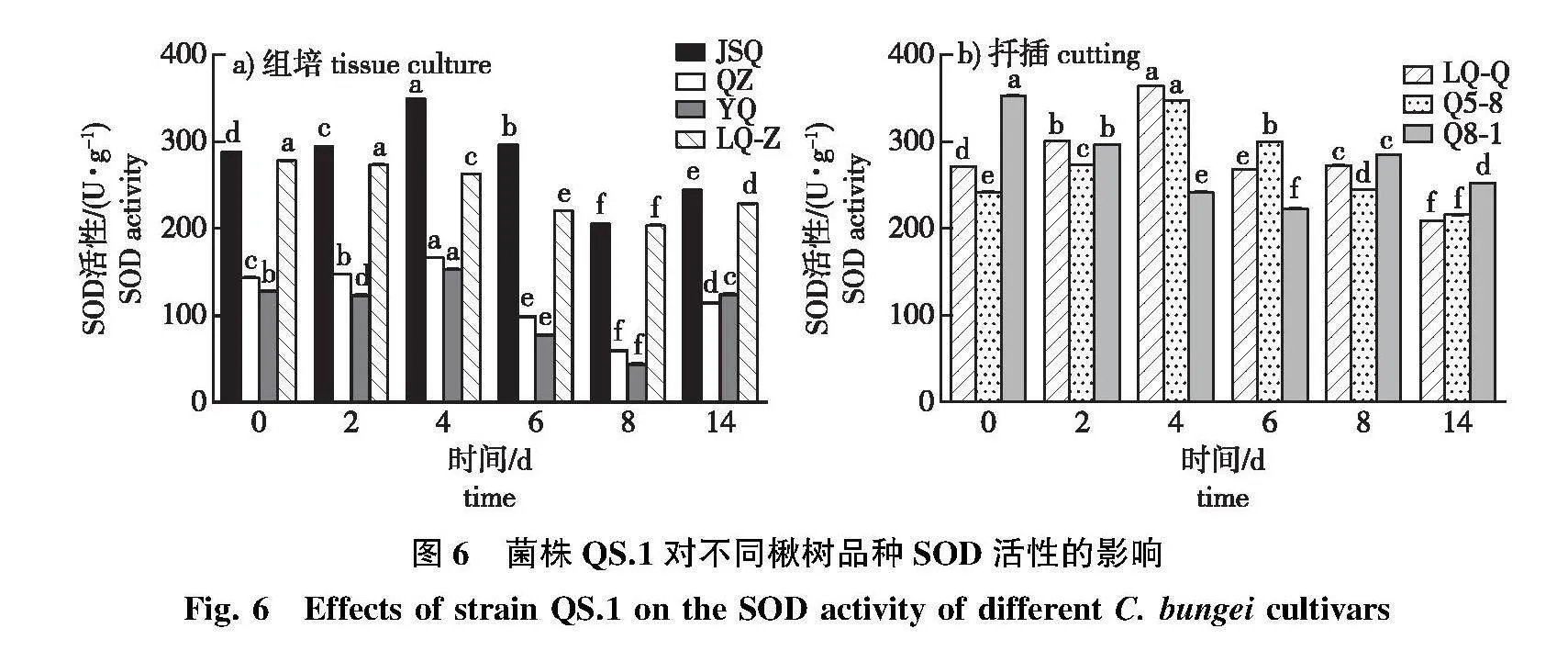
2.3.1" SOD活性变化
接种菌株QS.1后,JSQ、QZ和YQ的SOD活性呈先上升后下降再上升变化(图6a),抗病品种JSQ在接菌第4天后达到峰值,增幅为21.42%,感病品种QZ和YQ在接菌后第4天的峰值显著低于抗病品种JSQ;LQ-Z在感病期间SOD活性变化幅度较小,没有明显的峰值。
Q5-8和LQ-Q在受到病菌侵染后SOD的活性呈先上升后下降的变化趋势(图6b),LQ-Q和Q5-8的SOD活性在第4天达到峰值,Q5-8的SOD活性较对照显著上升43.85%。中抗品种Q8-1的SOD活性在接菌后显著低于对照,呈下降趋势。
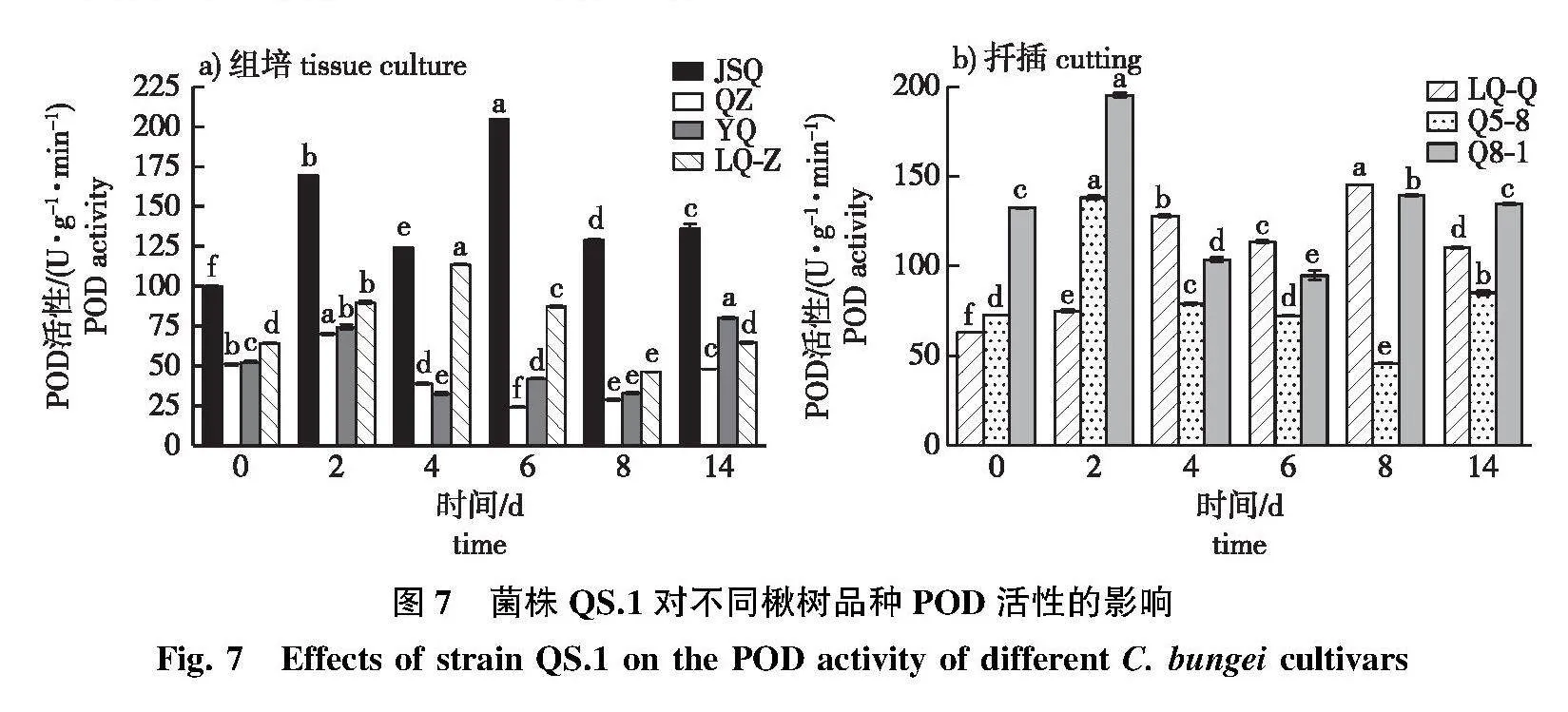
2.3.2" POD活性变化
不同楸树品种POD活性与对照相比均有显著变化。高抗品种JSQ接种后酶活性升高速度快,有2个酶活性高峰,第2个酶活峰值比第1个峰值高出20.71%。感病品种QZ和YQ只有1个的酶活性高峰,增幅小于JSQ;LQ-Z在接菌后POD活性在第4天达到峰值,感病后期下降,在接菌第14天的SOD活性与对照差异不显著(图7a)。
LQ-Q在感病后POD活性整体呈上升趋势,第8天的POD酶活性与对照相比增加1.3倍,酶活性峰值维持时间较长(图7b),感病后期POD活性下降;在接菌后后第14天除中抗品种Q8-1外,Q5-8和LQ-Q的POD活性显著高于对照。
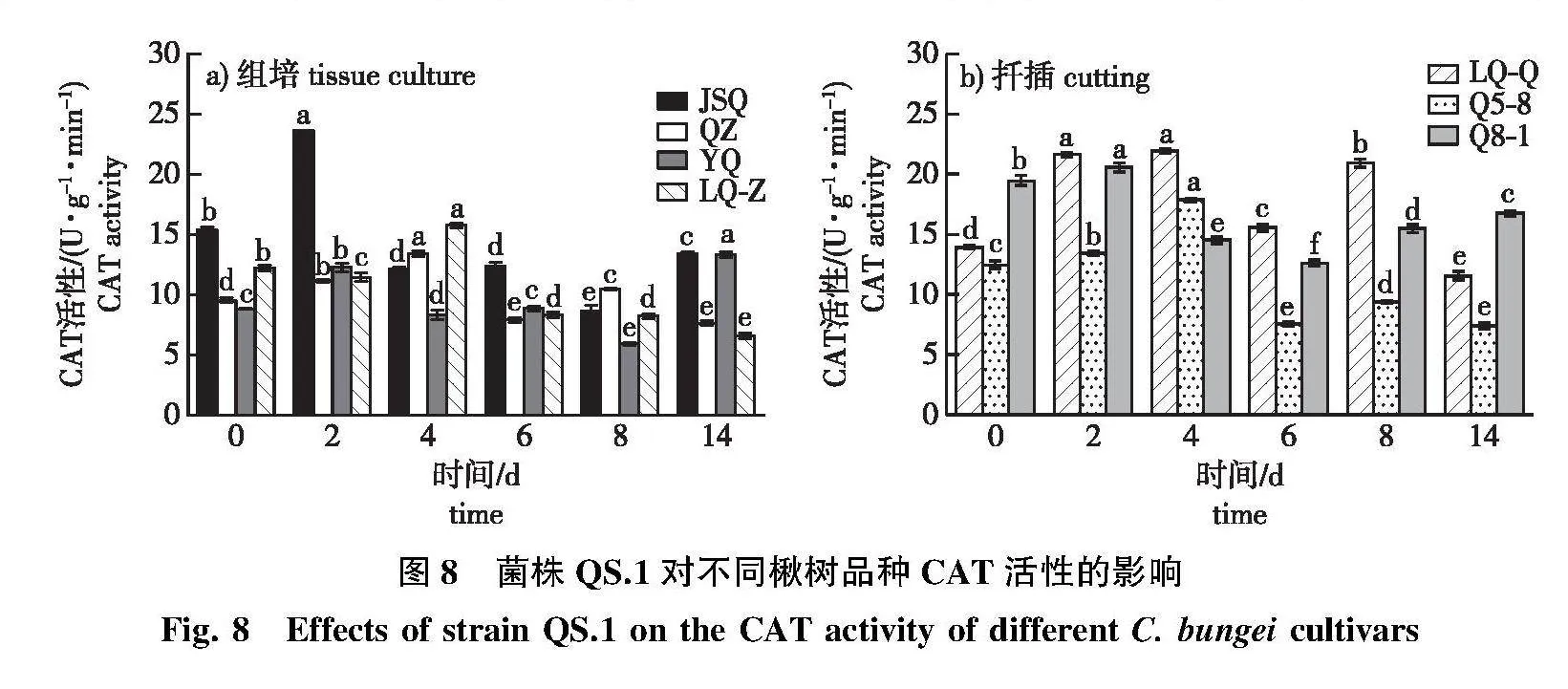
2.3.3" CAT活性变化
菌株QS.1侵染后,各楸树品种的CAT酶活性呈波动变化,酶活性峰值出现在感病前期。抗病品种JSQ在第2天达到峰值,JSQ较对照显著增加53.23%,感病品种QZ、YQ的CAT酶活性增幅低于JSQ,QZ和LQ-Z在感病后期酶活性随着侵染时间的增加呈下降趋势(图8a)。
中抗品种LQ-Q和Q5-8、Q8-1的CAT活性呈波动变化趋势(图8b),LQ-Q的CAT活性在第2、4天达到峰值,在接菌后第14天的CAT活性显著低于对照。中抗品种Q5-8在感病前期CAT活性呈上升趋势,在第4天峰值后迅速下降低于对照。
2.4" 菌株QS.1对不同楸树品种光合作用的影响
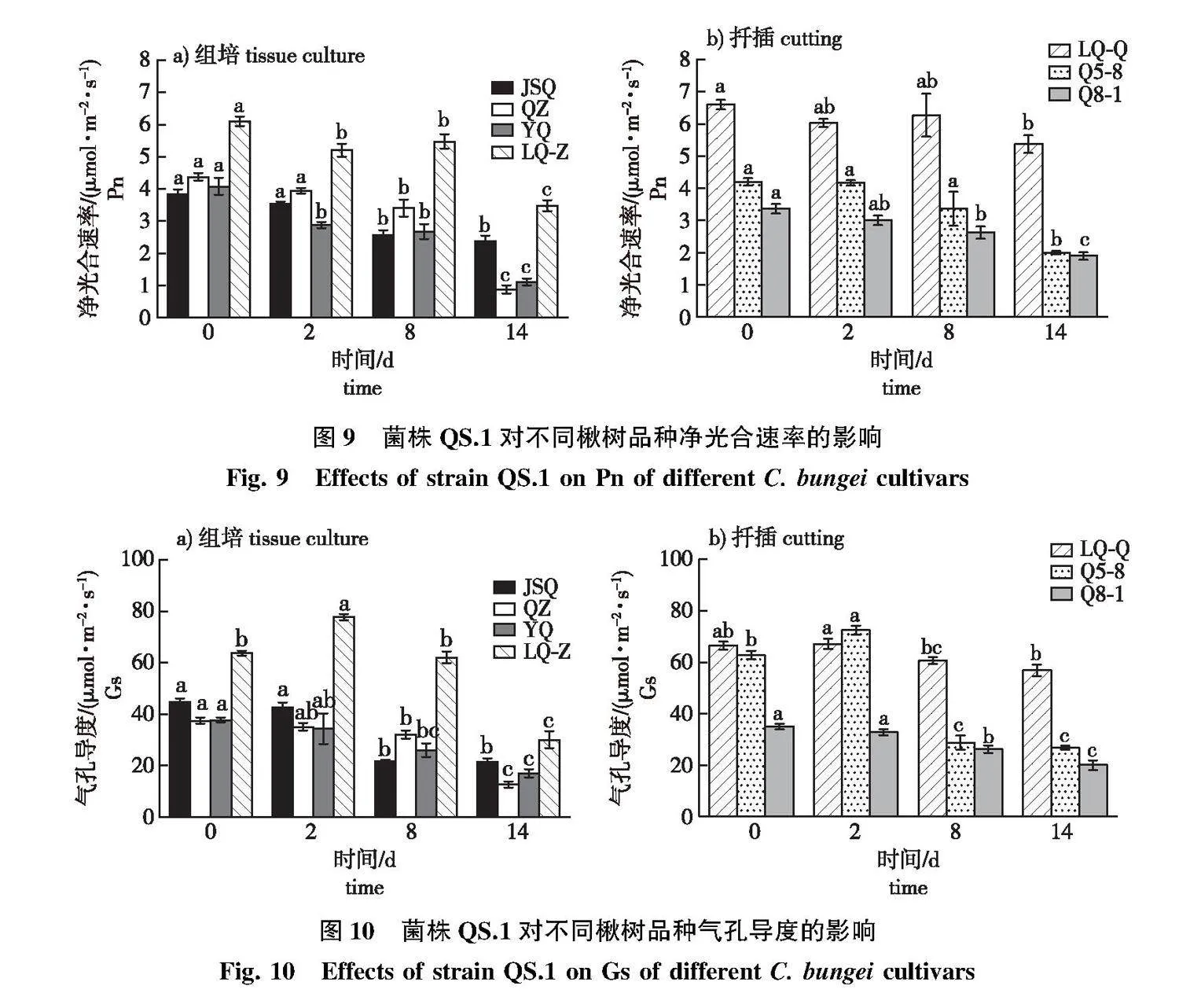
2.4.1" 净光合速率及气孔导度变化
菌株QS.1侵染后,各楸树品种净光合速率(Pn)呈减小趋势,并在各感病时期低于对照。接菌后第14天,抗病品种JSQ的净光合速率降幅较小,较对照下降38.3%;其次是LQ-Z,感病品种QZ的净光合速率较对照降幅最大,较对照显著下降80.0%(图9a)。
LQ-Q和Q5-8在接菌后第2、8天的Pn较对照变化差异不显著,各楸树品种在接菌后第14天的Pn较对照均差异显著下降,LQ-Q的Pn较对照降幅最小,Q5-8和Q8-1的降幅较大(图9b)。
接种菌株QS.1后期,不同楸树品种组培苗叶片的气孔导度(Gs)呈下降趋势(图10a)。随着侵染加深,在接菌后14 d各楸树品种的Gs相比对照显著降低,感病品种QZ的降幅最大达66.1%,其次是LQ-Z和YQ。菌株QS.1侵染楸树植株引起Gs下降,导致光合作用所需的CO2向叶肉细胞的运输受阻。
LQ-Q在接菌后Gs较对照变化差异不显著,感病第14天中抗品种Q5-8和Q8-1的Gs与对照相比分别显著下降62.9%和42.86%(图10b)。
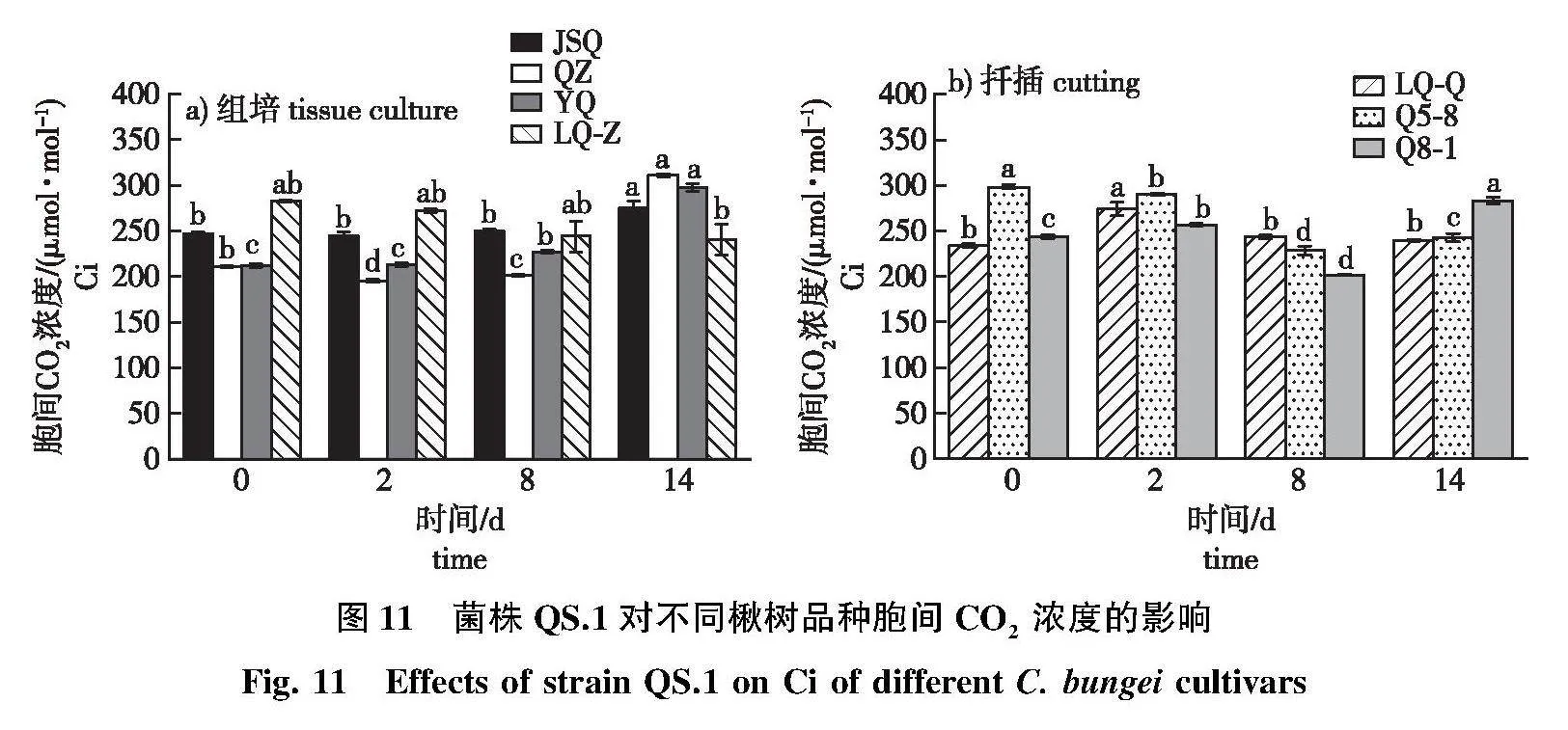
2.4.2" 胞间 CO2浓度变化
接菌后抗病品种JSQ和感病品种QZ、YQ的胞间CO2浓度(Ci)呈上升趋势,QZ增加幅度最大,接菌后第14天较对照增加47.65%,LQ-Z在接菌后叶片Ci下降不显著(图11a)。
LQ-Q在接菌后第2天较对照显著增加16.84%,接菌后期的Ci较对照变化不显著(图11b)。中抗品种Q5-8在接菌后第14天的Ci较对照显著下降18.82%。
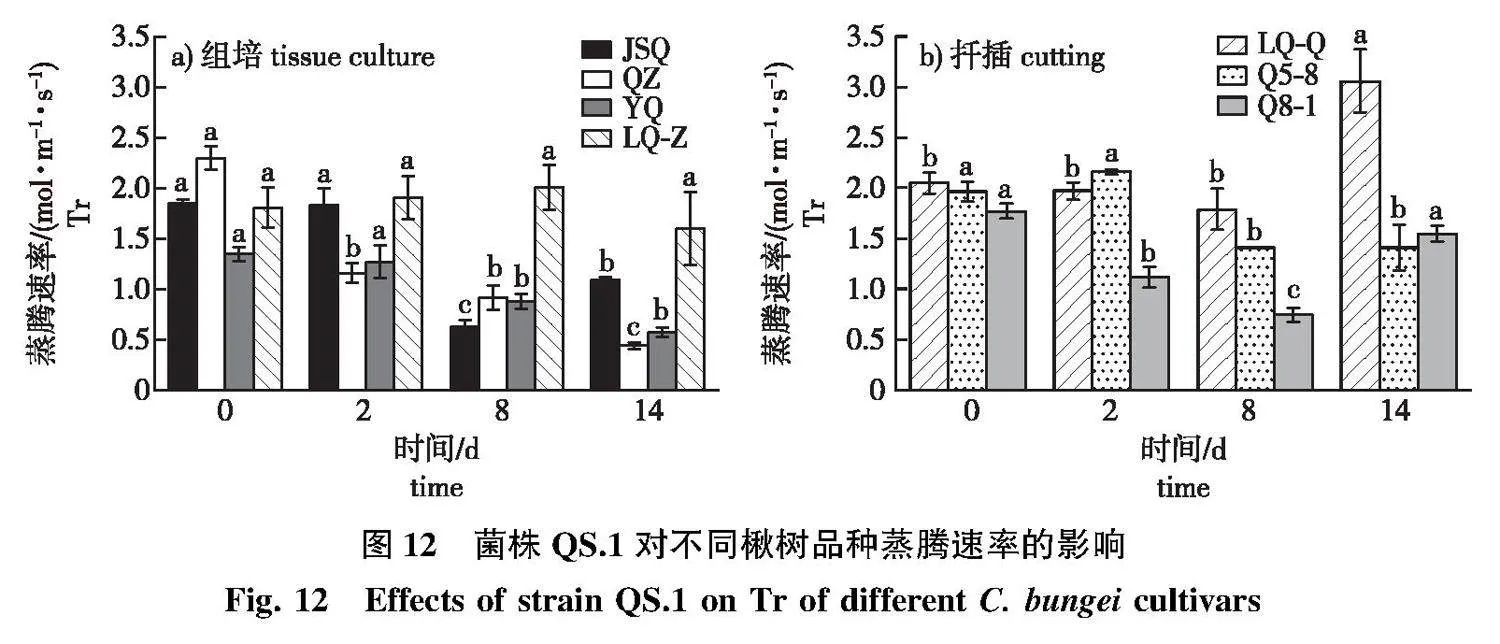
2.4.3" 蒸腾速率变化
抗病品种JSQ和感病品种QZ、YQ的蒸腾速率(Tr)总体呈下降趋势(图12a),接菌后第14天,感病品种QZ、YQ与对照相比显著下降,降幅大于JSQ。LQ-Z在受到病菌侵染后蒸腾速率先上升后下降,与对照差异不显著。
LQ-Q在第2、8天的蒸腾速率变化与对照差异不显著,第14天较对照显著上升49.1%(图12b)。中抗品种Q5-8、Q8-1的蒸腾速率整体呈下降趋,Q8-1在第8天蒸腾速度较对照显著下降58.00%。
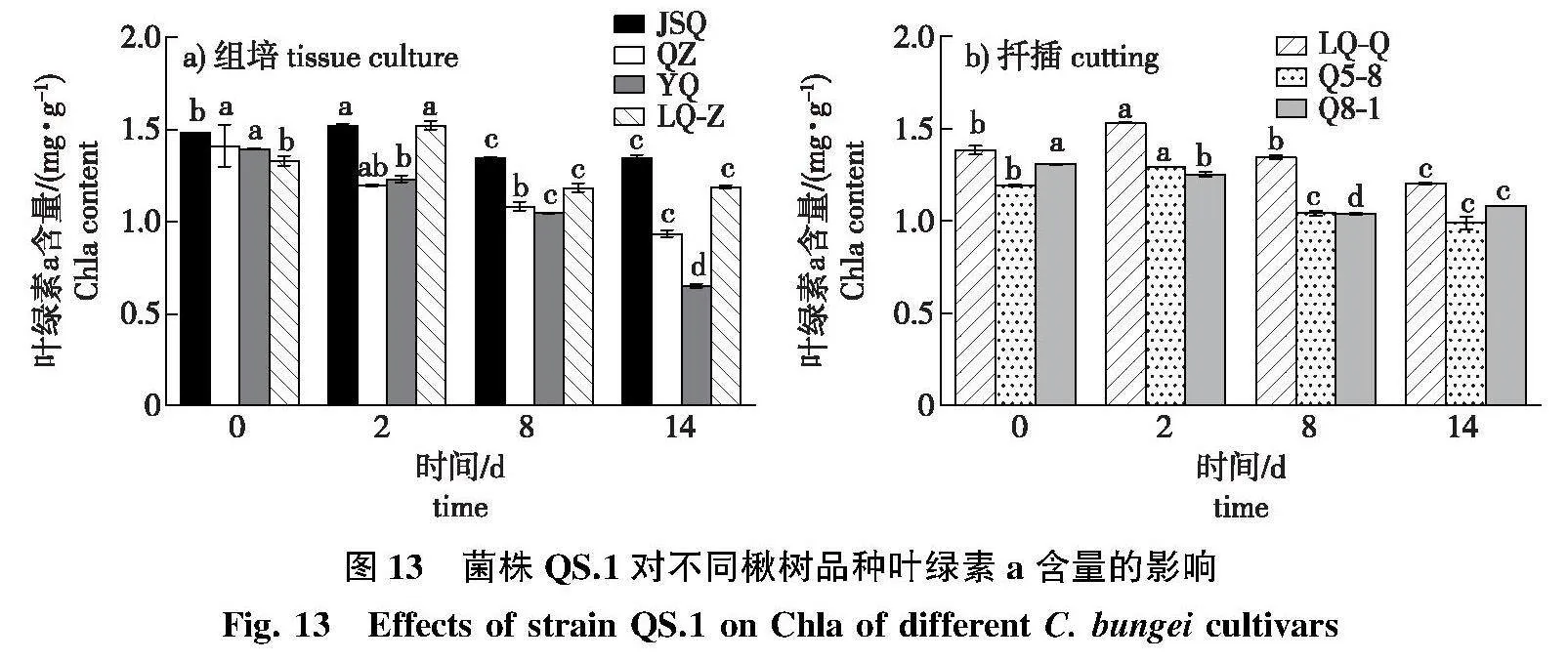
2.4.4" 叶绿素a含量变化
接菌第2天,JSQ、LQ-Z的叶绿素a含量较对照显著上升,感病后期叶绿素a含量变化差异不显著;感病品种QZ、YQ感病后期,叶绿素a含量较对照显著降低,降幅大于JSQ、LQ-Z(图13a)。
LQ-Q和Q5-8的叶绿素a含量在接菌后第2天较对照显著升高,接菌后第8、14天,Q5-8和Q8-1叶绿素a含量分别较对照显著降低(图13b)。
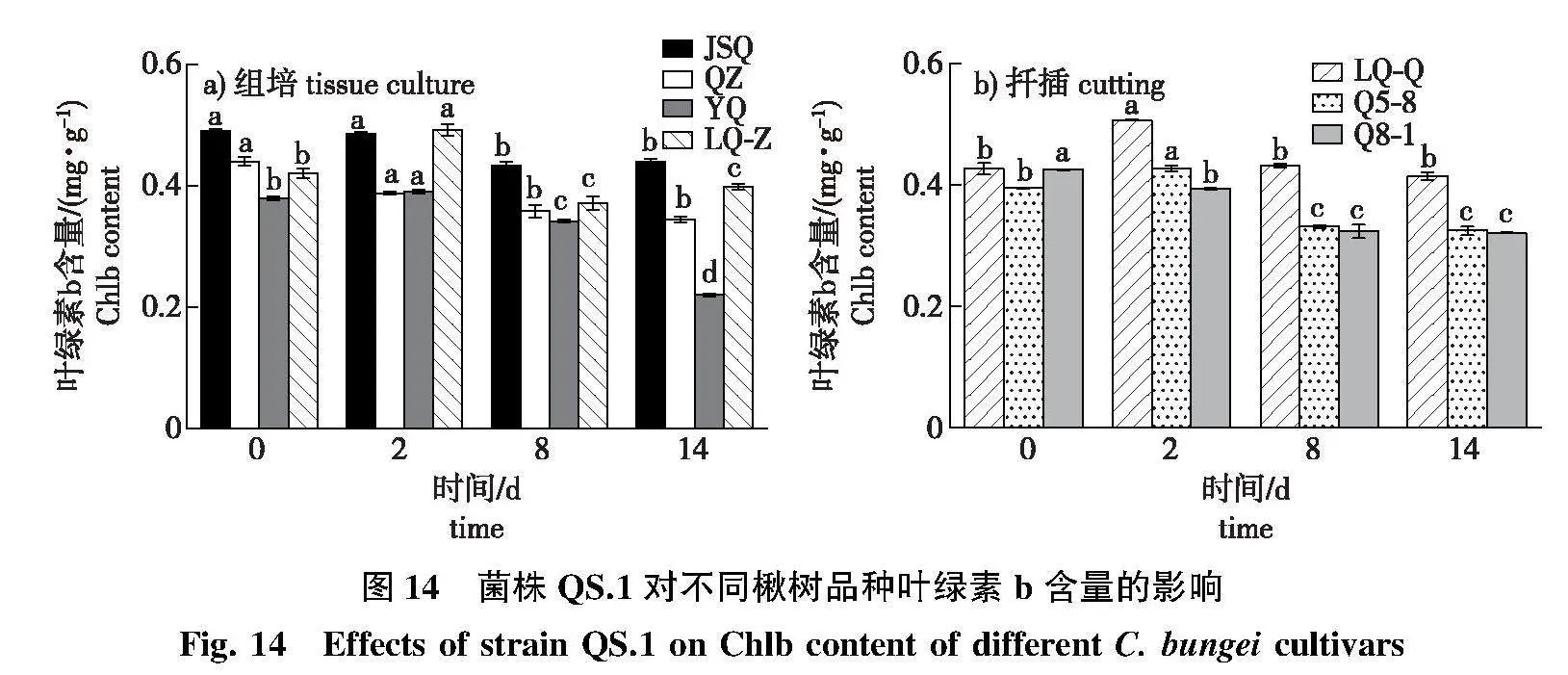
2.4.5" 叶绿素b含量变化
在接菌后第8、14天,JSQ、LQ-Z间的叶绿素b变化差异不显著(图14a),而感病品种QZ、YQ在感病后期叶绿素b含量较对照显著降低,YQ在第14天较对照降幅最大,为50.0%。
感病前期,LQ-Q和中抗品种Q5-8的叶绿素b含量较对照显著升高;接菌后第8、14天,Q5-8和Q8-1的叶绿素b含量较对照显著下降(图14b)。
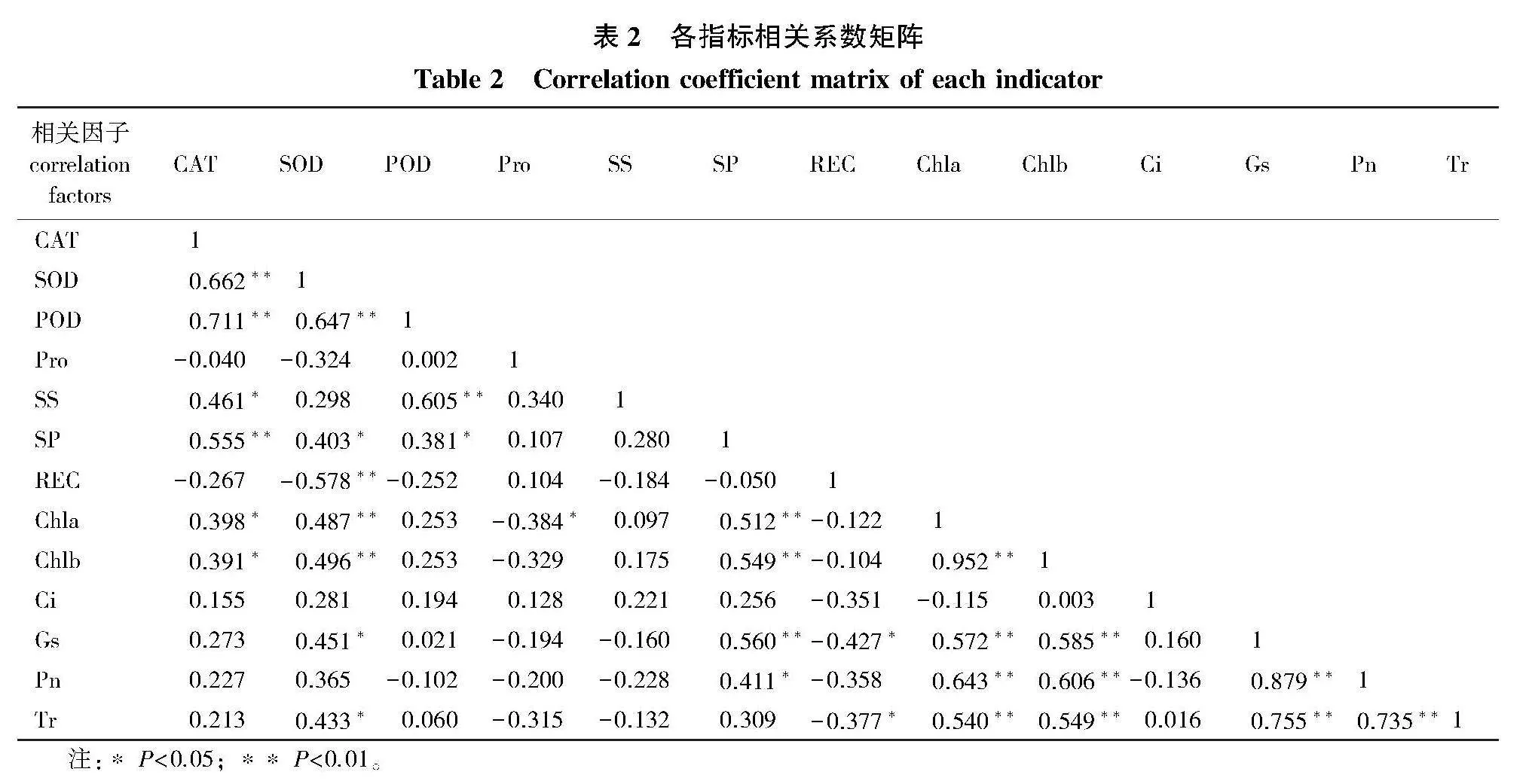
2.5" 生理指标相关性分析
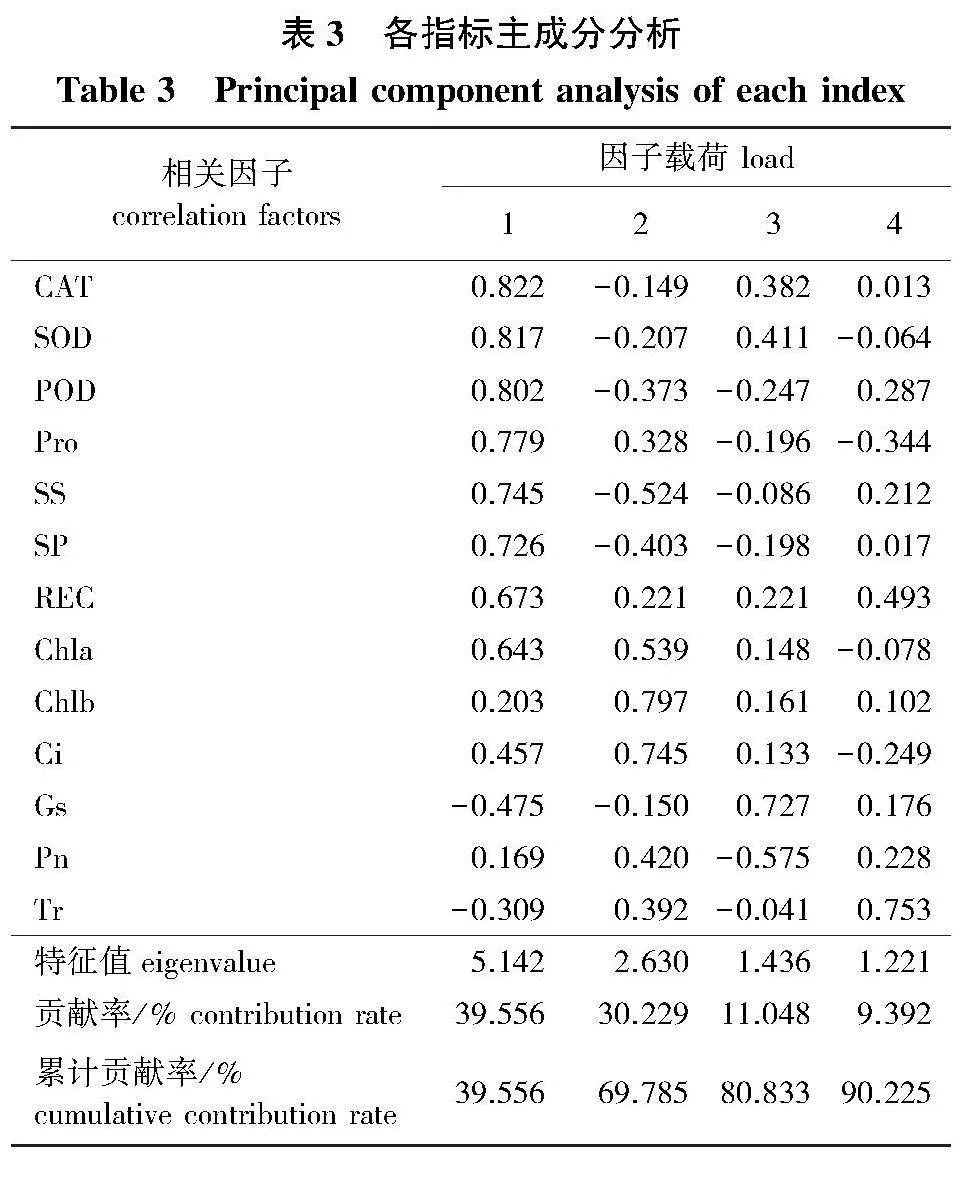
在受到QS.1菌株侵染以后,各指标在不同楸树品种抗病菌侵染能力中所起的作用不同,对楸树抗病性采用综合评价,将测定的6个楸树品种的单项指标进行主成分分析,继续将数据进行因子分析,综合指标消除重复信息。各防御酶之间相关性显著,净光合速率(Pn)与可溶性蛋白(SP)相关性显著,与Chla、Chlb、Gs极显著正相关,Ci与Pn、Tr之间相关性不显著(表2)。
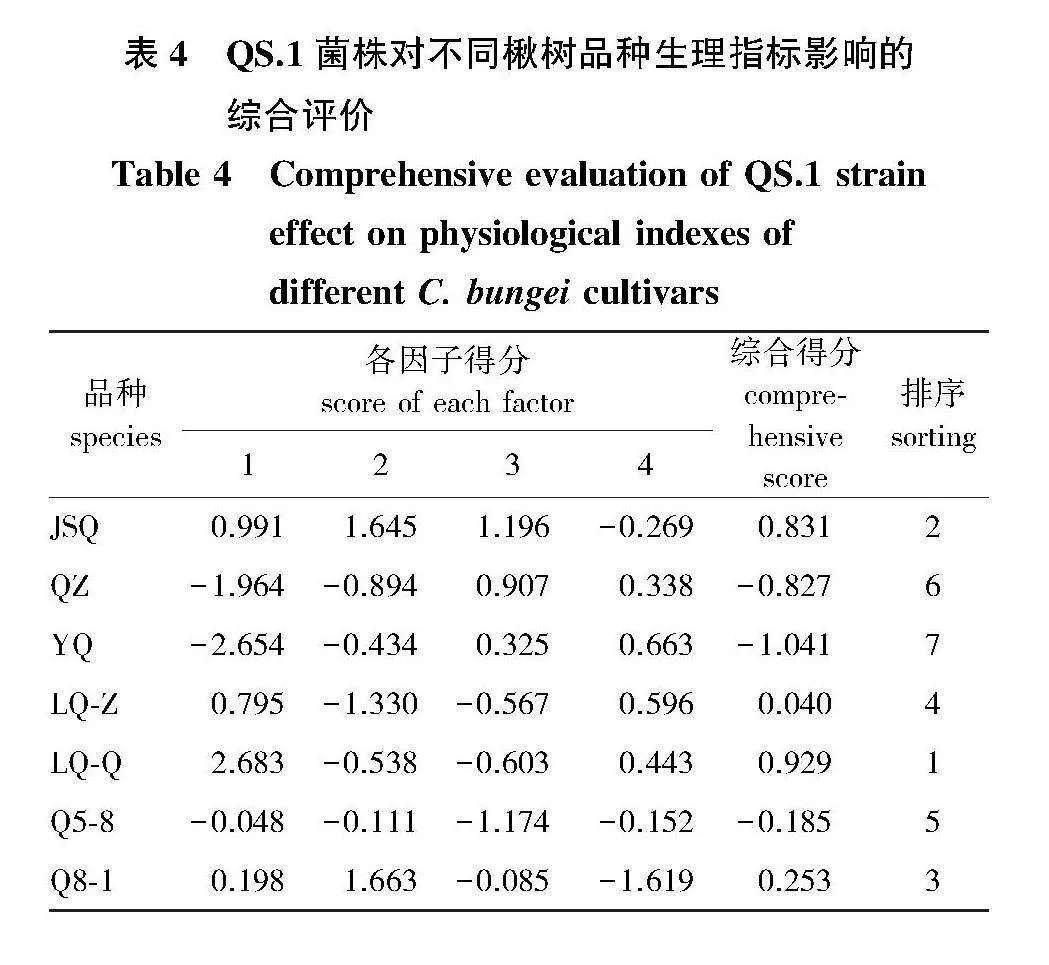
对不同楸树品种的13个指标进行主成分分析,提取了特征值大于1的4个主成分,第1主成分因子的方差贡献率为39.556%,第2主成分因子的方差贡献率为30.229%,第3主成分因子的方差贡献率为11.048%,第4主成分因子的方差贡献率为9.392%,其累计贡献率达到90.225%,可以较好地反映数据代表的信息(表3)。依据综合得分对其进行排序(表4)发现,各楸树品种幼苗抗烟草疫霉菌株QS.1感病力由大到小依次为:LQ-Q gt; JSQ gt; Q8-1 gt; LQ-Z gt; Q5-8 gt; QZ gt; YQ,与各指标的表现大致相同。
3" 讨" 论
3.1" 接菌后楸树不同品种渗透物质含量及防御酶活性的变化
植物在与病原菌的长期相互作用中,已经进化出复杂的防御系统,其中包括各种防御酶和抗病物质等因素,病原菌对不同植株或者不同品种致病性存在差异。本研究表明,不同楸树品种的幼苗抗烟草疫霉菌株QS.1感染致病存在差异,各供试楸树品种在接菌后相对电导率整体显著升高,说明菌株QS.1侵染楸树植株后破坏膜系统的选择透性,引起质膜透性的增大,使溶液电导率增加,这与赵小虎等在油菜感染菌核病后不同油菜品种电导率的变化一致。菌株QS.1诱导了不同楸树品种渗透物质、防御酶和光合特性变化。组培苗中,抗病品种‘金丝楸’脯氨酸峰值低于‘洛楸1号’组培苗和感病品种‘楸杂1号’‘豫楸1号’,而可溶性糖和可溶性蛋白的峰值高于感病品种;扦插苗中,各品种的渗透物质含量呈波动性变化,‘洛楸1号’扦插苗的各渗透物质的峰值较高,可溶性糖增幅最大,这与李赤等在富贵竹感染细菌性茎腐病的研究结果一致。相关研究表明易感病品种的渗透物质含量较高,本实验结果与此相反,推测楸树茎腐病是一种低糖病害。菌株QS.1的诱导使不同品种组培苗保护酶活性呈现波动性变化,‘金丝楸’保护酶活性峰值大于‘洛楸1号’组培苗和‘楸杂1号’‘豫楸1号’。‘洛楸1号’扦插苗除POD外,SOD、CAT酶活性峰值高于中抗品种‘楸树8-1’和‘楸树5-8’。这说明抗病品种在受到病菌侵染以后保护酶可以促进有害自由基的转化或者防止活性物质形成自由基,从而减轻膜脂过氧化伤害,与刘杜玲等研究早实核桃在冷胁迫中的结果一致。也有学者研究发现剑麻易感病品种中SOD的活性比较高,抗病玉米品种的CAT活性降低可以使H2O2维持在较高浓度水平, 这样反过来可以增加植物对病原菌的耐受力, 提高植物的抗性。
3.2" 接菌后不同楸树品种光合参数的变化
光合作用可以影响信号通路,为免疫防御提供物质和能量,而免疫防御过程也可以对光合作用产生反馈作用。光合作用可以反映出植物生长、品质及抗逆等特性的差异,病原体感染不可避免地导致光合作用参数的变化,严重时会导致碳同化减少,植物生长衰弱。光合作用对植物物质积累和生长发育具有重要作用,反映植株的生长势和抗逆性。大多数病原体入侵或者外界重度胁迫均可导致宿主光合作用速率下降。植物光合速率下降的原因可分为气孔因素和非气孔因素,当Gs、Ci都下降说明是气孔因素导致光合速率下降,Ci升高则说明是受非气孔因素影响。本研究结果显示:菌株QS.1浸染后6个楸树品种的Pn、Gs均下降,组培苗中,‘金丝楸’‘楸杂1号’和‘豫楸1号’的Ci增加,非气孔因素导致楸树光合作用下降;感病品种‘楸杂1号’和‘豫楸1号’的光合参数受菌株QS.1的影响明显大于抗病品种‘金丝楸’,表现感病性,在QS.1菌株胁迫下‘金丝楸’各光合参数变化幅度较小,表现出良好的抗病能力。扦插苗中,‘洛楸1号’扦插苗和中抗品种‘楸树5-8’的Ci整体呈下降趋势,气孔限制是导致光合作用下降的结果,而‘楸树8-1’的Ci在感病后期增加,非气孔因素导致楸树光合作用下降。‘洛楸1号’扦插苗的光合参数受菌株QS.1胁迫影响低于‘楸树5-8’和‘楸树8-1’。‘洛楸1号’在受到轻度胁迫后,净光合速率有小幅上升。烟草疫霉菌株QS.1可通过诱导导管堵塞阻碍水分通过木质部的运输,导致植物叶片病理性萎蔫,进而对光合气体参数造成不利影响,这一结果通过叶片脯氨酸含量的显著增加得到了进一步验证,因为脯氨酸是植物组织中抵抗水分亏缺的关键渗透压。本研究试验数据表明,抗病品种对其光合系统有更好的自我保护,提高了光能利用能力,并积累了更多的渗透调节物质,以减轻对细胞膜的损害,这些属性可能解释了‘金丝楸’和‘洛楸1号’扦插苗对烟草疫霉菌株QS.1的抗性。不同楸树品种的抗烟草疫霉菌株QS.1致病能力与光合性能的维持和防御相关酶活性的调节有关。
本研究以盆栽苗为试验材料,具有一定的便捷和可控性,但与大田试验环境存在一定的差异,导致试验结果可能会有偏差。由于进行试验时树龄较小,胸径约1 cm,加上高温高湿的环境有利于病菌的繁殖,有可能增加楸树感病,因此后续可对人工抚育林的楸树品种进行进一步试验。
参考文献(reference):
[1]HUANG W L,YE N L,XIAN B H. Investigation of stem base rot of sweetpotato and the pathogeny identification. Chinese Agri Cultural Science Bulletin,2019,35(18):135141.
[2]CHANG L,LIU K,WANG L G,et al.First report of Phytophthora nicotianae causing stem canker of Catalpa bungei (Chinese Catalpa) in China.Plant Dis,2022,106(4):1309.DOI: 10.1094/PDIS-08-21-1778-PDN.
[3]CLINE" E T,FARR" D F,ROSSMAN" A Y.A synopsis of Phytophthora with accurate scientific names,host range,and geographic distribution.Plant Heath Prog,2008,9(1):32.DOI: 10.1094/php-2008-0318-01-rs.
[4]BAI G,YANG D H,CHAO P J,et al.Genome-wide identification and expression analysis of NtbHLH gene family in tobacco (Ni-cotiana tabacum) and the role of NtbHLH86 in drought adaptation.Plant Divers,2021,43(6):510-522.DOI: 10.1016/j.pld.2020.10.004.
[5]BOUGHALLEB-MHAMDI N,BENFRADJ N,MIGLIORINI D,et al.Phytophthora nicotianae and P.cryptogea causing gummosis of citrus crops in Tunisia.Trop Plant Pathol,2018,43(1):36-48.DOI: 10.1007/s40858-017-0180-2.
[6]林霞.樱桃抗茎腐病机理与效应因子PnAvh241功能初步研究.烟台:烟台大学,2019.LIN X.Study on the cherry resistance mechanism of stem rot disease and the function of the RxLR effector PnAvh241.Yantai:Yantai University,2019.
[7]陈瑞泰,朱贤朝,王智发,等.全国16个主产烟省(区)烟草侵染性病害调研报告.中国烟草科学,1997,18(4):1-7. CHEN R T,ZHU X C,WANG Z F,et al.A report of investigating and studying tobacco infectious diseases of 16 main tobacco producing provinces(regions)in China.Chin Tob Sci,1997,18(4):1-7.
[8]PANABI R F,GUL S,ALI G,et al.Phytophthora nicotianae diseases worldwide: new knowledge of a long-recognised pathogen.Phytopathol Mediterr,2016,55(1):20-40.DOI: 10.14601/Phytopathol_Mediterr-16423.
[9]ZHANG C S,FENG C,ZHENG Y F,et al.Root exudates metabolic profiling suggests distinct defense mechanisms between resistant and susceptible tobacco cultivars against black shank di-sease.Front Plant Sci,2020,11:559775.DOI: 10.3389/fpls.2020.559775.
李合生,孙群,赵世杰. 植物生理生化实验原理和技术.北京:高等教育出版社,2000. LI H S,SUN Q,ZHAO S J. Principles and techniques of plant physiological and piochemical pxperiments . Beijing: Higher Education Press,2000.
杨兰芳,庞静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性.现代农业科技,2009(20):364-366.YANG L F,PANG J,PENG X L,et al.Measurement of catalase activity in plants by ultraviolet spectrophotometry.Mod Agric Sci Technol,2009(20):364-366.DOI: 10.3969/j.issn.1007-5739.2009.20.247.
DODDS P N,RATHJEN J P.Plant immunity:towards an integrated view of plant-pathogen interactions.Nat Rev Genet,2010,11(8):539-548.DOI: 10.1038/nrg2812.
赵小虎,陈翠莲,焦春香,等.不同油菜品种对油菜菌核病敏感性差异的生理生化特性研究.华中农业大学学报,2006,25(5):488-492.ZHAO X H,CHEN C L,JIAO C X,et al.Physiological and biochemical reaction responses to Sclerotium blight inoculation among different rapeseed varieties.J Huazhong Agric Univ (Nat Sci Ed),2006,25(5):488-492.DOI: 10.13300/j.cnki.hnlkxb.2006.05.007.
李赤,于莉,刘付东标,等.富贵竹中可溶性糖、蛋白质含量与细菌性茎腐病的关系.吉林农业大学学报,2007,29(6):620-622.LI C,YU L,LIU F D B,et al.Relation between contents of soluble sugar and protein in Dracaena sanderiana Virens and bacterial stem rot.J Jilin Agric Univ,2007,29(6):620-622.DOI: 10.13327/j.jjlau.2007.06.011.
杨汉波,曹广黎,韩珊,等.核桃对炭疽病菌抗性相关的生理生化响应差异研究.四川农业大学学报,2020,38(4):463-470.YANG H B,CAO G L,HAN S,et al.Study on the difference in physiological and biochemical response of walnut (Juglans spp.) to anthracnose resistance.J Sichuan Agric Univ,2020,38(4):463-470.DOI: 10.16036/j.issn.1000-2650.2020.04.012.
ALI S,KHAN A S,ANJUM M A,et al.Effect of postharvest oxalic acid application on enzymatic browning and quality of lotus (Nelumbo nucifera Gaertn.) root slices.Food Chem,2020,312:126051.DOI: 10.1016/j.foodchem.2019.126051.
朱学明,史祥鹏,雍道敬,等.内生放线菌A-1诱导苹果对炭疽叶枯病的抗性.植物生理学报,2015,51(6):949-954.ZHU X M,SHI X P,YONG D J,et al.Induction of resistance against Glomerella cingulata in apple by endophytic actinomycetes strain A-1.Plant Physiol J,2015,51(6):949-954.DOI: 10.13592/j.cnki.ppj.2015.0129.
王莎莎,盛业龙,马文广,等.抗氧化系统参与不同抗性烟草品种幼苗对干旱和低温综合抗性的形成.生物技术通报,2014(1):132-142.WANG S S,SHENG Y L,MA W G,et al.Involvement of antioxidant defense system in drought and chilling comprehensive resistance formation in different resistant varieties of tobacco seedlings.Biotechnol Bull,2014(1):132-142.DOI: 10.13560/j.cnki.biotech.bull.1985.2014.01.025.
刘杜玲,张博勇,孙红梅,等.早实核桃不同品种抗寒性综合评价.园艺学报,2015,34(3):967-974.LIU D L,ZHANG B Y,SUN H M,et al.Comprehensive evaluation on cold resistance of early fruiting walnut cultivars.Acta Hortic Sin,2015,34(3):967-974.DOI: 10.16420/j.issn.0513-353x.2014-0917.
张燕梅,李栋梁,李俊峰,等.烟草疫霉侵染后剑麻H.11648叶片细胞超微结构和防御酶活性研究.热带作物学报,2018,39(6):1161-1165.ZHANG Y M,LI D L,LI J F,et al.Changes in ultrastructure and activities of defense-related enzymes in leaves of sisal H.11648 after Phytophthora nicotianae Breda infection.Chin J Trop Crops,2018,39(6):1161-1165.DOI: 10.3969/j.issn.1000-2561.2018.06.018.
MAGBANUA Z V,DE MORAES C M,BROOKS T D,et al.Is ca-talase activity one of the factors associated with maize resistance to Aspergillus flavus?.Mol Plant Microbe Interact,2007,20(6):697-706.DOI: 10.1094/MPMI-20-6-0697.
YANG H,LUO P G.Changes in photosynthesis could provide important insight into the interaction between wheat and fungal pathogens.Int J Mol Sci,2021,22(16):8865.DOI: 10.3390/ijms22168865.
MOHSENZADEH S,MALBOOBI M A,RAZAVI K,et al.Physiological and molecular responses of Aeluropus lagopoides (Poaceae) to water deficit.Environ Exp Bot,2006,56(3):314-322.DOI: 10.1016/j.envexpbot.2005.03.008.
BERGER S,SINHA A K,ROITSCH T.Plant physiology meets phytopathology:plant primary metabolism and plant-pathogen interactions.J Exp Bot,2007,58(15/16):4019-4026.DOI: 10.1093/jxb/erm298.
KRETSCHMER M,DAMOO D,DJAMEI A,et al.Chloroplasts and plant immunity:where are the fungal effectors?.Pathogens,2019,9(1):19.DOI: 10.3390/pathogens9010019.
马迎莉,高雨,袁婷婷,等.重金属铬胁迫对髯毛箬竹光合特性的影响.南京林业大学学报(自然科学版),2019,43(1):54-60.MA Y L,GAO Y,YUAN T T,et al.Effects of heavy metal chromium stress on the photosynthetic characteristics of Indocalamus barbatus McClure.J Nanjing For Univ (Nat Sci Ed),2019,43(1):54-60.DOI: 10.3969/j.issn.1000-2006.201712013.
STEWART J D,ZINE EL ABIDINE A,BERNIER P Y.Stomatal and mesophyll limitations of photosynthesis in black spruce seedlings during multiple cycles of drought.Tree Physiol,1995,15(1):57-64.DOI: 10.1093/treephys/15.1.57.
FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis.Annu Rev Plant Physiol,1982,33:317-345.DOI: 10.1146/annurev.pp.33.060182.001533.
WAHID A,GELANI S,ASHRAF M,et al.Heat tolerance in plants:an overview.Environ Exp Bot,2007,61(3):199-223.
(责任编辑" 李燕文)
——致秋天的花楸树

