H2S供体NaHS对渗透胁迫下美国剑麻干旱适应性及抗氧化特性的影响
收稿日期Received:2023-05-25""" 修回日期Accepted:2023-08-27
基金项目:国家重点研发计划(2017YFD0601301);江苏高校优势学科建设工程资助项目(PAPD)。
第一作者:沈瑒(2276582506@qq.com)。
*通信作者:陈颖(chynjfu@163.com),教授。
引文格式:
沈瑒, 狄晶晶, 陈颖,等. H2S供体NaHS对渗透胁迫下美国剑麻干旱适应性及抗氧化特性的影响. 南京林业大学学报(自然科学版),2024,48(2):121-128.
SHEN Y, DI J J, CHEN Y, et al. Effects of H2S donor NaHS on adaptability and antioxidant properties of Agave americana plantlets under" in vitro culture of osmotic stress. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(2):121-128.
DOI:10.12302/j.issn.1000-2006.202305030.
摘要:【目的】美国剑麻(Agave americana)是热带地区一种具有高经济价值的、重要的景天科酸代谢(CAM) 植物,研究其干旱适应性可为CAM植物的耐旱机制研究提供理论依据。【方法】通过对美国剑麻进行1.0 mmol/L NaHS (NS)、10% PEG(聚乙二醇, PEG10)、20% PEG (PEG20)、1.0 mmol/L NaHS+10%PEG (NS+PEG10)、1.0 mmol/L NaHS+20% PEG (NS+PEG20) 的处理,以不添加PEG和NaHS的处理为对照,研究美国剑麻组培苗对PEG渗透胁迫的响应,以及渗透胁迫下H2S供体NaHS对其渗透调节和抗氧化特性的影响。【结果】美国剑麻组培苗在20% PEG高浓度处理下仍然存活,具有一定的抗旱能力。但植株出现了鲜质量下降(PEG20处理比对照降低了16.6%)、超微结构发生变化、丙二醛(MDA)和H2O2含量增加等受害症状和氧化胁迫反应。然而美国剑麻可以通过增加脯氨酸、可溶性糖的水平调节渗透压,降低胁迫强度。在高浓度PEG存在下,添加NaHS可降低脯氨酸和H2O2含量,从而减少脯氨酸和H2O2的过度积累;通过调节超氧化物歧化酶(SOD)等5种抗氧化酶活性,提高还原型谷胱甘肽(GSH)含量清除活性氧和活性羰基物,降低美国剑麻的脂质过氧化水平,增强其抗逆性。【结论】美国剑麻本身具有一定的耐旱性,H2S能够通过调控美国剑麻的渗透调节和抗氧化水平,使其更加适应干旱的环境。
关键词:美国剑麻;渗透胁迫;硫化氢;抗旱性;渗透调节;抗氧化作用
中图分类号:S759.3""""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)02-0121-08
Effects of H2S donor NaHS on the adaptability and antioxidant properties of Agave americana plantlets under an in vitro culture of osmotic stress
SHEN Yang, DI Jingjing, CHEN Ying*, FENG Kai, LU Jinling, HU Yuchen
(Co-Innovation Center for Sustainable Forestry in Southern China, College of Life Sciences, Nanjing Forestry University, Nanjing 210037, China)
Abstract: 【Objective】Agave americana is an important crassulacean acid metabolism (CAM) plant with high economic value in tropical areas. Studying its drought adaptability could provide evidence of the drought tolerance mechanism, and support for resource development and engineering research regarding the utilization of CAM plants. 【Method】In this study, A. americana plantlets were treated with 1.0 mmol/L NaHS (NS), 10% polyethylene glycol (PEG10), 20% PEG (PEG20), 1.0 mmol/L NaHS+10% PEG (NS+PEG10), and 1.0 mmol/L NaHS+20% PEG (NS+PEG20) under an in vitro culture. The responses to PEG osmotic stress were studied and the effects of H2S donor NaHS on osmotic regulation and antioxidant properties in A. americana were investigated. 【Result】The results showed that the A. americana plantlets could survive under the 20% PEG (high concentration) treatment and had a degree of drought resistance. However, injury symptoms and oxidative stress reactions occurred, with the fresh mass decreasing by 16.6% in PEG20. The cell ultrastructure changed, and the malondialdehyde (MDA) and H2O2 contents increased in PEG20. Despite this, the plantlets regulated osmotic pressure and reduced the stress intensity by increasing the levels of proline and soluble sugars. In the presence of PEG, H2S donor NaHS could reduce the excessive accumulation of proline and H2O2. Furthermore, H2S could activate superoxide dismutase (SOD) and five antioxidases, and increased the glutathione (GSH) content to clear active oxygen species (ROS) and active carbonyl compounds, subsequently enhancing the antioxidant capacity. 【Conclusion】The A. americana plantlets had a certain degree of drought tolerance. The H2S had an important role in osmotic regulation and regulating antioxidant levels, making the plantlets better adapted to drought conditions.
Keywords:Agave americana; osmotic stress; H2S; drought resistance; osmotic regulation; oxidation resistance
美国剑麻(Agave americana)为龙舌兰科剑麻属(Agave)植物,原产于墨西哥中部和美国西南部的沙漠和干旱地区,我国华南及西南各省区皆有引种栽培。剑麻属植物叶含有高质量、丰富的纤维,可用于制作船缆、绳索、麻袋等,还可用于生产生物燃料、纤维和酿酒,其叶片液汁含有剑麻皂苷元,具有杀菌抗炎、解热镇痛、增强免疫等功效, 因此剑麻是热带地区重要的经济作物。
剑麻的光合作用类型属于景天科植物酸代谢(crassulacean acid metabolism, CAM)途径,能够长期在干旱和极端高温地区、不可开垦的岩石土壤上生长。其气孔晚上开放,吸收CO2;白天关闭,进行碳同化固定CO2合成糖类。CAM中羧化酶活性的昼夜分离,导致其具有较高的水分利用效率,比C3植物高 6.0 倍,比C4植物高2.0倍。将 CAM 光合作用途径转移到C3作物中,可提高 C3 作物水分利用效率。因此深入探究CAM植物光合作用及抗旱相关的调控机制,可以为合理开发利用CAM植物资源、提高经济效益、实现CAM工程化等提供参考。
硫化氢(H2S)是继一氧化氮(NO)和一氧化碳(CO)之后发现的第3个气体信号分子。研究表明,内源性硫化氢能够在没有受体的情况下穿过细胞膜,参与信号转导,是一种新型气体递质信号物质。H2S可以调节植物种子萌发、侧根发生、气孔开放、逆境胁迫响应及适应性等多种生理代谢过程。适宜的外源硫化氢可促进植物种子萌发和幼苗生长。外源添加NaHS促进了多种植物的根系产生,如0.2 mmol/L NaHS处理调节了桃树(Prunus persica)苗的根构型,增加了侧根数量,再如H2S能促进秋茄(Kandelia obovata)根系的形态建成,且诱导作用呈剂量依赖性。外源NaHS的添加也有助于植物适应逆境和增强抗性,如提高青钱柳 (Cyclolocarya paliurus)、板栗(Castanea mollissima) 和烟草(Nicotiana tabacum) 抗氧化酶的活性。但H2S对CAM 植物,特别是剑麻的生长和逆境适应性影响还鲜见报道。
本研究以美国剑麻组培苗为试验材料,在离体培养条件下,探究渗透胁迫时H2S 供体NaHS对美国剑麻组培苗生长及抗氧化性能的影响,为剑麻的抗旱性机制和H2S 在逆境中的作用机制研究提供理论依据。
1" 材料与方法
1.1" 材料来源及组培苗培养
美国剑麻的无菌苗来自南京林业大学组培室,从培养30 d的美国剑麻丛生芽中分出单芽,接种在MS + 0.5 mg/L 6-BA + 0.1 mg/L NAA的芽伸长培养基上。培养1个月后,芽苗长至3~4 cm时,将其接种在MS+ 0.5 mg/L NAA培养基中进行生根培养,生长60 d左右(高6~7 cm),选出长势较一致的组培苗,进行NaHS及PEG (聚乙二醇)处理。
1.2" NaHS和PEG处理
NaHS和PEG处理中设置0" mmol/L NaHS+0%PEG(CK,对照组)、1.0 mmol/L NaHS (NS)、10%PEG(PEG10)、20%PEG (PEG20)、1.0" mmol/L NaHS+10%PEG (NS+PEG10)、1.0 mmol/L NaHS+20%PEG (NS+PEG20) 共6组。先将各处理的PEG按照相应的浓度添加到不含调节剂的MS半固体培养基中(含0.4% 琼脂、3.0%蔗糖),pH调至5.8左右,120 ℃高压灭菌20 min,灭菌后待培养基温度降至35 ℃左右,立即将过滤灭菌后的NaHS 添加到相应的培养基中,待培养基凝固且冷却至室温后,选择生长较一致、长势良好的美国剑麻无菌苗,接种于上述培养基中,每瓶放入 2 株苗,每个处理15瓶,培养15 d, 期间定期观察。至第15天时,将苗木从培养基中取出,用清水洗净培养基,用滤纸吸干水分,拍照、称质量后剪取叶片混合,一部分用于生理指标测定,一部分用于电镜观察,3次重复。
培养室中温度控制在(25±2)℃,光照强度55 mmol/(m2·s),光照时间 14 h/10 h (光照/黑暗)。
1.3" 指标测定
丙二醛(MDA)、 H2O2、可溶性糖(SS)含量(蒽酮比色法)、可溶性蛋白质(SP)含量(考马斯亮蓝法)测定均参照文献方法。超氧化物歧化酶(SOD)活性(氮蓝四唑还原法)、过氧化氢酶(CAT)活性(紫外吸收法)、过氧化物酶(POD)活性(愈创木酚法)、抗坏血酸过氧化物酶(APX)活性、脯氨酸(Pro)含量测定均参照文献方法。谷胱甘肽还原酶(GR)活性、谷胱甘肽(GSH)含量测定参照文献方法。
1.4" 透射电镜观察
选取3~4 mm2的剑麻叶片,参照文献方法制片,并使用JEM-1400 透射电子显微镜(JEOL Ltd.)观察并拍照。
1.5" 数据处理
采用Excel 2019对数据进行处理,SPSS 21.0软件进行统计分析,方差分析采用Duncan新复极差法。
2" 结果与分析
2.1" PEG与NaHS处理对美国剑麻组培苗生长的影响
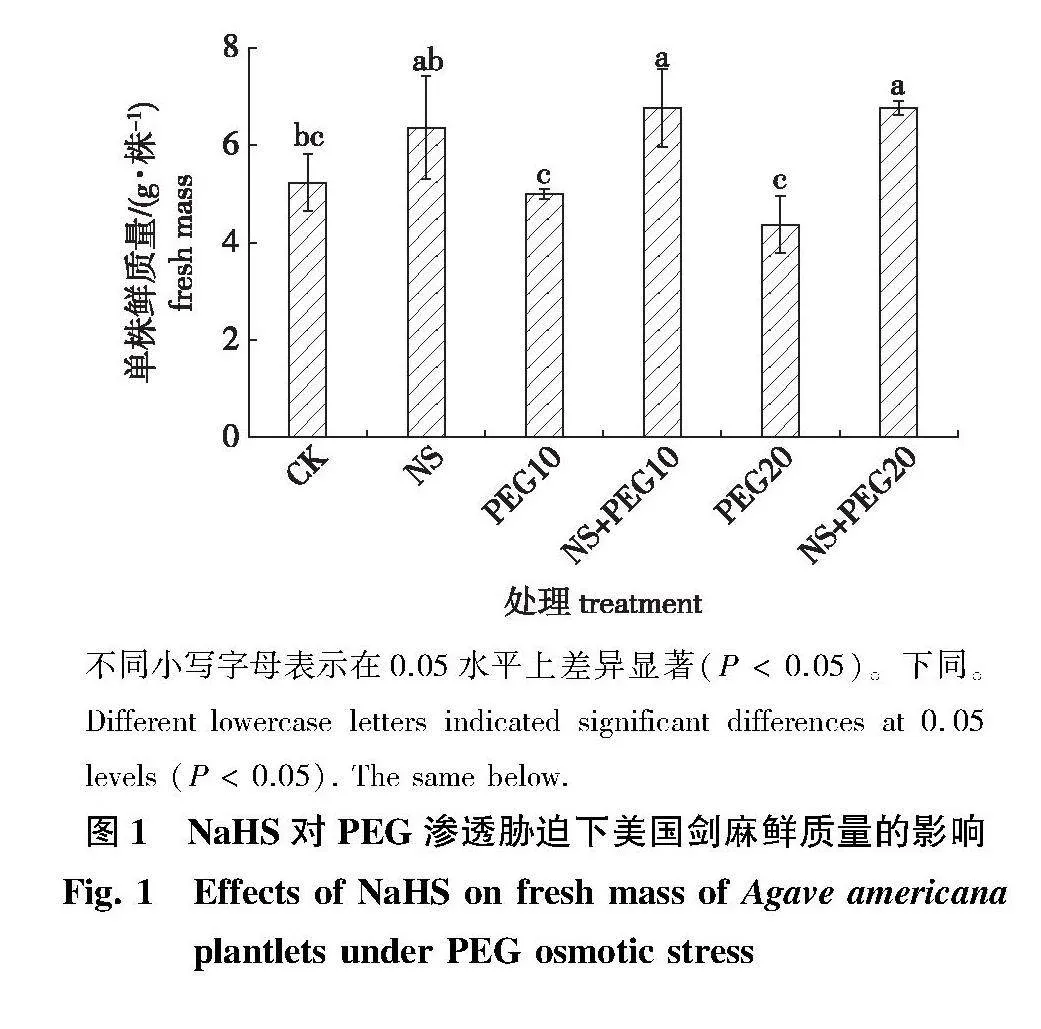
渗透胁迫下添加1.0" mmol/L NaHS后,美国剑麻的生长表现不同(图1)。从图1中可以看出,与对照相比,PEG处理降低了美国剑麻的单株鲜质量,高浓度PEG抑制强度大于低浓度,PEG20处理单株鲜质量比对照降低了16.6%。而NS+ PEG20处理组的单株鲜质量较对照组增加了21.7%,较PEG20组增加了54.9%,说明添加1.0 mmol/L NaHS可以减缓渗透胁迫,甚至可以消除PEG 的影响。单施NaHS也提高了美国剑麻组培苗的单株鲜质量。
不同小写字母表示在0.05水平上差异显著(P lt; 0.05)。下同。Different lowercase letters indicated significant differences at 0.05 levels (P lt; 0.05). The same below.
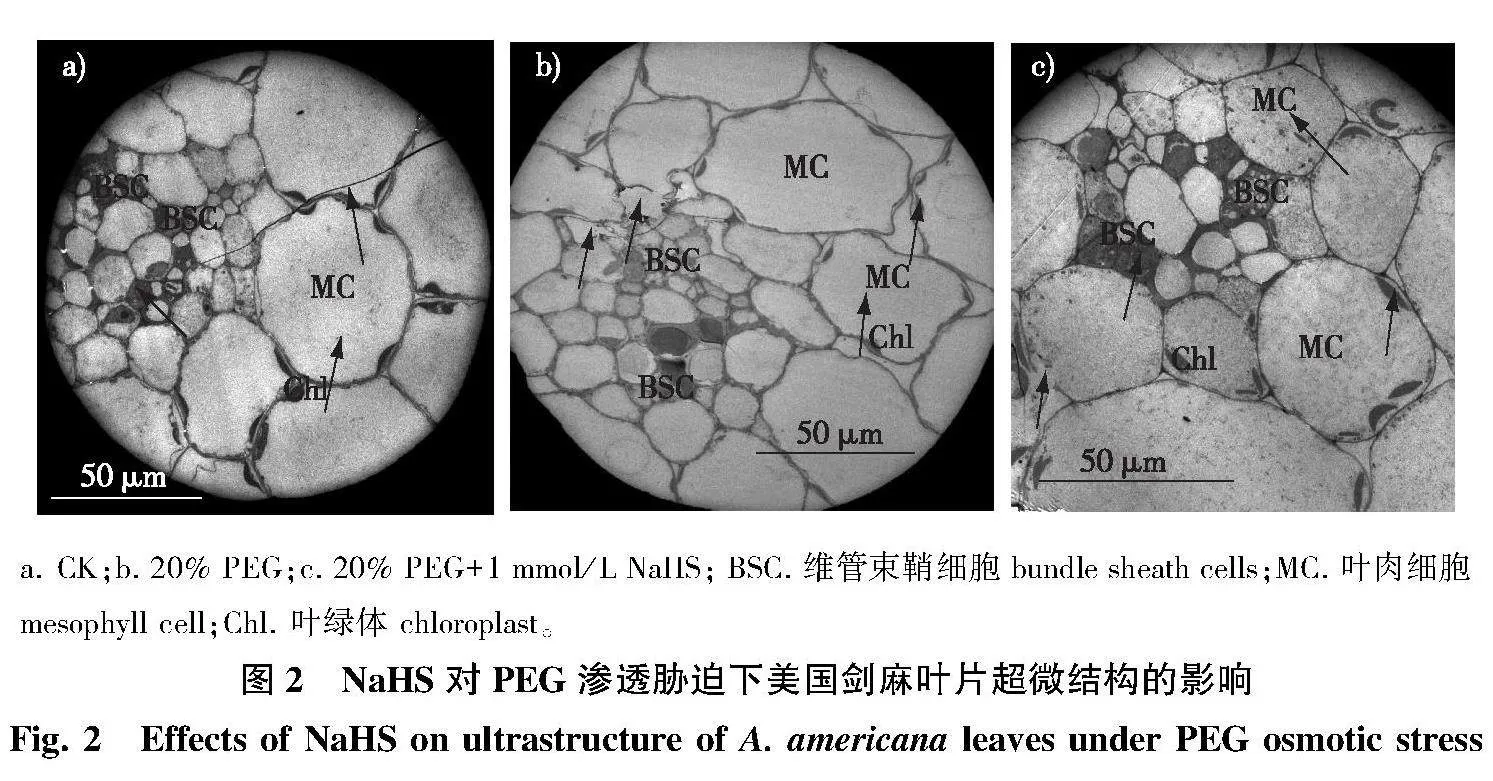
2.2" PEG与NaHS处理对美国剑麻组培苗超微结构的影响
在透射电镜下可以看出美国剑麻叶肉细胞没有栅栏组织和海绵组织的划分。对照植株叶片的维管束鞘细胞完整、体积小、细胞质浓厚,部分细胞有细胞核和线粒体,有的还没有形成,周围的叶肉细胞体积大,有的有叶绿体存在(图2a)。20%PEG处理的维管束细胞结构与对照相似,但维管束鞘细胞的细胞质内含物减少,细胞质浓度低,叶肉细胞叶绿体数量减少,有的细胞壁出现裂痕(箭头方向,图2b)。20%PEG+NaHS 处理的美国剑麻维管束鞘细胞结构完整,细胞核大,细胞质浓厚,叶肉细胞内有较多叶绿体,维管束周围叶肉细胞体积减小。与对照相比,叶肉细胞结构稍微有所损坏,部分细胞壁也出现了裂痕,但相对于20%PEG处理的伤害程度小,说明NaHS能够缓解渗透胁迫对美国剑麻的细胞伤害(图2c)。
2.3" PEG与NaHS处理对美国剑麻组培苗渗透调节物质的影响
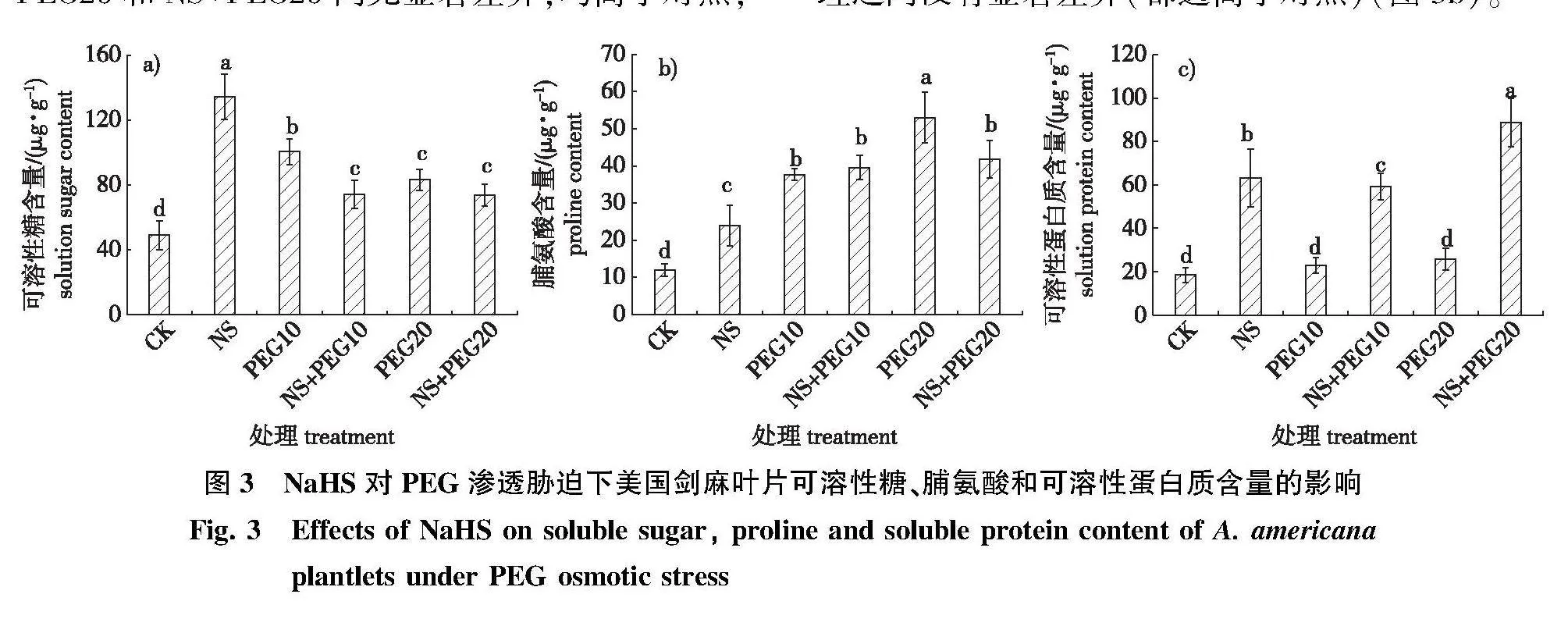
NaHS对渗透胁迫下美国剑麻可溶性糖含量的影响如图3a所示。添加PEG和NaHS的5个处理都显著提高了可溶性糖含量,其中单独采用NS和PEG10处理可使美国剑麻可溶性糖含量显著提高,分别比对照组提高了174.1%和104.9%(Plt;0.05)。而NS+PEG10的处理尽管较对照高,但比单独10%PEG处理降低了44.8%。NS+PEG10与PEG20和NS+PEG20间无显著差异,均高于对照,但低于10%PEG和 NaHS单独处理(图3a)。NaHS 和PEG 5个处理组均显著促进了美国剑麻组培苗脯氨酸的积累(图3b)。但与可溶性糖的变化不同,以PEG20处理的美国剑麻脯氨酸含量最高,较对照组提高了3.4倍(Plt;0.05);NS+PEG20处理的脯氨酸积累较单独PEG20处理的下降了21.2%,但比对照提高了2.5倍,说明适宜浓度的NaHS处理能够缓解高强度渗透胁迫造成的脯氨酸含量的过度积累。PEG10处理和NS+PEG10处理之间没有显著差异(都远高于对照)(图3b)。
单独添加NaHS和NS+PEG处理下也都显著提高了美国剑麻的可溶性蛋白含量,NS、NS+PEG10、NS+PEG20 3个处理分别比对照提高了2.4、2.2、3.8倍,说明添加NaHS 能提高美国剑麻的渗透调节能力。但单独添加10%和20% PEG美国剑麻的蛋白质含量稍高于对照,与对照之间没有显著差异(图3c)。
2.4" PEG与NaHS处理对剑麻组培苗MDA和H2O2 含量的影响
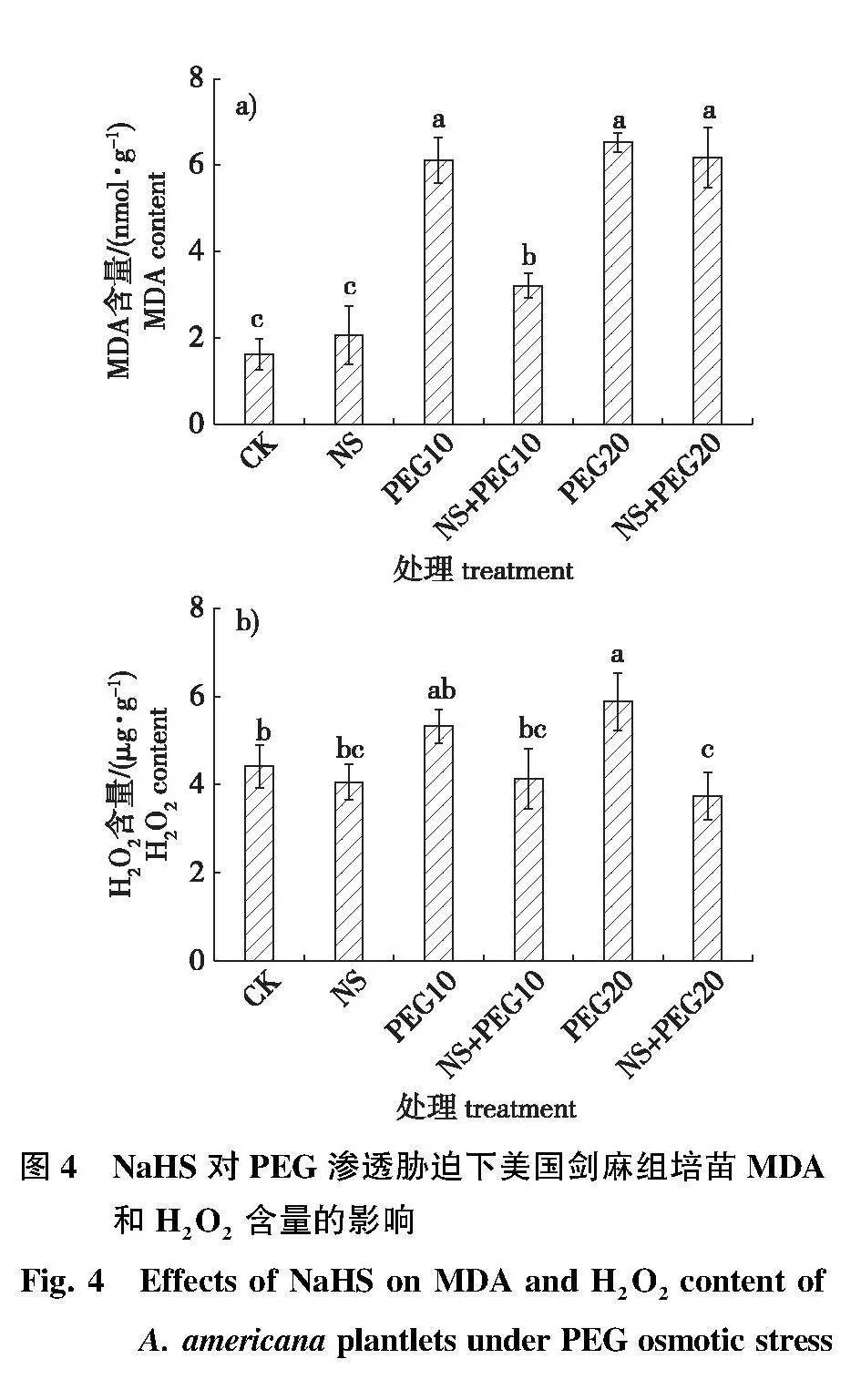
NaHS对PEG渗透胁迫下美国剑麻组培苗丙二醛(MDA)含量的影响见图4a。PEG20处理的美国剑麻MDA含量高于PEG10处理的,但两者之间没有显著差异,PEG10和PEG20处理后MDA含量分别是对照组的3.8倍和4.0倍(Plt;0.05)。而10%PEG添加1.0 mmol/L NaHS后MDA含量显著下降,NS+PEG10处理比PEG10处理MDA含量降低了47.64%(Plt;0.05)。而NS+PEG20与PEG20处理的MDA含量之间没有显著差异。单独添加1.0 mmol/L NaHS 处理的MDA 含量尽管有所提高,但与对照之间没有显著差异。
NaHS对渗透胁迫美国剑麻H2O2含量的变化见图4b,PEG10与对照相比剑麻H2O2含量差异不显著,而PEG20处理的剑麻组培苗中H2O2含量显著高于对照,比对照提高了33.5%(Plt;0.05)。NS+PEG20处理的H2O2含量较单独PEG20处理降低了36.4%,说明高浓度PEG胁迫下添加NaHS会降低美国剑麻组培苗H2O2积累。单独添加1.0 mmol/L NaHS 处理的H2O2 含量稍有下降,但与对照之间没有显著差异。
2.5" PEG与NaHS处理对美国剑麻组培苗抗氧化酶活性的影响
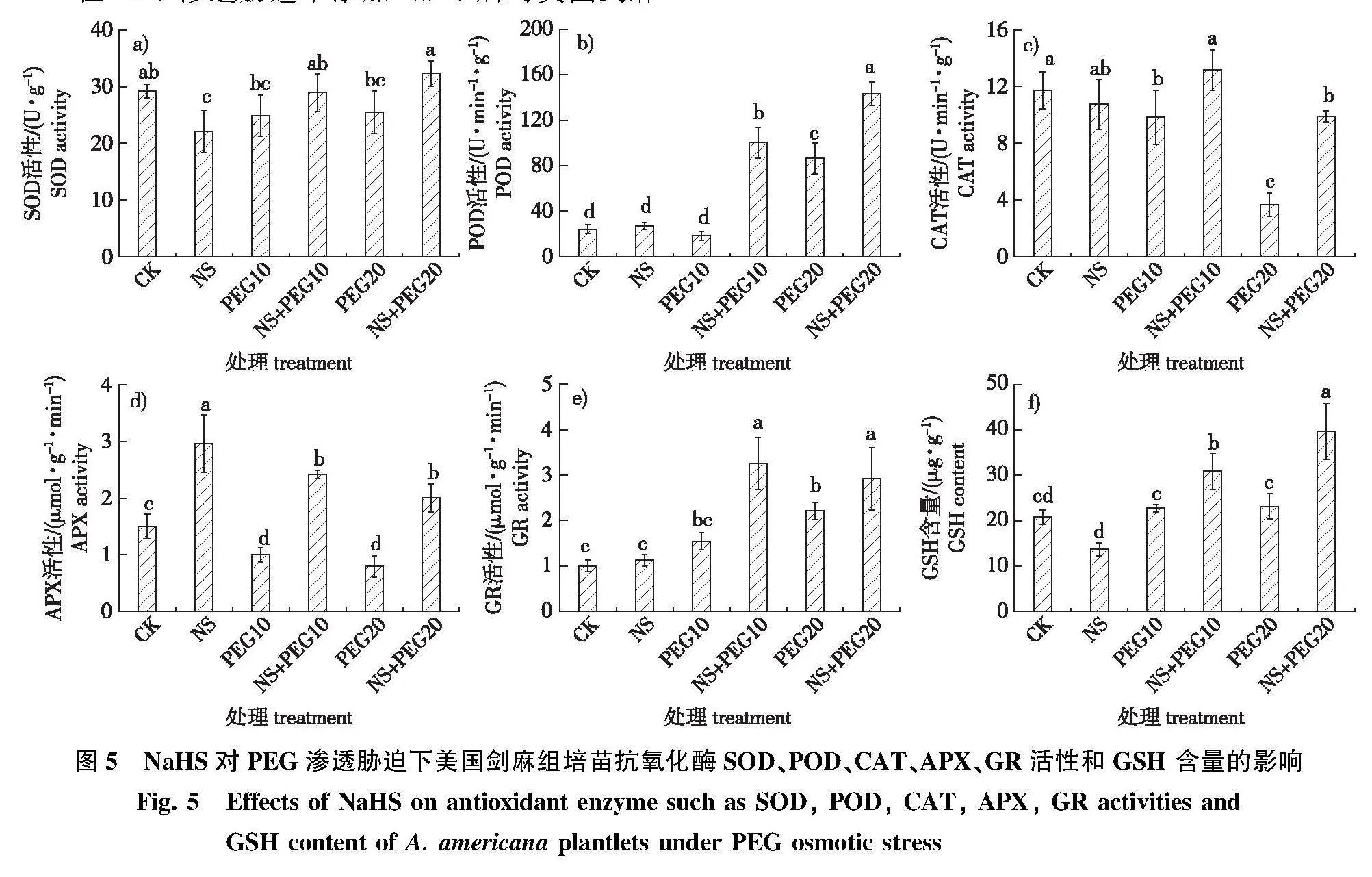
在PEG渗透胁迫下添加NaHS后对美国剑麻组培苗抗氧化酶如SOD、POD、CAT、APX、GR活性,以及GSH含量的影响见图5。对SOD 酶来说,单独添加NaHS与两种浓度PEG处理都使美国剑麻SOD活性出现下降,分别降低了24.6%、14.9%以及12.9%,但只有单独NS处理的与对照有显著差异(Plt;0.05)。在两种浓度PEG处理的基础上加入NaHS后,SOD活性都有所提高,NS+PEG10与NS+PEG20组分别较PEG10和PEG20提高了16.3%、26.9%,达到对照水平(图5a)。
POD活性在单独添加1.0" mmol/L NaHS和10%PEG处理时与对照没有明显差异;但NS+PEG10处理则能显著提高美国剑麻的POD活性,比PEG10处理提高了4.5倍,比对照提高了3.2倍(Plt;0.05)。PEG20处理的POD活性比对照提高了3.15倍,在此基础上添加NaHS使POD活性显著提高, NS+PEG20处理较PEG20处理提高了65.9%,比对照提高了4.9倍(Plt;0.05, 图5b)。
10%PEG和20%PEG单独处理都显著地降低了美国剑麻组培苗CAT的活性,分别比对照下降了16.3%和68.8%(Plt;0.05)。而在单独PEG处理的基础上添加NaHS 都显著地提高了CAT 的活性,NS+PEG10与NS+PEG20分别比PEG单独处理提高了33.9%和170.5%(Plt;0.05),特别是NS+PEG20处理的效果非常显著。单独添加NaHS与对照的CAT活性没有显著差异(图5c)。
NaHS对渗透胁迫下美国剑麻APX活性的影响与CAT活性的变化趋势相似,也是两种浓度的PEG处理美国剑麻组培苗APX活性显著地下降, PEG10与PEG20比对照组分别降低了33.3%和47.2%。在两种浓度PEG处理的基础上加入NaHS后,美国剑麻APX活性都显著高于对照组。但单独NaHS处理更显著提高了APX 的活性,比对照提高了97.2%(图5d)。
除单独NaHS处理和PEG10处理时美国剑麻组培苗的GR活性与对照没有显著差异外,其他3个处理都显著提高了GR的活性,且在PEG处理的同时添加NaHS后,GR的活性比单独处理的活性更高,其中NS+PEG10处理使得美国剑麻GR活性达到最大值,比PEG10处理提高了110.8%,比对照提高了2.2倍(Plt;0.05)。而NS+PEG20处理较PEG20处理提高了32.1%,比对照提高了1.9倍(图5e)。
对抗氧化剂GSH含量来讲,10%PEG和20%PEG两种处理都稍提高了美国剑麻GSH的含量,但与对照之间都没有显著差异,而在NS+PEG10、NS+PEG20处理后GSH含量都显著提升,较单独PEG10、PEG20处理组分别提高了35.7%和71.5%(Plt;0.05)。单独添加NaHS美国剑麻组培苗的GSH 含量却出现了下降(图5f)。
3" 讨" 论
剑麻属植物具有耐干旱瘠薄的特点,本研究也证实了这一点,美国剑麻组培苗在20%PEG高浓度处理下仍然存活,较其他植物如板栗、烟草、杨树(Populus sp.)等耐性强。但在高浓度渗透胁迫下单株鲜质量较对照降低,说明其生长受到了抑制,添加1.0 mmol/L NaHS可缓解这种胁迫。从超微结构来看,20%PEG 胁迫后, 其叶肉细胞的体积较对照变小,细胞壁出现裂痕,细胞受害明显,但添加H2S供体NaHS后,细胞的受害程度降低,维管束及维管束鞘细胞质浓厚,说明H2S能通过维持维管束的结构起到保水和储水的功能,缓解渗透胁迫。干旱情况下叶片解剖结构的变化在CAM植物中也有发现,如火龙果气孔密度和气孔大小均降低, 八宝景天等植物出现异质细胞、细胞壁加厚现象。
渗透胁迫下植物会主动积累渗透调节物质来降低细胞中的渗透势,稳定细胞结构,是其适应环境胁迫的保护机制之一。本研究中添加10%~20% PEG可显著提高可溶性糖和脯氨酸的含量,但20%PEG处理的可溶糖含量较10%PEG处理的低,而脯氨酸含量在20%PEG处理下显著高于10%PEG;PEG处理下可溶性蛋白含量与对照比没有显著变化,这些结果表明美国剑麻在低渗透胁迫下可通过可溶性糖和脯氨酸等渗透调节物质调节渗透压,适应胁迫环境,而高浓度(20%PEG)下可溶性糖含量降低,脯氨酸过度积累,可能是美国剑麻受到干旱胁迫伤害的表现,这些现象与干旱胁迫下白枪杆(Fraxinus malacophylla)、越橘(Vaccinium duclouxii)等植物的表现相似。
本研究中10%PEG+NaHS处理的美国剑麻与单独10%PEG处理相比其脯氨酸和可溶性糖含量并没有显著增加,说明低渗透胁迫下,美国剑麻本身就可通过渗透调节作用适应干旱,不需要NaHS来缓解胁迫,这与干旱胁迫下外源H2S也没有提高燕麦可溶糖水平的结果一致。而20%PEG+NaHS处理后脯氨酸含量较单独PEG处理显著降低,说明NaHS可通过调控脯氨酸的过度积累缓解渗透胁迫对美国剑麻的伤害,使其适应干旱环境。研究表明,逆境情况下脯氨酸的过度积累会导致呼吸链电子的超载而外渗,破坏生物大分子的结构,因此高胁迫强度下脯氨酸的积累值越大说明植物受渗透胁迫的强度越大,H2S可能通过改善植物代谢和生化水平,使渗透调节物质处于合适的水平,从而提高抵抗渗透胁迫的能力,增强干旱胁迫的耐受性。
严重的渗透胁迫会导致植物的氧化胁迫,产生活性氧(reactive oxygen species,ROS,如O-·2、H2O2)和活性羰基物(reactive carbonyl species,RCS,如丙烯醛、丙二醛等),细胞内高浓度的活性氧和活性羰基物会导致细胞膜脂过氧化。丙二醛(MDA)是膜脂过氧化的主要产物,也是一种RCS,其含量能够反映植物受氧化损伤的程度。本研究中,随着渗透胁迫的增强,美国剑麻的H2O2 和MDA 含量都显著增加,说明美国剑麻在渗透胁迫下产生一定的活性氧(包括H2O2)导致膜脂过氧化伤害,而PEG处理添加NaHS均能显著降低剑麻H2O2的含量,低浓度PEG(10%)处理添加NaHS也能降低MDA的含量,而高浓度PEG添加NaHS后MDA 的降低程度不大。可见适宜浓度NaHS可以有效缓解渗透胁迫对美国剑麻细胞膜的损伤。这些结果与对烤烟、板栗的研究结果类似,但各植物处理采用NaHS的浓度有所不同,这可能是由于植物本身的抗逆性不同。
抗氧化酶SOD、POD、CAT、APX和GR是重要的ROS和RCS的清除剂,在细胞的Habere-Weiss反应和AsA-GSH循环(Foyer-Halliwell-Asada cycle)中维持着ROS和RCS的稳态。SOD、POD、CAT主要参与Habere-Weiss反应,而APX将Habere-Weiss反应和AsA-GSH循环交联在一起,利用AsA作为电子供体,催化H2O2生成DHA(单脱氢抗坏血酸)和H2O。GR是清除ROS并将氧化型谷胱甘肽(GSSG)转化为还原型谷胱甘肽(GSH)的关键酶,维持着GSH的稳态。另外GSH也参与HO· 的清除,并将其转变成各种RCS而起到解毒的作用。而H2S 与NO介导的信号上游组分相交联,NO·又可与HO·交联,构成整个植物体的氧化胁迫信号转导途径。
本研究中 SOD、CAT、APX 3个抗氧化酶在10%~20%PEG处理下都较对照出现显著下降,特别是20%PEG 处理的CAT酶及10%~20%PEG 处理的APX酶活性下降极为显著,且H2O2含量的增加,说明PEG处理对美国剑麻组培苗造成了一定的氧化胁迫,20%PEG处理更严重。但20%PEG处理显著提高了POD、GR酶的活性,说明美国剑麻在SOD、CAT、APX活性下降的情况下,可通过增强POD、GR抗氧化酶活性提高其抗氧化性能,这与板栗、白杆枪在干旱性情况下酶活性的变化不完全一致,可能与植物本身的抗逆性能力和遗传特性差异有关。本研究中美国剑麻组培苗在PEG+NaHS处理后都非常显著地提高了SOD、POD、CAT、APX、GR 5个酶活性和GSH的含量,特别是POD、APX、GR的活性甚至都超过了对照,这说明美国剑麻在干旱胁迫下启动了Habere-Weiss反应和AsA-GSH循环,外源H2S 通过调节抗氧化酶活性清除O-·2和H2O2,降低了MDA水平。另外H2S还通过与NO·信号的交联,提高了GSH(还原型谷胱甘肽)的水平,进而对活性羰基物进行了清除和解毒,减轻干旱胁迫对美国剑麻的伤害作用,促进其抗逆性。这些结果与在干旱胁迫下H2S促进板栗、烤烟中的抗氧化酶活性一致,说明H2S能够提高植物的抗旱性具有普遍性。
综上所述,美国剑麻组培苗在20%PEG高浓度处理下仍然存活,有一定的抗旱能力,但在胁迫状态下仍出现鲜质量减少,H2O2 和MDA 含量增加,产生氧化胁迫,这种胁迫可通过增加脯氨酸和可溶性蛋白的水平调节渗透压来缓解。在PEG存在情况下,H2S 供体NaHS通过降低脯氨酸水平减少其在干旱胁迫下的过度积累;通过调节SOD、CAT、APX、POD、GR酶活性启动抗氧化系统,降低H2O2等活性氧物质的积累, 提高抗氧化水平;还通过提高还原型谷胱甘肽水平清除活性羰基物,降低美国剑麻的脂质过氧化水平,增强其抗逆性,使其更加适应干旱的环境。
参考文献(reference):
[1]SOMERVILLE C,YOUNGS H,TAYLOR C,et al.Feedstocks for lignocellulosic biofuels.Science,2010,329(5993):790-792.DOI: 10.1126/science.1189268.
[2]陈莉莎.我国剑麻种质资源纤维强力性能研究.中国麻业科学,2023,45(1):33-40,48.CHEN L S.Research of fiber strength of sisal germplasm resources in China.Plant Fiber Sci China,2023,45(1):33-40,48.DOI: 10.3969/j.issn.1671-3532.2023.01.005.
[3]FIGUEREDO-URBINA C J,LVAREZ-ROS G D,GARCA-MONTES M A,et al.Morphological and genetic diversity of traditional varieties of agave in Hidalgo State,Mexico.PLoS One,2021,16(7):e0254376.DOI: 10.1371/journal.pone.0254376.
[4]BARRETO S M A G,CADAVID C O M,MOURA R A O,et al.In vitro and in vivo antioxidant activity of Agave sisalana agro-industrial residue.Biomolecules,2020,10(10):1435.DOI: 10.3390/biom10101435.
[5]MARONE M P,CAMPANARI M F Z,RAYA F T,et al.Fungal communities represent the majority of root-specific transcripts in the transcriptomes of Agave plants grown in semiarid regions.Peer J,2022,10:e13252.DOI: 10.7717/peerj.13252.
[6]HUANG X,XIAO M,XI J G,et al.De novo transcriptome assembly of Agave H11648 by illumina sequencing and identification of cellulose synthase genes in Agave species.Genes,2019,10(2):103.DOI: 10.3390/genes10020103.
[7]WINTER K,HOLTUM J A M. Crassulacean acid metabolism:a continuous or discrete trait?.New Phytol,2015,208(1):73-78.DOI: 10.1111/nph.13446.
[8]LIU D G,HU R B,ZHANG J,et al.Overexpression of an Agave phospho enol pyruvate carboxylase improves plant growth and stress tolerance.Cells,2021,10(3):582.DOI: 10.3390/cells10030582.
[9]李俊璋,秦源,肖强,等.景天酸代谢植物分子生物学研究进展及应用潜力.园艺学报,2022,49(12):2597-2610.LI J Z,QIN Y,XIAO Q,et al.Recent advances in molecular biology of crassulacean acid metabolism plants and the application potential of CAM engineering.Acta Hortic Sin,2022,49(12):2597-2610.DOI: 10.16420/j.issn.0513-353x.2021-0835.
WANG C L,DENG Y Z,LIU Z S,et al.Hydrogen sulfide in plants:crosstalk with other signal molecules in response to abiotic stresses.Int J Mol Sci,2021,22(21):12068.DOI: 10.3390/ijms222112068.
GAO S H,WANG Y F,ZENG Z,et al.Integrated bioinformatic and physiological analyses reveal the pivotal role of hydrogen sulfide in enhancing low-temperature tolerance in alfalfa.Physiol Plant,2023,175(2):e13885.DOI: 10.1111/ppl.13885.
GARCA-CALDERN M,VIGNANE T,FILIPOVIC M R,et al.Persulfidation protects from oxidative stress under nonphotorespi-ratory conditions in Arabidopsis.New Phytol,2023,238(4):1431-1445.DOI: 10.1111/nph.18838.
RAZA A,TABASSUM J,MUBARIK M S,et al.Hydrogen sulfide:an emerging component against abiotic stress in plants.Plant Biol,2022,24(4):540-558.DOI: 10.1111/plb.13368.
牟雪姣,张远兵,吴燕,等.外源H2S缓解黄瓜种子萌发过程中干旱胁迫伤害的生理机制.西北农业学报,2018,27(9):1328-1334.MU X J,ZHANG Y B,WU Y,et al.Physiological mechanism of exogenous H2S in alleviating drought stress-induced injury in germination of cucumber seed.Acta Agric Boreali Occidentalis Sin,2018,27(9):1328-1334.DOI: 10.7606/j.issn.1004-1389.2018.09.013.
WU X L,DU A Q,ZHANG S H,et al.Regulation of growth in peach roots by exogenous hydrogen sulfide based on RNA-Seq.Plant Physiol Biochem,2021,159:179-192.DOI: 10.1016/j.plaphy.2020.12.018.
LI H,GHOTO K,WEI M Y,et al.Unraveling hydrogen sulfide-promoted lateral root development and growth in mangrove plant Kandelia obovata:insight into regulatory mechanism by TMT-based quantitative proteomic approaches.Tree Physiol,2021,41(9):1749-1766.DOI: 10.1093/treephys/tpab025.
CHEN P,YANG W X,WEN M X,et al.Hydrogen sulfide alleviates salinity stress in Cyclocarya paliurus by maintaining chlorophyll fluorescence and regulating nitric oxide level and antioxidant capacity.Plant Physiol Biochem,2021,167:738-747.DOI: 10.1016/j.plaphy.2021.09.004.
孙晓莉,张鑫荣,田寿乐,等.外源硫化氢处理对板栗幼苗干旱胁迫抗性的影响.北方园艺,2017(15):7-12.SUN X L,ZHANG X R,TIAN S L,et al.Effect of exogenous hydrogen sulfide on resistance of drought stress of chestnut seedlings.North Hortic,2017(15):7-12.DOI: 10.11937/bfyy.20165060.
李冬,申洪涛,王艳芳,等.干旱胁迫下外源硫化氢对烤烟幼苗光合荧光参数及抗氧化系统的影响.西北植物学报,2019,39(9):1609-1617.LI D,SHEN H T,WANG Y F,et al.Effect of exogenous hydrogen sulfide on photosynthetic fluorescence para-meters and antioxidant system of flue-cured tobacco seedlings under drought stress.Acta Bot Boreali Occidentalia Sin,2019,39(9):1609-1617.DOI: 10.7606/j.issn.1000-4025.2019.09.1609.
李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000.LI H S.Principles and techniques of plant physiological biochemical experiment.Beijing:Higher Education Press,2000.
陈建勋,王晓峰.植物生理学实验指导.2版.广州:华南理工大学出版社,2006.
CHEN J X,WANG X F.Experimental instruction of plant physiology.2nd ed.Guangzhou:South China University of Technology Press,2006.
CHEN Y,YUAN B L,WEI Z H,et al.The ion homeostasis and ROS scavenging responses in ‘NL895’ poplar plantlet organs under in vitro salinity stress.In Vitro Cell Dev Biol-Plant,2018,54(3):318-331.DOI: 10.1007/s11627-018-9896-z.
魏子涵,袁斌玲,陈茜,等. 聚乙二醇处理对‘717’杂交杨组培苗的影响. 森林与环境学报,2017,37(4): 412-417. WEI Z H, YUAN B L CHEN X, et al. Effect of polyethylene glycol treatment on hybrid poplar ( Populus tremula × P. alba ‘717-1B4’) in vitro culture. Journal of Forest and Environment, 2017,37(4): 412-417. DOI: 10.13324/j.cnki. jfcf. 2017. 04. 005.
王荔,张雪,赵晓珍,等.火龙果对干旱胁迫的适应性研究.热带作物学报,2020,41(11):2237-2244.WANG L,ZHANG X,ZHAO X Z,et al.Drought adaptability of Hylocereus undatus.Chin J Trop Crops,2020,41(11):2237-2244.DOI: 10.3969/j.issn.1000-2561.2020.11.013.
申艳梅.景天科植物耐旱性及其机理的研究.呼和浩特:内蒙古农业大学,2010.SHEN Y M.Studies on drought resistance and the physiological mechanism in species Sedum L..Hohhot:Inner Mongolia Agricultural University,2010.
黎远东,江海霞,谢丽琼.植物盐胁迫适应性机制研究进展.植物遗传资源学报,2022,23(6):1585-1593.LI Y D,JIANG H X,XIE L Q.Review of plant adaptation mechanism to salt stress.J Plant Genet Resour,2022,23(6):1585-1593.DOI: 10.13430/j.cnki.jpgr.20220518003.
茶晓飞,董琼,段华超,等.干旱下白枪杆幼苗生物量及生理活性物质对钙添加的适应性调节.西北林学院学报,2023,38(3):10-17.CHA X F,DONG Q,DUAN H C,et al.Adaptive re-gulation of biomass and physiologically active substances in response to calcium addition in Fraxinus malacophylla seedlings under drought.J Northwest For Univ,2023,38(3):10-17.DOI: 10.3969/j.issn.1001-7461.2023.03.02.
李林宇,马靖恒,张璐瑶,等.6-BA预处理对干旱胁迫下越橘生理特性的影响.分子植物育种,2023(20):1-11.LI L Y,MA J H,ZHANG L Y,et al.Effects of 6-BA pretreatment on physiological characteristics of blueberry under drought stress.Mol Plant Breed,2023(20):1-11.
刘建新,刘瑞瑞,刘秀丽,等.外源硫化氢对盐碱胁迫下裸燕麦光合碳代谢的调控.植物生态学报,2023,47(3):374-388.LIU J X,LIU R R,LIU X L,et al.Regulation of exogenous hydrogen sulfide on photosynthetic carbon metabolism in Avena nude under saline-alkaline stress.Chin J Plant Ecol,2023,47(3):374-388.
张林,陈翔,吴宇,等.脯氨酸在植物抗逆中的研究进展.江汉大学学报(自然科学版),2023,51(1):42-51.ZHANG L,CHEN X,WU Y,et al.Research progress of proline in plant stress resistance.J Jianghan Univ (Nat Sci Ed),2023,51(1):42-51.DOI: 10.16389/j.cnki.cn42-1737/n.2023.01.006.
CHEN J,SHANG Y T,WANG W H,et al.Hydrogen sulfide-me-diated polyamines and sugar changes are involved in hydrogen sulfide-induced drought tolerance in Spinacia oleracea seedlings.Front Plant Sci,2016,7:1173.DOI: 10.3389/fpls.2016.01173.
YALCINKAYA T,UZILDAY B,OZGUR R,et al.The roles of reactive carbonyl species in induction of antioxidant defence and ROS signalling in extreme halophytic model Eutrema parvulum and glycophytic model Arabidopsis thaliana.Environ Exp Bot,2019,160:81-91.DOI: 10.1016/j.envexpbot.2019.01.009.
FENG K,LU J L,CHEN Y,et al.The coordinated alterations in antioxidative enzymes,PeCu/ZnSOD and PeAPX2 expression facilitated in vitro Populus euphratica resistance to salinity stress.Plant Cell Tiss Organ Cult,2022,150(2):399-416.DOI: 10.1007/s11240-022-02292-7.
PANDA A, RANGANI J, PARIDA A K.Cross talk between ROS homeostasis and antioxidative machinery contributes to salt tole-rance of the xero-halophyte Haloxylon salicornicum . Environ Exp Bot, 2019, 166:1-19. https://doi. org/10. 1016/j. envex pbot. 2019. 103799.
MUKHERJEE S,CORPAS F J.Crosstalk among hydrogen sulfide (H2S),nitric oxide (NO) and carbon monoxide (CO) in root-system development and its rhizosphere interactions:a gaseous interactome.Plant Physiol Biochem,2020,155:800-814.DOI: 10.1016/j.plaphy.2020.08.020.
ZHOU X R,JOSHI S,PATIL S,et al.Reactive oxygen,nitrogen,carbonyl and sulfur species and their roles in plant abiotic stress responses and tolerance.J Plant Growth Regul,2022,41(1):119-142.DOI: 10.1007/s00344-020-10294-y.
(责任编辑" 李燕文)

