一株马铃薯干腐病生防菌的鉴定及其抑菌活性研究
吴慧芳 蒙耀 石晖琴 魏琳 沈硕

摘要
鐮孢菌引起的马铃薯干腐病是影响马铃薯贮存期间产量与品质的重要病害之一。寻找高效低毒的防治马铃薯干腐病的生防药剂对提高马铃薯的产量与质量具有重要意义。本研究以腐皮镰孢Fusarium solani为病原菌,测定分离自马铃薯块茎的菌株219CJK2的抑菌活性。该菌株发酵液、无菌发酵液、菌悬液、胞内组分以及挥发性有机物对腐皮镰孢均具有抑菌活性,抑制率分别为93.37%、61.92%、80.82%、44.01%和49.16%。结合形态学、生理生化特征和多基因系统发育树构建鉴定其为贝莱斯芽胞杆菌Bacillus velezensis。马铃薯切片试验和马铃薯块茎试验表明,当菌株发酵液浓度为1×109 cfu/mL时,对病原菌的抑制效果最好。除此之外,菌株可以分泌蛋白酶、淀粉酶、纤维素酶,具有溶磷能力和生物膜形成能力,但不具有溶血性,并且对供试的其他6种病原真菌有较强的抑菌活性。研究表明贝莱斯芽胞杆菌219CJK2抑菌谱广,具有生物安全性,对腐皮镰孢有较强的抑菌活性,在植物病害防治中具有一定的应用潜力,可为马铃薯干腐病生防制剂的开发奠定基础。
关键词
马铃薯干腐病; 腐皮镰孢; 贝莱斯芽胞杆菌; 生物防治
中图分类号: S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2023408
Identification of a biocontrol bacterium against potato dry rot and its antibacterial activity
WU Huifang, MENG Yao, SHI Huiqin, WEI Lin, SHEN Shuo*
(Key Laboratory of Biotechnology in QinghaiTibet Plateau, Ministry of Education, Key Laboratory of Potato
Breeding in Qinghai Province, Engineering Research Center of Northwest Potato, Ministry of Education,
Qinghai Academy of Agricultural and Forestry Sciences, Qinghai University, Xining 810016, China)
Abstract
Potato dry rot caused by Fusarium is one of the important diseases affecting both the yield and quality of potato during storage. Finding highly efficient and lowtoxicity biocontrol agents to control potato dry rot holds great significance in improving the yield and quality of potato. In this study, the antifungal activity of strain 219CJK2 isolated from potato tubers against Fusarium solani was determined. The results revealed that various components of the strain, including the fermentation broth, sterile fermentation broth, bacterial suspension, intracellular components, and volatile organic compounds, exhibited notable antifungal activity against F.solani, with an inhibition rate of 93.37%, 61.92%, 80.82%, 44.01% and 49.16%, respectively. A combination of morphological, physiological, and biochemical characteristics, along with multigene phylogenetic analysis, it was identified as Bacillus velezensis. Antifungal test using potato slice and tubers showed that the optimal control effect was achieved when the concentration of the fermentation broth was 1×109 cfu/mL. In addition, the strain could secrete proteases, amylases, and cellulases, has along with the ability to dissolve phosphate and form biofilm, but it lacked hemolysis activity and displayed strong antifungal activity against six other pathogenic fungi. These results showed that B.velezensis 219CJK2 had a broad antifungal spectrum, biosafety, and strong antifungal activity against F.solani. Our study suggests its potential application in the prevention and control of plant diseases, thereby laying a foundation for the development of biocontrol agents for potato dry rot.
Key words
potato dry rot; Fusarium solani; Bacillus velezensis; biological control
马铃薯Solanum tuberosum L.为茄科Solanaceae茄属Solanum的一年生草本植物,栽培范围广、产量高,是仅次于小麦、玉米、水稻之外主要的非谷类主粮作物[1]。在马铃薯栽培和贮藏期间会发生多种病害,其中由镰孢菌Fusarium spp.引起的马铃薯干腐病发生普遍,严重影响马铃薯的产量和品质,并给加工业和消费者带来重大损失[2]。该病害在马铃薯栽培期和贮藏期均可发生,主要危害块茎。发病初期薯块表面出现黑褐色凹陷病斑,随后扩大形成较多轮纹状褶皱;后期薯块内部变空,空腔内布满菌丝,整个薯块变硬、变轻、干缩,呈灰褐色或深褐色[3]。
马铃薯干腐病病原菌以菌丝体或孢子在病残组织或土壤中越冬,可以在土壤中存活多年,给该病害的防治带来很大挑战[4]。迄今为止,尚未有抗所有致病镰孢的马铃薯品种,且不同镰孢菌的致病力和危害方式也不同[5]。目前对马铃薯干腐病主要采取化学防治的手段,常用药剂有噻菌灵、抑霉唑和仲丁胺等[67]。但长期使用化学药剂会导致病菌产生抗药性和耐药性,降低化学药剂的防治效果。因此使用对人体和生态环境无害的生防菌菌剂替代化学药剂,已成为世界范围内植物病害防治的方向。
芽胞杆菌作为生防菌的一大类,具有抗逆性强和抑菌谱广的特点,被广泛用于植物病害防治。多项研究表明,贝莱斯芽胞杆菌可有效防治核桃黑斑病[8]、番茄灰霉病[9]、烟草青枯病[10]、马铃薯炭疽病[11]等多种病害,并且一些芽胞杆菌具有溶磷,产IAA和铁载体的能力,并能促进植物生长[12]。沈硕[13]研究发现,特氏盐芽胞杆菌Halobacillus trueperi对马铃薯干腐病病原菌具有良好的抑制活性,抑制率为55.67%,其发酵液可以产生蛋白酶、淀粉酶和纤维素酶等,并且能产生脂肽类抑菌物质。目前,用于马铃薯干腐病的芽胞杆菌类生防菌的研究较少,本研究以腐皮镰孢为病原菌,从多方面评估贝莱斯芽胞杆菌219CJK2的抑菌活性,旨在丰富马铃薯生防菌资源,为马铃薯干腐病的生物防治提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
腐皮镰孢Fusarium solani,极细链格孢Alternaria tenuissima,互生链格孢Alternaria alternata,燕麦镰孢Fusarium avenaceum,球炭疽菌Colletotrichum coccodes,立枯丝核菌Rhizoctonia solani,灰葡萄孢Botrytis cinerea,由青海省农林科学院微生物研究室保存。菌株219CJK2分离自马铃薯块茎,由青海省农林科学院微生物研究室分离并保存。
1.1.2 供试培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,自然pH (不添加琼脂为PDB液体培养基)。
NB培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,蒸馏水1 000 mL,pH 7.2~7.4 (添加琼脂为NA固体培养基)。
蒙金娜无机磷培养基:葡萄糖10 g,硫酸铵0.5 g,氯化钠0.3 g,氯化钾0.3 g,硫酸镁0.3 g,硫酸亚铁0.03 g,硫酸锰0.03 g,磷酸钙10 g,琼脂16 g,蒸馏水1 000 mL,pH 7.0~7.5。
蛋白酶檢测培养基:脱脂奶粉12 g,琼脂粉20 g,蒸馏水1 000 mL,自然pH。
淀粉酶检测培养基:蛋白胨5 g,牛肉膏3 g,可溶性淀粉10 g,琼脂18 g,蒸馏水1 000 mL,自然pH。
纤维素酶检测培养基: 蛋白胨5 g,酵母浸粉5 g,羧甲基纤维素钠5 g,氯化钠2.5 g,磷酸二氢钾0.5 g,琼脂8 g,蒸馏水500 mL。
血琼脂培养基:胰酶消化酪蛋白10 g,氯化钠5 g,肉胃酶消化物5 g,玉米淀粉1 g,心胰酶消化物3 g,酵母浸粉5 g,琼脂15 g,蒸馏水1 000 mL,pH 7.1~7.5。121℃高压灭菌15 min,冷却至55℃左右加入7%~10%无菌脱纤维羊血,混匀后制成平板。无菌脱纤维羊血(货号TX0020100ml)购自北京索莱宝科技有限公司。
1.2 试验方法
1.2.1 菌株219CJK2对腐皮镰孢的抑菌活性
采用平板对峙法[14],将腐皮镰孢在PDA平板上于28℃黑暗培养5 d,在菌落边缘打取直径7 mm的菌饼,置于PDA平板中心,在距离菌饼25 mm相对四点处,用接种针点接生防菌株,以不接种生防菌株为空白对照。待对照菌丝快长满整个培养皿时测量菌落直径,并计算生防菌株对腐皮镰孢的抑制率,每个处理重复3次。抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。在对峙平板上挑取病原菌菌落边缘菌丝,置于光学显微镜下观察病原菌菌丝形态。
1.2.2 菌株219CJK2培养液不同组分对腐皮镰孢的抑菌活性
菌株种子液制备:挑取菌株219CJK2单菌落接種在NB液体培养基中,28℃,180 r/min过夜培养,即为种子液。
发酵液制备:将种子液按1%接种量接种到NB液体培养基中,28℃,180 r/min培养72 h,获得发酵液。
无菌发酵液制备:将发酵液在4℃,12 000 r/min离心15 min,收集上清,经0.22 μm孔径滤膜过滤除去菌体,即为无菌发酵液。
菌悬液制备:将发酵液在4℃,12 000 r/min离心15 min,收集菌体,使用PBS缓冲液清洗3遍后,加入PBS缓冲液至原体积,即为菌悬液。
胞内组分制备:将菌悬液在冰浴下破碎6 s,间隔6 s,破碎20 min,4℃,12 000 r/min离心15 min,收集上清,即为胞内组分。
在锥形瓶中加入90 mL PDA培养基并灭菌,待培养基冷却至50℃左右分别加入10 mL发酵液,无菌发酵液,菌悬液和胞内组分,使各组分的最终含量为10% (V/V),摇匀后倒平板,以不添加其他成分的PDA培养基为对照,每处理重复3次。平板凝固后在平板中央接入直径为7 mm的腐皮镰孢菌饼,28℃培养7 d,测量菌落直径,计算抑菌率。
1.2.3 菌株219CJK2产生的挥发性有机物对腐皮镰孢的抑菌活性
采用平板对扣法,将菌株219CJK2的种子液100 μL涂布于NA平板上,将7 mm的腐皮镰孢菌饼接种于PDA平板中央,将2个平板对扣,用封口膜密封,28℃黑暗培养7 d,测量菌落直径,计算抑菌率。每处理重复3次,对照使用空白NA平板。
1.2.4 菌株219CJK2的鉴定
1.2.4.1 形态学鉴定
参照《常见细菌系统鉴定手册》[15]对生防菌株219CJK2进行形态学特征观察。将菌株在NA平板上划线,35℃培养48 h,观察记录菌落形态、颜色和透明程度,并对菌株219CJK2进行革兰氏染色并置于显微镜下观察。
1.2.4.2 生理生化鉴定
参照《常见细菌系统鉴定手册》[15]的方法对生防菌株219CJK2进行甘露醇、乳糖、柠檬酸盐、丙酸盐的利用,耐盐性,VP试验,硝酸盐还原等生理生化特性鉴定。
1.2.4.3 分子生物学鉴定
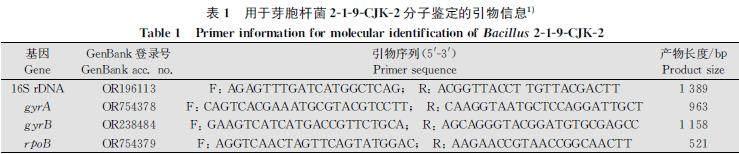
利用细菌基因组DNA提取试剂盒提取菌株219CJK2基因组DNA,选择可用于鉴定芽胞杆菌种属的保守基因16S rDNA、DNA回旋酶亚基A(DNA gyrase subunit A, gyrA)、DNA回旋酶亚基B(DNA gyrase subunit B, gyrB)和RNA聚合酶β亚基(RNA polymerase subunit β, rpoB)进行PCR扩增与测序。PCR扩增产物用1%琼脂糖凝胶电泳进行检测后回收,送至艾优稷生物科技(西安)有限公司测序,所得序列上传至NCBI获得登录号(表1)。以软件MEGA 7.0和Sequence Matrix将16S rDNA、gyrA、gyrB、rpoB的基因序列连接后比对,采用最大似然法(自展值设为1 000)构建系统进化树,确定219CJK2分类地位[16]。
1.2.5 菌株219CJK2发酵液对马铃薯干腐病菌的抑制作用
菌株219CJK2不同浓度发酵液制备:按照1.2.2制备生防菌株发酵液,用空白培养基将发酵液分别稀释为1×105、1×106、1×107、1×108、1×109 cfu/mL。
病原菌孢子悬浮液制备:将腐皮镰孢Fusarium solani菌饼接种于PDB培养基中,28℃,180 r/min培养4 d,用3层无菌纱布过滤除去菌丝,滤液在4℃,10 000 r/min离心10 min,弃上清,用无菌水将孢子浓度调整为1×107个/mL。
1.2.5.1 马铃薯切片抑菌试验
参照Loria等[17]的方法,用马铃薯块茎切片法评价菌株219CJK2不同浓度发酵液对腐皮镰孢的抑菌活性。用自来水洗净马铃薯上的泥土,在室温下晾干后用1%的次氯酸钠溶液消毒10 min后切片(直径27 mm,厚度3 mm)。将马铃薯切片放在不同浓度的发酵液中浸泡15 min,以在无菌水中浸泡15 min为对照,置于含有湿润无菌滤纸的培养皿中。2 h后接种直径为5 mm的F.solani菌饼。每处理3次重复,在28℃条件下黑暗培养5 d,观察病原菌在块茎切片上受抑制情况及马铃薯切片发病情况。
1.2.5.2 马铃薯块茎抑菌试验
参照Zhang等[18]的方法,评价不同浓度发酵液对马铃薯干腐病的防治效果。用自来水洗净马铃薯上的泥土,在室温下晾干后用1%的次氯酸钠溶液消毒10 min,在超净台上晾干。用无菌打孔器在马铃薯块茎表面制造1个圆形伤口(直径5 mm,深7 mm)。分别接种不同浓度的219CJK2发酵液40 μL,以无菌水作为对照。2 h后,每个创面接种40 μL F.solani孢子悬浮液(1×107个/mL)。自然干燥后,置于28℃,相对湿度90%~95%的培养箱中贮藏7 d,测量其病灶直径及腐烂情况。抑菌率=(对照病灶直径-处理病灶直径)/(对照病灶直径-5 mm)×100%。每处理重复3次,每次10个马铃薯块茎。
1.2.6 菌株219CJK2胞外酶活性、解磷能力检测及溶血安全性的评价
按照1.2.2制备生防菌种子液。采用透明圈法测定生防菌株219CJK2的产酶能力。在蛋白酶检测培养基、淀粉酶检测培养基和蒙金娜无机磷培养基平板上各打3孔(d=7 mm),每孔加入100 μL种子液,28℃恒温培养3 d,查看蛋白酶检测平板是否出现水解圈,有水解圈表明菌株能产生蛋白酶。将鲁戈氏碘液加入淀粉酶检测平板,若淀粉酶检测培养基出现水解圈,表明菌株能产生淀粉酶。将适量0.1%刚果红染液加入纤维素酶检测平板,静置染色15 min,用NaCl溶液冲洗,观察是否出现黄色晕圈,若有则表明菌株能产生纤维素酶。查看蒙金娜无机磷平板是否出现水解圈,有水解圈表明菌株有解磷能力。将菌株划线接种于血琼脂平板上,置于35℃恒温培养箱中倒置培养24 h,观察菌株溶血现象,判断其安全性。
1.2.7 菌株219CJK2生物膜形成能力检测
在6孔板中加入5 mL LB培养基,而后接种新鲜过夜培养的500 μL种子液,置于35℃培养箱分别静置培养24 h和48 h;小心取出6孔板,用无菌注射器小心吸出6孔板中生物膜下的培养基和游离细胞,用无菌PBS轻轻柔洗1遍后,加入5 mL甲醇溶液固定15 min;小心弃去甲醇溶液,在室温下静置至生物膜干燥,加入5 mL 1%结晶紫溶液染色15 min,小心弃去染色剂,用无菌PBS将染液洗净,倒置放在37℃恒温培养箱中烘干;加入5 mL 33%冰醋酸溶液在37℃温浴30 min使生物膜完全溶解,分光光度计测定OD590。每处理重复6次,以空白培养基为对照。
1.2.8 菌株219CJK2抑菌谱测定
参照1.2.1中平板对峙法测定菌株219CJK2对其他6种病原菌的抑菌活性。
2 结果与分析
2.1 菌株219CJK2对腐皮镰孢的抑菌活性
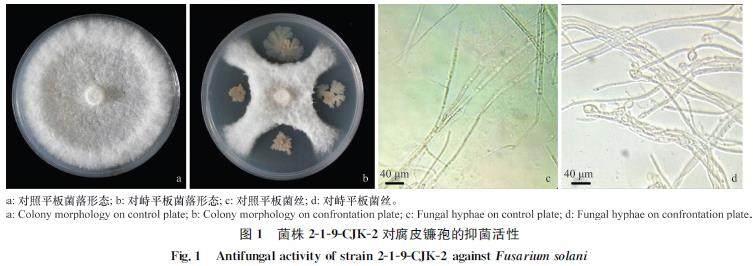
平板对峙试验结果显示,当对照菌落长至7.76 cm時,对峙菌落仅长至3.21 cm,生防菌对腐皮镰孢有很强的抑菌活性,菌丝生长抑制率为64.45%。正常的腐皮镰孢可形成完整的辐射状菌落,而生防菌株219CJK2能明显抑制腐皮镰孢菌丝的生长。使用显微镜观察对峙菌丝和对照菌丝,发现与正常生长的腐皮镰孢菌丝相比,与219CJK2对峙培养的腐皮镰孢菌丝顶端膨大,且形成不规则畸变,整个菌丝呈不规则弯曲凸起状(图1)。
2.2 菌株219CJK2不同组分对腐皮镰孢的抑菌活性
使用添加菌株219CJK2不同组分的培养基进行抑菌活性测定,不同组分对腐皮镰孢均有抑菌活性(表2)。添加菌株219CJK2发酵液的抑菌活性最高,抑菌率为93.37%;添加菌悬液对腐皮镰孢的抑菌率为80.82%;添加无菌发酵液对腐皮镰孢抑菌率为61.92%,添加胞内活性组分对腐皮镰孢生长抑制能力较弱,抑菌率为44.01%。
2.3 菌株219CJK2挥发性有机物对腐皮镰孢的抑菌活性
腐皮镰孢经菌株219CJK2挥发性有机物处理7 d后,对照菌落直径为7.82 cm,处理菌落直径为4.32 cm,菌丝生长明显受到抑制,抑菌率为49.16%,表明菌株219CJK2挥发性有机物对腐皮镰孢有较好的抑菌活性。
2.4 菌株219CJK2的鉴定结果
2.4.1 形态学鉴定
菌株219CJK2在NA平板上生长状态良好,35℃培养48 h后,菌落圆形或不规则形,边缘光滑湿润,表皮有褶皱,乳白色不透明,挑取时呈黏稠状。显微镜观察菌株呈单细胞杆状,革兰氏染色呈阳性(图2)。
2.4.2 生理生化鉴定
菌株219CJK2能利用甘露醇、乳糖和葡萄糖,VP试验阳性,能在7%氯化钠、pH 5.7条件下生长,不能利用柠檬酸盐和丙酸盐,不能还原硝酸盐,不产生IAA(表3)。
2.4.3 分子生物学鉴定
基于菌株219CJK2的16S rDNA、gyrA、gyrB和rpoB基因序列,构建219CJK2多基因系统进化树(图3)。结果表明,菌株219CJK2与贝莱斯芽胞杆菌LMG 22478聚在同一支。综合菌落形态、生理生化和分子生物学鉴定结果,最终将菌株219CJK2鉴定为贝莱斯芽胞杆菌Bacillus velezensis。
2.5 菌株219CJK2发酵液对马铃薯干腐病的抑制效果
2.5.1 马铃薯切片抑菌试验结果
不同浓度的219CJK2发酵液对腐皮镰孢引起的马铃薯切片腐烂有不同的抑制效果(图4A)。对照切片上布满菌丝,且呈现出褐变。与对照相比,1×109 cfu/mL的219CJK2处理防治效果最好,切片没有发生褐变,菌丝在切片上几乎不生长,抑制效果呈现浓度依赖性。
2.5.2 马铃薯块茎抑菌试验结果
菌株219CJK2对马铃薯块茎上腐皮镰孢的抑制效果如图4B和表4。由图表可看出,马铃薯块茎的病灶直径随着发酵液浓度增加而减小,且明显小于对照。防治效果随着发酵液浓度的增加,呈上升趋势。1×105、1×106、1×107、1×108 cfu/mL和1×109 cfu/mL浓度处理的防治效果分别为26.92%、40.44%、57.85%、80.99%和88.55%。结果表明,219CJK2对马铃薯干腐病具有明显的抑制效果。
2.6 菌株219CJK2胞外酶活性、解磷能力检测及溶血安全性的评价
胞外酶活性及解磷能力检测结果表明,生防菌219CJK2具有产蛋白酶、淀粉酶、纤维素酶和解磷的能力(图5)。
将菌株219CJK2接种于血琼脂平板中培养24 h后,溶血性试验结果如图5f所示。结果显示,在培养24 h后,血琼脂平板上未出现溶血现象,因此可认为菌株219CJK2不具溶血性,初步认为219CJK2为一株安全的菌株。
2.7 菌株219CJK2生物膜形成能力
结晶紫染色后,孔板内壁形成一圈紫环,说明菌株219CJK2能形成生物膜。静置培养24 h和48 h,其在590 nm处的吸光度分别为2.989和3.240,说明48 h生物膜形成量比24 h略有增长。
2.8 菌株219CJK2的抑菌谱
平板对峙试验结果表明,菌株219CJK2对其他6种病原菌均表现出良好的抑菌活性(图6),抑菌率均在55%以上,其中对球炭疽菌的抑菌活性最强,抑菌率可达86.60%,对互生链格孢的抑菌活性最弱,抑菌率为59.77%(表5)。
3 结论与讨论
农业生产上经常依赖化学药剂和化肥来获得丰厚的农业产出[19]。在过去的几个世纪里,农药对提高作物的质量和产量起到了非常重要的作用[20]。近年来,由于环境污染和农药残留对人类健康和地球生态系统的影响,人们对化学肥料和农药的态度发生了变化[21]。相对于化学防治,生物防治具有专一性,对环境友好,对人类和动物安全无害,是化学防治的良好替代措施[22]。芽胞杆菌已成为很有吸引力的生物菌剂,其能够产生坚硬、耐药的芽胞和抗生素,对多种病原菌都有抑制作用[23]。据报道,芽胞杆菌属中的贝莱斯芽胞杆菌可以抑制多种微生物病原体的生长,包括细菌、真菌和线虫[24]。
本研究从马铃薯块茎中分离得到一株生防细菌219CJK2,其对马铃薯干腐病病原腐皮镰孢有很强的抑菌活性,抑制率为64.45%。对其不同组分抑菌活性进行研究發现,发酵液的抑菌活性最高,抑制率为93.37%,胞内组分抑菌活性最低,抑制率为44.01%。微生物产生的次生代谢产物有的分泌于细胞外,形成细胞外次生代谢产物,有的则留在细胞内,形成细胞内次生代谢产物[25]。目前对于芽胞杆菌的抑菌活性物质的研究多集中在细胞外代谢产物,对于芽胞杆菌细胞内代谢产物研究甚少[26],菌株219CJK2的胞内抑菌活性物质有待进一步研究。无菌发酵液的抑制率为61.92%,有较强的抑菌活性,说明菌株219CJK2产生的胞外次级代谢产物对病原菌有良好的抑菌活性。
细菌产生的挥发性有机物(volatile organic compounds, VOCs),能够影响病原真菌的生长代谢,促进植物的生长。Fernando等[27]从油菜和大豆以及相关作物土壤中分离出的假单胞菌Pseudomonas adaceae产生的挥发物有抑制菌核活性和限制子囊孢子产生和萌发的作用。陈奕鹏等[28]从健康香蕉植株分离得到一株解淀粉芽胞杆菌Bacillus amyloliquefaciens BEB17,该菌株挥发性有机物可抑制多种病原菌生长,并能抑制病原菌孢子萌发。菌株219CJK2挥发性有机物对腐皮镰孢具有较强的抑菌活性,有开发为生物熏蒸剂的潜力,其产生的挥发性有机物物质还待进一步研究鉴定。
胞外酶可以通过溶解病原菌的细胞壁、抑制菌丝生长、孢子生长等,干扰病原菌对植物的侵染,从而防治植物病害,可以用来评估生防菌的生防潜力[2930]。已报道的相关胞外酶有几丁质酶、蛋白酶、纤维素酶等。张红霞等[31]发现致病疫霉Phytophthora infestans可诱导细菌HT6产生纤维素酶,且纤维素酶在抑制致病疫霉菌丝生长和引起菌丝体畸变中发挥了重要作用。土壤中含有较多磷元素,但大多以溶解度极低的化合物形态存在,难以被植物吸收和利用,自然环境中普遍存在可利用磷缺少的情况[3234]。芽胞杆菌是主要的解磷细菌之一,能通过分泌有机酸溶解土壤中的无机磷[35],促进植物生长和对其他微量营养元素的吸收。本研究获得的生防菌219CJK2能够分泌蛋白酶、淀粉酶和纤维素酶,同时具有溶磷能力,表明分泌水解酶是其抑菌机理之一,且菌株219CJK2具有潜在的促生能力。
生防菌在植物体内成功定殖直接决定其生防能力,而菌株生物膜的形成是菌株定殖成功的关键因素。司方洁等[9]通过构建贝莱斯芽胞杆菌5YN8生物膜相关基因突变体发现,生物膜形成能力增强突变体菌株在番茄叶面的定殖能力增强,对番茄灰霉病的防治效果显著增强,为80.77%,而生物膜形成能力减弱突变体菌株在叶面的定殖能力显著降低,对灰霉病的防效显著降低,仅为16.02%。菌株219CJK2具有形成生物膜的能力,且随着时间增长,生物膜形成量增加。有溶血性的芽胞杆菌具有致病性,能引起人和动物的多种疾病[36]。菌株219CJK2溶血安全性试验表明,菌株不具有溶血性,可作为开发为生防菌剂的候选菌株。
本研究以腐皮镰孢为病原菌,检测贝莱斯芽胞杆菌219CJK2的抑菌活性。该菌株发酵液、无菌发酵液、菌悬液、胞内组分和挥发性有机物对腐皮镰孢均具有良好的抑菌活性。该菌株能分泌多种胞外酶,具有解磷能力、生物膜形成能力和溶血安全性,对其他6种植物病原菌均具有抑菌活性,是一株有应用潜力的生防菌株。接下来将进一步探索菌株219CJK2的抑菌机理,通过盆栽试验检测生防菌株实际抑菌效果和抑菌稳定性,为生防菌的开发和利用奠定基础。
参考文献
[1] CAMIRE M E, KUBOW S, DONNELLY D J. Potatoes and human health [J]. Critical Reviews in Food Science and Nutrition, 2009, 49(10): 823840.
[2] LUI L H, KUSHALAPPA A C. Response surface models to predict potato tuber infection by Fusarium sambucinum from duration of wetness and temperature, and dry rot lesion expansion from storage time and temperature [J]. Internal Journal of Food Microbiology, 2002, 76(1/2): 1925.
[3] 李金花, 王蒂, 柴兆祥, 等. 甘肅省马铃薯镰刀菌干腐病优势病原的分离鉴定[J]. 植物病理学报, 2011, 41(5): 456463.
[4] BOJANOWSKI A, AVIS T J, PELLETIER S, et al. Management of potato dry rot [J]. Postharvest Biology Technology, 2013, 84: 99109.
[5] 王文重, 高云飞, 闵凡祥, 等. 马铃薯镰刀菌干腐病研究进展及防控手段[J]. 植物保护, 2020, 46(5): 612.
[6] CARNEGIE S F, RUTHVEN A D, LINDSAY D A, et al. Effects of fungicides applied to seed potato tubers at harvest or after grading on fungal storage diseases and plant development [J]. Annals of Applied Biology, 2010, 116(1): 6172.
[7] WHARTON P S, KIRK W W, BERRY D, et al. Seed treatment applicationtiming options for control of Fusarium decay and sprout rot of cut seedpieces [J]. American Journal of Potato Research, 2007, 84(3): 237244.
[8] 王迪, 高岩, 吴小双, 等. 两株贝莱斯芽胞杆菌鉴定及其对薄壳山核桃黑斑病病原菌的拮抗效果[J]. 中国生物防治学报, 2022, 38(6): 15721581.
[9] 司方洁, 任金瑶, 黄涛祥, 等. 贝莱斯芽胞杆菌5YN8生物被膜在防治番茄灰霉病过程中的功能研究[J]. 中国生物防治学报, 2022, 38(5): 12231230.
[10]周向平, 滕凯, 肖启明, 等. 贝莱斯芽胞杆菌F10促生作用及对烟草青枯病的防治效果[J]. 烟草科技, 2022, 55(7): 916.
[11]李統华. 马铃薯炭疽菌生防细菌的筛选、鉴定及发酵工艺优化[D]. 兰州: 甘肃农业大学, 2022.
[12]HASHEM A, TABASSUM B, FATHI ABD ALLAH E. Bacillus subtilis: A plantgrowth promoting rhizobacterium that also impacts biotic stress [J]. Saudi Journal of Biological Sciences, 2019, 26(6): 12911297.
[13]沈硕. 中度嗜盐菌S61生防因子分析及其对马铃薯干腐病的防效[J]. 南方农业学报, 2021, 52(10): 26192631.
[14]ZHAO Yueju, SELVARAJ J N, XING Fuguo, et al. Antagonistic action of Bacillus subtilis strain SG6 on Fusarium graminearum [J/OL]. PLoS ONE, 2014, 9(3): e92486. DOI: 10.1371/journal.pone.0092486.
[15]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[16]LI Jieling, HU Ming, XUE Yang, et al. Screening, identification and efficacy evaluation of antagonistic bacteria for biocontrol of soft rot disease caused by Dickeya zeae [J/OL]. Microorganisms, 2020, 8(5): 697. DOI: 10.3390/microorganisms8050697.
[17]LORIA R, BUKHALID R A, CREATH R A, et al. Differential production of thaxtomins by pathogenic Streptomyces species in vitro [J]. Phytopathology, 1995, 85: 537541.
[18]ZHANG Xiaoyun, WU Feng, GU Ning, et al. Postharvest biological control of rhizopus rot and the mechanisms involved in induced disease resistance of peaches by Pichia membranefaciens [J/OL]. Postharvest Biology and Technology, 2020, 163(1): 111146. DOI:10.1016/j.postharvbio.2020.111146.
[19]GAGIC V, KLEIJN D, BLDI A, et al. Combined effects of agrochemicals and ecosystem services on crop yield across Europe [J]. Ecology Letter, 2017, 20(11): 14271436.
[20]SANCHEZ P A, BUOL S W. Soils of the tropics and the world food crisis [J]. Science, 1975, 188(4188): 598603.
[21]CULLEN M G, THOMPSON L J, CAROLAN J C, et al. Fungicides, herbicides and bees: A systematic review of existing research and methods [J/OL]. PLoS ONE, 2019, 14(12): e0225743. DOI: 10.1371/journal.pone.0225743.
[22]TEEM J L, ALPHEY L, DESCAMPS S, et al. Genetic biocontrol for invasive species [J/OL]. Frontiers Bioengineering Biotechnology, 2020, 8: 452. DOI: 10.3389/fbioe.2020.00452.
[23]GUAN Junfeng, ZENG Kaifang, CHEN Zhihui. Editorial: Postharvest disease management in fruits and vegetables: recent advances and mechanisms [J/OL]. Frontiers in Microbiology, 2023, 14: 1203010. DOI: 10.3389/fmicb.2023.1203010.
[24]RABBEE M F, ALI M S, CHOI J, et al. Bacillus velezensis: A valuable member of bioactive molecules within plant microbiomes [J/OL]. Molecules, 2019, 24(6): 1046. DOI: 10.3390/molecules24061046.
[25]刘霞, 李骞, 许贤, 等. 昆虫病原线虫共生菌YL001细胞内代谢产物抑菌作用研究初报[J]. 农药学学报, 2006, 8(1): 9598.
[26]XU Zhihui, MANDICMULEC I, ZHANG Huihui, et al. Antibiotic bacillomycin D affects iron acquisition and biofilm formation in Bacillus velezensis through a Btrmediated FeuABCdependent pathway [J]. Cell Reports, 2019, 29(5): 11921202.
[27]FERNANDO W G D, RAMARATHNAM R, KRISHNAMOORTHY A S, et al. Identification and use of potential bacterial organic antifungal volatiles in biocontrol [J]. Soil Biology Biochemistry, 2005, 37(5): 955964.
[28]陈奕鹏, 杨扬, 桑建伟, 等. 拮抗内生芽孢杆菌BEB17分离鉴定及其挥发性物质抑菌活性分析[J]. 植物病理学报, 2018, 48(4): 537546.
[29]李桂娥, 吳小芹. 水拉恩氏菌JZGX1及其诱变菌株对马尾松苗的促生效应[J]. 南京林业大学学报(自然科学版), 2014, 38(3): 8387.
[30]陈思宇, 陈志谊, 张荣胜. 水稻纹枯病菌拮抗细菌的筛选及鉴定[J]. 植物保护学报, 2013, 40(3): 211218.
[31]张红霞, 蒋继志, 张荷花, 等. 致病疫霉诱导细菌HT6产生纤维素酶发挥抑菌作用[J]. 河北农业大学学报, 2019, 42(4): 8287.
[32]GOLDSTEIN A H. Bacterial solubilization of mineral phosphates: Historical perspective and future prospects [J]. American Journal of Alternative Agriculture, 1986, 1(2): 5157.
[33]SUNDARA B, NATARAJAN V, HARI K. Influence of phosphorus solubilizing bacteria on the changes in soil available phosphorus and sugarcane and sugar yields [J]. Field Crops Research, 2002, 77(1): 4349.
[34]李雪艳, 张涛, 杨红梅, 等. 棉花黄萎病拮抗细菌产铁载体测定及其对抑菌活性的影响[J]. 微生物学通报, 2019, 46(5): 10741080.
[35]SANG Yue, JIN Long, ZHU Rui, et al. Phosphorussolubilizing capacity of Mortierella species isolated from rhizosphere soil of a poplar plantation [J/OL]. Microorganisms, 2022, 10(12): 2361. DOI: 10.3390/microorganisms10122361.
[36]王捷. 蘋果腐烂病生防芽孢杆菌的筛选鉴定及其防治效果初探[D]. 杨凌: 西北农林科技大学, 2022.
(责任编辑:杨明丽)

