山新杨谷胱甘肽S-转移酶PdbGST基因的克隆与胁迫表达分析
平晓帆 遇文婧 黄颖

摘要: 在植物中,谷胱甘肽S-转移酶是一类多功能酶,能够在其响应非生物胁迫中发挥作用。为研究该基因在杨树中的功能,本研究克隆了山新杨谷胱甘肽S-转移酶基因PdbGST及其启动子序列,对其进行生物信息学分析和表达特征分析。结果显示,PdbGST基因的开放阅读框(ORF)全长666 bp,编码221个氨基酸,其形成的蛋白质相对分子质量为25.57 kDa,为稳定亲水性酸性蛋白,定位于细胞质中。系统进化分析表明,山新杨PdbGST蛋白与山新杨中的XP_034926648蛋白的同源性最高。对克隆获取的2 000 bp启动子序列进行分析,结构显示该启动子序列中,含有多种响应非生物胁迫的顺式作用元件。荧光定量PCR分析显示PdbGST基因在山新杨根部表达量最高,其次在山新杨叶部也有较高表达量,相反在山新杨顶芽中表达量最低。此外,对PdbGST基因响应非生物胁迫分析显示,山新杨根部PdbGST基因受诱导后即出现持续且大量的表达。
关键词: 山新杨; 谷胱甘肽S-转移酶; 非生物胁迫; 表达模式
中图分类号: S 762. 8 文献标识码: A 文章编号:1001 - 9499(2024)03 - 0033 - 08
Analysis of Cloning, Identification and Expression Pattern of
Glutathione S-transferases Gene in Poplar
PING Xiaofan YU Wenjing HUANG Ying**
(Forestry Protection Institute of Heilongjiang Province, Heilongjiang Harbin 150081)
Abstract In plant, glutathione S-transferase (GST) refers to a multifunctional enzymes that plays an important role in abiotic stress modulation pathways. To investigate the function of GST in poplar trees, a PdbGST gene and its 2 000 bp promoter squence were cloned and analyzed in Populus davidiana×P. bolleana, and the expression pattern of it were also analyzed by RT-qPCR. The results showed that the open reading frame (ORF) length of PdbGST is 666 bp, which encodes 221 amino acids with the molecular weight is 25.57 kDa. The PdbGST is a stable hydrophilic acidic protein located in the cytoplasm. Systematic evolutionary analysis reveals that PdbGST in Populus davidiana × P. bolleana has a close relationship with XP_034926648 in P. alba. The analysis of cis-acting elements in promoter sequence of PdbGST showed that, this sequence contains multiple cis-acting elements related to plant response to abiotic stress. RT-qPCR showed that PdbGST had the highest expression level in the roots of Populus davidiana×P.bolleana, followed by a higher expression level in the leaves , and the lowest expression level in the top buds . In addition, analysis of the response of PdbGST in response to abiotic stress showed that PdbGST in the roots of Populus davidiana×P.bolleana exhibited sustained and extensive expression after induction.
Key words Populus davidiana×P.bolleana; glutathione S-transferases; abiotic stress; expression pattern
谷胱甘肽S-转移酶(glutathione S-transferases , GST)是一类广泛存在于动、植物及微生物中的多功能酶[ 1 - 3 ]。在植物中,GST基因最早被发现于玉米中,该基因被证实能够参与玉米对除草剂的解毒过程中[ 4 ]。随后,在玉米、水稻、桑树、大豆等不同植物中均被分离鉴定出了GST基因[ 5 - 10 ]。目前,GST基因依据其基因的结构、蛋白质序列的相似性及底物的专一性等,被划分为14大类:metaxin、Phi(F)、Tau(U)、Zeta(Z)、谷胱甘肽依赖性脱氫抗坏血酸还原酶(DHAR)、真核翻译延伸因子1B的γ-亚基类(EF1Bγ)、Lambda(L)、四氯对苯二酚脱氢卤化酶(TCHQD)、hemerythrin(H)、iota(I)、Theta(T)、微粒体前列腺素E合成酶2型(mPGES2)、含两种硫氧还蛋白的GST(GST2N)和谷胱甘肽氢醌还原酶(GHR)[ 11 - 13 ]。在这14类GST基因中,Tau、Phi、DHAR和Lambda四类为植物所特有,其中以针对Tau和Phi类GST基因功能的研究最为广泛[ 14 , 15 ]。
GST基因的功能丰富,既能参与到植物生长、发育及衰老的过程中,又能够帮助植物抵御外界不良环境的毒害[ 16 ]。针对GST基因表达模式的分析发现,来自小麦、苜蓿、水稻等不同植物中GST基因能够不同程度地响应盐碱、干旱、寒冷、重金属等非生物胁迫的诱导,说明该类基因能够广泛地参与到植物对非生物胁迫的适应过程中[ 17 - 20 ]。同时,多项针对转GST基因植株的研究证实,GST基因的过表达有助于提高转基因植物对盐、寒冷或是氧化胁迫的耐受性。如在烟草中过表达拟南芥AtGSTF11基因或是盐角海蓬子SbGSTU基因,能够增强其对氧化胁迫和盐胁迫的耐受性[ 21 , 22 ]。而在拟南芥中,过表达水稻OsGSTU4基因也能够增强其加对盐及氧化胁迫的耐受性[ 23 ]。大量的研究表明,GST基因在植物应对非生物胁迫过程中起着重要作用,但是这类研究的对象以草本植物为主,而针对木本植物的研究较为稀少。
杨树分布广泛且用途多样,兼具社会、经济及生态效益,也是研究林木抗逆机理,培育优良新品种的首选树种。山新杨(Populus davidiana×P.bolleana)是以山杨及新疆杨杂交而成的品种,是北方地区防护林的主要种植树种。因其抗逆能力突出,适应能力较强,故以山新杨为模式植物开展的研究已应用于多个领域,如通过转基因技术培育出抗逆性、抗病虫害能力更加突出的优良品种[ 24 - 26 ];将山新杨引入盐碱地修复过程中,探究其生长状况等[ 27 ]。本研究克隆了山新杨PdbGST基因及其启动子序列,并通过荧光定量PCR(RT-qPCR)技术分析其响应非生物胁迫下的表达模式,为后续深入研究該基因的功能提供理论依据,同时为林木抗逆基因工程育种提供潜在的基因资源。
1 材料与方法
1. 1 试材与采样
选取健康且长势一致的山新杨组培苗,将其移栽至规格为11cm×10 cm的花盆中进行培养,其培养基质为混有V(泥炭土)∶V(蛭石)∶V(珍珠岩)=3∶1∶1的混合基质。其培养环境为:光照14 h/黑暗10 h,平均温度约为(23±1)℃、相对湿度为60%~70%、光照强度400 μmol/m2·s培养15 d后,挑选长势一致,且状态优良无病虫害的幼苗用于后续实验。分别摘取山新杨土培苗顶芽、叶片、叶柄、茎部及根部组织用于PdbGST基因的组织特异性分析,每个组织分别摘取自三株生长状态一致的山新杨土培苗作重复。分别使用300 mM甘露醇溶液、200 mM NaCl溶液和20% PEG6 000溶液灌溉山新杨土培苗进行非生物胁迫处理。分别在处理后第1、3、6、12、24和48 h后,取其叶部及根部组织,液氮冷冻后储存于-70 ℃,用于PdbGST基因响应非生物胁迫的基因表达模式分析,每种处理胁迫25株苗,每次取样3株植株做重复,并分别以未经处理的山新杨土培苗的根部与叶部作对照。
1. 2 山新杨PdbGST基因及其启动子序列的克隆
使用山新杨cDNA作为模版,并将转录组中的基因序列作为参照设计引物,克隆PdbGST基因。使用引物如下:GST-F:ATGGCGGAGGTGGTGAAGCT-GCTCGG;GST-R:TCAGGCGGATGCAAGCCTCTTT-TCTCTG。具体PCR扩增体系为cDNA2ul,上下游引物各1ul,无酶水12.1ul,10×Star Taq PCR buffer 2ul,dNTP Mix(2.5 mM)1.6ul, Star Taq(5 U/μL)0.3ul;PCR扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,57 ℃退火30 s,72℃延伸45 s,35个循环;72 ℃延伸10 min。取PCR产物电泳检测,确认条带大小符合预期后,对PCR产物进行回收。将回收后的产物连接至pMD18-T载体,并转化至大肠杆菌TOP10中,将筛选后的阳性菌株送至生工生物工程(上海)公司进行测序[ 28 ]。
在山新杨基因组中查找获得PdbGST基因上游约2 000 bp的序列作为启动子区,设计引物对该序列进行克隆,所用引物如下:GST-proF:ATGGC-GGAGGTGGTGAAGCTGCTCGG;GST--proR:TCAG-GCGGATGCAAGCCTCTTTTCTCTG。具体PCR扩增体系为DNA1ul,上下游引物各1ul,无酶水13.1ul,10×Star Taq PCR buffer 2ul,dNTP Mix(2.5 mM)1.6ul, Star Taq(5 U/μL)0.3ul;PCR扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。
1. 3 山新杨PdbGST蛋白质的生物信息学分析
使用ExPASy-ProtParam(https://web.expasy.org/protparam/)对PdbGST蛋白进行基础理化性质分析;使用ProtComp(http://yadamp.unisa.it/protcomp/)进行亚细胞定位预测。在NCBI官网通过BlastP(https://blast.ncbi.nlm.nih.gov/Blast.)进行比对,筛选与PdbGST相似性高的序列,使用ClustalW(http://www./Tools/msa/clustalo/)对这些序列进行多序列比对分析,并通过MEGA7.0软件,使用邻接法(Neighbor- Joining,NJ)构建进化树,其中Bootstrap参数设置为1 000。分别使用PredictProtein(https://www.pre-dictprotein.org)及Swissmodel(https://swissmodel.expa-sy.org)预测蛋白质的二级结构及三维结构。使用Plant CARE(http://bioinformatics.psb.ugent.be/web-tools/plantcare/html/)预测其启动子序列所含cis-顺式作用元件。
1. 4 山新杨PdbGST基因的表达模式分析
提取不同处理后山新杨不同组织的RNA进行反转录,并进行荧光定量PCR(RT-qPCR),分析不同植物组织及非生物胁迫下PdbGST基因的表达模式,所用引物序列见表1。使用2-ΔΔCt方法对定量数据进行处理,本文图中所用基因的表达水平均进行了Log2转化[ 29 , 30 ]。
2 结果与分析
2. 1 山新杨PdbGST基因和其启动子序列克隆
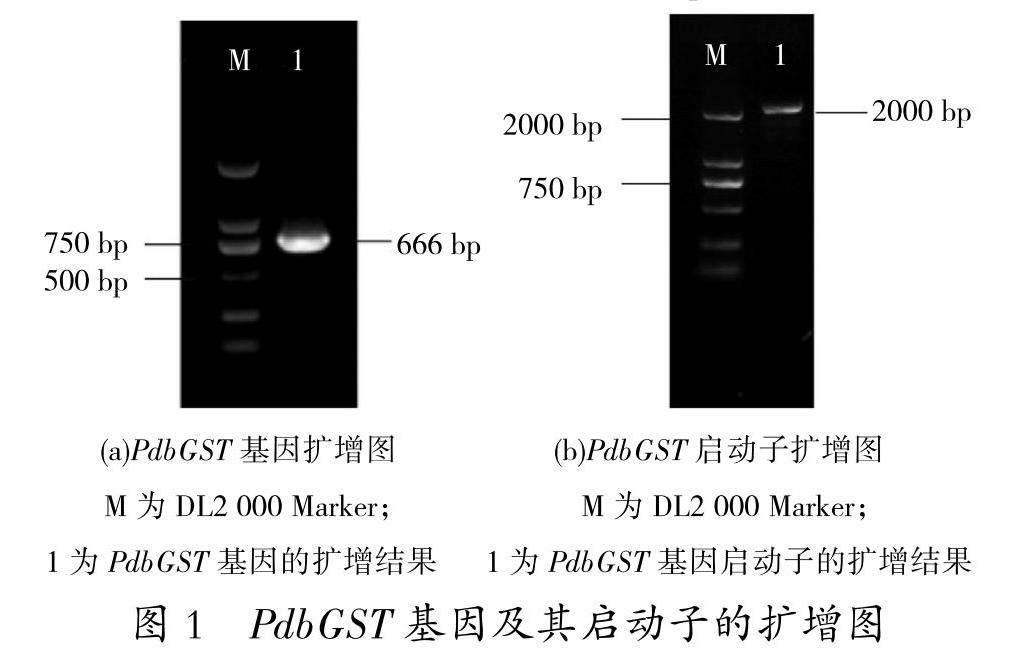
以山新杨cDNA为模版,将转录组测序获得的基因序列作参照,设计引物,克隆PdbGST基因。通过琼脂糖凝胶电泳对PCR结果进行检测(图1a),克隆获得条带长度约为666 bp的PCR产物,符合预期。所获PCR产物经纯化、连接及转化等步骤后,送至生工生物工程(上海)公司进行测序。通过tBlastn对测序结果进行比对,结果显示该基因属于GSTU家族基因。以山新杨DNA为模板,以搜索其基因组获得的序列做参照,设计引物,经PCR、纯化回收、连接转化及测序等过程,共克隆获得PdbGST基因的启动子序列2 000 bp(图1b)。
2. 2 山新杨PdbGST蛋白的基础理化性质分析
对克隆获得的PdbGST基因所编码的蛋白质进行理化性质的分析表2。该基因编码氨基酸221个,构成蛋白质相对分子质量为25.57 kDa。蛋白质理论等电点为5.65,推测其为酸性蛋白;不稳定系数为31.84,为稳定蛋白。蛋白质亲疏水性分析显示其GRAVY值为-0.132,为亲水蛋白。此外,亚细胞定位显示该蛋白定位于细胞质中(表2),说明其在细胞质中发挥作用。
2. 3 山新杨PdbGST蛋白质结构分析
对该基因编码形成的蛋白质进行二维结构预测,结果显示其二级结构含有56.11%的螺旋、9.05%的折叠以及34.84%的Ω环(图2a)。三维结构预测显示,该蛋白主要由两个亚基组成,其中位于N端的亚基较小,而位于C端的亚基则较大。同时,这两个亚基由较短的氨基酸残基相连(图2b),该预测结果符合GST蛋白的结构特点。
2. 4 山新杨PdbGST蛋白的进化树分析与多序列比对
通过BlastP比对,选取与PdbGST蛋白相似性高的蛋白序列,进行多序列比对分析的结果(图3)可见,GST的氨基酸序列包含两个保守结构域:N端包含影响催化功能的GSH结合位点(G-site),C端包含与特定底物结合的共底物结合域(H- site)。这两个结构域由约10个残基的短连接子序列连接。所有的活性位点都分布在这些结构域上,其中G位点通常是保守的,但H位点高度可变以允许一系列疏水底物的结合。
使用MEGA7.0软件对与PdbGST蛋白序列相似性高的杨树GST蛋白序列进行进化树分析(图4)。9个来自于不同种类杨树的GST蛋白序列被分为3大分支。其中山新杨PdbGST蛋白与来自山杨(Populus alba)的XP_034926648蛋白亲缘关系最近,位于第一分支(group1)。而来自亚东杨(P.yatungensis)的蛋白ANO39977与其他8种杨树的GST蛋白亲缘关系最远,独自处于一个分支(group3)。
2. 5 山新杨PdbGST基因的启动子cis-顺式作用元件分析
通过Plant CARE网站,对克隆获得的PdbGST基因2 000 bp的启动子序列所含的cis-顺式作用元件种类进行预测。结果显示:PdbGST的启动子序列中共含有26种顺式作用元件,除去一些调控基因转录所必需的基本元件外,还含有6种能够响应非生物胁迫的顺式作用元件,包括MYB,MYB-like,MYC,W-box,GT1和WUN-motif。此外,該基因的启动子序列中也含有部分能够响应光的元件,如Box-4,AE-box等(图5)。该预测结果表明,PdbGST可能响应逆境环境的胁迫,进而参与到山新杨对非生物胁迫的抵御过程中。
2. 6 山新杨PdbGST基因的表达模式分析
对山新杨土培苗的顶芽、叶片、叶柄、茎及根部组织进行RT-qPCR分析,PdbGST基因在顶芽中表达量最低,故以其作为对照进行数据处理。结果显示,该基因在山新杨根部表达量最高为25.6倍,其次在山新杨叶部也有较高表达量,为24.2倍。此外,该基因在杨树茎部与叶柄处也有表达(图6 a)。说明在山新杨的不同组织中,PdbGST基因的表达存在一定的差异,其在杨树的生长、发育等过程中可能具有不同的功能。
分别使用PEG6000及甘露醇灌施山新杨根部,模拟干旱胁迫,分析了PdbGST基因在干旱下的表达模式。结果(图6b、图6c)显示,在PEG6000的诱导下,山新杨根部PdbGST基因的表达呈持续上调的表达趋势,基因的表达量在处理后第48 h达到最大,为29.39倍。而经PEG诱导后,山新杨叶部的基因呈现先抑制后上调的表达趋势,其表达量在处理后第48 h达到最大,为22.41倍(图6b)。在甘露醇的处理下,山新杨根部基因呈上调后下调的表达趋势,基因的表达量在处理后第1 h即达到最大,为24.41倍。而经甘露醇诱导后,山新杨叶部的基因在短暂上调后基本呈现下调的表达趋势,其表达量在处理后第24 h达到最大,为21.99倍(图6c)。该结果表明,山新杨根部的PdbGST基因可能参与到杨树对干旱条件的应对过程中。
通过分析NaCL处理下PdbGST基因的表达模式,分析其是否参与到杨树对盐胁迫的响应过程,结果(图6d)显示,在NaCL诱导下,山新杨根部PdbGST基因的表达呈持续上调的表达趋势,基因的表达量在处理后第12 h达到最大,为29.91倍。而经NaCL诱导后,山新杨叶部的基因呈现先抑制后上调的表达趋势,其表达量在处理后第24 h达到最大,为23.99倍。该结果显示,PdbGST基因可能参与到杨树对盐胁迫的响应过程中。
3 讨 论
在植物中,谷胱甘肽S-转移酶(glutathione S- transferases, GST)是一类数量众多、功能广泛的酶类。这类酶被证实能够参与植物的生长、发育、衰老过程,同时其也能够参与响应植物对逆境环境的胁迫过程[ 1 - 3 ]。目前,针对GST基因功能的研究主要集中在草本植物中,极少针对木本植物中GST基因参与植物对逆境环境的响应过程中。因此,本研究克隆了山新杨PdbGST基因,对其在山新杨中的组织表达特性,以及在非生物胁迫条件下的表达模式进行分析,为后续研究该基因在木本植物中的功能提供理论基础。
本研究克隆获得的PdbGST基因长666 bp,编码221个氨基酸,其形成的蛋白质为稳定的亲水性酸性蛋白,定位于细胞质中(表2)。同时,针对其氨基酸序列的分析及三维结构的预测显示,该蛋白的结构符合GST蛋白的基本结构特征[ 31 ],既其由分别位于N端及C端的两个亚基构成。且位于N端的亚基含有高度保守的且能够影响其催化功能G-site,而其C端的亚基则含有可变性较高的,能够与特定底物结合H-site(图2,图3)。其中,H-site氨基酸残基的可变性,使得不同的GST蛋白能够结合不同的底物,参与到植物不同的生理生化过程中。
植物中的GST基因被证实能够参与到其生长、发育及衰老等过程中。如Kumar等针对过表达水稻OsGSTL2基因的拟南芥观察发现,过表达该基因提高了种子的发芽率,同时促进了植株子叶发育与根系生长[ 32 ]。拟南芥AtGSTU17基因则能够参与其幼苗发育、下胚轴伸长等过程[ 33 ]。番茄中GST的表达能够降低细胞内总谷胱甘肽的水平,减少细胞总磷脂含量,改变细胞内氧化还原电位,抑制细胞的程序性死亡过程[ 34 ]。同样,本研究也发现,山新杨PdbGST基因在5种组织中的表达情况存在差异,其在顶芽中表达量最少,在根部表达量最高,此外其在叶部也有较高表达(图6),表明该基因可能在杨树的不同组织或是不同的发育阶段起到重要作用。
大豆、番茄、水稻等植物GST基因的研究表明,该基因能够保护植物细胞免受盐碱、干旱、重金属以及氧化胁迫等逆境环境造成的损伤。Xu等研究发现,在拟南芥中过表达番茄LeGSTU2基因,能够提高其对盐及干旱的耐受性[ 35 ]。过表达水稻OsGSTU4基因的拟南芥不仅显示出了较高的耐盐性,并对氧化胁迫的耐受性也有所提高[ 23 ]。对过表达GST基因的苜蓿进行分析发现,GsGSTU14、GsGSTU19和GsGSTU13均在苜蓿响应盐碱胁迫的过程中起作用[ 36 - 38 ]。针对耐盐植物藜麦中GST基因的研究发现,GST基因能够平衡其根部中受盐胁迫而产生的内源性过氧化氢的含量,减轻了过氧化氢对其根细胞造成的损害[ 39 ]。因此,本研究分析了PdbGST启动子的序列,结果显示该基因启动子序列含有能够响应非生物胁迫的顺式作用元件,如MYB,GT1,MYC,W-box等(图5)。其中,水稻Os2H16的启动子序列上的GT1元件被证实能够与其反式作用因子OsASR2结合,参与其对干旱环境的响应过程中[ 40 ]。同时,对山新杨PdbGST基因响应的干旱及盐胁迫下的表达模式的分析表明,结该基因受干旱或是盐胁迫后。在山新杨根部出现持续大量的表达,而其叶部基因的表达在两种胁迫下主要呈现先抑制后上调的表达模式(图6)。该结果与来自部分来自苜蓿和土豆中的GST基因的表达模式一致[ 41 , 42 ]。以上结果表明,PdbGST基因能够参与杨树对干旱及盐等逆境的响应,但其在叶部及根部的作用时间或是功能可能不同。
参考文献
[1] Vaish S, et al. Glutathione S-transferase: a versatile protein family[J]. 3 Biotech. 2020, 10(7): 321.
[2] Martínez-Márquez A,etal.A Tau class glutathione-S-transferase is involved in trans-resveratrol transport out of grapevine cells. Front[J]. Plant Sci. 2017(8): 1457.
[3] Edwards,R. and Dixon,D.P. (2005) Plant glutathione transfera- ses[J]. Methods Enzymol. 2005(401): 169–186.
[4] Shimabukuro R H,Swanson H R,Walsh W C. Glutathione conjuga- tion: atrazine detoxication mechanism in corn[J]. Plant physiology, 1970, 46(1): 5.
[5] Islam S, et al. Genome-wide identification of glutathione S-transferase gene family in pepper, its classification, and expression profiling under different anatomical and environmental condi-tions[J]. Sci. Rep. 2019(9): 1 - 15.
[6] 張创娟, 程斌, 杨乐, 等. 基于全基因组和转录组的绿豆谷胱甘肽转移酶基因及其对镉胁迫的响应[J]. 西北农业学报,2022, 31(6): 703 - 717.
[7] 江董丽, 才华, 端木慧子, 等. 大豆GST基因家族全基因组筛选、分类和表达[J]. 分子植物育种,2013, 11(5): 465 - 475.
[8] 马骊, 白静, 赵玉红, 等. 冷胁迫下甘蓝型冬油菜表达蛋白及BnGSTs基因家族的鉴定与分析[J]. 作物学报, 2023, 49(1):153 - 169.
[9] Soranzo, N., Gorla, M.S., et al. Organisation and structural evolution of the rice glutathione S-transferase gene family[J]. Mol. Genet.Genom. 2004(271): 511 - 521.
[10] Sytykiewicz, H..Expression patterns of glutathione transferase gene(GstI) in maize seedlings under juglone-induced oxidative stress[J]. Int. J. Mol. Sci. 2001(12): 7982 - 7995.
[11] Qi Yang,Yan-Jing Liu,Qing-Yin Zeng. Biochemical functions of the glutathione transferase supergene family of Larix kaemp- feri[J]. Plant Physiology and Biochemistry, 2014(77): 99 - 107.
[12] Lo Piero AR, et al. Gene isolation and expression analysis of two distinct sweet orange [Citrus sinensis L: (Osbeck)] tau-type glutat-hione transferases[J]. Gene 2009; 443: 143 - 150.
[13] 张创娟. 植物谷胱甘肽转移酶及其响应非生物胁迫的研究[D].甘肃: 兰州大学,2022.
[14] 郑永兴. 谷胱甘肽合成关键基因GST1参与小麦幼苗铜胁迫响应的分子机制[D]. 郑州: 河南农业大学, 2020.
[15] Musin Kh. G.,Fedyaev V. V.,Kuluev B. R.. State of Antioxidant System and Long-Term Storage of Tobacco Hairy Roots with Constitutive Expression of Glutathione-S-Transferase Gene ATGSTF11[J]. Russian Journal of Plant Physiology, 2021, 68(4): 641 - 651.
[16] mita K, Trivedi P K. Glutathione S-transferases: role in combating abiotic stresses including arsenic detoxification in plants[J]. Frontiers in Plant Science, 2018(9): 751.
[17] 孫蕊. 寒地冬小麦抗氧化指标低温响应及GST基因的差异表达分析[D]. 哈尔滨: 东北农业大学, 2015.
[18] 刘婧愉. 茶树谷胱甘肽转移酶与脱氢抗坏血酸还原酶家族分析及逆境表达分析[D]. 南京: 南京农业大学, 2020.
[19] Jain M, Ghanashyam C, Bhattacharjee A. Comprehensive expression analysis suggests overlapping and specific roles of rice glutathione S-transferase genes during development and stress responses[J]. BMC Genomics, 2010, 11(1): 73.
[20] H Vijayakumar,SK Thamilarasan,etc.Glutathione Transferases Superfamily: Cold-Inducible Expression of Distinct GST Genes in Brassica oleracea[J]. 2016(17): 1211.
[21] R. B K ,A. A E ,V. E M .Overexpression of the Glutathione S-Transferase ATGSTF11 Gene Improves Growth and Abiotic Stress Tolerance of Tobacco Transgenic Plants[J]. Russian Journal of Plant Physiology, 2023, 69(7): 148.
[22] Bhavanath J ,Anubha S ,Avinash M.Expression of SbGSTU (tau class glutathione S-transferase) gene isolated from Salicornia brachiata in tobacco for salt tolerance[J]. Molecular biology reports, 2011, 38(7):4823 - 32.
[23] Sharma R, Sahoo A, Devendran R, et al. Over-expression of a rice Tau class glutathione S-transferase gene improves tolerance to salinity and oxidative stresses in Arabidopsis[J]. PLoS One, 2014, 9(3): 929.
[24] Huang Y, et al. Expression patterns of the poplar NF-Y gene family in response to Alternaria alternata and hormone treatment and the role of PdbNF-YA11 in disease resistance[J]. Front Bioeng Biotechnol. 2022; 10: 956271.
[25] 馬姗姗, 杨静静, 曲德辉, 等. 过表达C2H2型锌指蛋白基因PdbZFP26提高山新杨耐盐性[J]. 林业科学, 2023, 59(1): 110 - 118.
[26] 李健, 王有菊, 姜静, 等. 山新杨转eIF1A基因及耐盐性分析[J]. 东北林业大学学报, 2010, 38(1): 12 - 14 + 27.
[27] 侯庚. 利用杨树修复重金属污染土壤的研究进展[J]. 湖北植保, 2022(4): 69 - 71.
[28] 遇文婧. 深绿木霉刺激植物响应蛋白TatEpl1诱导杨树系统抗病性机制[D]. 哈尔滨: 东北林业大学, 2014.
[29] 黄颖. 山新杨响应细链格孢菌侵染的转录组分析及PdbMYB85基因功能的研究[D]. 哈尔滨: 东北林业大学, 2022.
[30] K.J.L.A., and T.D.S.B. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].
[31] Droog F. Plant glutathione S-transferases, a tale of theta and tau[J]. Plant Growth Regul. 1997, 39(16): 95 - 107.
[32] Kumar S, Asif M H, Chakrabarty D, et al. Expression of a rice Lambda class of glutathione S-transferase, OsGSTL2, in Arabi- dopsis provides tolerance to heavy metal and other abiotic stresses[J]. Journal of Hazardous Materials, 2013, 248 (15):228-237.
[33] Jiang H W, Liu M J, Chen I C, et al. A glutathione S-transferase regulated by light and hormones participates in the modulation of Arabidopsis seedling development[J]. Plant Physiology, 2010, 154(4): 1646 - 1658.
[34] Kampranis S C, Damianova R, Atallah M, et al. A novel plant glutathione S-transferase/peroxidase suppresses Bax lethality in yeast[J]. Journal of Biological Chemistry, 2000,275: 29207 - 29216.
[35] Xu J, Xing X J, Tian Y S, et al. Transgenic Arabidopsis Plants Expressing Tomato Glutathione S-Transferase Showed Enhanced Resistance to Salt and Drought Stress[J]. Plos One, 2015, 10(9).
[36] Jia B, Sun M, Sun X, et al. Overexpression of GsGSTU13 and SCMRP in Medicago sativa confers increased salt-alkaline tolerance and methionine content[J]. Physiol Plant, 2016, 156: 176-189.
[37] Wang Z Y, Cai H, Bai X, et al. Isolation of GsGST19 from Glycine soja and analysis of saline-alkaline tolerance for trans-genic Medicago sativa[J]. Acta Agron Sin, 2013, 38: 971 - 979.
[38] Wang Z Y, Song F B, Cai H, et al. Over-expressing GsGST14 from Glycine soja enhances alkaline tolerance of transgenic Medicago sativa[J]. Biologia Plantarum, 2012, 56(3): 516 - 520.
[39] 褚晶. 藜麦GST基因家族的鉴定与表达分析及发根农杆菌介导的GST基因功能研究[D]. 烟台: 烟台大学, 2022.
[40] Li N , Wei S , Chen J ,et al. OsASR2 regulates the expression of defence-relatedgene, Os2H16, by targeting the GT-1 cis-ele- ment[J]. 2018, 16(3): 771 - 783.
[41] Hasan MS, Singh V, Islam S,et al. Genome-wide identification and expression profiling of glutathione S-transferase family under multiple abiotic and biotic stresses in Medicago truncatula L[J]. PLoS One, 2021, 16(2): 247170.
[42] Ding N, Wang A, Zhang X,etc.Identification and analysis of glutathione S-transferase gene family in sweet potato reveal divergent GST-mediated networks in aboveground and under- ground tissues in response to abiotic stresses[J]. BMC Plant Biol,2017, 17(1):225.

