浅谈分子中“大π键”的判断方法
宋尚荣
一、对大π键认识
在平面结构的多原子分子内,相邻的多个原子中相互平行且未参与杂化的p轨道肩并肩地相互重叠形成的多电子π型化学键,称为大π键,记作πn
m,读作“m中心n电子大π键”,其中m表示平行的p轨道数,即参与形成大π键的原子数;n表示平行p轨道中的电子总数,即参与形成大π键的电子数。
二、大π鍵的形成条件及判断方法
(一)分子的空间结构的确定
由大π键的概念可知,只有平面型分子才能形成大π键,这是形成大π键的前提条件。
对有机分子,一般通过给定分子的结构式来确定,有单双键交替结构的分子必有平面型结构存在。例如,1,3-丁二烯的结构中,由于存在单双键交替结构,其分子结构为平面型。
对于ABm型无机分子或离子,用VSEPR理论确定其构型。例如,在BCl3分子中,B原子的价层电子对数为(3+3×1)/2=3,分子构型为平面正三角形。又如,在CH4中,C原子的价层电子对数为(4+4×1)/2=4,C原子上没有孤电子对,分子构型为正四面体,5个原子不共平面,无法形成大π键。
(二)确定大π键的原子数
除分子构型为平面型外,相邻原子中必须有相互平行且未参与杂化的p轨道才能形成大π键,这就要求参与形成大π键的原子必须采取sp2杂化或sp杂化,这是形成大π键的第二个条件。如何确定形成大π键的原子数呢?
对于有机分子,由化学键特征来确定。烷烃中只含有单键,中心原子为sp3杂化,无相互平行且未参与杂化的p轨道,无法形成大π键;若分子中存在单双键交替结构,形成碳碳双键的碳原子为sp2杂化,原子中有相互平行且未参与杂化的p轨道,能形成大π键。例如,在1,3-丁二烯中,构成单双键交替结构的4个碳原子都采取sp2杂化,4个碳原子提供4个相互平行且未参与杂化的p轨道可参与形成大π键。
对于ABm型无机分子或离子,用杂化轨道理论来确定。例如,在BF3分子中,B原子采取sp2杂化,假设参与杂化的轨道是2s、2px、2py,则未参与杂化的2pz轨道与3个F原子的2pz轨道相互平行,4个原子提供4个相互平行且未参与杂化的p轨道,参与形成大π键。又如:在H2S中,S原子的价层电子对数为(6+2×1)/2=4,O原子上有2个孤电子对,分子构型为V形,3个相邻原子虽然共平面,但S原子采取sp3杂化,分子中无相互平行且未参与杂化的p轨道,无法形成大π键。
(三)确定大π键的电子数
由杂化轨道理论可知,若相互平行且未杂化的p轨道都已容纳2个电子时不会重叠成键,所以形成大π键的每个p轨道有的容纳2个电子,有的容纳1个电子,有的是无电子的空轨道,由此可知形成大π键的第三个条件是p轨道上的电子总数小于p轨道数的2倍。
如何确定大π键的电子数呢?
对于有机分子,由化学键特征确定。碳原子有4个单电子,若形成3个σ键,则剩余1个电子参与形成大π键;若形成2个σ键,则剩余2个电子可能分别参与形成2个相互垂直的大π键。例如,在1,3-丁二烯中,每个碳原子均已形成3个σ键,剩余1个电子参与形成大π键,4个平行的p轨道重叠形成了大π键,记作π44。
对于ABm型无机分子或离子,形成大π键的电子由中心原子和配位原子相互平行且未杂化的p轨道共同提供。中心原子提供的电子数=中心原子的价电子数-参与杂化的电子数。配位原子提供的电子数可分为2种情况:若配位原子的单电子全部参与形成σ键,则每个配位原子提供2个电子;若配位原子的单电子部分参与形成σ键,为了达到稳定结构,单电子优先参与形成大π键,则每个配位原子提供1个电子。例如BF3分子中,B原子3个价电子全部参与形成σ键,形成大π键时只提供空轨道,每个配位F原子仅有的1个单电子参与形成σ键,形成大π键时每个F原子分别提供2个电子,共有6个电子,满足第三个条件。最终,4个相互平行的p轨道重叠形成了大π键,记作π64。
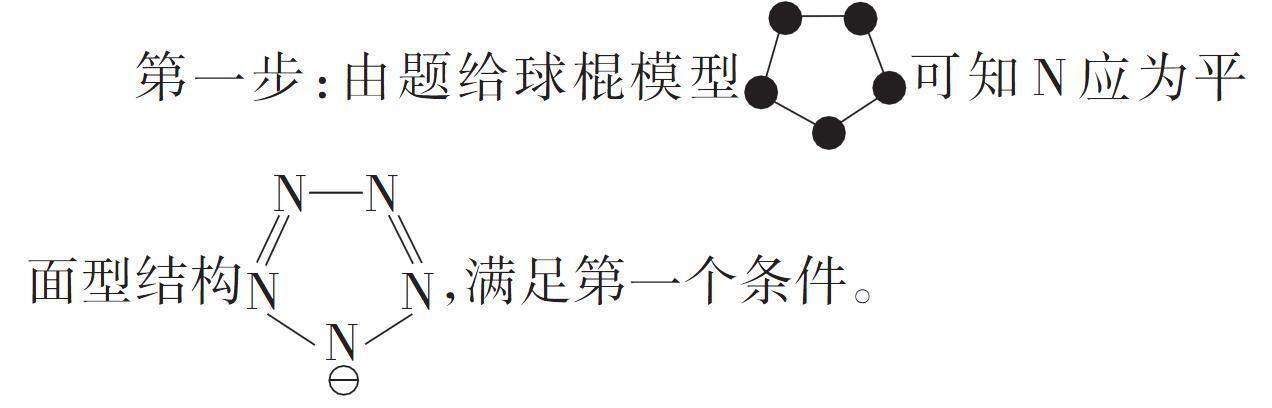
[例1]我国科学家成功合成了世界首个五氮阴离子(N-5)盐:N-5中的大π键应表示为______________。
第一步:由题给球棍模型可知N应为平面型结构[N—N][N][N][N],满足第一个条件。
第二步:由N-5的平面型结构可知N原子的杂化类型为sp2,即N-5中有5个相互平行且未参与杂化的p轨道,满足第二个条件。
第三步:每个N原子均有3个单电子,拿出2个单电子分别参与形成σ键,还剩余1个单电子参与形成大π键,再加上1个负电荷,共6个电子,满足第三个条件。
即5个相互平行的p轨道重叠形成了π键,记作π65。
[例2]气态三氧化硫以单分子形式存在,其分子的空间结构为________,其中共价键的类型有________种。
第一步,用VSEPR理论确定SO3空间结构。SO3空间结构为平面正三角形,满足第一个条件。
第二步,用杂化轨道理论确定大π键的原子数。S原子采取sp2杂化,假设参与杂化的轨道是3s、3px、3py,则未参与杂化的3pz轨道与3个O原子的2pz轨道相互平行,4个原子提供4个相互平行且未参与杂化的p轨道,满足第二个条件。
第三步,确定大π键的电子数。S原子提供3个电子参与形成σ键,提供给大π键的电子数为6-3=3,每个配位O原子2p轨道上有2个单电子,其中1个单电子与S原子形成σ键,剩余1个单电子参与形成大π键,共6个电子,满足第三个条件。即4个相互平行且未杂化的p轨道重叠形成了四中心六电子大π键,记作π64。

