帕博利珠单抗联合白蛋白紫杉醇与卡培他滨方案治疗进展期胃癌患者的疗效评估
王文斌 郭小花 郑兆华 郭曼 孙力
西安交通大学附属红会医院消化外科,西安 710001
胃癌是一种全球常见的恶性肿瘤,具有高度的异质性和侵袭性,其发展受遗传、环境及生活方式等多种因素的共同影响[1-2]。特别是在进展期,胃癌可能突破胃壁侵犯邻近组织或远处器官,这时治疗的主要目标是控制病情进一步恶化,并提高患者生存质量[3]。对于进展期胃癌,结合手术、化疗和放疗的综合治疗是其常规的治疗策略。近年来,肿瘤免疫疗法在肿瘤学领域取得重大突破,尤其在提升患者生存率方面成效显著。免疫检查点抑制剂帕博利珠单抗,作为一种程序性死亡受体-1(PD-1)药物,能有效增强机体对肿瘤的免疫应答,抑制肿瘤细胞增殖和扩散,在多种实体瘤治疗中显示出重要价值[4]。此外,紫杉醇类药物因其独特的抗肿瘤机制和较高的耐受性,已成为治疗多种恶性肿瘤的重要选择[5]。基于此,本研究探讨帕博利珠单抗联合白蛋白紫杉醇与卡培他滨方案在治疗进展期胃癌患者中的疗效。
资料与方法
1.一般资料
选取2019年10月至2022年9月西安交通大学附属红会医院收治的122例进展期胃癌患者进行随机对照试验,按照随机数字表法分为两组,各61例。观察组男47例,女14例;年龄<65岁31例,≥65岁30例;美国东部肿瘤协作组(ECOG)评分:0分30例,1分31例;原发部位:胃食管结合部21例,胃40例;转移数目:1个24例,≥2个37例。对照组男48例,女13例;年龄<65岁29例,≥65岁32例;ECOG评分:0分28例,1分33例;原发部位:胃食管结合部23例,胃38例;转移数目:1个25例,≥2个36例。纳入标准:⑴经病理学检查确诊为进展期胃癌;⑵东部肿瘤协作组性能状态(ECOG-PS)评分0~1分;⑶预期生存期超过3个月;⑷按照实体瘤疗效评估标准(RECIST)[6],具有至少1个可测量病灶;⑸患者知情同意并签署知情同意书。排除标准:⑴有严重并发症或合并症,如心脏病、肝硬化、肾功能衰竭等;⑵有其他恶性肿瘤病史或同时患有多种恶性肿瘤;⑶怀孕或哺乳期妇女;⑷近期接受过其他试验性药物治疗;⑸对研究药物成分有过敏史;⑹精神疾病或认知障碍。两组患者一般资料比较,差异均无统计学意义(均P>0.05),具有可比性。
本研究经西安交通大学附属红会医院伦理委员会审批通过(批准文号:202312009)。
2.方法
对照组接受卡培他滨方案联合白蛋白紫杉醇治疗,药物包括卡培他滨、奥沙利铂和白蛋白紫杉醇。卡培他滨(上海罗氏制药有限公司,注册证号:H20093487,规格0.5 g/片)剂量为1 000 mg/m2,餐后30 min内口服,从每个疗程第1天开始连续服用14 d,2次/d,第15~21 d停药;奥沙利铂[齐鲁制药(海南)有限公司,注册证号:H20093167,规格50 mg]剂量为85 mg/m2,静脉滴注,仅在每个疗程第1天给药1次;白蛋白紫杉醇(美国Abraxis Bio Science,注册证号:H20130650,规格100 mg)剂量为260 mg/m2,静脉滴注,于每个疗程第1天和第8天给药1次。观察组在对照组治疗基础上增加帕博利珠单抗[美国MSD Ireland (Carlow),注册证号:S20180019,规格100 mg/4 ml]治疗,剂量200 mg,每个疗程静脉滴注1次。所有治疗均在医师监督下进行,帕博利珠单抗剂量不能下调,其他药物选择和剂量根据患者的具体情况进行调整。每3周为1个疗程,治疗2个疗程。
3.观察指标
⑴疗效。治疗6周后采用实体瘤疗效评价标准1.1版(RECIST 1.1)评估近期疗效,分为完全缓解、部分缓解、疾病稳定和疾病进展。完全缓解:所有可测量和非可测量病灶消失,且无新病灶出现;部分缓解:可测量病灶尺寸总和至少减少30%,且无新病灶出现;疾病稳定:肿瘤负荷未达到部分缓解标准,且未表现为疾病进展;疾病进展:所有可测量病灶尺寸总和增加20%以上,或出现新病灶。患者部分缓解和完全缓解例数计入总有效率。⑵血清肿瘤标志物。治疗前及治疗6周后,在患者空腹状态下收集血液样本,3 000 r/min,离心半径10 cm,时间5 min分离血清,采用酶联免疫吸附技术(上海酶联生物科技有限公司提供)对血清中糖类抗原724(CA-724)、糖类抗原199(CA-199)、血管内皮生长因子(VEGF)和肿瘤坏死因子(TNF-α)进行定量测定。⑶不良反应及预后情况。观察两组不良反应发生情况,包括血小板减少、粒细胞减少、腹泻、甲状腺功能减退。根据世界卫生组织制定的抗癌药物常见毒副反应分级标准[7]将不良反应分为0~Ⅳ级,Ⅲ~Ⅳ级为严重反应。治疗后随访1年,以患者肿瘤复发或死亡为终点事件,统计复发率和病死率。
4.统计学方法
应用SPSS 25.0软件进行数据分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,计数资料以例(%)表示,行χ2检验。以P<0.05为差异有统计学意义。
结果
1.两组患者近期疗效比较(表1)

表1 两组进展期胃癌患者近期疗效比较[例(%)]
观察组总有效率为68.85%(42/61),高于对照组的47.54%(29/61),差异有统计学意义(χ2=5.509,P=0.019)。
2.两组患者血清肿瘤标志物比较(表2)
表2 两组进展期胃癌患者治疗前及治疗6周后血清肿瘤标志物比较(±s)
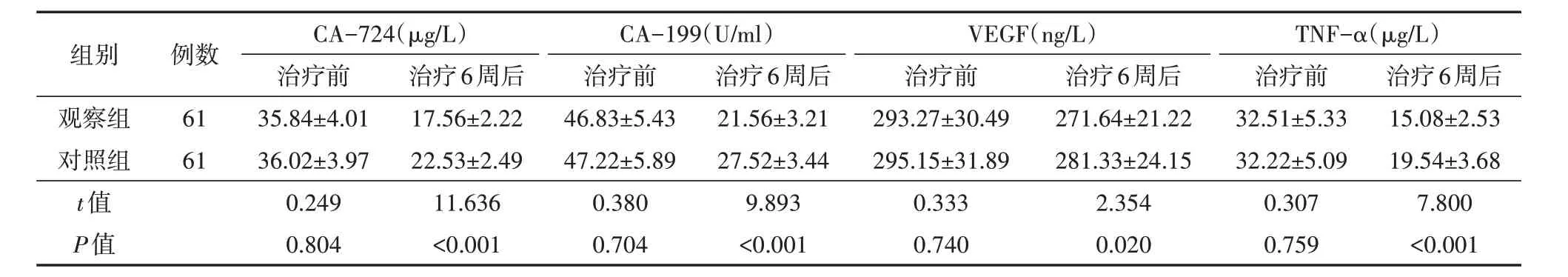
表2 两组进展期胃癌患者治疗前及治疗6周后血清肿瘤标志物比较(±s)
注:对照组接受卡培他滨方案联合白蛋白紫杉醇治疗,观察组在对照组基础上增加帕博利珠单抗治疗;CA-724为糖类抗原-724,CA-199为糖类抗原-199,VEGF为血管内皮生长因子,TNF-α为肿瘤坏死因子-α
组别例数CA-724(μg/L)治疗前治疗6周后CA-199(U/ml)治疗前治疗6周后VEGF(ng/L)治疗前治疗6周后TNF-α(μg/L)治疗前治疗6周后观察组对照组t值P值61 61 35.84±4.01 36.02±3.97 0.249 0.804 17.56±2.22 22.53±2.49 11.636<0.001 46.83±5.43 47.22±5.89 0.380 0.704 21.56±3.21 27.52±3.44 9.893<0.001 293.27±30.49 295.15±31.89 0.333 0.740 271.64±21.22 281.33±24.15 2.354 0.020 32.51±5.33 32.22±5.09 0.307 0.759 15.08±2.53 19.54±3.68 7.800<0.001
治疗前,两组患者CA-724、CA-199、VEGF、TNF-α水平比较,差异均无统计学意义(均P>0.05);治疗6周后,两组患者CA-724、CA-199、VEGF、TNF-α水平均低于治疗前,且观察组均低于对照组,差异均有统计学意义(均P<0.05)。
3.两组患者不良反应分级比较(表3)

表3 两组进展期胃癌患者不良反应分级比较[例(%)]
治疗期间,观察组血小板减少发生情况低于对照组,差异有统计学意义(P<0.05);两组其他不良反应发生率比较,差异均无统计学意义(均P>0.05)。
4.预后情况
所有患者经1年随访,观察组复发5例(8.20%),死亡3例(4.92%),生存率为95.08%(58/61);对照组复发7例(11.48%),死亡10例(16.39%),生存率为83.61%(51/61)。观察组生存率高于对照组,差异有统计学意义(χ2=4.218,P=0.039);两组复发率比较差异无统计学意义(P>0.05)。
讨论
在进展期胃癌治疗中,虽然氟尿嘧啶、多西他赛及铂类等传统化疗药物初期表现有效,但由于药物耐药性的发展,这些药物的长期疗效面临挑战[8-9]。耐药性可能由肿瘤细胞的基因变异、表达型变化或肿瘤微环境的适应性调整引起,导致标准化疗方案难以持续抑制肿瘤生长。因此,寻找能够克服耐药性并减少毒副作用的新疗法显得尤为迫切。PD-1抑制剂作为一种免疫治疗手段,其作用机制与调节宿主免疫系统与肿瘤细胞间的相互作用有关[10]。在正常生理状态下,PD-1与程序性死亡受体配体1(PD-L1)结合有助于保持免疫耐受,避免自身免疫反应。PD-1抑制剂通过阻断这种相互作用,解除肿瘤细胞对T细胞的抑制,激活这些T细胞,使它们识别并杀死PD-L1的肿瘤细胞,恢复免疫系统的肿瘤监视和清除功能[11]。与传统化疗相比,PD-1抑制剂具有更好耐受性和较低的毒副作用。另一方面,白蛋白紫杉醇作为一种改良的化疗药物,通过优化紫杉醇的传递效率,展示其治疗潜力。紫杉醇是一种微管动力学调节剂,通过促进微管聚合并阻止其解聚来破坏微管的动态平衡。这种干预阻碍有丝分裂期间纺锤体的正确形成和染色体分离,从而抑制肿瘤细胞分裂和扩散[12]。白蛋白作为紫杉醇的载体,不仅提高药物在体内的稳定性和靶向性,还减少对正常组织的毒性影响,从而提高疗效和患者耐受性。
张瑾和刘艳屏[13]在贝伐珠单抗的基础上联用紫杉醇脂质体治疗晚期胃癌的有效率为73.53%,患者生活质量得到较大提高。王俊松和吕秀鹏[14]通过帕博利珠单抗与卡培他滨、奥沙利铂联用能提高进展期胃癌患者客观缓解率,18个月的总生存时间优于对照组。本研究中,观察组治疗总有效率为68.85%(42/61),高于对照组的47.54%(29/61)(P<0.05),表明帕博利珠单抗联合白蛋白紫杉醇方案治疗,可提高进展期胃癌患者疗效。肿瘤标志物的变化可为胃癌治疗效果提供生物学证据。观察组治疗后血清CA-724、CA-199、VEGF、TNF-α水平均低于对照组(均P<0.05)。CA-724和CA-199作为与胃癌紧密相关的糖蛋白标志物,通常与肿瘤体积及扩散程度有直接关联[15]。VEGF是促进肿瘤血管生成的关键因子,而TNF-α作为炎症因子,与肿瘤炎症反应、免疫逃逸以及细胞增殖和存活紧密相关[16-17]。在联合方案治疗下,这些生物标志物的降低预示着病情的潜在改善,反映肿瘤微环境的变化,包括对肿瘤血管生成的抑制、肿瘤相关炎症的减少以及免疫反应恢复。这些结果进一步证实帕博利珠单抗联合白蛋白紫杉醇方案治疗在进展期胃癌治疗中的有效性和潜在机制。
Shitara等[18]研究发现,接受帕博利珠单抗治疗的患者中Ⅲ~Ⅴ级不良事件发生率为14.00%,而仅接受紫杉醇治疗组不良事件发生率高达35.00%,表明帕博利珠单抗的安全性较高。在本研究中,观察组治疗期间Ⅲ~Ⅳ级血小板减少事件发生率低于对照组(P<0.05),表明帕博利珠单抗联合白蛋白紫杉醇治疗在减轻血小板减少方面具有优势。然而,在粒细胞减少、腹泻和甲状腺功能减退等其他常见不良反应方面,两种治疗方案的患者表现出一致性,这一结果表明使用帕博利珠单抗治疗对其他一些不良反应的影响较为有限[19]。
综上所述,帕博利珠单抗联合白蛋白紫杉醇在治疗进展期胃癌方面具有优势,血清中肿瘤标志物[20]降低进一步验证其在控制肿瘤进展方面的有效性。未来,更深入的研究和长期的临床跟踪有助于更全面评估这种联合疗法的长期效果和潜在价值。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明王文斌:酝酿和设计试验,实施研究,采集、分析/解释数据,文章撰写,统计分析;郭小花:酝酿和设计实验,对文章的知识性内容作批评性审阅,支持性贡献;郑兆华:采集数据;郭曼:分析/解释数据;孙力:获取研究经费,指导,支持性贡献

