高粱CIPK家族基因的全基因组鉴定及非生物胁迫下的表达特征
徐鹏 李春宏 范昕琦 梁笃 沈新莲
摘要:钙调磷酸酶B样蛋白互作蛋白激酶(CIPK)是一种重要的Ca2+信号传感器,在植物应答逆境非生物胁迫过程中发挥着重要作用。为了探究高粱中CIPK家族基因的功能,本研究从高粱基因组中鉴定了31个SbCIPK基因,这些基因不均匀地分布在高粱的9条染色体上,编码蛋白质的氨基酸数量为403~519个,等电点为6.07~938,相对分子质量为46 357.31~58 316.97。基因结构分析结果表明,SbCIPK家族基因分为内含子缺失型和内含子富集型2类。进化树分析结果表明,SbCIPK家族蛋白质成员分为8个亚族。基于转录组数据的表达模式分析结果表明,SbCIPK基因广泛参与对盐胁迫、干旱胁迫等非生物胁迫的响应。本研究结果可以为高粱CIPK家族基因的功能研究奠定基础。
关键词:高粱;CIPK基因;全基因组鉴定;非生物胁迫
中图分类号:S514文献标识码:A文章编号:1000-4440(2024)04-0591-08
Whole genome-wide identification of CIPK family and their expression characteristics under abiotic stress in Sorghum bicolor
XU Peng1,LI Chun-hong1,FAN Xin-qi2,3,LIANG Du2,3,SHEN Xin-lian1
(1.Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences/Key Laboratory of Cotton and Rapeseed, Ministry of Agriculture and Rural Affairs, Nanjing 210014, China;2.College of Agriculture, Shanxi Agricultural University, Jinzhong 030801;3.Shanxi Key Laboratory of Sorghum Genetic and Germplasm Innovation, Sorghum Research Institute of Shanxi Academy of Agricultural Sciences, Jinzhong 030600)
Abstract:Calcineurin B-like proteins interacting protein kinase (CIPK) is an important Ca2+ signal sensor, which plays an important role in plants response to abiotic stress. In order to explore the function of CIPK family gene members in Sorghum bicolor a total of 31 SbCIPK genes were identified, which were unevenly distributed on nine chromosomes from Sorghum bicolor in this study. The length of the SbCIPKs encoded proteins ranged from 403 to 519 aa, the isoelectric points ranged from 607 to 938, and the relative molecular weights ranged from 46 357.31 to 58 316.97. The SbCIPK gene family members were divided into intron deletion type and intron enrichment type by gene structure analysis. According to the results of phylogenetic tree analysis, the S. bicolor SbCIPK family protein members were divided into eight subgroups. SbCIPK genes were widely involved in abiotic stress responses to salt and drought and so on based on the published transcriptome data. These results can lay the foundation for the functional study of SbCIPK family members in S. bicolor.
Key words:Sorghum bicolor;CIPK gene;whole genome-wide identification;abiotic stress
植物在生长发育过程中经常遭受各种非生物胁迫,如盐胁迫、干旱胁迫、低温脅迫。在漫长的进化过程中,为了适应生存条件,植物形成了完整的胁迫反应分子机制。植物通过调节信号转导和内源激素代谢来应对非生物胁迫。Ca2+作为第二信使,在多种非生物胁迫的响应中发挥着重要作用[1]。Ca2+信号传感器主要包括3种:钙结合蛋白钙调蛋白(CaM)和CaM样蛋白(CMLs)、钙依赖蛋白激酶(CDPK)、类钙调磷酸酶B蛋白(CBL)[2]。CBL是植物特有的一种新型EF手型钙感受器蛋白,其本身并没有激酶活性,当它识别到钙信号后,可以与下游的钙调磷酸酶B样蛋白互作蛋白激酶(CIPK)相互作用,形成丝氨酸/苏氨酸磷酸酶复合体,通过调节植物细胞中离子浓度以缓解逆境胁迫。
CIPK是一类丝氨酸/苏氨酸蛋白激酶,通常具有N端激酶催化结构域和C端调节结构域。C端调节结构域内有21~24个氨基酸组成的保守的NAF结构域。CIPK通过C端的NAF与CBL相互作用,从而产生一个复杂的信号网络。NAF结构域具有双重功能,包括自我抑制和与CBL特异性结合以激活CIPK活性[3]。目前,在水稻[4]、小麦[5]以及棉花[6]中分别发现了33个、20个以及79个CIPK基因。已有研究者鉴定出部分CBL-CIPK系统成员在植物应答逆境胁迫中发挥的功能[7-9]。CIPK的结构高度保守,同一物种CIPK成员之间存在部分功能冗余,不同物种间也存在功能高度相似的CIPK,它们可能介导相同的应激反应。为了进一步揭示CIPK介导的复杂网络系统,利用基因工程技术改良作物在非生物胁迫下的抗性,我们还需要对CIPK基因的功能进行详细研究。
高粱(Sorghum bicolor)是世界第五大禾谷类作物,也是中国主要的杂粮作物之一,具有耐旱、耐涝、耐贫瘠、耐盐碱等多重抗性。随着高粱基因组序列的公布,高粱基因家族鉴定的研究工作广泛开展,但目前尚未见有关高粱CIPK基因家族全基因组鉴定的报道。本研究拟基于公布的高粱基因组序列,在基因组水平上鉴定高粱CIPK家族成员,并对其进行生物信息学分析以及表达特征分析,以期为进一步探究高粱CIPK家族基因功能奠定基础。
1材料与方法
1.1高粱CIPK基因家族成员的鉴定
从拟南芥TAIR数据库(http://www.arabidopsis.org)中获取26个CIPK蛋白的氨基酸序列,并利用本地BLASTP同源比对高粱基因组数据库[10],获得候选高粱CIPK基因家族成员。在Pfam网站(http://pfam-legacy.xfam.org/)下载获得保守结构域NAF的种子文件(PF03822),利用本地HMMER软件对候选高粱CIPK成员的NAF功能结构域进行筛选,获得同时具有N端激酶催化结构域和C端NAF调节结构域的SbCIPK家族成员。
1.2高粱CIPK基因家族成员染色体分布及其编码蛋白质的理化性质分析
利用ProtParam软件(http://web.expasy.org/protparam)分析高粱CIPK家族成员的氨基酸数量、等电点以及相对分子质量等理化性质;根据高粱CIPK家族基因的基因组位置信息提取基因全长序列,利用Mapinspect软件绘制染色体分布图。
1.3高粱CIPK基因家族系统进化与基因结构分析
利用MEGA 6.0软件构建高粱和拟南芥的CIPK蛋白系统进化树;利用GSDS软件(http://gsds.cbi.pku.edu.cn)分析SbCIPK家族基因结构;利用MEME软件(http://meme-suite.org/tools/meme)对SbCIPK蛋白进行保守基序(Motif)分析。
1.4非生物胁迫下高粱CIPK家族基因的表达特征分析
分析高粱SbCIPK家族基因在非生物胁迫下的表达特征。在美国国立生物技术信息中心(NCBI)网站(http://www.ncbi.nlm.nih.gov/)下载高粱表达序列标签(EST)数据,提取盐胁迫、干旱胁迫、水分胁迫以及低温胁迫等非生物胁迫诱导表达的EST序列共30 771条。分析非生物胁迫下,在耐非生物胁迫材料与对非生物胁迫敏感材料之间差异表达的SbCIPK基因。在NCBI网站下载已发表的高粱非生物胁迫下的转录组数据,将Clean data与高粱参考基因组数据库[10]进行比对,以每千个碱基的转录每百万映射读取的片段(FPKM)量化基因的表达量,采用DESeq软件以伪发现率(FDR)≤0001且差异倍数在2倍以上作为标准筛选差异表达的SbCIPK基因。
2结果与分析
2.1高粱CIPK家族基因的鉴定、染色体定位及其编码蛋白质的理化性质
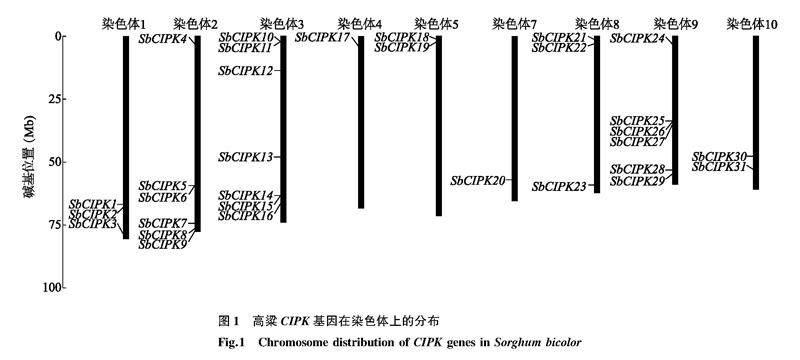
基于同源比对获得31个高粱CIPK基因家族成员,命名为SbCIPK1~SbCIPK31。31个SbCIPK基因不均匀地分布在高粱9条染色体上,其中染色体3上分布的最多,有7个SbCIPK基因;其次是染色体2和染色体9,各有6个SbCIPK基因;染色体1和染色体8上均有3个SbCIPK基因;染色体5和染色体10上均有2个SbCIPK基因;染色体4和染色体7上均只有1个SbCIPK基因;而染色体6上没有SbCIPK基因(图1)。
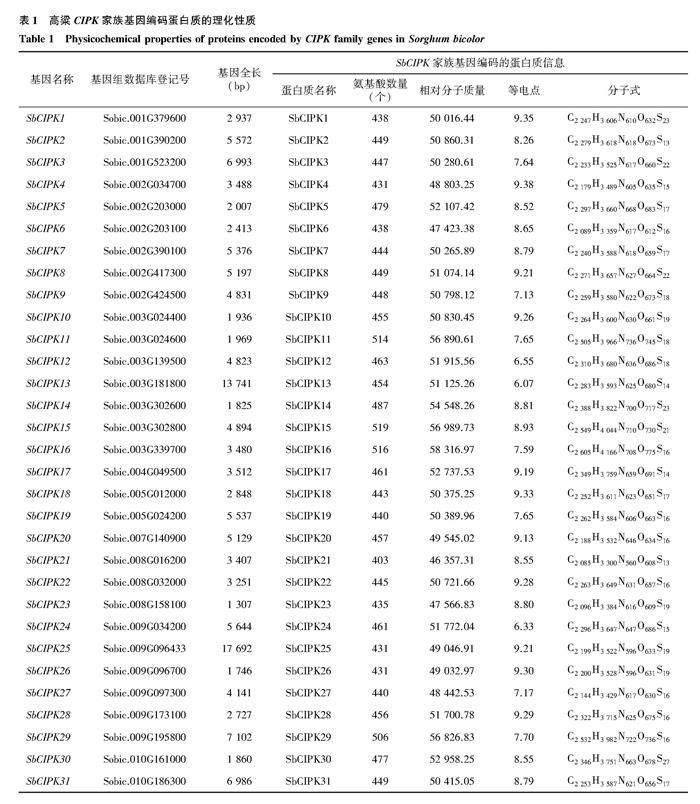
蛋白质理化性质分析结果(表1)表明,SbCIPK家族的氨基酸数量差异不大,氨基酸数量最多的为519個,最少的为403个;相对分子质量为46 357.31~58 316.97,虽然SbCIPK15含有的氨基酸数量最多,但相对分子质量并非最大,相对分子质量最大的是SbCIPK16,含有516个氨基酸。SbCIPK21含有的氨基酸数量最少,相对分子质量也最小。SbCIPK家族蛋白质理论等电点为6.07~938,大部分为碱性蛋白质,仅SbCIPK12、SbCIPK13和SbCIPK24为酸性蛋白质。
2.2高粱CIPK家族的进化树分析
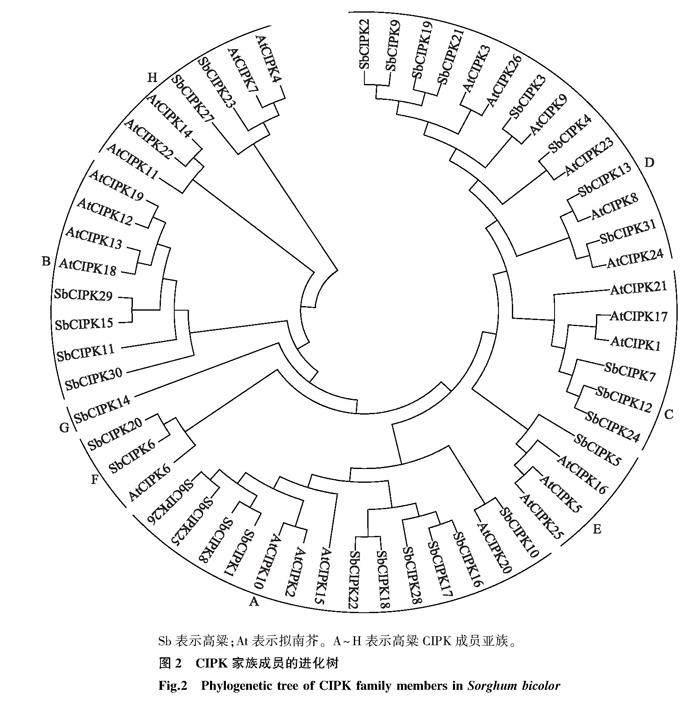
对31个高粱CIPK家族成员和26个拟南芥CIPK家族成员构建进化树,分析高粱CIPK家族系统进化关系。图2显示,将高粱CIPK家族成员分为8个亚族,其中A亚族中SbCIPK成员最多,有10个SbCIPK成员(SbCIPK1、SbCIPK8、SbCIPK10、SbCIPK16、SbCIPK17、SbCIPK18、SbCIPK22、SbCIPK25、SbCIPK26、SbCIPK28);B亚族中有4个SbCIPK成员(SbCIPK11、SbCIPK15、SbCIPK29、SbCIPK30);C亚族中有3个SbCIPK成员(SbCIPK7、SbCIPK12、SbCIPK24);D亚族有8个SbCIPK成员(SbCIPK2、SbCIPK3、SbCIPK4、SbCIPK9、SbCIPK13、SbCIPK19、SbCIPK21、SbCIPK31);E亚族和G亚族中均仅有1个SbCIPK成员,分别为SbCIPK5和SbCIPK14;F亚族和H亚族中各有2个SbCIPK成员,分别为SbCIPK6、SbCIPK20和SbCIPK23、SbCIPK27。在系统进化上高粱和拟南芥CIPK具有较高的同源复制系数,推测它们的同源基因执行相似的功能。
2.3高粱CIPK家族基因结构分析
图3显示,有11个SbCIPK基因包含内含子,分别为SbCIPK2、SbCIPK3、SbCIPK4、SbCIPK7、SbCIPK9、SbCIPK12、SbCIPK13、SbCIPK19、SbCIPK21、SbCIPK24、SbCIPK31。另外20个SbCIPK基因没有内含子,其中SbCIPK23只有外显子。结合进化树分析结果,发现11个包含内含子的SbCIPK基因均聚类在C亚族和D亚族;A、E、F、G亚族中所有基因都有上下游非编码区;B亚族中SbCIPK11和SbCIPK15没有下游非编码区,其余基因均含有上下游非编码区;H亚族中的2个基因SbCIPK23和SbCIPK27均没有上游非编码区。因此,推测C亚族、D亚族与其他亚族相比在功能上存在较大差异。
2.4高粱CIPK家族蛋白质保守基序分析
利用MEME软件分析高粱CIPK家族中10个保守基序,31个SbCIPK家族成员的基序分析结果(图4)表明,每个亚族的成员具有相同或类似的基序类型和排列顺序。A亚族中10个SbCIPK家族成员具有全部10个保守基序且排列顺序完全一致;B亚族中的4个SbCIPK成员均缺少基序9,除了SbCIPK11外,其他3个成员还缺少基序8;C亚族中的3个SbCIPK成员均缺少基序9;D亚族中SbCIPK2、SbCIPK3、SbCIPK9和SbCIPK19具有全部10个保守基序,SbCIPK13和SbCIPK31缺少基序9,SbCIPK4缺少基序2,SbCIPK21缺少基序2和基序4;E亚族中的SbCIPK5缺少基序8;F亚族中SbCIPK20包含全部的基序,而SbCIPK6缺少基序6;G亚族中的SbCIPK14缺少基序8;H亚族中SbCIPK23缺少基序6和基序7,而SbCIPK27仅含有5个基序,缺少的基序较多。
2.5高粱CIPK家族基因在非生物胁迫下的表达特征
本研究分析了高粱CIPK家族基因在非生物胁迫下的诱导表达情况。以31个高粱CIPK家族基因作为查询序列,以获得的30 771条EST序列作为参考序列进行本地BLASTN比对。结果(表2)表明,受水分胁迫诱导表达的基因有7个,分别为SbCIPK6、SbCIPK18、SbCIPK19、SbCIPK20、SbCIPK21、SbCIPK22和SbCIPK24;受盐胁迫诱导表达的基因有6个,分别为SbCIPK2、SbCIPK7、SbCIPK9、SbCIPK18、SbCIPK21和SbCIPK22;受干旱胁迫诱导表达的基因有3个,分别为SbCIPK4、SbCIPK18和SbCIPK22;受低氮胁迫诱导表达的基因有1个,为SbCIPK23。总共有12个SbCIPK基因受至少一种非生物胁迫诱导表达,SbCIPK18和SbCIPK22同时受干旱胁迫、盐胁迫以及水分胁迫诱导表达;SbCIPK21同时受盐胁迫和水分胁迫诱导表达。
我们同样分析了在耐非生物胁迫材料与对非生物胁迫敏感材料之间差异表达的SbCIPK基因。在水分胁迫诱导下,在耐水分胁迫材料与对水分胁迫敏感材料之间差异表达的SbCIPK基因有2个,分别为SbCIPK7和SbCIPK12;在盐胁迫诱导下,在耐盐胁迫材料与对盐胁迫敏感材料之间差异表达的SbCIPK基因有4个,分别为SbCIPK4、SbCIPK6、SbCIPK18和SbCIPK22;在干旱胁迫下,在耐干旱胁迫材料与对干旱胁迫敏感材料之间差异表达的SbCIPK基因有4个,分别为SbCIPK4、SbCIPK5、SbCIPK22和SbCIPK29;在低温胁迫下,在耐低温胁迫材料与对低温胁迫敏感材料之间差异表达的SbCIPK基因有1个,为SbCIPK10;在低氮胁迫下,在耐低氮胁迫材料与对低氮胁迫敏感材料之间差异表达的SbCIPK基因有1个,为SbCIPK30。总共有10个SbCIPK基因在至少一种非生物胁迫下表现为在耐非生物胁迫材料与对非生物胁迫敏感材料之间差异表达。在盐胁迫和干旱胁迫下,SbCIPK4和SbCIPK22在耐盐/耐干旱胁迫材料与对盐/干旱胁迫敏感材料之间差异表达。
3讨论
CIPK蛋白在植物界广泛存在,对于植物通过介导Ca2+信号响应各种生理和发育过程至关重要[11]。CIPK蛋白最早是在模式植物拟南芥中被發现的,在植物应对逆境胁迫中发挥着重要的作用。在本研究中,我们从高粱基因组中鉴定出31个SbCIPK基因家族成员。不同物种中CIPK数量的差异较大,如拟南芥中有26个CIPK,水稻中有33个CIPK[4],小麦中有20个CIPK[5],棉花中有79个CIPK[6],菠萝中21个CIPK[12],萝卜中有51个CIPK[13],茄子中有15个CIPK[14],苜蓿中有135个CIPK[15]。基因可以通过多种机制复制,包括多倍化等全基因组复制。大量连续的全基因组复制产生了重复的基因,随后大量重复的基因在非功能化过程中趋于丢失。推测在进化过程中CIPK家族基因的复制和丢失是导致植物CIPK基因数量不等的主要原因[16]。
作为钙传感器CBL的靶向激酶,CIPK在N端含有激酶催化结构域,在C端含有NAF基序。CIPK的磷酸化是调节这些靶向互作的重要模式[17]。在本研究中,所有SbCIPK都具有相似的N端和C端的调控结构域,磷酸化仍然是大多数CIPK发挥作用的主要途径[18]。NAF是CIPK C端自身抑制结构域中的一个保守区,是CIPK家族的保守特征之一,是CBL的结合位点[19]。高粱CIPK基因结构与其他植物中的一些CIPK基因相似。31个SbCIPK的外显子数量从1个或2个到多个不等,不同的外显子/内含子数量造成了不同的基因长度。这些研究结果表明,具有不同长度外显子的SbCIPK可能发挥多种作用。此外,除了C亚族和D亚族外,A、B、E、F、G、H亚族中的SbCIPK基因是无内含子的分支。因此,推测SbCIPK的聚类可能是由高粱内含子保留和选择性剪接机制的进化造成的。
CIPK广泛存在于植物中,在植物应答非生物胁迫的响应中起着重要作用。Ca2+信号由非生物应激触发,并与1种或多种新型CBL激酶有特定的相互作用。CBL/CIPK复合物可能参与多种CBL-CIPK信号通路,在植物生长和非生物胁迫耐受调控中发挥重要作用。近年来,关于拟南芥、水稻以及小麦等多种植物的研究结果表明,CIPK基因在调节植物的非生物胁迫耐受性方面至关重要。在拟南芥中,AtCBL4和AtCIPK24在质膜上结合,并激活质膜Na+/H+反轉运体AtNHX7,从而维持耐盐离子的稳态[7]。AtCBL10-AtCIPK24主要通过靶向液泡定位的K+(Na)+/H+反转运蛋白AtNHX1从细胞质中排除过量Na+进入液泡,以维持细胞质中Na+的稳定[8]。拟南芥CBL1/9-CIPK23复合物通过磷酸化硝酸盐转运蛋白1/肽转运蛋白家族6.3调控硝酸根离子的摄取[20]。水稻中,CBL1-CIPK23的互作激活了K+转运蛋白AKT1,增强低K+胁迫下水稻植株对K+的吸收[9]。OsCIPK23的过表达诱导了水稻抗旱相关基因的表达[21]。过表达TaCIPK23的小麦在干旱条件下存活率更高,发芽率提高,根系发育更旺盛,渗透物质积累增加,失水率降低[22]。过表达TaCIPK25的小麦表现为对Na+超敏感和Na+的过量积累,根系细胞的Na+/H+跨膜交换受到影响,表明TaCIPK25对小麦的盐胁迫具有负向调控作用[23]。在本研究中,我们分析了高粱CIPK家族基因在多种非生物胁迫下的表达特征,其中多个SbCIPK基因受非生物胁迫诱导表达。基因表达模式的分析结果可以为基因功能的确定提供重要线索,本研究结果为进一步探究高粱SbCIPK家族基因功能奠定了基础。
参考文献:
[1]KOLUKISAOGLU U, WEINL S, BLAZEVIE D, et al. Caleium sensors and their interacting protein kinases:genomics of the Arabidopsis and rice CBL-CIPK signaling networks[J]. Plant Physiology,2004,134:43-58.
[2]KUDLA J, BATISTIC O, HASHIMOTO K. Calcium signals:the lead currency of plant information processing[J]. Plant Cell,2010,22(3):541-563.
[3]ALVRECHTV, RITZ O, LINDER S, et al. The NAF domain defines a novel protein-protein interaction module conserved in Ca2+-regulated kinases[J]. EMBO Journal,2001,20:1051-1063.
[4]CHEN X F, GU Z M, LIU F, et al. Molecular analysis of rice CIPKs involved in both biotic and abiotic stress responses[J]. Rice Science,2011,18:1-9.
[5]SUN T, WANG Y, WANG M, et al. Identification and comprehensive analyses of the CBL and CIPK gene families in wheat (Triticum aestivum L.)[J]. BMC Plant Biology,2015,15:269.
[6]SUN W N, ZHANG B, DENG J W, et al. Genome-wide analysis of CBL and CIPK family genes in cotton:conserved structures with divergent interactions and expression[J]. Physiology and Molecular Biology of Plants,2021,27(2):359-368.
[7]QIU Q S, GUO Y, DIETRICH M A, et al. Regulation of SOS1, a plasma membrane Na+/H+ exchanger in Arabidopsis thaliana, by SOS2 and SOS3[J]. Proceedings of the National Academy of Sciences,2002,99(12):8436-8441.
[8]KIM B G, WAADT R, CHEONG Y H, et al. The calcium sensor CBL10 mediates salt tolerance by regulating ion homeostasis in Arabidopsis[J]. The Plant Journal,2007,52(3):473-484.
[9]LI J, LONG Y, QI G N, et al. The OsAKT1 channel is critical for K+ uptake in rice roots and is modulated by the rice CBL1-CIPK23 complex[J]. Plant Cell,2014,26(8):3387-3402.
[10]MCCORMICK R F, TRUONG S K, SREEDASYAM A, et al. The Sorghum bicolor reference genome:improved assembly,gene annotations,a transcriptome atlas,and signatures of genome organization[J]. The Plant Journal,2017,93(2):338-354.
[11]SANYAL S K, RAO S, MISHRA L K, et al. Plant stress responses mediated by CBL-CIPK phosphorylation network[J]. Enzymes,2016,40:31-64.
[12]ASLAM M, FAKHER B, JAKADA B H, et al. Genome-wide identification and expression profiling of CBL-CIPK gene family in pineapple (Ananas comosus) and the role of AcCBL1 in abiotic and biotic stress response[J]. Biomolecules,2019,9(7):293.
[13]YIN X, WANG Q, CHEN Q, et al. Genome-wide identification and functional analysis of the calcineurin B-like protein and calcineurin B-like protein-interacting protein kinase gene families in turnip (Brassica rapa var. rapa)[J]. Frontiers in Plant Science,2017,8:1191.
[14]LI J, JIANG M M, REN L, et al. Identification and characterization of CBL and CIPK gene families in eggplant (Solanum melongena L.)[J]. Molecular Genetics and Genomics,2016,291(4):1769-1781.
[15]ZHANG X X, REN X L, QI X T, et al. Evolution of the CBL and CIPK gene families in Medicago:genome-wide characterization, pervasive duplication, and expression pattern under salt and drought stress[J]. BMC Plant Biology,2022,22(1):512.
[16]ZHANG X X, LI X X, ZHAO R, et al. Evolutionary strategies drive a balance of the interacting gene products for the CBL and CIPK gene families[J]. New Phytologist,2020,226(5):1506-1516.
[17]DENG J, YANG X, SUN W, et al. The calcium sensor CBL2 and its interacting kinase CIPK6 are involved in plant sugar homeostasis via interacting with tonoplast sugar transporter TST2[J]. Plant Physiology,2020,183(1):236-249.
[18]SANYAL S K, PANDEY A, PANDEY G K. The CBL-CIPK signaling module in plants:a mechanistic perspective[J]. Physiologia Plantarum,2015,155(2):89-108.
[19]GUO Y, HALFTER U, ISHITANI M, et al. Molecular characterization of functional domains in the protein kinase SOS2 that is required for plant salt tolerance[J]. Plant Cell,2001,13:1383-1400.
[20]LERAN S, EDEL H, PERVENT M, et al. Nitrate sensing and uptake in Arabidopsis are enhanced by ABI2, a phosphatase inactivated by the stress hormone abscisic acid[J]. Science Signaling,2015,8(375). DOI:10.1126/scisignal.aaa4829.
[21]YANG W, KONG Z, OMO-IKERODAH E, et al. Calcineurin B-like interacting protein kinase OsCIPK23 functions in pollination and drought stress responses in rice (Oryza sativa L.)[J]. Journal of Genetics and Genomics,2008,35(9):531-543.
[22]CUI X Y, DU Y T, FU J D, et al. Wheat CBL-interacting protein kinase 23 positively regulates drought stress and ABA responses[J]. BMC Plant Biology,2018,18:93.
[23]JIN X, SUN T, WANG X T, et al. Wheat CBL-interacting protein kinase 25 negatively regulates salt tolerance in transgenic wheat[J]. Scientific Reports,2016,6:28884.
(責任编辑:王妮)
收稿日期:2023-02-21
基金项目:亚夫科技服务项目[KF(21)3001];山西省基础研究计划项目(202103021223130);山西种业创新良种联合攻关项目(2022N2GL-06);山西省农业科学院杂粮分子育种平台专项(YGC2019FZ5);山西省科技合作交流专项(202204041101032)
作者简介:徐鹏(1981-),男,江苏扬中人,博士,副研究员,主要从事作物分子育种研究。(E-mail)xupengjaas@126.com
通讯作者:沈新莲,(E-mail)xlshen68@126.com

