2021-2022年河南省猪细小病毒1~7型检测与分析
郭全海,许夕雅,石蒙蒙,杨 寒,高冬生,王永生,陈 陆*
(1.商丘职业技术学院牧医学院,河南商丘 476100;2.河南农业大学动物医学院,河南郑州 450046)
猪细小病毒(Porcine parvovirus,PPV)是细小病毒科一类单链无囊膜的DNA病毒,其基因组大小约为4~6.3 kb[1],两端有回文序列。PPV最早于1965年在德国首次发现,并于1967年从猪流产胎儿的器官中成功分离[2]。该病毒可引起初产母猪产死胎、木乃伊胎、延迟发情等[3]。近些年,不断发现新型猪细小病毒,经典PPV被定义为PPV1,PPV则被定义为PPV1~PPV7的统称。2001年,Hijikata M等[4]在缅甸首次在猪血清中发现猪细小病毒2型(Porcine parvovirus 2,PPV2);2008年,香港学者在猪样品中发现猪细小病毒3型(Porcine parvovirus 3,PPV3);2009年,美国科研人员首次报道在北卡罗来纳州检测到猪细小病毒4型(Porcine parvovirus 4,PPV4);2013年,Xiao C T等[5]首次于美国育肥猪肺中发现猪细小病毒5型(Porcine parvovirus 5,PPV5);2014年,Ni J等[6]在中国猪流产胎儿的组织样品中发现猪细小病毒6型(Porcine parvovirus 6,PPV6);同年,Xing X等[7]在中国首次从血清中检测到猪细小病毒7型(Porcine parvovirus 7,PPV7);2016年,Palinski R M等[8]首次报道在健康成年猪的肛拭子中发现了PPV7。之后全球多个国家相继报道了涵盖上述7种PPV的流行情况,它们大多以引种方式传入[9]。PPV2~PPV7在国内外猪群中广泛流行,PPV2是世界公认的感染率最高的型,约为20%~40%[10-12],肺部组织的检出率为48.8%[13],扁桃体中PPV1~PPV4的检出率为44%~83%[14]。我国的PPV3感染率为43.23%~51.30%,分布在江苏、上海、浙江、安徽等11个省市,在血清、肝脏、肺脏等组织器官中均可检测到[15-16]。 PPV5多发现于临床表现为呼吸系统疾病、腹泻、全身性疾病或生殖系统疾病的发病猪[5]。我国的PPV6感染分布在北京、江苏、天津和四川,流产胎儿(50%)和仔猪(75%)的患病率明显高于育肥猪(15.6%)和母猪(3.8%)。PPV7具有相对广泛的组织趋向性,病猪的血清、肝、肺、腹股沟淋巴结、脾和肾均可检测到PPV7[8]。根据NS1蛋白序列同源性,PPV分为4个不同的细小病毒属,即Protoparvovirus(PPV1)[17]、Tetraparvoviru(PPV2~PPV3)、Copiparvovirus(PPV4~PPV6)和Chapparvovirus(PPV7)[18]。PPV1~PPV7有相似的病毒结构,PPV4具有独特的ORF3,其编码1个功能未知的蛋白(类似“Y”或“T”形状),但PPV1~PPV7基因组同源性较低[19](31.1%~37.0%)。这些PPV是否可引起猪群发病仍在探索中,基于此,需要引起人们的重视,对PPV1~PPV7持续监测。
为了解河南省PPV1~PPV7流行现状,本研究通过对河南省不同地区2021-2022年PPV1~PPV7进行PCR检测,分析不同地区、季节、生长阶段、样品类型的流行情况及其与猪圆环病毒2型(Porcine circovirus 2,PCV2)和猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)混合感染的情况,以期为临床诊断和疫病防控提供依据。
1 材料与方法
1.1 材料
1.1.1 样品 河南农业大学动物疫病防控实验室从河南省猪场于2021-2022年送检样品中选取748份(有合样),包括275份血样、78份口腔液、406份肺脾淋巴结,为临床上有呼吸困难、厌食、高热、咳嗽症状或检出PCV2、PRRSV或无症状的猪样品;PRRSV(cDNA)、PCV2核酸,由河南农业大学动物疫病防控实验室保存。
1.1.2 主要试剂及仪器 2×TaqMaster Mix、DNA Marker,宝日医生物技术(北京)有限公司产品;T100TMPCR仪,Bio-Rad公司产品;全自动样品快速研磨仪Tissuelyser-48L,上海净信实业发展有限公司产品;天隆GeneRotex96核酸提取仪,西安天隆科技有限公司产品。
1.2 方法
1.2.1 引物设计 通过对比分析NCBI数据库中多条PPV1~PPV7的全基因组序列,找到各自保守区利用Primer Premier 5.0设计特异性引物(表1),其中PCV2引物为本实验室保存设计序列,由生工生物工程(上海)股份有限公司合成。

表1 PCR引物信息
1.2.2 样品处理及核酸提取 将肺脾淋巴结剪碎,加入1 mL ddH2O用自动研磨仪研磨3 min成匀浆后冻融3次;向口腔液中加入1 mL ddH2O置于涡旋仪混匀,然后肺脾淋巴结匀浆、口腔液、血样均8 000 r/min离心3 min后取上清,利用GeneRotex96核酸提取仪及配套试剂盒自动化程序完成核酸提取。
1.2.3 样品检测 以1.2.2中提取的核酸为模板,分别利用表1中相应引物对748份样品核酸进行单一PCR扩增。反应体系为25 μL:2×TaqMaster Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA 1 μL,ddH2O 9.5 μL。反应程序:95 ℃ 5 min预变性;95 ℃ 30 s,95 ℃ 30 s(退火温度参考表1),72 ℃ 30 s(扩增片段>1 000 bp 时,延伸时间为45 s),共29个循环;72 ℃终延伸10 min。电泳鉴定,将有目的条带的确定为阳性。
1.2.4 数据统计分析 将样品检测结果输入Excel软件,分析6种PPV感染的情况,包括其在不同地区、季节、生长阶段、样品类型中的感染情况及6种PPV之间、其与PCV2、PRRSV混合感染的情况。
2 结果
2.1 PCR扩增结果
PPV1~PPV7经特异性引物扩增,PCR产物电泳后,除PPV4未检到阳性外,分别在约1 600、1 000、900、600、800、400 bp处观察到目的条带(图1),与预期片段大小相符。

M.DNA标准DL 2 000; 1~6.依次为PPV1、PPV2、PPV3、PPV5、PPV6、PPV7 PC扩增结果
2.2 样品检测结果
2.2.1 PPV1~PPV7的检测结果 对748份样品检测结果显示,PPV2和PPV7的感染率较高,分别是16.04%(120/748)、15.11%(113/748),其次是PPV6为6.55%(49/748),PPV1、PPV3、PPV5的感染率均不到5%,分别为2.41%(18/748)、2.94%(22/748)、3.07%(23/748),其中365份样品中未检出PPV4。
2.2.2 不同地区6种PPV的感染情况 如图2所示,PPV各型在河南省有广泛的地理分布,总体上,豫南的感染率较高。各地区PPV2和PPV7的感染率均高于其他PPV,且除豫北外,PPV2的感染率均高于PPV7,豫南较明显,豫西未检出PPV3。豫北的样品最多,但只有PPV3的感染率高于其他地区,为5.29%(11/208),其他5种PPV的感染率均较低。
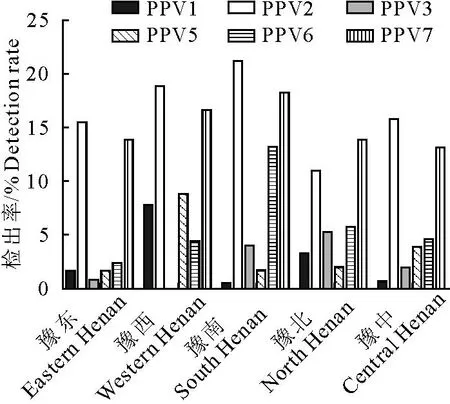
图2 2021-2022年河南省不同地区PPV1/2/3/5/6/7感染情况
2.2.3 不同季节6种PPV的感染情况 按照春(3~5月)、夏(6~8月)、秋(9~11月)和冬(12月~次年2月)四季划分,不同季节检出结果见图3。PPV各型一年四季均流行,PPV7秋季感染率最高,为23.96%(52/217),在春、夏、冬季PPV2的感染率相较于其他PPV高,夏季未检出PPV5。
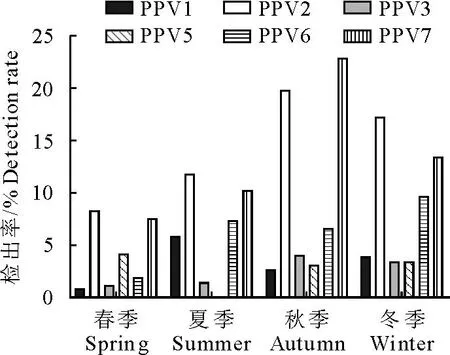
图3 2021-2022年河南省不同季节PPV1/2/3/5/6/7感染情况
2.2.4 不同生长阶段6种PPV的感染情况 不同生长阶段检测结果见图4。不同生长阶段猪群中PPV各型的感染率相差较大,从仔猪到育肥后期PPV各型整体呈现递增态势。在胎儿中,PPV2和PPV7的感染率较高,分别为8.79%(8/91)、7.69%(7/91),PPV3/5/6感染率较低,未检测到PPV1;在仔猪中也发现了类似情况,PPV2的感染率最高,增加到15.69%,此阶段未发现PPV1/3/5感染;PPV1/2/3/5/6/7的感染率逐渐上升,直到育肥后期,保育猪中PPV2感染率最高(19.84%,45/231),PPV7 次之(16.45%,38/231),育肥猪中PPV2 和PPV7感染均达到峰值,分别为20.34%(48/236)、24.58%(58/236);在母猪中,同样均发现6种PPV感染,但整体较低,其中PPV2的感染率最高,为7.53%(11/146),其他PPV检出率都不超过6%。
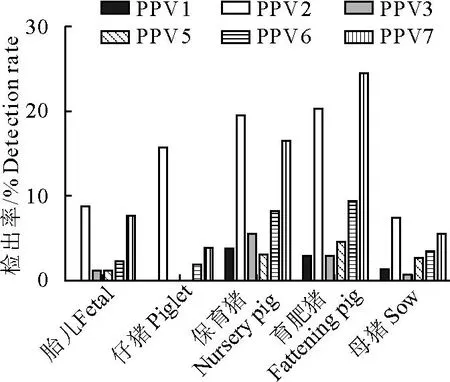
图4 2021-2022年河南省各生长阶段猪PPV1/2/3/5/6/7的感染情况
2.2.5 不同类型样品6种PPV的感染情况 不同类型样品检测结果见图5。PPV1/2/3/5/6/7在口腔液、血样、肺脾淋巴结中均可检出,口腔液和肺脾淋巴结检出率较高。口腔液中检出率最高的是PPV2(23.08%,18/78),其次是PPV7(19.23%,15/78)。血样中检出率最高的是PPV2(9.45%,26/275),其次是PPV6(8.00%,22/275)。肺脾淋巴结中检出率最高的是PPV7(20.94%,85/406),其次是PPV2(19.46%,79/406)。其他PPV检出率都不超过8%。

图5 2021-2022年河南省不同类型样品PPV1/2/3/5/6/7的感染情况
2.2.6 混合感染情况 本研究分别统计了2021-2022年PPV1/2/3/5/6/7之间(表2,图6)及与PCV2、PRRSV的混合感染情况。在PPV1/2/3/5/6/7之间混合感染情况研究中,未发现PPV单一感染,混合感染现象严重,多见于保育和育肥猪。相比于无症状猪样品,PPV2更易在PPV7阳性样品中检出,共在32份样品中发现,除保育和育肥猪的组织样品外,还在1份母猪口拭子、3份死胎、1份仔猪口拭子中检出。PPV2、PPV7均可以与其他PPV混合感染,存在多重感染,双重感染样品数远高于三重、四重、五重感染。PPV2和PPV6的混合感染中,仅有1份在母猪血中检出,其余均在保育和育肥猪的血或肺脾淋巴结中检出。
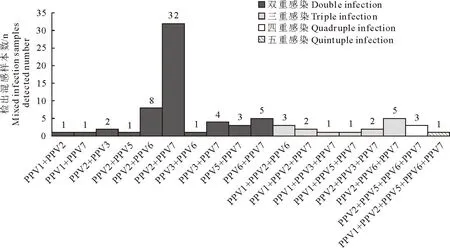
图6 PPV1/2/3/5/6/7之间混合感染情况

表2 PPV1/2/3/5/6/7之间混合感染情况
PPV1/2/3/5/6/7与PCV2混合感染率依次为4.17%(4/96)、26.04%(25/96)、6.25%(6/96)、6.25%(6/96)、8.33%(8/96)、37.50%(36/96)。其中PCV2阳性样品中PPV的感染率高于阴性样品,PPV7与PCV2混合感染最常见。PPV2、PPV7与PCV2的混合感染集中在保育和育肥猪,且多数猪只出现呼吸困难、发热、咳嗽、厌食等症状,PPV2与PCV2的混合感染中育肥猪占比高出保育猪1倍。另外,此种感染偶见于拉稀仔猪,可从肠道和内脏器官检出。PPV1/3/5/6与PCV2混合感染及PPV3/5/6与PRRSV混合感染的猪只未见临床症状,且未在仔猪中发现。PPV2、PPV7与PRRSV、PCV2的混合感染症状类似,PPV2与PRRSV的混合感染率(32.9 7%,30/91)高于PPV7与PRRSV(28.57%,26/91)。PPV1/3/5/6在PRRSV阳性样品中的感染率低于PRRSV阴性样品,其混合感染率依次为2.20%(2/91)、4.40%(4/91)、1.10%(1/91)、6.59%(6/91)。
3 讨论
在病原核酸检测中,PCR方法被认为是“金标准”,本研究利用该方法检测了748份样品,从不同地区、季节、生长阶段、样品类型4个方面对7种PPV感染情况进行分析。结果表明,PPV1/2/3/5/6/7在河南省猪群中广泛流行,PPV2(16.04%)的感染率最高,这与PPV2是全世界最普遍的PPV[12,22-25]的研究是一致的;PPV7(15.11%)感染率次之;未检测出PPV4,可能在2021-2022年河南省未发生该病毒的广泛传播,也可能是所选检测样本中不含该型病毒。何玉[26]研究也发现在2013-2014年中国多个省市均未检PPV4。Li J等[23]、Lagan Tregaskis P等[27]、Huang L等[28]及Afolabi K O等[10]也发现PPV4感染率极低的特点。样品检测发现豫南PPV的检出率高,豫北相对较低,秋、冬季的保育和育肥猪中较常见,这可能与地理位置及自然条件差别有关。赵润泽等[30]研究湖北地区猪细小病毒流行情况,发现恩施地区感染率尤为高,同样有同省不同地区检出率差别大的现象。研究表明,PPV1主要危害初产母猪和血清学阴性的经产母猪[22],PPV2~PPV7未成功分离培养,其致病性暂不清楚。PPV1在保育、育肥猪中样品中检出,而在胎儿及仔猪中未检出,这可能与母猪使用疫苗对该病毒阻断及仔猪出生后获得的母源抗体随猪龄的增高而衰减有关。资料显示,母猪抗体水平高是可以预防PPV1感染,而低的抗体水平可以减少感染猪的PPV1传播[30],这说明了疫苗在很大程度上削弱了河南省PPV1的流行。
在患病保育和育肥猪的肺脾淋巴结中,PPV2/7检出率较高,PPV6在血样中检出率较高,这一结果可能与不同型的PPV组织亲嗜性不同有关。李厚伟等[31]研究发现PPV对猪肾脏、脾脏、淋巴结、妊娠母猪子宫的嗜性最强,对肝脏的嗜性较弱。PPV2感染始于胎儿,并且随着日龄增加感染率逐渐升高,育肥后期开始回落,与Kim S C等[12]、Milek D等[32]的研究结果一致。这一现象表明PPV2感染具有慢性特征,可以感染各个年龄段的猪,这可能是该型PPV检出率高的重要原因。检测结果表明,PPV7的感染与PPV2类似,同样可以感染胎儿、哺乳仔猪保育猪育肥猪和成年猪,这与严美君等[33]研究结果一致。有资料表明,PPV7病毒具有相对广泛的组织趋向性,在病猪的血清、肝脏、肺、腹股沟淋巴结、脾和肾脏中都能够检测到PPV7的存在[8],这可能是它检出率高的因素。人们对PPV2及PPV7的致病性了解少、在引种和防控方面容易忽视它们也可能是传播的另一原因。在本研究中检出PPV2与PPV7的混合感染样本比例大与之前研究的结果吻合。
本研究在样本检测PPV阳性样品中,未发现单一感染,均是混合感染。有资料显示,多数情况下,单独感染PPV并不能引起未怀孕成年猪或仔猪产生临床症状[34]。可能正是这个原因,养殖人员不能及时的进行病原检测与净化,导致该病毒在猪群中广泛传播,待混合其他病毒感染才出现临床症状。本检测中发现PPV与PCV2或PRRSV混合感染率高,可能与PPV对有丝分裂活性组织的趋向性有关。PPV可能通过刺激宿主细胞分裂和酶的产生来増强PCV2与PRRSV的复制,也可能通过减少宿主免疫保护和刺激病毒感染同一宿主细胞来促进PVC2或其他病原体的感染[35]。有报道称PPV2和PRRSV感染有明显的正相关趋势,PPV1~PPV7可作为PCV2复制的刺激因子,并加重PCV2相关疾病[12]。研究证实,猪细小病毒本身能引起繁殖障碍,还可以与PCV2及PRRSV混合感染,与繁殖障碍性疾病有协同作用[36],与本研究结果一致。根据检测结果推测PPV2、PPV7并不直接导致母猪繁殖障碍而是与呼吸系统疾病有关。这与Li J等[23]、Kim S C等[12]的研究结果吻合。
目前市场上暂未流通PPV2~PPV7疫苗,PPV2/3/5/6/7感染率较PPV1高且它们之间的同源性较低,这说明PPV1疫苗很难对PPV2~PPV7产生交叉保护作用[1]。PPV1对外界环境的抵抗力很强,猪场一旦感染很难消除,最好的防控措施是接种疫苗。鉴于PPV1的防控经验,在PPV2~PPV7没有疫苗的情况下,饲养人员应当切实做好猪舍通风和定期消毒工作,阻断病原微生物的感染与传播,坚持自繁自养,确需引种的要做好监测、消毒和隔离工作[37-38]。PPV与多种病原混合感染已是常态,今后猪病的防控与净化应以多病原治理为思路。制定优良的免疫程序,搭配科学的管理制度,强化疫病净化,建立生物安全体系。就目前所知,本研究为首次对河南省PPV1~PPV7的检测分析,可为河南省PPV防控提供新的参考。

