阿米卡星诱导对大肠埃希氏菌耐药性及生物被膜和外排泵活性的影响
李苗苗,赵 恒,陶梦珂,张鲁星,石晴晴,胡功政,贺丹丹,刘建华
(河南农业大学,河南郑州 450000)
大肠埃希氏菌易附着于物体表面形成生物被膜(biofilm,BF),其形成是细菌建立感染并导致宿主疾病的重要过程之一[1],并影响细菌对抗菌药物的敏感性,从而使得细菌出现耐药性[2]。此外,BF对抗菌药物具有很强的抵抗性,形成后很难被彻底清除,易导致反复感染[3]。研究发现,多种抗菌药物及消毒剂等在亚抑菌浓度可以影响细菌的某些生物学行为,包括耐药性、毒力、运动性及生物被膜形成、外排泵活性等。如亚抑菌浓度的头孢哌酮对部分大肠埃希氏菌生物被膜形成具有诱导作用[4];庆大霉素对粪肠球菌耐药性的诱导作用[5]及亚抑菌浓度的消毒剂苯扎氯氨对金黄色葡萄球菌、无乳链球菌、李斯特菌生物被膜形成的促进作用[6]。亚抑菌浓度不足以杀死细菌,但可改变细菌代谢、细胞壁结构,从而影响细菌对细胞的吸附力以及增加细菌的耐药性。针对亚抑菌浓度抗菌药物对细菌生物被膜形成的影响,研究结果显示有抑制、诱导和无作用,呈多样性[7]。但过去的文献研究内容,更多的集中在耐药性方面,而对于亚抑菌状态下的生物被膜和主动外排泵活性的研究相对较少。
细菌外排泵是细菌中普遍存在的跨膜蛋白,可将多种有害物质从细菌细胞内排到外部环境,因此是多药耐药的关键机制[8]。由于亚抑菌浓度在治疗感染过程中不可避免,因此研究亚抑菌浓度阿米卡星对大肠埃希氏菌细菌生物被膜和外排泵活性的影响,具有重要的临床意义。本研究观察亚抑菌浓度阿米卡星对6株大肠埃希氏菌分离菌株耐药性、生物被膜形成和主动外排泵的影响,为进一步深入探讨亚抑菌浓度阿米卡星诱导大肠埃希氏菌生物被膜形成的作用机制奠定基础,同时为氨基糖苷类药物用药提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 质控菌株大肠埃希氏菌ATCC25922,购自中国兽医药品监察所;156株大肠埃希氏菌,由河南农业大学药理实验室分离、鉴定并保存。
1.1.2 药品与试剂 溴化乙锭(ethidium bromide,EtBr),上海阿拉丁生化科技股份有限公司产品;LB肉汤培养基、胰蛋白胨大豆(TSB)肉汤培养基、MH(B)培养基、麦康凯琼脂(MAC)培养基和结晶紫,青岛海博生物技术有限公司产品;阿米卡星,河南牧翔动物药业有限公司产品。
1.1.3 主要仪器与设备 Spapk 10M酶标仪,瑞士帝肯(Tecan)公司产品;紫外分光光度计,上海奥析科学仪器有限公司产品;电子天平,梅特勒-托里仪器上海有限公司;96孔细胞培养板,赛默飞世尔科技有限公司产品。
1.2 方法
1.2.1 菌株复苏 从-80 ℃取出保存的菌液,与LB肉汤按1∶100混合后,190 r/min 37 ℃摇床过夜培养,次日在超净台中用一次性无菌接种环蘸取适量菌液接种于MAC培养基上,并在恒温培养箱中37 ℃静置培养16~18 h ,置于4 ℃冰箱备用。
1.2.2 阿米卡星敏感菌株的筛选 根据阿米卡星对大肠埃希氏菌折点敏感值,配制含有相应药物浓度的MAC培养基,并将156株分离大肠埃希氏菌分别划线于培养基,在37 ℃培养16~20 h。记录未生长菌株。
1.2.3 微量肉汤稀释法测定阿米卡星最小抑菌浓度 以大肠埃希氏菌标准菌株ATCC25922作为质控菌株,阿米卡星配制和药物敏感性试验操作步骤及其结果判定均参考美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)2022版标准[9],采用微量肉汤稀释法测定阿米卡星对1.2.2项下未生长菌株的最小抑菌浓度(minimum inhibitory concentration,MIC),重复3次,并将阿米卡星对应0.5 MIC作为初始诱导浓度。
1.2.4 敏感菌株的诱导 取高压灭菌后的10 mL试管,每管加入3 mL LB肉汤和各菌株悬液100 μL,计算应加入的药液体积,使试管中阿米卡星终浓度为0.5 MIC,37 ℃恒温190 r/min培养18~24 h,此即为1 d,连续诱导30 d,期间进行如下操作:①每隔5 d测定MIC并调整肉汤中的阿米卡星浓度,使之保持0.5 MIC。②每隔5 d将诱导菌株划线于MAC培养基并观察菌落形态及是否污染有杂菌,同时保存菌株。③若在培养过程中菌株生长不良,则使用前1 d的菌株在无药物状态下进行再次培养,然后加入0.5 MIC的阿米卡星继续诱导。
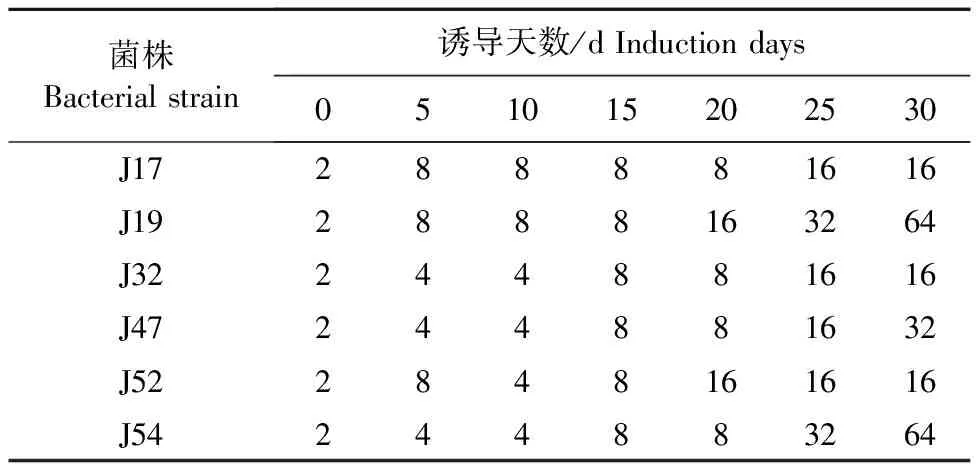
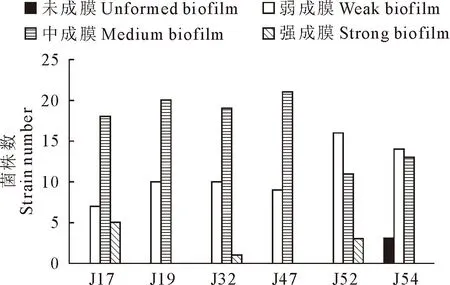
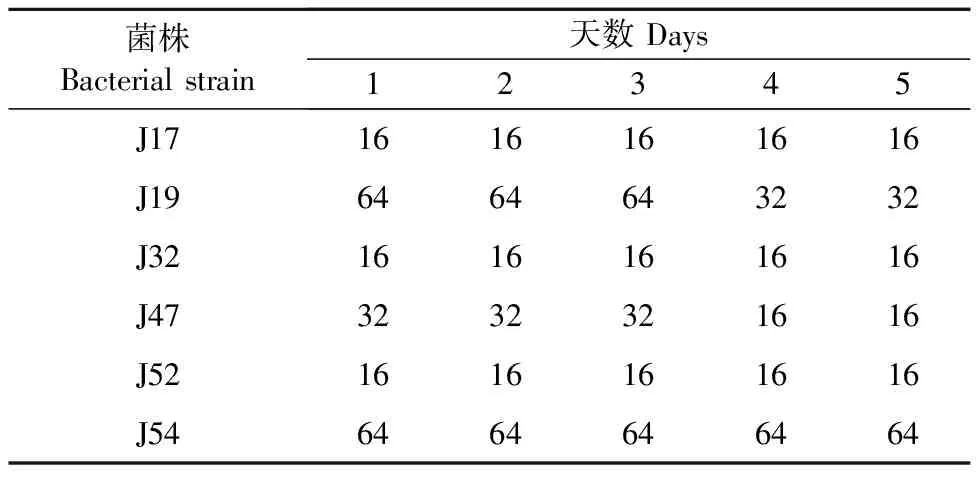
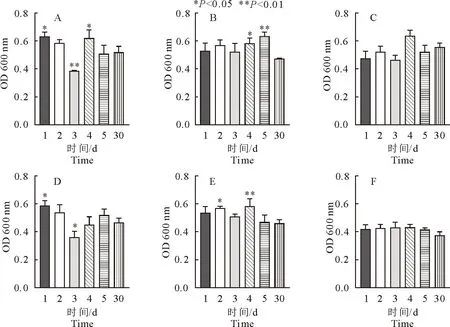
1.2.5 诱导菌株生物被膜形成能力测定 将诱导后保存菌株复苏划线于MAC培养基,37 ℃培养12~16 h,挑取单菌落至3 mL TSB(含1%葡萄糖)中,37 ℃、190 r/min摇菌过夜培养。使用细菌比浊仪调节稀释菌液至108CFU/mL,将稀释后的菌液用TSB(含1%葡萄糖)进行1∶100稀释,稀释后分别加入含有硅胶片的24孔细胞培养板中,每孔500 μL,每株菌做3个复孔;以无菌培养基作为阴性对照,25 ℃静置培养72 h。弃去培养基并用灭菌去离子水轻柔冲洗,甲醇固定,后使用灭菌去离子水轻柔冲洗风干;每孔中加入结晶紫染色,洗涤后冰醋酸脱色,将24孔板中的液体每孔200 μL转至96孔板,在600 nm单波长下使用酶标仪测定吸光值。结果判定:以空白对照组的2倍OD值为临界值(ODC),生物被膜依据与ODC的关系分为强成膜能力菌株(4ODC 1.2.6 诱导菌株无药培养及稳定性测定 取高压灭菌后的10 mL试管,每管加入LB肉汤2.9 mL,将经阿米卡星诱导第30天菌株悬液100 μL分别加入各管中,37 ℃、190 r/min培养18~24 h,连续共计培养5 d,保存每天的各菌株悬液。 1.2.7 阿米卡星诱导对菌株外排泵活性的影响 将各菌株悬液置于37 ℃、190 r/min 摇床振荡培养至指数期;以10 000 r/min离心5 min;用缓冲液反复洗涤2次,再悬浮于缓冲液中配制OD 600 nm= 0.5 的菌悬液。加入EtBr至终浓度为5 μmol/L。并将其分装到相应的2 mL试管中,充分混匀,37 ℃孵育1.5 h。用Spark多功能酶标仪以530 nm激发波长,600 nm发射波长进行荧光强度测定。 1.2.8 数据统计及分析 所有试验均进行3个平行,使用SPSS 26.0软件对数据进行统计和显著性分析,使用GraphPad Prisim 8.0软件进行绘图。*表示P<0.05,差异显著;**表示P<0.01,差异极显著。 表1为阿米卡星对诱导不同天数各个菌株MIC测定结果。从表1可以看出,随着诱导天数的增加,阿米卡星对各诱导菌株MIC均有所增加。诱导至第30天时,阿米卡星MIC上升8~32倍,其中对J19、J54的诱导菌株MIC变化最大,为原来的32倍;J17、J32和J52变为原来的8倍,J47为原来的16倍。 表1 阿米卡星对其诱导大肠埃希氏菌MIC变化 图1为阿米卡星诱导后菌株生物被膜形成能力测定结果。从图1可以看出,经阿米卡星诱导30 d后,6株菌株各有30株诱导菌株,共180株。测定结果显示,J17、J32、J52诱导后,分别有5、1、3株强成膜能力菌株。强成膜能力菌株占总诱导菌株的5%,中成膜能力菌株为56.7%,其余为弱成膜及未成膜能力菌株。 图1 阿米卡星诱导后大肠埃希氏菌生物被膜形成能力测定结果 图2为阿米卡星诱导后菌株每5 d OD 600 nm均值变化,从图2可以看出,随着阿米卡星诱导时间增加,生物被膜形成量也逐渐增多。与诱导前原菌相比,图2A中J17诱导菌株在第11~15天 OD 600 nm均值出现显著升高(P<0.05),诱导第21~25天和第26~30天菌株OD 600 nm均值极显著升高(P<0.01)。在图2B和2C中,诱导菌株J19和J32在第1~5天OD 600 nm均高于原菌(P<0.01),随着时间的延长诱导菌株生物被膜形成量增加,且与原菌相比,生物被膜生成量差异显著。在图2D中J47生物被膜形成量变化较大,在第6~10天诱导菌株较原菌显著升高,但在第11~15天无显著变化,之后从第16~20天之后OD 600 nm均值均显著高于原菌。图2E中J52第1~5天、第6~10天、第11~15天、第16~20天这4个阶段的生物被膜形成量相近,与原菌相比,均呈现极显著升高,但在第21~25天OD 600 nm均值突然升高,同时与第26~30天OD 600 nm相近。图2F中J54诱导菌株中从第6~10天出现极显著升高,随时间延长诱导菌株生物被膜量增加,在第26~30天达到了最高量。以上结果表明,阿米卡星诱导时间长的菌株生物被膜形成量较多,亚抑菌浓度阿米卡星诱导能够促进菌株生物被膜形成。 A.J17;B.J19;C.J32;D.J47;E.J52;F.J54 表2为第30天诱导菌株无药培养后敏感性测定结果。可以看出,无药培养5 d的菌株与诱导第30天菌株相比,阿米卡星对J17、J32、J52和J54菌株MIC无显著变化;而对J19和J47在无药前3 d培养菌株MIC一致,后2 d下降至原来的1/2。 表2 阿米卡星诱导大肠埃希氏菌MIC稳定性测定结果 图3为诱导第30天菌株在无药培养后生物被膜量测定结果。可以看出,图3A和图3D无药培养菌株J17和J47在第3天生物被膜形成量显著降低,但第1天显著升高。图3C和3F中无药培养菌株在5 d内生物被膜形成量与第30天诱导菌株相比无显著性差异。图3B中与诱导第30天菌株生物被膜形成量相比,J19无药培养第4天和第5天菌株显著升高,其他3 d无显著性差异。图3E中与诱导第30天菌株生物被膜形成量相比,J52无药培养第2天和第4天菌株显著升高,其他3 d无显著性差异。结果说明诱导菌株在无药培养5 d生物被膜形成能力较稳定。 A.J17;B.J19;C.J32;D.J47;E.J52;F.J54 荧光探针EtBr被用于作为主动外排泵的作用底物,以追踪外排泵的活性。荧光探针EtBr本身只产生微弱的荧光,这种探针可以通过自由扩散进入细菌细胞内,与细胞内的DNA结合时产生强荧光,但细菌外膜上的外排泵可主动将其泵出细胞外,从而减少EtBr在细胞内的蓄积,导致荧光强度降低,可以用其来示踪外排泵活性。 图4为阿米卡星诱导30 d菌株外排泵测定结果,与原菌相比,阿米卡星诱导菌株JA17、JA19、JA47、JA52、JA54荧光强度显著升高(P<0.05或P<0.01),而JA32荧光强度增加,但差异不显著。说明阿米卡星诱导使细菌外排泵活性降低。图5为第30天诱导菌株无药传代后外排泵测定结果,从图中可以看出,与第30天诱导菌株荧光强度相比,菌株JA17-35、JA19-35、JA32-35、JA52-35显著升高(P<0.05),但菌株JA47-35、JA54-35无显著变化。说明经5 d的无药物压力培养后,部分菌株外排泵活性持续降低,以上表明阿米卡星诱导减弱了外排泵部分基因的表达,从而使其活性减弱。 图4 阿米卡星诱导对大肠埃希氏菌外排泵活性的影响 图5 阿米卡星诱导对大肠埃希氏菌外排泵活性稳定性测定结果 普遍观点认为抗菌药物的使用是病原菌产生耐药性的关键。由于长期持续的不当使用抗菌药物,给细菌的生存环境造成了选择性压力,这种环境压力因素通过多种机制导致病原菌对抗菌药物产生耐药性[10]。本研究对6株大肠埃希氏菌进行体外诱导试验,结果发现阿米卡星对6株菌株产生了耐药性。生物被膜形成能力结果发现,阿米卡星诱导后促进菌株生物被膜形成。有研究表明亚抑菌浓度抗菌药物可以增强细菌生物被膜的形成能力从而造成其持续性感染[11]。但也有研究表明亚抑菌浓度的阿米卡星会抑制大肠埃希氏菌生物膜形成[12],这与本研究不一致,这可能与菌株差异及研究方法不同有关。有研究发现,氨基糖苷类药物作用靶点可能是铜绿假单胞菌内膜的氨基糖苷类反应蛋白,该蛋白具有c-di-GMP磷酸二酯酶活性,可被氨基糖苷类药物诱导,使第二信使c-di-GMP失活,促进铜绿假单胞菌生物被膜形成。同源性检索发现,大肠埃希氏菌等其他一些革兰氏阴性菌中存在类似蛋白,提示氨基糖苷类药物可能对其他革兰氏阴性菌生物被膜也有诱导作用[12],本试验研究结果也证实了以上观点。诱导后耐药菌株在无药物压力下培养后,其耐药状态不变,较为稳定,这与詹煜慧[13]结果相似。 Ara J报道[14],金黄色葡萄球菌经亚抑菌浓度的左氧氟沙星和苯唑西林诱导后,其耐药性下降,生物被膜黏附相关基因和主动外排基因表达量至少增加了5倍以上。本研究的结果显示,阿米卡星诱导大肠埃希氏菌外排泵活性降低,且经无药物压力培养后,部分菌株外排泵活性继续降低,这可能和诱导药物的种类及菌株种类有关,具体的机制有待进一步研究。本研究中,诱导菌株耐药性的加剧可能更多与生物被膜的形成量的增加有关,而外排泵活性的降低则会使诱导菌株体内药物浓度增加,恢复其敏感性,显而易见,在本研究中,生物被膜的增加占主导地位,从而使菌株耐药性增加。 综上所述,亚抑菌浓度阿米卡星诱导使敏感菌株生物被膜形成能力增加,外排泵活性降低,促进耐药性的产生,因此治疗过程中应根据药物的代谢特点,尽量避免或减少细菌处于亚-MIC的时间。本研究为抗菌药物的合理使用提供了理论依据,丰富了抗感染理论。但本研究测定菌株均为浮游菌,其生物被膜菌的耐药性及外排泵活性有待进一步研究。2 结果
2.1 阿米卡星对诱导不同天数菌株最小抑菌浓度测定结果
2.2 阿米卡星诱导后菌株生物被膜形成能力测定结果
2.3 阿米卡星诱导后菌株被膜形成能力变化

2.4 诱导菌株稳定性测定
2.5 阿米卡星诱导对菌株外排泵活性的影响


3 讨论

