腹泻犬粪源大肠埃希氏菌的分离鉴定及其耐药特性与毒力基因的检测
邓亚飞,王 康,闫 康,张留君,贺绍君
(安徽科技学院动物科学学院/动物营养调控与健康安徽省重点实验室,安徽凤阳 233100)
我国宠物市场的规模快速增长,其中犬为主要饲养宠物。大肠埃希氏菌是分布广泛的常在菌群,也是造成人类和动物感染的元凶之一。大肠埃希氏菌感染性疾病往往导致幼犬成活率低、生长缓慢甚至死亡[1]。另外,宠物犬作为亲密的家庭成员,与我们关系密切,存在将高耐药致病株传播给人类的可能。研究资料表明,犬是导致人类肠外感染的致病性大肠埃希氏菌(Extraintestinal pathogenicEscherichiacoli,ExPEC) 的可能储存库[2]。宠物犬带给人类的传染性疾病呈现出高发的趋势[3]。世界卫生组织调查表明,有近75%的人类新发传染病来源于动物[4]。细菌对抗菌药物的耐受是一个全球性问题,耐药菌株污染食品、环境和水源,严重威胁人类健康[5]。大肠埃希氏菌作为内源性微生物群的一部分,很容易对人类和动物摄入的抗菌药物产生耐药[6],构成抗性基因库,并可水平转移给其他细菌[7],使一些病原体威胁人类健康的能力显著增强。从动物源头防控传染病,“人病兽防”是减少人传染病的关键环节[8]。本研究以采集自安徽省蚌埠地区的75份腹泻宠物犬粪便为样本,进行大肠埃希氏菌分离培养,并对分离菌株的耐药表型和耐药基因、毒力基因进行检测,旨在调查蚌埠地区犬大肠埃希氏菌抗菌药物耐药性和毒力基因流行的情况,对犬大肠杆菌病的防治提供指导,并对大肠埃希氏菌致病性及耐药机制的研究提供参考。
1 材料方法
1.1 材料
1.1.1 样本材料 腹泻犬肛拭子75份,其中41.3% (31/75) 来自宠物交易市场,32%(24/75)来自宠物医院,26.7%(20/75)来自流浪犬收养基地;2月龄内犬占60%(45/75),1~5岁犬18.7%(14/75),5~10岁犬21.3%(16/75),样本均为稀便或水样粪便。
1.1.2 主要试剂 麦康凯琼脂、营养琼脂,广东环凯微生物科技有限公司产品;药敏试纸片,杭州滨和微生物试剂有限公司产品;DNA标准DL 2 000、2×SanTaqPCR Mix (Dye Plus),生工生物工程(上海) 股份有限公司产品。
1.1.3 主要仪器 立式压力蒸汽灭菌器(LDZX-50FB),上海申安医疗器械厂产品;超净工作台(ZWZM-1),上海智城分析仪器制造有限公司产品;隔水式恒温培养箱(GSP-9050MBE),上海森信实验仪器有限公司产品;PCR扩增仪(ETC811),北京东胜生物科技有限公司产品;凝胶成像仪(Tanon1600),上海天能科技有限公司产品。
1.2 方法
1.2.1 细菌的分离鉴定 灭菌LB肉汤稀释粪便样本,无菌接种环蘸取稀释液划线于接种麦康凯琼脂,37 ℃培养18 h后挑取单菌落(粉红色、光滑、湿润)接种于营养琼脂纯化,对纯化菌株进行革兰氏染色、镜检,采用煮沸法提取疑似大肠埃希氏菌DNA,对16S rRNA基因进行扩增、测序,通过NCBI数据库比对鉴定。
1.2.2 引物设计及基因扩增 参考文献[9]合成16S rRNA引物序列:27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTAACCTTGTTACGACT-3′; 50 μL PCR体系:2×SanTaqPCR Mix (Dye Plus) 25 μL,上、下引物各1.5 μL,DNA模板3 μL,无菌超纯水19 μL;PCR程序:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃终延伸10 min。
1.2.3 药敏试验 K-B纸片扩散法进行药物敏感试验,用无菌涂布棒沾取适量大肠埃希氏菌均匀涂布于营养琼脂平板,然后均匀的贴上药敏纸片,37 ℃培养16 h,观察记录结果。
1.2.4 大肠埃希氏菌耐药基因检测 参考文献[9]合成所需引物,耐药基因引物序列信息见表1。分别为tetA、aac(6’)-Ⅱ、qnr、blaCMY-2、aadA1和sul1。引物合成由生工生物工程(上海)股份有限公司完成。25 μL PCR体系:2×SanTaqPCR Mix (Dye Plus) 12.5 μL,上、下引物各1 μL,DNA模板2 μL,超纯水8.5 μL;PCR程序:94 ℃ 5 min;94 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃终延伸10 min。PCR扩增完成后,PCR产物用2%琼脂糖凝胶进行电泳,120 V电压,30 min。

表1 大肠埃希氏菌耐药基因PCR引物信息
1.2.5 大肠埃希氏菌毒力基因检测 参考文献[9]合成所需引物,毒力基因引物序列信息见表2。

表2 大肠埃希氏菌毒力基因PCR引物信息
表2中分别为大肠埃希氏菌的质控基因mdh、编码Ⅰ型菌毛的fimC、外膜蛋白的ompA、编码溶血素的hlyF、编码血清抗性的iss以及编码气杆菌素的iucD,引物合成由生工生物工程(上海)股份有限公司完成。25 μL PCR体系:2×SanTaqPCR Mix (Dye Plus) 12.5 μL,上、下引物各1 μL,DNA模板2 μL,超纯水8.5 μL;PCR程序:94 ℃ 5 min;94 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃终延伸10 min。PCR扩增完成后,PCR产物用2%琼脂糖凝胶进行电泳,120 V电压,30 min。
2 结果
2.1 细菌的分离鉴定
分离菌株在麦康凯琼脂上为红色圆形、表面光滑、湿润、不透明的中等大小菌落,镜检结果显示62株分离菌株均为单个存在、杆状的革兰氏阴性菌,16SrRNA基因PCR扩增产物见图1(图中仅为部分个体样本代表),经测序对比后可确定分离菌株均为大肠埃希氏菌。

M.DNA标准DL 2 000;NC.阴性对照;1~19.16S rRNA产物M.DNA Marker DL 2 000;NC.Negative control;1-19.16S rRNA products
2.2 药敏试验结果
62株大肠埃希氏菌对12种抗菌药物药敏试验结果见表3,其中对恩诺沙星耐药率最高为46.8%,对头孢菌素类抗菌药物普遍较敏感,耐药率在6.5%~12.9%之间。
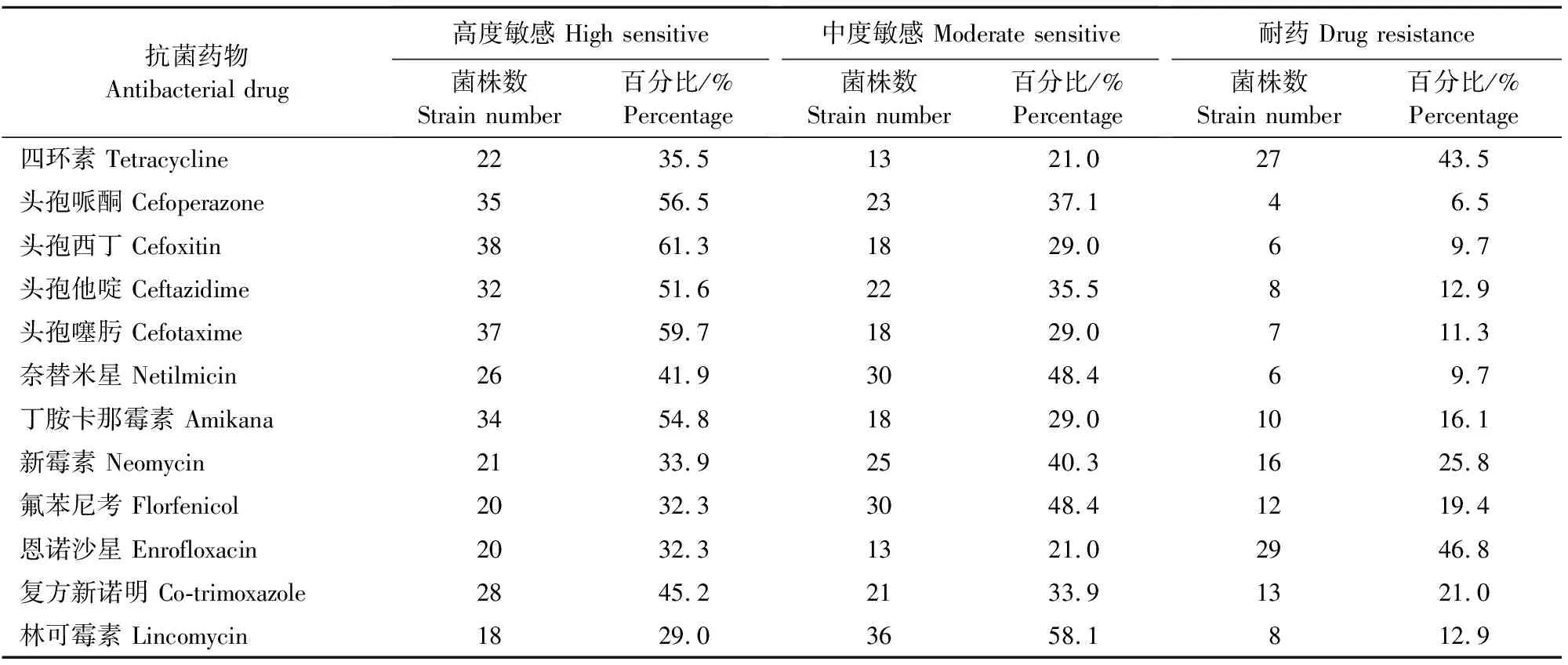
表3 大肠埃希氏菌药敏试验结果Table 3 Results of drug sensitivity test of Escherichia coli
2.3 大肠埃希氏菌耐药基因检测结果
62株大肠埃希氏菌的6种耐药基因扩增结果见图2(图中仅为部分个体样本代表),其中携带率最高的是qnr(51.6%,32/62),最低的是blaCMY-2(9.7%,6/62);tetA、aac(6′)-Ⅱ、aadA1、sul1的携带率分别为45.2%(28/62)、29.0%(18/62)、22.6%(14/62)、27.4%(17/62)。
A.tetA;B.aac(6′)-Ⅱ;C.aadA1; D.blaCMY-2; E.qnr;F.sul1;M.DNA标准DL 2 000;1~17.大肠埃希氏菌A.tetA;B.aac(6′)-Ⅱ;C.aadA1;D.blaCMY-2;E.qnr;F.sul1; M.DNA Marker DL 2 000;1-17.Escherichia coli
2.4 大肠埃希氏菌毒力基因检测结果
62株大肠埃希氏菌的6种毒力基因扩增结果见图3(图中仅为部分个体样本代表),其中mdh、ompA、fimC有较高的携带率分别为100%(62/62)、74.2%(46/62)、64.5%(40/62),iss的携带率最低19.4%(12/62),iucD、hlyF的携带率分别为27.4%(17/62)、24.2%(15/62)。

A.mdh; B.fimC; C.ompA; D.hlyF; E.iss; F.iucD; M.DNA标准DL 2 000; 1~17.大肠埃希氏菌A.mdh; B.fimC; C.ompA; D.hlyF; E.iss; F.iucD; M.DNA Marker DL 2 000; 1-17.Escherichia coli
3 讨论
大肠埃希氏菌是普遍的胃肠道共生微生物,大多是无害的,但是由于基因的获得或丧失,共生大肠埃希氏菌可能获得不同类型的耐药和毒力基因[10],从而成为导致多种食源性疾病的高耐药致病株。越来越多的证据表明,抗菌药物的使用是细菌耐药性产生的关键风险所在[6],本试验中样本对恩诺沙星表现出较高的耐药性,与本地区主要以恩诺沙星作为犬用抗菌制剂使用相关,符合抗菌药物压力选择耐药菌株产生的理论[6]。对头孢菌素类、氨基糖苷类、磺胺类等11种抗菌药物均有较高敏感性,其中对头孢类抗菌药物尤为敏感。另有证据表明,天然分离大肠埃希氏菌对抗菌药物的耐药性不断增加,这突出了耐药基因水平转移的重要性[11]。宠物犬也可能成为耐药基因的潜在宿主和传播者,对人类和其他动物健康构成威胁。本研究的耐药基因检测结果显示,qnr基因的携带率为51.6%,与喹诺酮类抗菌药物恩诺沙星的耐药率46.8%相近,两者的一致性达到了90.6% (29/32),四环素类、磺胺类的耐药基因与耐药表型的相关性也分别达到了96.4%(27/28)、76.5%(13/17),表明以分子学方法对大肠埃希氏菌抗菌药物耐受表型进行检测有较高的可信度。
毒力基因是病原微生物致病力决定的关键[12]。本研究对所分离的62株大肠埃希氏菌进行6种毒力基因的重点检测,结果显示大肠埃希氏菌的看家基因的mdh检出率为100%,这也进一步证实了对分离菌株基因检测的有效性。ompA、fimC基因的检出率最高分别为74.2%、64.5%,ompA在细菌外膜基本功能及免疫方面有重要作用,它的高携带率为大肠杆菌病防治的深入研究提供了思路[13],fimC与菌毛形成有关,关系到细菌在机体的定植、抵抗清除与细菌生物膜形成能力,它的高携带率为致病作用提供了重要条件[9]。iss基因的携带率最低为19.4%。本研究中所分离大肠埃希氏菌均有不同数量的毒力基因携带,部分毒力基因的组合可能会存在较高的发病威胁[10],特别是对于处于较差生理状况的宿主[14]。本研究中较高毒力基因的携带应当引起我们的特别关注。
高耐药致病性大肠埃希氏菌一直被认为是人兽共患病的重要问题[15],而且,与生产动物相比,用于伴侣动物的抗菌制剂更类似于用于人类医学的抗菌剂,耐药菌株的跨物种传播更增大了人类临床治疗的难度[16]。以伴侣动物为对象的病原菌监测有助于预防及指导抗菌药物的使用[17],大肠埃希氏菌是非常理想的研究细菌的模型,该群体的耐药性发展可能对人类公共卫生产生更显著的影响。结合耐药检测结果,本次试验同时也为犬大肠埃希氏菌感染性疾病中抗菌药物的选择和使用提供有效参考。犬和主人长期共同生活,增加了将病原菌传染给主人的机率,甚至可能出现由同一微生物引起的多处感染,肠道及泌尿道感染较为常见[3]。加强对伴侣动物大肠埃希氏菌致病因子基因的流行分布及耐药情况检测就显得更为重要。

