青海牧区犊牛腹泻大肠埃希氏菌毒力基因及血清型分布特征研究
石 田,韩生义,李淑萍,胡国元,李玲霞,李生庆*
(1.青海大学农牧学院,青海西宁 810016;2.青海大学畜牧兽医科学院,青海西宁 810016;3.青海省动物疾病病原诊断与绿色防控技术研究重点实验室,青海西宁 810016)
近年来,青藏高原牧区犊牦牛腹泻的发病率呈上升趋势,同时犊牦牛腹泻死亡时常发生。引起犊牦牛腹泻的病因可分为两大类,主要包括传染性因素和非传染性因素,在临床中以传染性因素较多见,传染性因素主要包括细菌、病毒、寄生虫等。研究表明细菌性因素是引起青海牧区犊牦牛腹泻的主要原因,其中大肠埃希氏菌是最主要的致病因素。大肠埃希氏菌作为一种条件性致病菌,在正常情况下不会对动物机体造成损伤,但当外界环境发生改变以及动物机体抵抗能力下降时便会大量繁殖,产生毒素,危及牦牛的生长;加之青海地区地处高海拔环境,冷季持续周期较长,同时牦牛养殖业粗放的养殖方式,在这样的情况下,一旦犊牛没有得到好的照料,会导致机体抵抗力降低,大肠埃希氏菌便会在犊牛体内繁殖产生大量毒素,引起犊牛腹泻的发生,且其主要危害哺乳阶段的犊牛,具有发病急、传播速度快、危害严重的特点,一旦发生流行,将会引发大量的死亡[1]。大肠埃希氏菌拥有多种致病性的血清型,且各血清型之间的交叉保护能力较差,导致该病的防控难度增大。同时,已有研究证实大肠埃希氏菌可经接合、转座等方式进行水平传播,将其具有的毒力基因和耐药基因进行水平传播,增大对该病的治疗和防治难度[2]。近年来的研究发现大肠埃希氏菌上不断有新的毒力因子和血清型的发现。然而,现有的关于青海地区大肠埃希氏菌在该方面的细致研究较少,因此,通过本项研究可以为青海牧区致犊牦牛腹泻大肠埃希氏菌流行病学及部分生物学特性的深入探析及犊牦牛腹泻病的防治提供依据。
1 材料与方法
1.1 材料
1.1.1 样品及标准菌株 样品采自青海省玉树、果洛、海北3个州的腹泻犊牦牛新鲜粪便、腹泻死亡犊牛肠道内容物(粪便93份、肠内容物6份)。大肠埃希氏菌(Escherichiacoli)标准菌株ATCC 25922、大肠埃希氏菌O157:H7 NCTC12900菌株,由青海大学畜牧兽医科学院高原动物疫病诊断实验室保存。
1.1.2 实验动物 昆明系小白鼠,16~18 g,雄性,购自中国农业科学院兰州兽医研究所实验动物中心(生产许可证号:SCXK(甘)2020-0002)。
1.1.3 主要试剂 伊红美蓝琼脂、SS琼脂、LB琼脂、LB肉汤等,北京索莱宝科技有限公司产品;DNA标准DL 2 000、DNA标准DL 1 000、DNA标准DL 700,宝日医生物技术(北京)有限公司产品;2×TaqMaster Mix,西安擎科生物股份有限公司产品;PCR扩增引物由西安擎科生物股份有限公司合成。细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司产品;O抗原标准血清,购自中国兽医药品监察所。
1.1.4 主要仪器 电热恒温培养箱(DNP-9272),宁波普朗特仪器有限公司产品;超净工作台(SW-CJ-2FD),苏州安泰空气技术有限公司产品;离心机、移液枪、PCR仪,Ependorf公司产品;电子天平(GL822i-1SCN),北京赛多利斯仪器系统有限公司产品;全功能凝胶成像仪(FluorChem R),Protein Simple公司产品;水平电泳槽(WIX-liteDNA)、多功能电泳仪电源(WIX-EP600T),北京韦克斯科技有限公司产品。
1.2 方法
1.2.1 菌株的分离鉴定 将采集的肛门拭子和胃肠道内容物样本,无菌接种于LB肉汤培养基中,置于37 ℃恒温培养箱中培养16~18 h后;划线接种于伊红美蓝琼脂平板以及SS平板,37 ℃培养16~18 h[3-4];挑取紫黑色带有金属光泽区域的表面光滑、大小适中的疑似菌落进行革兰氏染色镜检,并传代纯化培养。
1.2.2 菌株的16S rDNA鉴定 设计并合成大肠埃希氏菌16S rDNA通用引物,上游引物F:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物R:5′- GGTTACCTTGTTACGACTT-3′,引物由西安擎科生物股份有限公司合成,提取分离纯化后的菌株DNA作为模板[4-6]。PCR反应体系:(50 μL体系)上、下游引物各1 μL,菌株DNA模板2 μL,2×TaqMaster Mix 25 μL,ddH2O 21 μL;PCR扩增条件:95 ℃预变性5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min 30 s,共35个循环;最后72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳进行检测,并送北京擎科生物股份有限公司进行测序,测序结果与NCBI的GenBank已知序列进行比对分析,确定菌种信息。
1.2.3 菌株的毒力基因检测 根据参考文献[7-8]和 NCBI数据库基因序列设计毒力基因扩增引物序列见表1;PCR反应体系(25 μL体系):上、下游引物各0.5 μL,菌株DNA模板1 μL,2×TaqMaster Mix 12.5 μL,ddH2O 10.5 μL;PCR扩增条件:95 ℃预变性5 min;94 ℃变性50 s,退火30 s,72 ℃ 1 min,共32个循环;72 ℃延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳进行检测。

表1 毒力基因引物信息
1.2.4 菌株的致病性试验 为进一步验证分离菌株的致病力,对分离的疑似大肠埃希氏菌菌株进行小鼠腹腔攻毒试验。将分离菌株接种于LB液体培养基中,37 ℃摇菌18 h,用PBS洗涤后调整浓度为2.5×109、5×108、2.5×108CFU/mL,每株菌分别注射小鼠2只,每只小鼠腹腔注射0.2 mL;对照组小鼠腹腔注射等量生理盐水,接种后各组隔离词养,每隔8 h观察一次,连续观察5 d,记录小鼠的死亡情况[9-11]。
1.2.5 菌株的血清型鉴定 对初步鉴定为致病性大肠埃希氏菌的菌株,采用玻片凝集试验进行血清型鉴定[12-13]。
1.2.6 系统进化分群 采用已提取的大肠埃希氏菌菌株基因组,采用三重PCR,对chuA、yjaA和TspE4.C2[14-16]这3种基因(表2)同时进行PCR检测,利用电泳图谱确定大肠埃希氏菌的系统发育群分型;引物由西安擎科生物股份有限公司合成。PCR反应体系(25 μL体系):3对上、下游引物各1 μL,菌株DNA模板3 μL,2×TaqMaster Mix 12.5 μL,ddH2O 3.5 μL;PCR扩增条件:94 ℃预变性5 min;94 ℃ 30 s、退火30 s,72 ℃ 30 s,共30个循环;最后72 ℃延伸7 min。PCR产物用1.5%琼脂糖凝胶电泳进行检测。系统发育群分型依据见表3。
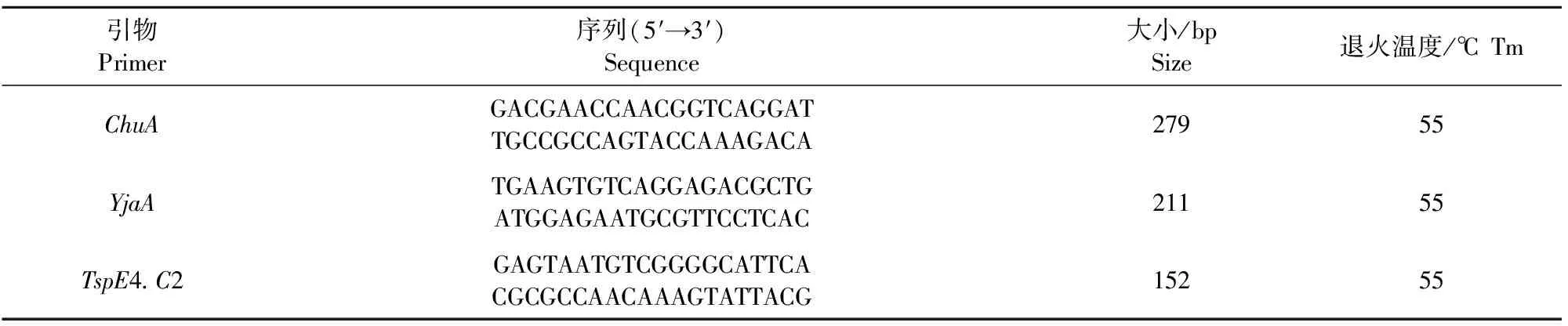
表2 系统发育群分类引物信息

表3 系统发育群分型
2 结果
2.1 菌株分离培养及染色镜检
经细菌分离培养,得到疑似大肠埃希氏菌79株,菌株在伊红美蓝培养基上呈圆形、紫黑色的、带有绿色金属光泽的不透明边界清晰的菌落;在SS培养基上呈圆形、粉色,不透明边界清晰的菌落;革兰氏染色镜检,可见两端钝圆的长杆状,长度在2~4 μm之间。
2.2 16S rDNA PCR鉴定
经PCR扩增以及凝胶电泳,得到约1 450 bp的目的条带(图1),与预期结果相符;分离菌株的测序结果呈单一峰值,表明测序结果可靠;经Blast比对,79株分离菌株与大肠埃希氏菌同源性在99%以上,确定其为大肠埃希氏菌。

M.DNA标准DL 2 000; E1~E7.大肠埃希氏菌分离菌株; N.阴性对照
2.3 毒力基因检测
对79株分离菌株进行毒力基因检测,凝胶电泳鉴定结果见图2,其中79株菌株均检测出毒力基因,毒力基因检出率为100%。检测出的毒力基因分别是F17、ompA、fimC、espA、HPI、VT1、SLT2和LEE,检出率分别为62.03%、100%、100%、5.06%、17.72%、2.53%、1.27%和1.27%,其中多株含有3种及以上毒力基因。

M.DNA标准DL 2 000; E1~E21.大肠埃希氏菌分离菌株M.DNA Marker DL 2 000; E1-E21.Escherichia coli isolates
2.4 小鼠致病性试验
试验组小鼠精神沉郁,行动迟缓不喜动,呼吸急促,被毛凌乱无光泽、食欲减退;对照组小鼠生命体征正常。79株菌株2.5×109CFU/mL剂量组小鼠均在72 h内死亡;部分菌株接种2.5×108CFU/mL也可致死小鼠,对死亡小鼠进行剖检可见小肠部分肠段内含大量积液,肠壁变薄;肺部可见点状出血点,其他脏器无明显病变。
2.5 O抗原血清型鉴定
血清凝集试验结果显示,79株致病性大肠埃希氏菌分离株中,共鉴定出17种血清型,分别为 O4、O20、O25、O26、O27、O55、O64、O78、O107、O117、O126、O127、O144、O148、O152、O153和O154(表4),其中O25、O55和O107为优势血清型,分别占定型血清的20.3%、11.4%和15.2%。

表4 血清型检出
2.6 系统进化分群结果
大肠埃希氏菌chuA、YjaA、TspE4.C2基因的PCR扩增结果见图3,79株牦牛源大肠埃希氏菌中,检测出A、B1和B2共3种进化分群,优势菌群为B1,其次是A,未有D群检出,各个分群的地区分布比例见表5。

M.DNA标准DL 600; E1-E24.大肠埃希氏菌分离菌株M.DNA Marker DL 600; E1-E24.Escherichia coli isolates
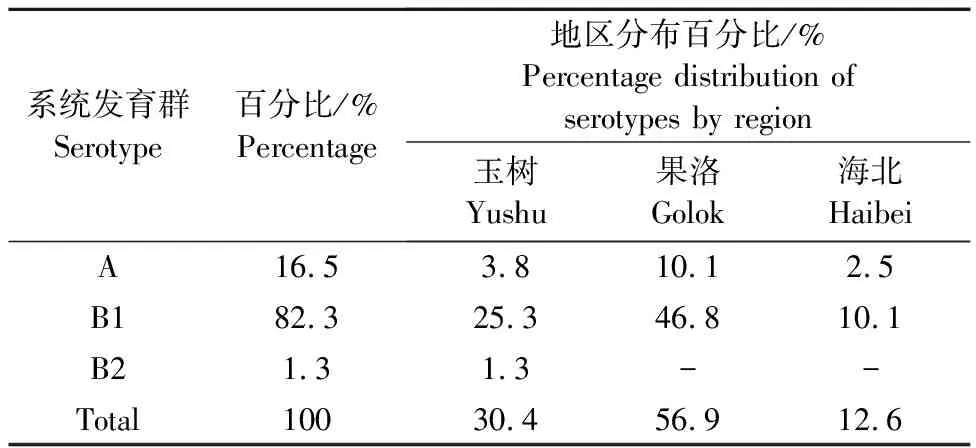
表5 不同地区系统发育群分型分布
3 讨论
大肠埃希氏菌是自然界中通用的微生物,也是人类和动物正常肠道微生物群的重要组成部分[17],这种无害的共生生物可以通过含有编码毒力因子的基因的综合移动遗传元件的混合物[18],通过基因突变成为能够引起广泛肠道和肠外疾病的人兽共患病病原体,相关研究证明非致病性大肠埃希氏菌可以通过突变其必需的脂多糖转运蛋白获得毒力,从而导致宿主患病[19]。同时,大肠埃希氏菌作为条件性致病菌,受犊牛免疫力、圈舍卫生情况及环境等因素的影响,会导致犊牛腹泻的发生,犊牛腹泻临床症状表现为急性腹泻、脱水、虚脱等[20]。导致腹泻发生的主要因素是大肠埃希氏菌携带的毒力因子,毒力因子是特定的分子,主要是由细菌、真菌、原生动物和病毒产生和释放的蛋白质,大肠埃希氏菌的毒力因子种类繁多,其中肠毒素、志贺类菌素、菌毛黏附素和毒力岛等是最常见的毒力因子[21]。本研究中检测出的毒力基因主要是fimC(100%)、ompA(100%)、F17(62.03%)及部分HPI(17.72%)大肠埃希氏菌常见的黏附素K88、K99、F41、987P毒力因子均不携带,与宋康[22]的研究结果黏附素K99、F41阳性率为92.5%存在差异;与姚望远等[23]关于青海腹泻牦牛大肠埃希氏菌分离株的生物学特性研究比较而言存在较大差异,该研究表明青海地区大肠埃希氏菌的优势毒力基因sfa占比96.9%,大部分大肠埃希氏菌的进化群属A型(79.5%),所检测的大肠埃希氏菌菌株中优势血清型为O91和O145,分别占15.4%和14.4%,与本研究关联性不强。79株大肠埃希氏菌菌株检测出16种血清型, O25、O55和O107为优势血清型;同时陈明勇等[24]的研究表明西藏地区牦牛致病性大肠埃希氏菌O血清型检测的优势血清型是 O142、O148、O158和O26;达娃次仁等[25]研究表明,西藏地区导致牦牛腹泻大肠埃希氏菌的优势血清型为 O78、O26、O115、O158 和 O14; 高睿等[26]的研究证明陕西省引起犊牛腹泻的主要致病菌为大肠埃希氏菌,其优势血清型为O2、O86和O101。以上研究与青海地区大肠埃希氏菌O血清型优势血清与其他地区所报告的并不相符。79株大肠埃希氏菌的系统进化分群为A、B1、B2这3个组群,未检测出D群,其中优势群为B1群,其次为A群。江婉琳等人的研究表明新疆克拉玛依地区奶牛源致病性大肠埃希氏菌的系统进化群主要是B1群,其次为A群,与本研究一致[13],然而张星星等[27]的研究表明新疆犊牛源大肠埃希氏菌系统进化群主要是A群,D群与本研究存在差异。研究表明,大肠埃希氏菌的致病力与系统进化分群有关,其中A和B1群为条件致病群,因毒力较弱直接引起宿主患病的概率较低,但在宿主免疫力降低时则会发挥致病性,与本研究的结论一致;其中B2和D与致病性紧密相关,因其可携带大量毒力因子[28-29]。引起腹泻的大肠埃希氏菌主要发生在A、B1和D群,引起肠外感染的主要分布于B2群。研究表明,B1群菌株从家养动物中分离的频率较高,人类宿主中分离的大肠埃希氏菌主要为B2和A群,这些研究表明大肠埃希氏菌系统发育结构与大肠埃希氏菌定植的自然宿主类型之间存在关联[30]。综上所述,说明对于引起犊牛腹泻的大肠埃希氏菌的血清型、系统进化分群,以及携带的毒力因子等,不同区域之间存在差异,虽具有相似性但致病机理还是存在差异。腹泻病的防治需考虑地域因素,且需要对不同地区的致病性大肠埃希氏菌的致病机理、血清型、耐药性、毒力基因等进行研究分析,才能确保后续对该病的防治和治疗方案是切实有效的。本研究证实,青海省牦牛源大肠埃希氏菌临床菌株具有多种O血清型,普遍携带多种毒力基因,且大多数菌株属B1条件致病群,通过本研究了解了青海犊牛源大肠埃希氏菌的遗传特征、毒力之间的相关性,对犊牛大肠埃希氏菌性疾病的防控具有重要意义。

