氯化钴模拟低氧条件下红景天苷对小鼠成骨细胞的调节作用
罗婷 祁琳 李杰 薛文舒 田晨晨 曹清文 王越


基金項目:1.天津伊特生命科学研发有限公司项目(编号:HX2023-7);2.天津市自然科学基金重点项目(编号:18JCZDJC33200);3. 天津中医药大学研究生创新基金(编号:ZXYCXLX202119、ZXYCXLX202213)
作者简介:罗婷(1989.5-),女,湖南湘潭人,硕士,主治医师,主要从事口腔种植外科研究
通讯作者:王越(1968.8-),女,天津人,博士,教授,博士生导师,主要从事中西医结合抗骨丢失分子机制的研究
摘要:目的 研究氯化钴(CoCl2)模拟的低氧条件下红景天苷(SAL)对小鼠成骨细胞的调节作用。方法 用CoCl2模拟低氧条件(1%O2),建立体外低氧模型。采用MTS法研究低氧条件下不同浓度SAL对MC3T3-E1细胞增殖的影响,磷酸苯二钠法研究低氧条件下SAL对MC3T3-E1细胞分化的影响,实时荧光定量PCR(RT-qPCR)、Western blot及ELISA技术检测低氧诱导因子-1α(HIF-1α)、下游靶基因血管内皮生长因子(VEGF)mRNA及蛋白表达水平。结果 确定用0.5 mmol/L的CoCl2来模拟低氧(1%O2)环境。低氧可明显抑制MC3T3-E1细胞的增殖及分化。经SAL预处理后,可显著促进MC3T3-E1细胞的增殖及分化,其中SAL(10 nmol/L)可显著上调HIF-1α和VEGF的mRNA表达水平及HIF-1α的蛋白表达水平,并下调VEGF蛋白的表达。结论 低氧条件下SAL促进小鼠成骨细胞增殖与分化。其具体机制有待进一步研究,可能与HIF-1α/VEGF信号通路有关。关键词:红景天苷;成骨细胞;增殖;分化;骨结合;HIF-1α/VEGF通路
中图分类号:R285.5 文献标识码:A DOI:10.3969/j.issn.1006-1959.2024.09.019
文章编号:1006-1959(2024)09-0101-06
Regulatory Effect of Salidroside on Mouse Osteoblasts Under Hypoxic Conditions Simulated
by Cobalt Chloride
LUO Ting1,QI Lin2,LI Jie1,XUE Wen-shu3,TIAN Chen-chen3,CAO Qing-wen3,WANG Yue3
(1.Department of Stomatology,General Hospital of Tianjin Medical University,Tianjin 300052,China;
2.Department of Pharmacy,Characteristic Medical Center of PAP,Tianjin 300162,China;
3.School of Integrative Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin 301617,China)
Abstract:Objective To study the regulatory effect of salidroside (SAL) on mouse osteoblasts under hypoxic conditions simulated by cobalt chloride (CoCl2).Methods CoCl2 was used to simulate hypoxic conditions (1%O2) to establish an in vitro hypoxic model. MTS method was used to study the effect of different concentrations of SAL on the proliferation of MC3T3-E1 cells under hypoxic conditions. The effect of SAL on the differentiation of MC3T3-E1 cells under hypoxic conditions was studied by disodium phenyl phosphate method. Real-time fluorescence quantitative PCR (RT-qPCR), Western blot and ELISA were used to detect the mRNA and protein expression levels of hypoxia-inducible factor-1α (HIF-1α) and downs.Results 0.5 mmol/L CoCl2 was used to simulate the hypoxic (1%O2) environment. Hypoxia could significantly inhibit the proliferation and differentiation of MC3T3-E1 cells. After pretreatment with SAL, the proliferation and differentiation of MC3T3-E1 cells were significantly promoted. SAL (10 nmol/L) significantly up-regulated the mRNA expression levels of HIF-1α and VEGF and the protein expression level of HIF-1α, and down-regulated the expression of VEGF protein.Conclusion SAL promotes the proliferation and differentiation of mouse osteoblasts under hypoxia. The specific mechanism needs to be further studied, which may be related to the HIF-1α/VEGF signaling pathway.
Key words:Salidroside;Osteoblasts;Proliferation;Differentiation;Osseointegration;HIF-1α/VEGF pathway
口腔种植术后容易导致手术区域血供不足、微循环受阻,从而出现术区的低氧环境。术区牙周组织的低氧,致使周围骨稳态失衡,导致骨量的损失,最终引起种植体的松动或脱落。如何促进种植区新骨形成和避免种植区牙槽骨的吸收萎缩,对于种植体继发性初期稳定性具有重要的临床意义。红景天苷(salidroside, SAL)是藏药红景天主要活性成分,具有抗缺氧、促血管新生、抗骨质疏松、抗细胞凋亡、抗癌、抗炎、抗衰老、抗疲劳、抗缺氧、抗纤维化、抗病毒、等多种药理作用[1,2]。低氧条件下骨组织通过血流再分配、增加无氧代谢等代偿反应来适应低氧微环境[3]。低氧诱导因子-1α(hypoxia-inducible factor-1 alpha, HIF-1α)对组织的缺氧比较敏感,可在特异性缺氧状态下迅速发挥活性。HIF-1α是细胞缺氧的重要指标之一,在血管新生、骨改建、炎症反应等多种生理和病理过程中均有表达,通过活化下游靶基因血管内皮生长因子(vascular endothelial growth factor, VEGF)来调节骨改建。VEGF是促进骨组织周围血管新生的主要细胞因子。本课题组前期研究发现[4,5],常氧条件下SAL促进成骨细胞的增殖、分化以及HIF-1α依赖的VEGF的表达。王洁等[6]的研究发现,低氧通过激活HIF-1α/VEGF通路,促进牙周组织成骨能力。持续的缺氧通过调控c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和核因子κB抑制蛋白α磷酸化抑制破骨细胞分化和骨吸收[7]。而低氧环境下SAL是否通过激活HIF-1α信号通路调节成骨细胞增殖与分化功能从而调节骨重建的研究少见报道。本研究以小鼠成骨细胞MC3T3-E1为细胞模型,进一步研究CoCl2模拟的低氧条件下SAL对其影响,旨在为促进种植骨结合的药物治疗提供理论依据。
1材料与方法
1.1主要试剂 SAL:中国药品生物制品鉴定所(纯度99.9%)。CoCl2:美国Sigma公司(纯度>92.5%)。胎牛血清(fetal bovine serum, FBS)及DMEM高糖培養基:美国GIBCO公司。乙二胺四乙酸二钠(ethylenediamine tetraacetic acid, EDTA)及羟乙基哌嗪乙磺酸(hydroxyethyl piperazine ethanesulfonic, HEPES):美国Sigma公司。青链霉素混合液:南京凯基生物科技公司。胰蛋白酶及二甲基亚砜(Dimathyl sulfoxide, DMSO):北京索莱宝科技有限公司。MTS细胞增殖与毒性检测试剂盒:上海贝博(BestBio)公司。碱性磷酸酶(AKP)测试盒:南京建成生物工程研究所;引物:南京金思特科技公司。Trizol Reagent:美国Invitrogen公司。cDNA合成试剂盒及RT-qPCR扩增试剂:上海Yeasen生物技术公司。HIF-1α及VEGF引物:北京鼎国昌盛生物技术有限责任公司。BCA蛋白定量试剂盒、HiFi Script cDNA Synthesis Kit:康为世纪生物科技有限公司。HIF-1α抗体(ab2185,1∶1000):Abcam公司。VEGF试剂盒:天津伊特生命科学研发有限公司。
1.2主要仪器 SW-CJ-1F医用型洁净工作台:苏州安泰空气技术公司。Forma 3111 CO2培养箱:美国forma公司。实时荧光定量PCR仪及酶标仪:美国Bio-Rad公司。
1.3细胞系和细胞培养 小鼠成骨细胞MC3T3-E1购自武汉大学中国典型培养物保藏中心。使用加入含有双抗(100 IU/L青霉素及100 μg/ml链霉素)的10% FBS DMEM高糖培养基培养。其置于CO2孵箱(37 ℃,5%CO2)中培养,隔天换液。
1.4低氧模型及CoCl2模拟低氧模型的建立
1.4.1低氧模型的建立 取对数生长期的小鼠成骨细胞MC3T3-E1消化后接种到培养皿中,待细胞饱和度达到80%左右,更换1% FBS DMEM高糖培养基使细胞同步化24 h。然后将细胞放入低氧罐中密封培养,同时通入40 min的混合气体(1%O2),最后放入孵育箱培养24 h。
1.4.2 CoCl2模拟低氧模型的建立 取对数期细胞接种。在细胞同步化24 h后加入不同浓度CoCl2(0.2、0.3、0.4、0.5、0.6、0.8、1.0、1.2 mmol/L),随后放入CO2孵箱培养24 h。用MTS法检测细胞增殖活性,Western blot法检测关键蛋白HIF-1α的表达变化,按说明书比例配制含PMSF的RIPA裂解液,冰上裂解后按BCA蛋白定量试剂盒说明书测定样品浓度。随后进行SDS-PAGE电泳、转膜,封闭孵育后显影,用Image J分析条带,使用GraphPad Prism 9作图。
1.5 MTS法检测MC3T3-E1细胞增殖活性 取对数生长期的MC3T3-E1接种于96孔培养板上。24 h后,更换1% FBS DMEM高糖培养基。设对照组、CoCl2组(0.5 mmol/L)及SAL干预组(0.1、1、10、100、1000、10 000 nmol/L)。每组均设5个复孔。药物作用24 h后,CoCl2组和SAL干预组加入CoCl2,作用24 h。结束前4 h,避光加入MTS,置于CO2孵箱中培养4 h。4 h后,应用酶联免疫检测仪,测量各孔波长492 nm的吸光度(A492)。
1.6 ALP法检测MC3T3-E1细胞分化活性 细胞处理同前,每组均设2个复孔。SAL干预组分别加入相应浓度的SAL,分别作用2、6、9、12 d。培养结束前24 h加入CoCl2。0.01 mol/L PBS缓冲液漂洗细胞3次,吸干。其次加入0.1% Triton X-100,用移液器充分吹打,作用3 min,收集入1.5 ml Ependorf管中。然后低温下用细胞超声破碎仪破碎细胞,1500 rpm离心10 min。最后取上清液作为细胞内ALP活性测定的标本。按照说明书使用碱性磷酸酶试剂盒进行ALP活性测定。
1.7 RT-PCR法检测HIF-1α及VEGFmRNA表达水平 取对数生长期的MC3T3-E1细胞调整浓度后接种在6孔培养板中。实验共分对照组、CoCl2组和SAL干预组(终浓度10、100、1000、10 000 nmol/L)。用Trizol试剂提取细胞总RNA,按照cDNA合成试剂盒说明书将RNA逆转成cDNA备用,最后使用RT-qPCR扩增试剂在实时荧光定量PCR仪中将cDNA扩增,记录结果。目的基因数据用内参基因β-actin矫正后,用Graphpad prism 9软件作图。
1.8 Western blot法检测HIF-1α蛋白表达水平 用Western blot法检测加入SALHIF-1α蛋白表达水平。处理同上,引物见表1。
1.9 ELISA技术检测VEGF蛋白表达水平 收集对照组、CoCl2组和SAL干预组(终浓度10、100 nmol/L)细胞上清液。按照ELISA试剂盒说明书绘制标准曲线,依次加入样品,每个样品设置3个复孔,酶标仪检测OD值,检测上清液中VEGF表达量。
1.10统计学方法 实验数据均采用SPSS 21.0以及GraphPad Prism 9进行统计学分析及图表处理。组间比较采用单因素方差分析,P<0.05代表差异有统计学意义,P<0.01表示统计学意义显著。
2结果
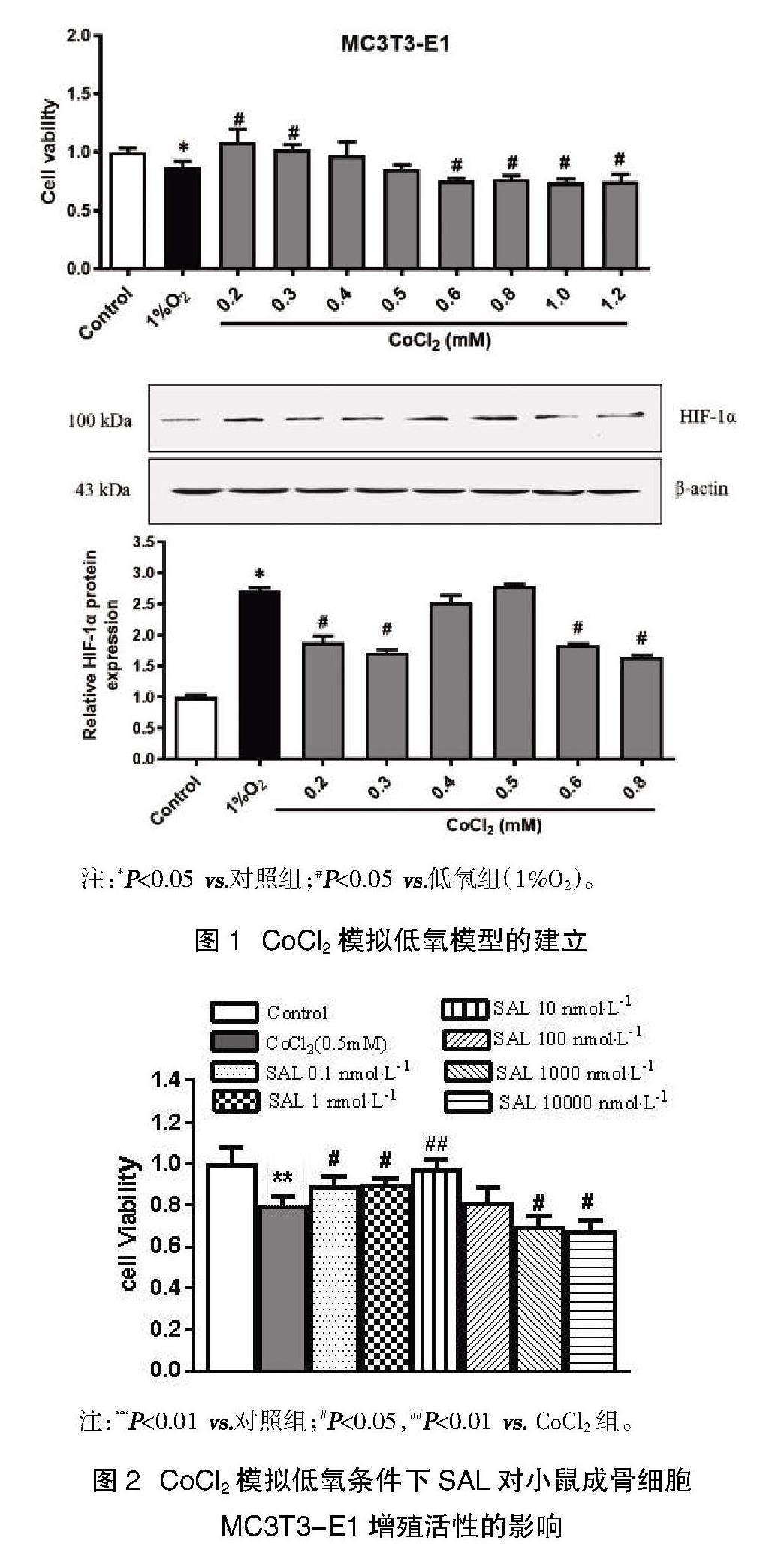
2.1 CoCl2模拟低氧模型的建立 与对照组相比,低氧(1%O2)抑制小鼠成骨细胞MC3T3-E1的增殖。选择不同浓度CoCl2(0.2、0.3、0.4、0.5、0.6、0.8、1.0、1.2 mmol/L)模拟低氧条件,结果显示,0.5 mmol/L CoCl2与低氧组(1%O2)对MC3T3-E1细胞增殖及HIF-1α蛋白表达的影响相近,见图1,故选择作为模拟低氧的浓度。
2.2 CoCl2模拟低氧条件下SAL对小鼠成骨细胞MC3T3-E1增殖活性的影响 与以上结果一致,低氧可抑制MC3T3-E1细胞的增殖(P<0.05)。SAL(0.1、1、10 nmol/L)可以促进MC3T3-E1增殖(P<0.05)。其中以10 nmol/L促增殖作用最为显著(P<0.01)。而高浓度的SAL(1000、10 000 nmol/L)则抑制MC3T3-E1细胞的增殖活性(P<0.05),见图2。
2.3 CoCl2模拟的低氧条件下SAL对小鼠成骨细胞MC3T3-E1分化的影响 ALP是成骨细胞早期分化的特异性标志酶之一。检测细胞上清液中的ALP活性可间接反映成骨细胞的分化程度。本研究进一步检测了SAL对小鼠成骨细胞MC3T3-E1分化的影响。结果显示,CoCl2模拟的低氧可抑制小鼠成骨MC3T3-E1细胞分化(P<0.01)。与CoCl2组相比,低氧条件下SAL作用2 d后,MC3T3-E1细胞ALP活性增加,延长作用时间至6、9、12 d后,SAL对ALP活性的影响更加显著,见图3、图4。提示低氧条件下SAL对MC3T3-E1细胞ALP的升高作用可能具有时间依赖性,但还需进一步验证。
2.4 CoCl2模拟的低氧条件下SAL对小鼠成骨MC3T3-E1细胞HIF-1α/VEGF信号通路的影响 诱导低氧基因和修复细胞内微环境是HIF-1α主要功能之一。本研究进一步研究了CoCl2模拟的低氧条件下SAL对小鼠成骨细胞MC3T3-E1 HIF-1α及其下游效应分子VEGF的基因表达影响。CoCl2组HIF-1α mRNA和VEGF mRNA表达水平较其对照组显著上调(P<0.01),SAL干预组HIF-1α mRNA和VEGF mRNA表达水平较低氧组上调,其中SAL(10 nmol/L)作用明显(P<0.05),见图5,提示CoCl2模拟的低氧条件下SAL能够激活HIF-1α/VEGF信号通路。
2.5 CoCl2模拟的低氧条件下SAL对HIF-1α/VEGF信号通路相关蛋白表达影响 为进一步验证CoCl2模拟的低氧下SAL对成骨细胞HIF-1α通路关键蛋白表达的影响,采用Western blot法检测SAL预处理后HIF-1α蛋白表达的变化。与CoCl2组相比,SAL干预组HIF-1α蛋白表达水平上调,且当SAL浓度为10 nmol/L最为明显(P<0.05)。使用ELISA法测定加入浓度为10~100 nmol/L SAL的上清液中VEGF的表达,见图6。结果显示:CoCl2模拟的低氧条件下VEGF蛋白表达增加,加入SAL后对其蛋白表达有一定抑制作用。
3讨论
骨结合即种植体表面与周围骨组织的直接结合,两者界面之间无纤维组织长入。骨结合是种植手术成功的基础。基于目前研究显示[8,9],促进种植体骨结合的基础研究方法主要包括调节骨代谢、种植体表面改性、干细胞相关疗法和调节骨免疫微环境等。种植体周围的成骨细胞与破骨细胞的骨稳态直接影响骨结合。种植术后常见的微血管供应不足会导致组织缺氧,从而影响骨重建。基于SAL抗缺氧、促血管新生及抗骨质疏松等多种药理作用[1,2],本实验利用CoCl2来模拟细胞体外的低氧环境。运用MTS比色法检测低氧条件下SAL对成骨细胞增殖的影响,此方法具有重复性好、灵敏度高和操作简便等特点,可反映存活细胞的数量。实验结果证明,CoCl2模拟的低氧抑制小鼠成骨细胞的增殖,SAL预处理后促进小鼠成骨细胞的增殖。
成骨细胞的分化为矿化提供骨基质,促进骨重建过程中新骨的形成。ALP是反映成骨细胞的活化及骨形成的特异性标志酶。成骨细胞活性增加,则ALP的合成和分泌增加。ALP是一种外分泌性糖蛋白,可作为成骨细胞早期分化的標志酶。检测细胞上清液中的ALP活性,即可间接反映出成骨细胞分化成熟程度[10,11]。本实验结果显示低氧条件下成骨细胞分化受到抑制,这与高文魁等[12]的研究结果一致。刘紫杉等[13]的研究发现,125 μmol/L CoCl2作用MC3T3-E1 48 h后,促进成骨细胞分化,提示CoCl2浓度及作用时间对成骨细胞的分化影响可能不一致。CoCl2模拟的低氧条件下加入SAL则能促进成骨细胞分化。
细胞能依靠氧感受器和信号转导通路特异地调节相应基因或蛋白的表达来适应低氧环境[14]。机体在对外界低氧的应答过程中HIF-1α发挥了核心作用。HIF-1α对于机体组织的急性缺氧的恢复的十分关键的。HIF-1α通过上调与血管生成相关蛋白的基因表达,如VEGF及其受体,增加血流量,降低组织损伤[15]。HIF-1α/VEGF在调节骨代谢过程中发挥重要作用[16]。目前普遍认为HIF-1α是上调VEGF的主要调节因子[17]。VEGF是一种多功能糖蛋白,分布于血管附近的细胞,促进血管内皮细胞的生长,从而达到促进血管生成的作用[18]。在骨形成早期阶段,VEGF被分泌释放到细胞外并激活血管的生成,为骨重建区提供血供和氧气[19]。VEGF可通过激活VEGFR-2的表达促进血管生成;同时还可以通过激活VCAM-1的表达促进细胞的黏附与增殖[20]。本实验中CoCl2模拟的低氧条件下SAL可显著上调小鼠成骨MC3T3-E1细胞HIF-1α、VEGF mRNA和HIF-1α蛋白的表达量,而VEGF蛋白表达量降低。所以HIF-1α蛋白质翻译修饰后与其它相关蛋白间如何相互作用,影响VEGF mRNA翻译的相关因素,以及低氧条件下信号转录的精确过程还需进一步研究。提示低氧条件下SAL促进成骨细胞的增殖与分化的具体机制尚待进一步研究。
综上所述,0.5 mmol/L CoCl2模拟的低氧条件下,SAL促进小鼠成骨细胞MC3T3-E1的增殖与分化。其具体的调控机制有待进一步研究以利于SAL用于调整种植术后骨重建。
参考文献:
[1]Song D,Zhao M,Feng L,et al.Salidroside attenuates acute lung injury via inhibition of inflammatory cytokine production[J].Biomed Pharmacother,2021,142:111949.
[2]Sun S,Tuo Q,Li D,et al.Antioxidant effects of salidroside in the cardiovascular system[J].Evid Based Complement Alternat Med,2020,2020:9568647.
[3]Baker CE,Moorelotridge SN,Hysong AA,et al.Bone Fracture Acute Phase Response-A Unifying Theory of Fracture Repair:Clinical and Scientific Implications[J].Clinical Reviews in Bone and Mineral Metabolism,2018,16(4):142-158.
[4]梅國华,郭小芹,陈京京,等.红景天苷对成骨细胞的作用及相关分子机制研究[J].口腔医学研究,2017,33(9):916-919.
[5]金昱彤,祁琳,牛芯蕊,等.红景天苷激活HIF-1α信号通路促进成骨细胞增殖的机制[J].中国药理学通报,2022,38(2):190-195.
[6]王洁,朱锐,李永明.低氧对大鼠牙周组织成骨及成血管能力影响的初步研究[J].实用口腔医学杂志,2023,39(3):307-312.
[7]Ma Z,Yu R,Zhao J,et al.Constant hypoxia inhibits osteoclast differentiation and bone resorption by regulating phosphorylation of JNK and IκBα[J].Inflamm Res,2019,68(2):157-166.
[8]Merheb J,Temmerman A,Rasmusson L,et al.Influence of skeletal and local bone density on dental implant stability in patients with osteoporosis[J].Clin Implant Dent Relat Res,2016,18(2):253-260.
[9]Albrektsson T,Jemt T,M?觟lne J,et al.On inflammation-immunological balance theory-A critical apprehension of disease concepts around implants: Mucositis and marginal bone loss may represent normal conditions and not necessarily a state of disease[J].Clin Implant Dent Relat Res,2019,21(1):183-189.
[10]Zhang J,Cai L,Tang LC,et al.Highly dispersed lithium doped mesoporous silica nanospheres regulating adhesion,proliferation,morphology,ALP activity and osteogenesis related gene expressions of BMSCs[J].Colloids Surf B Biointerfaces,2018,170:563-571.
[11]娄鸣,李晓红,饶国洲.BMP-2,BGP mRNA表达量及ALP活性的变化对大鼠骨髓间充质干细胞体外诱导成骨细胞的影响[J].现代检验医学杂志,2008,23(5):28-31.
[12]高文魁,王德元,李智钢,等.低氧条件下成骨细胞的增殖与分化[J].中国组织工程研究与临床康复,2011,15(46):8591-8594.
[13]刘紫杉,王一鑫,李永明.低氧环境下Ephrin B2/Eph B4调控MC3T3-E1细胞成骨分化的实验研究[J].口腔疾病防治,2023,31(9):618-624.
[14]Hochachka PW,Lutz PL.Mechanism,origin,and evolution of anoxia tolerance in animals[J].Comp Biochem Physiol B Biochem Mol Biol,2001,130(4):435-459.
[15]Rattner A,Williams J,Nathans J.Roles of HIFs and VEGF in angiogenesis in the retina and brain[J].The Journal of Clinical Investigation,2019,129(9):3807-3820.
[16]Xu J,Sun Y,Wu T,et al.Enhancement of bone regeneration with the accordion technique via HIF-1α/VEGF activation in a rat distraction osteogenesis model[J].J Tissue Eng Regen Med,2018,12(2):e1268-e1276.
[17]Belaidi E,Beguin PC,Levy P,et al.Delayed myocardial preconditioning induced by cobalt chloride in the rat: HIF-1α and iNOS involvement[J].Fundam Clin Pharmacol,2012,26(4):454-462.
[18]Zhao S,Gao J,Li J,et al.PD-L1 Regulates Inflammation in LPS-Induced Lung Epithelial Cells and Vascular Endothelial Cells by Interacting with the HIF-1α Signaling Pathway[J].Inflammation,2021,44(5):1969-1981.
[19]Gerber HP,Vu TH,Ryan AM,et al.VEGF couples hypertrophic cartilage remodeling, ossification and angiogenesis during endochondral bone formation[J].Nat Med,1999,5(6):623-628.
[20]周熳琳,董仕慧,張伊阳,等.VEGF及其相关低氧因子在不同发育阶段牦牛肾脏中的表达分布研究[J].核农学报,2023,37(8):1542-1550.
收稿日期:2023-07-28;修回日期:2023-08-22
编辑/肖婷婷

