基于生物信息学的hsa-miR-155-5p通过PTEN调控中央记忆T细胞/辅助T细胞对肝细胞癌免疫微环境的影响研究
张珍珍 刘一妍 舒悦 刘滋煜 王钰 王佳露 颜学兵

作者簡介:张珍珍(1992.11-),女,安徽阜南人,硕士,住院医师,主要从事消化疾病的研究
通讯作者:颜学兵(1967.11-),男,江苏徐州人,博士,主任医师,主要从事消化及感染性疾病的研究
摘要:目的 运用生物信息学方法预测人类miR-155-5p靶基因,进一步探索其在肝细胞癌(HCC)中的功能。方法 通过starBase数据库筛选出hsa-miR-155-5p靶基因,DAVID和Reactome数据库进行功能富集分析。蛋白-蛋白相互作用网络分析靶基因之间的相互关系,cytohubba插件获得关键基因。Kaplan-Meier生存分析进一步筛选关键基因,ssGSEA 算法分析HCC免疫浸润情况,Spearman相关系数分析关键基因与免疫浸润的相关性。结果 共筛选出1493个hsa-miR-155-5p靶基因;靶基因GO富集分析集中于调控转录、蛋白质分解代谢过程、细胞周期的调节;KEGG生物通路主要富集于AMPK信号通路、PI3K-Akt信号通路和FoxO信号通路、以及子宫内膜癌、胰腺癌和肝细胞癌等疾病通路。利用蛋白互作网络共获得30个关键基因,与HCC信号通路基因取交集获得GSK3B、PTEN、PIK3R1、EGFR、CCND1、SMAD2、PIK3CA、RPS6KB1、KRAS、SOS1 等10个关键基因。生存分析显示,PTEN高表达的HCC患者的预后优于低表达患者。PTEN表达量与中央记忆T细胞、辅助T细胞的免疫浸润均呈现较强的正相关性。结论 hsa-miR-155-5p通过下游靶基因PTEN调控中央记忆T细胞、辅助T细胞,进而影响HCC免疫浸润微环境,或可为HCC发生机制和临床治疗的探索提供帮助。
关键词:肝细胞癌;hsa-miR-155-5p;生物信息学;PTEN;中央记忆T细胞;辅助T细胞
中图分类号:R735.7 文献标识码:B DOI:10.3969/j.issn.1006-1959.2024.09.002
文章编号:1006-1959(2024)09-0007-09
Effect of hsa-miR-155-5p on the Immune Microenvironment of Hepatocellular Carcinoma
by Regulating Central Memory T Cells Helper T Cells Through PTEN
Based on the Bioinformatics Method
ZHANG Zhen-zhen1,LIU Yi-yan1,SHU Yue2,LIU Zi-yu1,WANG Yu1,WANG Jia-lu1,YAN Xue-bing1
(1.Department of Infection and Hepatology,East Hospital Affiliated Hospital of Xuzhou Medical University,
Xuzhou 221000,Jiangsu,China;
2.Department of Neurosurgery,the Third Affiliated Hospital of Kunming Medical University,Kunming 650500,Yunnan,China)
Abstract:Objective To predict the target genes of human miR-155-5p by bioinformatics methods, and to further explore its function in hepatocellular carcinoma (HCC).Methods The target genes of hsa-miR-155-5p were screened by starBase database, and functional enrichment analysis was performed by DAVID and Reactome databases. Protein-protein interaction network was used to analyze the relationship between target genes, and cytohubba plug-in was used to obtain key genes. Kaplan-Meier survival analysis was used to further screen key genes, ssGSEA algorithm was used to analyze the immune infiltration of HCC, and Spearman correlation coefficient was used to analyze the correlation between key genes and immune infiltration.Results A total of 1493 hsa-miR-155-5p target genes were screened. GO enrichment analysis of target genes focused on the regulation of transcription, protein catabolic process and cell cycle regulation. The KEGG biological pathway was mainly enriched in AMPK signaling pathway, PI3K-Akt signaling pathway and FoxO signaling pathway, as well as endometrial cancer, pancreatic cancer and hepatocellular carcinoma. A total of 30 key genes were obtained by protein interaction network, and 10 key genes such as GSK3B, PTEN, PIK3R1, EGFR, CCND1, SMAD2, PIK3CA, RPS6KB1, KRAS and SOS1 were obtained by intersection with Hepatocellular carcinoma signaling pathway genes. Survival analysis showed that the prognosis of HCC patients with high expression of PTEN was better than that of patients with low expression. The expression of PTEN was positively correlated with the immune infiltration of central memory T cells and helper T cells.Conclusion hsa-miR-155-5p regulates central memory T cells and helper T cells through the downstream target gene PTEN, thereby affecting the immune infiltration microenvironment of HCC, which may provide help for the exploration of HCC pathogenesis and clinical treatment.
Key words:Hepatocellular carcinoma;hsa-miR-155-5p;Bioinformatics;PTEN;Central memory T cells;Helper T cells
原发性肝癌(primary liver cancer, PLC)是世界范围内常见的恶性肿瘤之一,发病率在恶性肿瘤中排名第6,肿瘤致死病因排第3位[1],我国原发性肝癌的发病率严重威胁我国人民的生命和健康。原发性肝癌主要包括肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)和混合型肝细胞癌-胆管癌(combined hepatocellular-cholangiocarcinoma, cHCC-CCA)3种不同病理学类型[2],三者在发病机制、生物学行为、病理组织学、治疗方法以及预后等方面差异较大。本文中的“肝癌”仅指HCC。核微小RNA(microRNA, miRNA)是一种长度为19~25个核苷酸的短链、内源性、非编码RNA,与mRNA的3端的非翻译区(untranslated region, UTR)结合后,通过促进mRNA降解或抑制翻译降低靶基因蛋白表达并调控受体细胞的表型及功能[3]。此前很多研究表明[4-6],miRNA不仅参与人体的正常生命活动,还参与多种生物学功能,也与HCC患者的临床病理特征相关,如细胞分化、增殖、凋亡、血管生成以及细胞周期等。有研究发现hsa-miR-155在肝细胞癌组织中存在过表达,且高水平的hsa-miR-155为HCC患者预后差的独立危险因素[7];另有研究发现[8],与癌旁组织相比,hsa-miR-155-5p在人HCC组织中表达水平显著升高,且在Ⅲ期和Ⅳ期的HCC组织中的表达水平明显高于Ⅰ期和Ⅱ期HCC组织。据报道[9],作为长链非编码RNA(lncRNA),JPX通过hsa-miR-155-5p抑制XIST表达,从而抑制HCC进展;值得注意的是,hsa-miR-155-5p可促进HCC生长。因此,研究hsa-miR-155-5p在HCC中的作用机制有很大的价值,并为肝细胞癌的个性化治疗进一步提升准确性。本文通过生物信息学方法预测与HCC相关hsa-miR-155-5p的靶基因,并探讨靶基因在肿瘤免疫微环境中的调控作用,以期为后续研究HCC发生发展及免疫治疗提供新思路。
1资料与方法
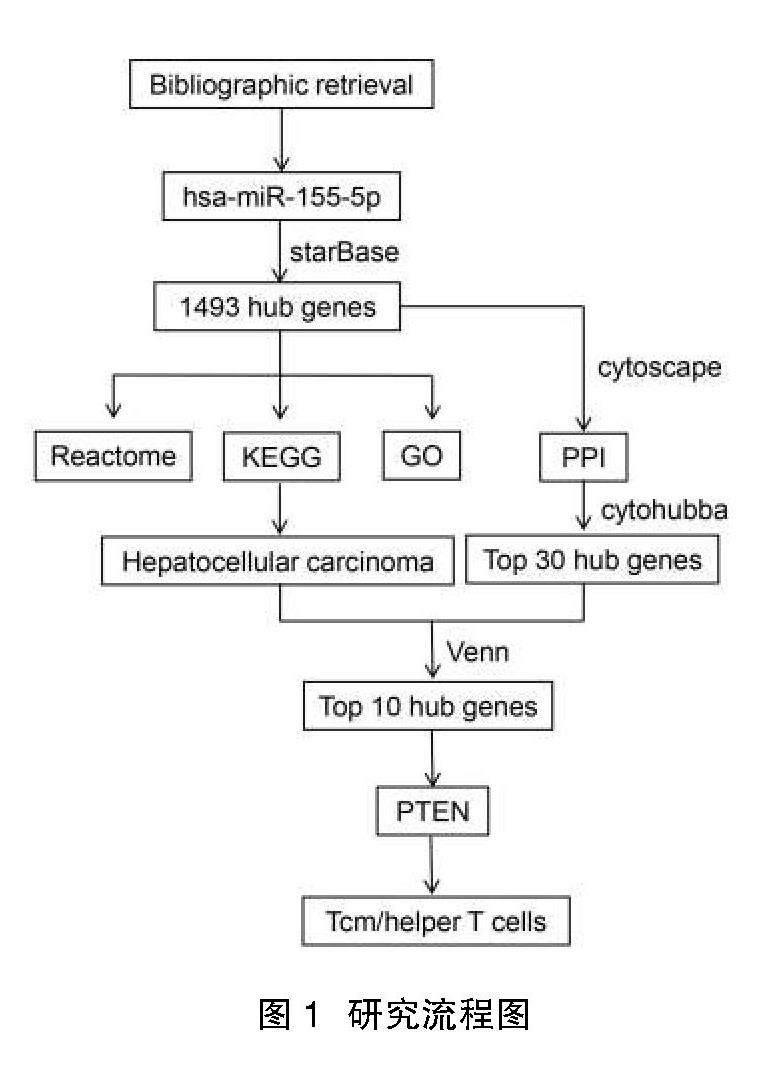
1.1 hsa-miR-155-5p的靶基因预测 使用PubMed数据库(https://pubmed.ncbi.nlm.nih.gov/pubmed)查询hsa-miR-155-5p相关文献,通过检索发现该miRNA参与人类多种疾病及肿瘤的发生发展。选择starBase数据库(https://starbase.sysu.edu.cn/)对hsa-miR-155-5p的靶基因mRNA进行预测。筛选条件为:Program≥2、CLIP_Data≥0、Low stringency。去重后,获得hsa-miR-155-5p靶基因集。
1.2功能富集分析 通过DAVID(https://david.ncifcrf.gov/)对预测的靶基因集进行基因本体(gene ontology, GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genome, KEGG)功能富集分析。GO分析包括细胞组分(cellular component, CC)、分子功能(molecular function, MF)和生物学过程(biological process, BP)3个部分。同时利用Reactome(https://reactome.org/)数据庫对靶基因进行通路分析。以P<0.05为差异有统计学意义。
1.3蛋白互作分析 利用STRING(version 11.5;https://cn.string-db.org/)数据库将靶基因组导入后完成蛋白-蛋白互相作用(protein-protein interaction, PPI)网络分析[10],将结果以tsv的格式输出。并导入cytoscape(version v3.9.1)绘制PPI网络图进行可视化分析,以连接度(degree)作为参数标准。利用cytohubba插件对PPI网络进行连接度分析,并初步筛选出排名前30位的关键基因。圆形节点表示靶基因,其中红色节点表示前30关键基因;线代表两个节点(靶基因)之间的相互作用。
1.4筛选HCC相关的关键基因 为筛选出与HCC相关的关键基因,将cytohubba插件获得的关键基因与经KEGG通路分析获得的参与肝细胞癌的发生的基因集取交集,并绘制Venn图,进一步筛选出关键基因。
1.5生存分析 利用癌症基因组图谱(TCGA)数据库中表达谱和临床信息,分析关键基因的生存预后,最终筛选出表达与生存预后相符合的下游关键基因。P<0.05被认为差异有统计学意义。
1.6免疫浸润分析 为了计算关键基因表达与免疫细胞浸润程度的相关性,采用R语言[11]通过Spearman相关和ssGSEA算法分析HCC样本中免疫细胞的成份,计算免疫细胞的免疫浸润程度与关键基因表达水平的关系。
2结果
2.1 hsa-miR-155-5p在不同疾病中的表达情况 通过PubMed对hsa-miR-155-5p进行检索发现,hsa-miR-155-5p在乳腺癌[12]、肝细胞癌[8]、慢性粒系白血病及慢性髓系白血病[13]等疾病中表达上调,在胃癌[14]、口腔扁平苔藓[15]等疾病中表达下调,另外还参与了骨质疏松[16]、感染性休克[17]、糖尿病肾病[18]、类风湿关节炎[19]等过程。据文献报道,miR-155-5p参与肝细胞癌的发生发展[20]。因此miR-155-5p可能为研究HCC发生机制和个性化治疗提供依据。研究流程图见图1。
2.2 hsa-miR-155-5p的靶基因预测 为了探索hsa-miR-155-5p潜在的下游靶点,通过starBase数据库进行分析和预测靶基因。该数据库的7种算法中至少2种算法同时预测基因与hsa-miR-155-5p靶向结合,去除重复基因后,共得到RNF160、STXBP5、EGFR、GSK3B、PTEN、PIK3R1、DPY19L1等1493个靶基因。
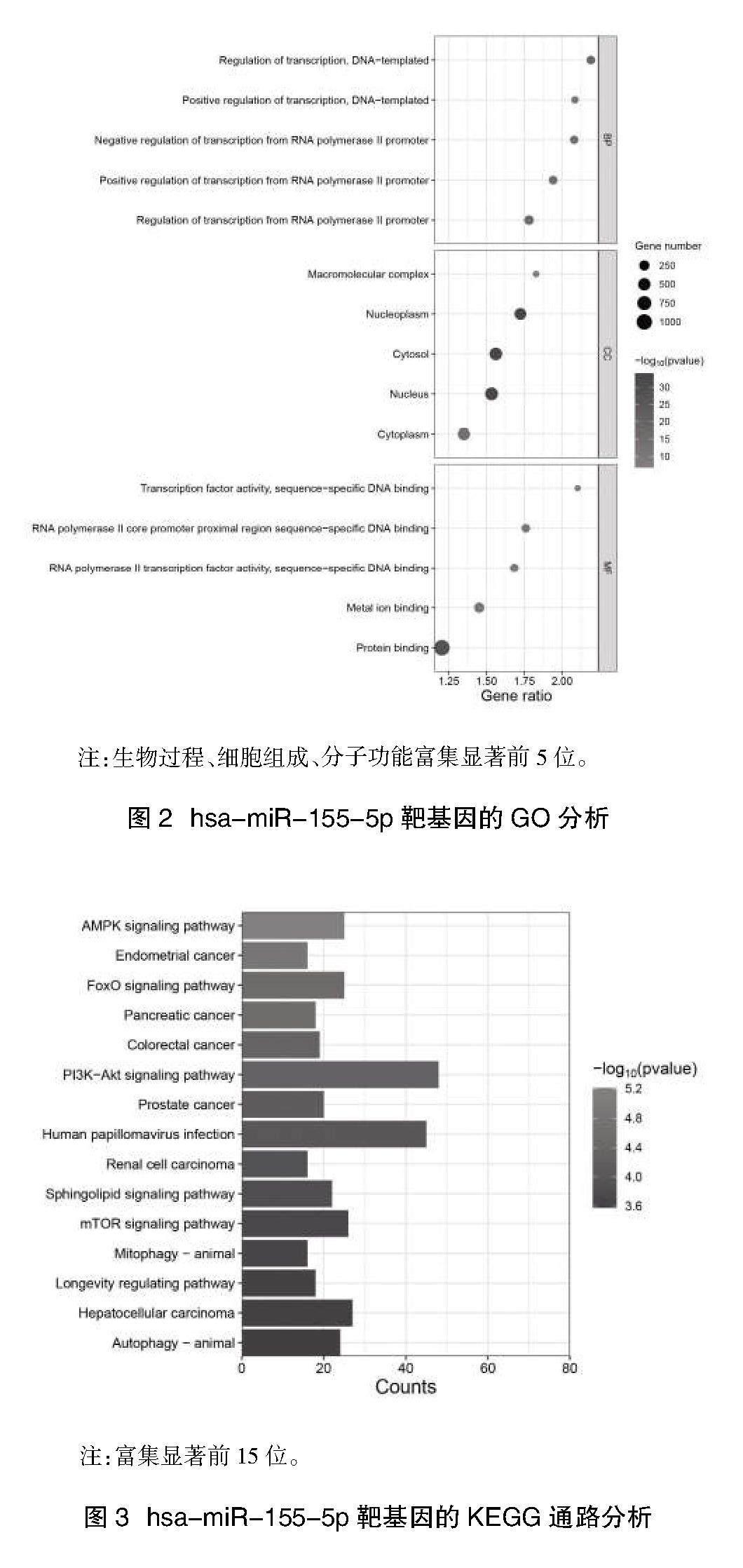
2.3 hsa-miR-155-5p靶基因的GO、KEGG和Reactome富集分析 利用DAVID数据库对预测的靶基因集进行GO、KEGG及Reactome富集分析。GO功能富集分析显示,在生物学过程的方面,hsa-miR-155-5p靶基因主要富集在调控转录、蛋白质分解代谢过程的调节;分子功能主要富集于蛋白结合、DNA结合等(P<0.05)(图2)。KEGG信号通路富集分析结果显示,hsa-miR-155-5p靶基因主要富集于肝细胞癌疾病通路(P<0.05)(图3)。Reactome通路分析表明,hsa-miR-155-5p靶基因主要富集在通用转录途径、RNA聚合酶Ⅱ转录过程等通路(表1)。
2.4蛋白相互作用网络 利用STRING数据库,获得PPI网络,将结果以tsv格式导入cytoscape软件,分析蛋白-蛋白互作网络图。以PPI评分>0.9为阈值条件,利用Cytohubba插件筛选出连接度排名前30位的关键基因(图4),作为hsa-miR-155-5p下游有价值的靶点。
2.5 HCC相关关键基因的获取 从KEGG信号通路可知Hepatocellular carcinoma信号通路包含27个靶基因,利用cytohubba插件获得的前30位关键基因与KEGG富集通路中Hepatocellular carcinoma信号通路的基因做交集,得到10个共同关键基因:GSK3B、PTEN、PIK3R1、EGFR、CCND1、SMAD2、PIK3CA、RPS6KB1、KRAS、SOS1(圖5)。因此,可推断hsa-miR-155-5p参与肝细胞癌的发生发展过程与该10个关键基因有密切关系。
2.6 hsa-miR-155-5p下游关键基因PTEN的表达 miRNA通过抑制下游靶基因的表达,从而发挥调控功能,因此miRNA与靶基因表达水平作用相反。文献报道hsa-miR-155-5p在HCC中高表达,因此下游靶基因低表达,是一个改善预后的基因。从TCGA数据库下载临床信息和基因表达情况,应用Kaplan-Meier分析对hsa-miR-155-5p下游关键基因GSK3B、PTEN、PIK3R1、EGFR、CCND1、SMAD2、PIK3CA、RPS6KB1、KRAS、SOS1等高、低表达组疾病特异性生存期。进行差异分析发现,高表达CCND1、PIK3R1、PTEN等的疾病特异性生存期优于低表达组(P<0.05)(图6)。其中已经有实验性研究报道CCND1[21]、PIK3R1[22]在HCC患者中表达上调;PTEN是一种主要的肿瘤抑制基因,在多种肿瘤中有其缺失、突变、基因沉默或表达下调的报道[23],肝癌中PTEN表达水平低于癌旁组织[24],因此进一步推断PTEN表达水平与HCC患者预后相关。
2.7 PTEN表达量与HCC中免疫细胞的相关性 免疫微环境被发现在肿瘤的发生发展过程中有重要的作用。为探索PTEN在肿瘤微环境中的功能,通过ssGSEA 算法和Spearman相关性分析PTEN的表达与肝细胞癌微环境的免疫细胞浸润之间的关系(图7A),结果显示PTEN 表达水平分别与中央记忆T细胞(r=0.263)(图7B)、辅助T细胞(r=0.229)(图7C)均呈正相关性。这说明PTEN可能参与免疫微环境中中央记忆T细胞和辅助T细胞的调控。
3讨论
HCC是世界范围内主要的原发性肝癌,恶性程度高。作为一种高度侵袭性疾病,患者术后5年的生存率仅为30%~40%[25]。因其起病隐匿,往往确诊时已达到晚期,致其疗效和预后均不佳[26]。其中,HCC患者预后不良的主要原因之一是高复发率[27],所以肝癌病死率仍一直居高不下。因此研究该病的分子机制对其进行早期干预和治疗的选择有重要意义。
miRNA是基因表达的多功能转录后调节因子,能够与靶 mRNA 3端非翻译区互补,进而降解或阻止该 mRNA 翻译出蛋白质,实现转录后水平的基因表达调控[28]。miRNA在调控基因表达方面起着非常重要的作用,通过负向调控mRNA的表达而发挥生物学功能[3]。目前很多文献报道miRNA参与肝细胞癌的发生发展过程[29]。其中miRNA-155是多功能miRNA分子,由B细胞整合簇加工产生,在多种生理病理过程中发挥重要作用;其参与调控造血细胞和免疫细胞的发育分化[30,31],尤其是在肿瘤发生过程中[32]。miRNA-155是与机体炎症反应、免疫平衡相关的促癌基因,可作为HCC患者预后的独立预测因子[7]。有实验研究[33]采用real-time PCR比较20只HCC大鼠、28例HCC患者组织及其匹配的癌旁组织和HCC细胞系中miR-155-5p的表达水平,结果显示在HCC中miR-155-5p的表达远高于癌旁组织。据报道[34],作为lncRNA一员的 LINC01189,其过表达抑制HCC的增殖和对5-Fu的耐药;过表达miR-155-5p可逆转LINC01189对HCC的抑制作用。这些研究均显示miR-155-5p可能在肿瘤的发生发展过程及预后中发挥着至关重要的作用。其中在实体肿瘤中,免疫细胞浸润是肿瘤微环境相关致癌机制中的关键因素[35]。因此通过生物信息学技术,预测 hsa-miR-155-5p 靶基因,进而调控HCC免疫微环境,对指导后续深入的研究具有重要理论意义。
本研究選用starBase数据库,通过不同计算方法筛选hsa-miR-155-5p的靶基因。利用富集分析发现筛选的靶基因不仅在RNA聚合酶Ⅱ启动子的调节、基因转录等生物过程中发挥作用,且参与AMPK信号通路、PI3K-Akt信号通路、FoxO信号通路。研究报道[36],组蛋白去乙酰化酶11(HDAC11)介导多种免疫功能和代谢,HDAC11的缺失从而激活AMPK信号通路并抑制糖酵解通路,进而抑制HCC发生发展。据报道[8],miR-155-5p通过靶基因激活PI3K/Akt通路促进HCC的体内肿瘤发生。
将预测的靶基因集导入STRING在线数据库后获得PPI网络。通过Cytoscape软件中cytohubba插件获得GSK3B、FOXO3、YES1、YWHAZ、KRAS等30个关键基因。其中部分关键基因已被证实与肝细胞癌相关。利用cytohubba插件获得的前30个关键基因与KEGG富集通路中与HCC发生相关的靶基因取交集获得GSK3B、PTEN、PIK3R1、EGFR、CCND1、SMAD2、PIK3CA、RPS6KB1、KRAS、SOS1。同时,推测hsa-miR-155-5p在肝细胞癌中的作用可能与这10个靶基因的调控密切相关,其中高表达CCND1、PIK3R1、PTEN的患者总体生存率优于低表达组。但已有实验性研究报道CCND1[21]、PIK3R1[22]在HCC患者中表达上调。PTEN是一种主要的肿瘤抑制基因,在调节肿瘤细胞进展中起重要作用。自PTEN被发现后,多项研究揭示其作为肿瘤抑制因子的功能[37,38]。此外也可抑制PI3K/Akt/mTOR轴,减少肿瘤生长、转移和耐药。据相关临床和小鼠研究报道[39],PTEN的部分缺失可导致肿瘤进展,PTEN在癌症中减少细胞进展的功能是基于其对PI3K/Akt/mTOR信号的调节作用。
由于肝动脉和门静脉的血液中含有多种内源性抗原和自身抗原,肝脏微环境通常倾向于免疫耐受状态[40],由于HCC的病因通常与肝硬化和乙型或丙型肝炎有关,因此HCC是在慢性炎症的背景下发生发展的[41-43]。肿瘤免疫治疗是目前发展最快的肿瘤治疗方法之一,但是实体肿瘤的免疫治疗方法依然存在困难,其关键在于实体肿瘤缺乏有效的T细胞浸润。T细胞全称为T淋巴细胞,来源于骨髓中的淋巴样祖细胞,在胸腺中分化、发育、成熟[44]。T细胞是具有高度异质性的细胞群,可以根据功能或活化阶段分为不同的亚群。其中中央记忆T细胞作为T细胞亚群之一,存在于淋巴结、淋巴组织和脾脏。有自我更新、分化和长久存活能力的功能,具有超级的抗肿瘤能力[45]。有研究发现[46],在肝脏肿瘤组织中聚集一群中央记忆T细胞,利用多色免疫荧光染色发现这群细胞主要富集于HCC患者早期三级淋巴结构。有文献报道[47],Th1/Th2失衡可能与多种肿瘤的患者不良预后相关,且过高水平的Th2细胞是肝癌转移复发的危险性因素[48]。本研究通过TCGA数据库,利用ssGSEA 算法分析以及Spearman相关系数进一步分析PTEN表达量与HCC中多种免疫细胞的占比情况,其中包括中中央记忆T细胞、细胞毒T细胞、B cells、树突状细胞、辅助T细胞、NK cells、嗜酸性粒细胞、CD8+T淋巴细胞、Th2 cells、Th17 cells等。结果提示PTEN的表达水平与中央记忆T细胞、辅助T细胞、NK cells、嗜酸性粒细胞等免疫细胞呈正相关,特别是中央记忆T细胞和辅助T细胞。但与B cells、细胞毒T细胞、树突状细胞等免疫细胞呈负相关。这提示PTEN可能调控HCC微环境中的中央记忆T细胞和辅助T细胞的功能。T细胞是特异性抗肿瘤免疫的关键之一[49],其复制潜能和分化状态也是抗肿瘤活性的重要调节[50],许多免疫治疗技术着重改变T淋巴细胞的活性发挥抗肿瘤作用[50,51]。因此,通过hsa-miR-155-5p可以调控HCC中PTEN的表达水平进而影响免疫细胞浸润水平,进一步影响HCC微环境中T细胞的活性,发挥抗肿瘤的作用。
综上所述,hsa-miR-155-5p通过PTEN调控中央记忆T细胞、辅助T细胞影响肝细胞癌免疫微环境。
参考文献:
[1]Sung H,Ferlay J,Siegel RL,et al.Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J].CA Cancer J Clin,2021,71(3):209-249.
[2]Gao YX,Yang TW,Yin JM,et al.Progress and prospects of biomarkers in primary liver cancer (Review)[J].Int J Oncol,2020,57(1):54-66.
[3]Hill M,Tran N.miRNA interplay:mechanisms and consequences in cancer[J].Dis Model Mech,2021,14(4):dmm047662.
[4]Shu J,Kren BT,Xia Z,et al.Genomewide microRNA down-regulation as a negative feedback mechanism in the early phases of liver regeneration[J].Hepatology,2011,54(2):609-619.
[5]Chen X,Murad M,Cui YY,et al.miRNA regulation of liver growth after 50% partial hepatectomy and small size grafts in rats[J].Transplantation,2011,91(3):293-299.
[6]Yan-Nan B,Zhao-Yan Y,Li-Xi L,et al.MicroRNA-21 accelerates hepatocyte proliferation in vitro via PI3K/Akt signaling by targeting PTEN[J].Biochem Biophys Res Commun,2014,443(3):802-807.
[7]Ning S,Liu H,Gao B,et al.miR-155, miR-96 and miR-99a as potential diagnostic and prognostic tools for the clinical management of hepatocellular carcinoma[J].Oncol Lett,2019,18(3):3381-3387.
[8]Fu X,Wen H,Jing L,et al.MicroRNA-155-5p promotes hepatocellular carcinoma progression by suppressing PTEN through the PI3K/Akt pathway[J].Cancer Sci,2017,108(4):620-631.
[9]Lin XQ,Huang ZM,Chen X,et al.XIST Induced by JPX Suppresses Hepatocellular Carcinoma by Sponging miR-155-5p[J].Yonsei Med J,2018,59(7):816-826.
[10]Szklarczyk D,Gable AL,Nastou KC,et al.The STRING database in 2021: customizable protein-protein networks, and functional characterization of user-uploaded gene/measurement sets[J].Nucleic Acids Res,2021,49(D1):D605-D612.
[11]Li B,Severson E,Pignon JC,et al.Comprehensive analyses of tumor immunity: implications for cancer immunotherapy[J].Genome Biol,2016,17(1):174.
[12]Pasculli B,Barbano R,Fontana A,et al.Hsa-miR-155-5p Up-Regulation in Breast Cancer and Its Relevance for Treatment With Poly[ADP-Ribose] Polymerase 1 (PARP-1) Inhibitors[J].Front Oncol,2020,10:1415.
[13]Soltani I,Bahia W,Farrah A,et al.Potential functions of hsa-miR-155-5p and core genes in chronic myeloid leukemia and emerging role in human cancer:A joint bioinformatics analysis[J].Genomics,2021,113(4):1647-1658.
[14]Li S,Zhang T,Zhou X,et al.The tumor suppressor role of miR-155-5p in gastric cancer[J].Oncol Lett,2018,16(2):2709-2714.
[15]Cheng J,Zhang Y,Yang J,et al.MiR-155-5p modulates inflammatory phenotype of activated oral lichen-planus-associated-fibroblasts by targeting SOCS1[J].Mol Biol Rep,2022,49(8):7783-7792.
[16]Wu YZ,Huang HT,Cheng TL,et al.Application of microRNA in Human Osteoporosis and Fragility Fracture: A Systemic Review of Literatures[J].Int J Mol Sci,2021,22(10):5232.
[17]Petejova N,Martinek A,Zadrazil J,et al.Acute Kidney Injury in Septic Patients Treated by Selected Nephrotoxic Antibiotic Agents-Pathophysiology and Biomarkers-A Review[J].Int J Mol Sci,2020,21(19):7115.
[18]Bai X,Luo Q,Tan K,et al.Diagnostic value of VDBP and miR-155-5p in diabetic nephropathy and the correlation with urinary microalbumin[J].Exp Ther Med,2020,20(5):86.
[19]Wang J,Zhao Q.LncRNA LINC-PINT increases SOCS1 expression by sponging miR-155-5p to inhibit the activation of ERK signaling pathway in rheumatoid arthritis synovial fibroblasts induced by TNF-α[J].Int Immunopharmacol,2020,84:106497.
[20]Wang J,Che J.CircTP63 promotes hepatocellular carcinoma progression by sponging miR-155-5p and upregulating ZBTB18[J].Cancer Cell Int,2021,21(1):156.
[21]Wu SY,Lan SH,Liu HS.Degradative autophagy selectively regulates CCND1 (cyclin D1) and MIR224, two oncogenic factors involved in hepatocellular carcinoma tumorigenesis[J].Autophagy,2019,15(4):729-730.
[22]Ai X,Xiang L,Huang Z,et al.Overexpression of PIK3R1 promotes hepatocellular carcinoma progression[J].Biol Res,2018,51(1):52.
[23]Li J,Yen C,Liaw D,et al.PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer[J].Science,1997,275(5308):1943-1947.
[24]Mi D,Yi J,Liu E,et al.Relationship between PTEN and VEGF expression and clinicopathological characteristics in HCC[J].J Huazhong Univ Sci Technolog Med Sci,2006,26(6):682-685.
[25]Zhu AX,Duda DG,Sahani DV,et al.HCC and angiogenesis: possible targets and future directions[J].Nat Rev Clin Oncol,2011,8(5):292-301.
[26]Wang W,Wei C.Advances in the early diagnosis of hepatocellular carcinoma[J].Genes Dis,2020,7(3):308-319.
[27]Yilma M,Saxena V,Mehta N.Models to Predict Development or Recurence of Hepatocellular Carcinoma (HCC) in Patients with Advanced Hepatic Fibrosis[J].Curr Gastroenterol Rep,2022,24(1):1-9.
[28]Bartel DP.Metazoan MicroRNAs[J].Cell,2018,173(1):20-51.
[29]Oura K,Morishita A,Masaki T.Molecular and Functional Roles of MicroRNAs in the Progression of Hepatocellular Carcinoma-A Review[J].Int J Mol Sci,2020,21(21):8362.
[30]Xu WD,Feng SY,Huang AF.Role of miR-155 in inflammatory autoimmune diseases: a comprehensive review[J].Inflamm Res,2022,71(12):1501-1517.
[31]Elton TS,Selemon H,Elton SM,et al.Regulation of the MIR155 host gene in physiological and pathological processes[J].Gene,2013,532(1):1-12.
[32]Higgs G,Slack F.The multiple roles of microRNA-155 in oncogenesis[J].J Clin Bioinforma,2013,3(1):17.
[33]Chen G,Wang D,Zhao X,et al.miR-155-5p modulates malignant behaviors of hepatocellular carcinoma by directly targeting CTHRC1 and indirectly regulating GSK-3β-involved Wnt/β-catenin signaling[J].Cancer Cell Int,2017,17:118.
[34]Yao Y,Shu F,Wang F,et al.Long noncoding RNA LINC01189 is associated with HCV-hepatocellular carcinoma and regulates cancer cell proliferation and chemoresistance through hsa-miR-155-5p[J].Ann Hepatol,2021,22:100269.
[35]Najafi M,Hashemi Goradel N,Farhood B,et al.Macrophage polarity in cancer: A review[J].J Cell Biochem,2019,120(3):2756-2765.
[36]Bi L,Ren Y,Feng M,et al.HDAC11 Regulates Glycolysis through the LKB1/AMPK Signaling Pathway to Maintain Hepatocellular Carcinoma Stemness[J].Cancer Res,2021,81(8):2015-2028.
[37]Simpson L,Parsons R.PTEN: life as a tumor suppressor[J].Exp Cell Res,2001,264(1):29-41.
[38]Worby CA,Dixon JE.PTEN[J].Annu Rev Biochem,2014,83:641-669.
[39]Alimonti A,Carracedo A,Clohessy JG,et al.Subtle variations in Pten dose determine cancer susceptibility[J].Nat Genet,2010,42(5):454-458.
[40]Doherty DG.Immunity, tolerance and autoimmunity in the liver: A comprehensive review[J].J Autoimmun,2016,66:60-75.
[41]Gnyawali B,Pusateri A,Nickerson A,et al.Epidemiologic and socioeconomic factors impacting hepatitis B virus and related hepatocellular carcinoma[J].World J Gastroenterol,2022,28(29):3793-3802.
[42]Huang DQ,Mathurin P,Cortez-Pinto H,et al.Global epidemiology of alcohol-associated cirrhosis and HCC: trends, projections and risk factors[J].Nat Rev Gastroenterol Hepatol,2023,20(1):37-49.
[43]Stella L,Santopaolo F,Gasbarrini A,et al.Viral hepatitis and hepatocellular carcinoma: From molecular pathways to the role of clinical surveillance and antiviral treatment[J].World J Gastroenterol,2022,28(21):2251-2281.
[44]Beier KC,Kallinich T,Hamelmann E.Master switches of T-cell activation and differentiation[J].Eur Respir J,2007,29(4):804-812.
[45]Klebanoff CA,Gattinoni L,Restifo NP.Sorting through subsets: which T-cell populations mediate highly effective adoptive immunotherapy?[J].J Immunother,2012,35(9):651-660.
[46]Lu Y,Yang A,Quan C,et al.A single-cell atlas of the multicellular ecosystem of primary and metastatic hepatocellular carcinoma[J].Nat Commun,2022,13(1):4594.
[47]Sakaguchi E,Kayano K,Segawa M,et al.Th1/Th2 imbalance in HCV-related liver cirrhosis[J].Nihon Rinsho,2001,59(7):1259-1263.
[48]Budhu A,Forgues M,Ye QH,et al.Prediction of venous metastases, recurrence, and prognosis in hepatocellular carcinoma based on a unique immune response signature of the liver microenvironment[J].Cancer Cell,2006,10(2):99-111.
[49]Scheper W,Kelderman S,Fanchi LF,et al.Low and variable tumor reactivity of the intratumoral TCR repertoire in human cancers[J].Nat Med,2019,25(1):89-94.
[50]Gattinoni L,Zhong XS,Palmer DC,et al.Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells[J].Nat Med,2009,15(7):808-813.
[51]Rosenberg SA.Raising the bar:the curative potential of human cancer immunotherapy[J].Sci Transl Med,2012,4(127):127ps8.
收稿日期:2023-05-30;修回日期:2023-06-26
編辑/成森

