大孔吸附树脂分离纯化甘草废渣中总黄酮的工艺研究
范博 舒泉湧 李宗霖 翟帆
摘要 [目的]开发大孔吸附树脂分离纯化甘草废渣中总黄酮的工艺。[方法]以静态吸附试验比较D101B、AB-8、DM-130这3种大孔吸附树脂對甘草废渣中总黄酮的吸附量和解吸率,筛选最优树脂。采用单因素试验筛选动态吸附过程中样液浓度、上样速度、上样体积、20%乙醇洗脱体积、洗脱剂浓度、洗脱剂体积。[结果]AB-8大孔树脂用于分离纯化甘草废渣中总黄酮效果最佳,样液浓度为2.345~3.126 mg/mL,上样速度为1.0~1.5 mL/min,上样体积为64 mL,20%乙醇洗脱体积为5 BV,80%乙醇洗脱体积为4 BV。经过该纯化工艺总黄酮浓度从15.63%提升至65.68%。[结论]该方法适用于甘草废渣中总黄酮的初步分离纯化。
关键词 大孔吸附树脂;分离纯化;甘草废渣;总黄酮;工艺
中图分类号 R284.2文献标识码 A文章编号 0517-6611(2024)08-0159-04
doi:10.3969/j.issn.0517-6611.2024.08.037
Study on the Process of Separating and Purifying Total Flavonoids from Licorice Waste Residue Using Macroporous Resin
FAN Bo1,SHU Quan-yong2,LI Zong-lin3 et al
(1.Shaanxi Pharmaceutical Holding Group Co., Ltd., Xian,Shaanxi 710075;2.Shaanxi Institute of Traditional Chinese Medicine,Xianyang,Shaanxi 712099;3. Shaanxi Pharmaceutical Holding Pharmaceutical Research Institute Co., Ltd., Xian,Shaanxi 710075)
Abstract [Objective]To develop a process for separating and purifying total flavonoids from licorice waste residue using macroporous resin.[Method]Comparing the adsorption capacity and desorption rate of D101B, AB-8 and DM-130 for total flavonoids to screen the optimal resin.Single factor experiments were used to screen the sample concentration, sample flow rate, sample volume, 20% ethanol elution volume, eluent concentration and eluent volume during the dynamic adsorption process.[Result]AB-8 macroporous resin had the best separation and purification effect for total flavonoids in licorice waste residue. The sample concentration was 2.345-3.126 mg/mL, the sample flow rate was 1.0-1.5 mL/min, and the sample volume was 64 mL,20% ethanol elution volume was 5 BV, and 80% ethanol elution volume was 4 BV. After this purification process, the total flavonoid concentration increased from 15.63% to 65.68%.[Conclusion]This method is suitable for the preliminary separation and purification of total flavonoids from licorice waste residue.
Key words Macroporous adsorption resin;Separation and purification;Licorice residue;Total flavonoids;Process
甘草为豆科植物甘草(Glycyrrhiza uralensis Fisch.)、胀果甘草(Glycyrrhiza inflata Bat.)或光果甘草(Glycyrrhiza glabra L.)的干燥根和根茎,在我国历代本草书籍中均有记载,具有补脾益气、清热解毒、祛咳止痰、缓急止痛、调和诸药的功效[1-2]。在我国,甘草是药食同源植物之一[3],除了作为中药饮片应用外,主要用来提取甘草酸及制备甘草浸膏,通过煎煮法提取后的废渣多被丢弃,造成巨大的环境污染和资源浪费[4-8]。甘草废渣中含有甘草素、甘草查耳酮A及光甘草定等黄酮类物质,这些物质具有抗氧化、抗菌、抗肿瘤、美白等生理活性,被广泛应用于保健品和化妆品中,其中光甘草定更有“美白黄金”的称号[9-12]。目前关于甘草废渣中总黄酮的分离纯化研究较少。大孔吸附树脂可用于中药材中黄酮、生物碱、萜类、皂苷等常规的分离纯化,具有适用范围广、成本低、选择性强、易于再生等优点[13-16]。该研究采用大孔吸附树脂对甘草废渣中总黄酮进行分离纯化,以期为该药材的综合利用奠定基础。
1 试验材料
1.1 药材与试剂
甘草废渣,由陕西富捷药业有限公司提供;芦丁,UV测定时含量92.4%,中国食品藥品检定研究院;乙醇、硝酸铝、亚硝酸钠、氢氧化钠、盐酸,均为分析纯,国药集团化学试剂有限公司;试验用水娃哈哈纯净水。D101B、AB-8、DM-130 大孔树脂,西安蓝晓科技新材料有限公司。
1.2 仪器
Cary 50 Conc 紫外-可见分光光度仪(Varian);AG135&PB3002-S电子天平(METTLER TOLEDO);1 000 μL & 100 μL移液枪(Eppendorf);RE-2000A 型旋转蒸发仪(上海亚荣生化仪器厂);KYC-100B台式恒温培养摇床(上海福玛实验设备有限公司);101型电热鼓风干燥箱(北京科伟永兴仪器有限公司)。
2 方法与结果
2.1 甘草黄酮粗提物的制备
甘草废渣100 g,经50 ℃鼓风干燥,粉碎后过2号筛备用。加70%乙醇1 500 mL,加热回流提取1 h,过滤,滤渣加1 000 mL的70%乙醇再提取一次,合并滤液。减压蒸馏除去溶剂,50 ℃鼓风干燥,即得甘草黄酮粗提物。
2.2 甘草总黄酮含量测定
2.2.1 对照品溶液制备。取芦丁对照品20 mg,精密称定,置50 mL容量瓶中,加无水乙醇适量,置水浴上微热使溶解,放冷,加无水乙醇定容至刻度,摇匀,备用。
2.2.2 标准曲线的绘制。
参考《中国药典》(2020版)一部槐花药材项下总黄酮含量测定方法[1],精密量取对照品溶液0.5、1.0、1.5、2.0、2.5、3.0 mL,分别置25 mL容量瓶中,各加水至3.0 mL,加5%亚硝酸钠溶液1 mL,混匀,放置6 min,加10%硝酸铝试液1 mL,混匀,放置6 min,加氢氧化钠试液10 mL,再加水至刻度,摇匀,放置15 min,以相应的试剂为空白,在500 nm波长处测定吸光度。以浓度为横坐标、吸光度为纵坐标绘制标准曲线并进行线性回归,得线性方程为y=13.317x-0.001 29(R2=0.999 1),线性范围为0.008 12~0.048 72 mg/mL。
2.2.3 总黄酮含量测定方法。
取甘草黄酮粗提物约40 mg,精密称定,置10 mL容量瓶中,加20%乙醇溶解。取1 mL置25 mL容量瓶中,按照“2.2.2”项下显色操作,记录吸光度,代入线性方程计算总黄酮含量。静态吸附及动态吸附试验得到的醇溶液取适量定容至线性范围,同法显色测定,计算总黄酮含量。
2.2.4 精密度试验。
取标准曲线溶液中第3份溶液(浓度0.022 mg/mL),在500 nm波长下测定吸光度6次,计算RSD为0.72%,表明仪器精密度良好。
2.2.5 稳定性试验。
取标准曲线溶液中第3份溶液(浓度0.022 mg/mL),分别于0、5、10、15、20、25、30 min在500 nm波长下测定吸光度,计算RSD为1.32%,表明样品显色后在30 min之内稳定。
2.2.6 重复性试验。取甘草黄酮粗提物6份,每份约40 mg,精密称定,置10 mL容量瓶中,加20%乙醇溶解。取1 mL 置25 mL容量瓶中,按照“2.2.2”项下显色操作,记录吸光度,代入线性方程计算总黄酮含量,6份样品含量RSD为2.06%,表明该方法重复性良好。
2.2.7 加样回收率。分别取甘草黄酮粗提物6份,每份约20 mg,精密称定,置10 mL容量瓶中,分别精密加入芦丁对照品溶液5 mL,摇匀溶解后,加20%乙醇溶液定容至刻度。取1 mL 置25 mL容量瓶中,按照“2.2.2”项下显色操作,记录吸光度,代入线性方程计算总黄酮含量,6份样品平均回收率为97.63%,RSD为2.32%,表明该方法准确度良好。
2.3 大孔吸附树脂预处理
取D101B、AB-8、DM-130 大孔树脂适量,投入烧杯中,加95%乙醇浸泡24 h,过滤,用95%乙醇反复清洗,直至乙醇液加水不浑浊。接着用纯化水冲洗,直到无明显的乙醇气味。然后用4%氢氧化钠溶液将树脂浸泡2~4 h,将碱液过滤,用纯化水冲洗至水接近中性。再用4%盐酸溶液将树脂浸泡2~4 h,将酸液过滤,用纯化水冲洗至水接近中性,抽干备用。
2.4 静态吸附研究
2.4.1 树脂筛选。
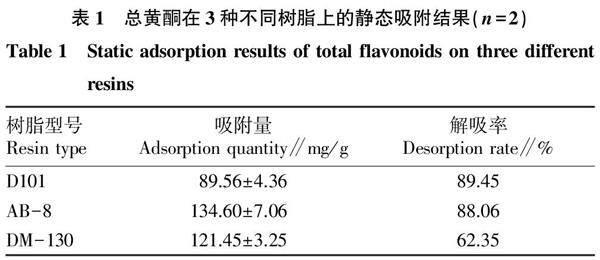
取甘草黄酮粗提物5 g,精密称定,共6份,分别置100 mL锥形瓶中,加入50 mL 20%乙醇超声溶解至无明显颗粒物。称取预处理的3种树脂各5 g,平行2份,置锥形瓶中,密塞。将锥形瓶置恒温摇床中振荡24 h(20 ℃,120 r/min),过滤,20%乙醇冲洗树脂并定容至100 mL容量瓶中,摇匀,测定总黄酮含量,计算树脂吸附量:吸附量=(C0V0-C1V1)/M,式中,C0 、C1分别为初始浓度、吸附后滤液浓度,V0、V1分别为吸附前溶液体积、吸附后溶液体积,M为树脂质量。将树脂抽干,置100 mL锥形瓶中,加入50 mL乙醇,同上操作,进行静态解吸附试验,计算解吸率:解吸率=C2V2/(C0V0-C1V1)×100%,式中,C2 、V2分别为解吸附后总黄酮浓度和溶液体积。结果见表1,由表1可见AB-8树脂对甘草黄酮的吸附量和解吸率均较高,因此选择AB-8树脂对甘草黄酮粗提物进行分离纯化。
2.4.2 静态吸附曲线绘制。
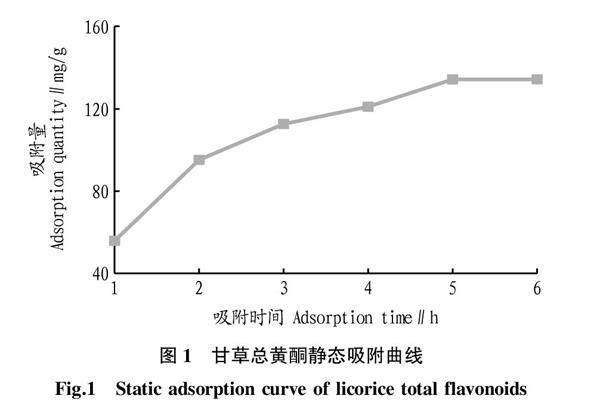
取甘草黄酮粗提物5 g,共3份,分别置100 mL锥形瓶中,加入50 mL 20%乙醇超声溶解至无明显颗粒物。取AB-8树脂加入锥形瓶中,密塞,将锥形瓶置恒温振荡器中振荡(20 ℃,120 r/min),分别于1、2、3、4、5、6 h精密量取液体1 mL测定总黄酮浓度,计算吸附量。以时间为横坐标、吸附量为纵坐标绘制静态吸附曲线,结果如图1所示。由图1可知,5 h甘草总黄酮达到吸附平衡。
2.5 动态吸附研究
2.5.1 树脂动态吸附容量研究。
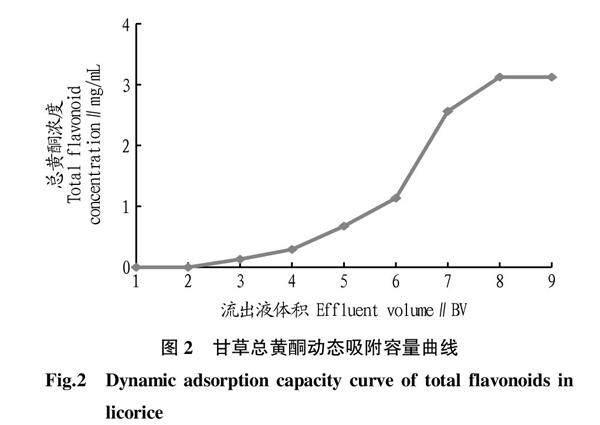
取预处理的AB-8树脂20 mL,精密称定,以20%乙醇为溶剂湿法装柱。取甘草黄酮粗提物8 g,加400 mL 20%乙醇溶解,以1.0 mL/min 流量上样,每20 mL(1个柱体积,用1 BV表示)收集一份流出液,测定总黄酮含量。以流出液体积为横坐标、总黄酮浓度为纵坐标,绘制总黄酮动态吸附容量曲线,如图2所示。20 mL树脂可处理4 BV的料液而不发生泄露(以流出液浓度为上样浓度1/10为泄露标准),此时树脂床共吸附甘草总黄酮249.23 mg,即泄露前AB-8树脂对甘草总黄酮的动态吸附容量为12.46 mg/mL。达到饱和时可处理8倍树脂体积量,吸附容量可达17.09 mg/mL。当上样浓度为3.13 mg/mL,第4份流出液浓度为0.293 mg/mL,以此确定上样体积为80 mL,实际操作取80%作为上样体积,即64 mL。
2.5.2 上样浓度对动态吸附的影响。
取预处理的AB-8树脂20 mL,精密称定,共5份,以20%乙醇为溶剂湿法装柱。分别精密称取甘草黄酮粗提物2、4、6、8、10 g,加400 mL 20%乙醇溶解,以1.0 mL/min 流量上样5 BV,用20%乙醇冲洗,合并水洗液及流出液,摇匀,测定总黄酮吸附质量。由图3可知,总黄酮吸附质量随着上样浓度增加而增加,当上样浓度为2.345 mg/mL后,动态吸附质量增加变缓。由于上样液浓度太低,树脂吸附饱和时间较长,而太高又会过早泄露或出现固体析出的问题,因此,最终确定上样浓度为2.345~3.126 mg/mL。
2.5.3 上样速度对动态吸附的影响。
取预处理的AB-8树脂20 mL,精密称定,共5份,以20%乙醇为溶剂湿法装柱。分别精密称取甘草黄酮粗提物6 g,共5份,加400 mL 20%乙醇溶解,分别以 0.5、1.0、1.5、2.0、2.5 mL/min流量上样,测定总黄酮浓度,计算泄露前总黄酮吸附质量。结果见图4。流速过小,树脂吸附达到饱和所需时间较长,过大则提早泄露,树脂吸附容量小,由此确定上样流速为1.0~1.5 mL/min。
2.5.4 20%乙醇洗脱体积考察。
取预处理的AB-8树脂20 mL,精密称定,以20%乙醇为溶剂湿法装柱。取甘草黄酮粗提物6 g,精密称定,加400 mL 20%乙醇溶解,以1.0 mL/min 流量上样64 mL。用20%乙醇以1 mL/min的流速进行洗脱,每一个柱体积(1 BV)收集一份洗脱液,测定总黄酮浓度,当浓度为上样浓度1/10时,即可终止20%乙醇洗脱。试验结果显示5 BV 20%乙醇洗脱较为合适。
2.5.5 洗脱剂浓度对解吸率的影响。
取预处理的AB-8树脂20 mL,精密称定,以20%乙醇为溶剂湿法装柱。称取甘草黄酮粗提物6 g,加400 mL 20%乙醇溶解,以1.0 mL/min流量上样64 mL。用20%乙醇以1 mL/min的流速洗脫5 BV,然后分别以50%、60%、70%、80%、95%乙醇洗脱1 BV,分别收集洗脱液,测定总黄酮浓度,计算总黄酮解吸率及累积解吸率。从图5可以看出,80%乙醇能洗脱出绝大部分甘草总黄酮,因此选择80%乙醇作为解析溶剂。
2.5.6 动态解吸曲线绘制。
取预处理的AB-8树脂20 mL,精密称定,以20%乙醇为溶剂湿法装柱。称取甘草黄酮粗提物6 g,加400 mL 20%乙醇溶解,以1.0 mL/min 流量上样64 mL。用20%乙醇以1 mL/min的流速洗脱5 BV,然后以80%乙醇洗脱,每0.5 BV收集一份洗脱液,测定总黄酮浓度,以柱体积为横坐标、甘草总黄酮浓度为纵坐标绘制动态解吸曲线,如图6所示。由图6可知,4 BV的80%乙醇可将甘草总黄酮洗脱完全。
2.6 大孔吸附树脂分离纯化甘草总黄酮工艺验证试验
取预处理的AB-8树脂20 mL,精密称定,共3份,以20%乙醇为溶剂湿法装柱。称取甘草黄酮粗提物6 g,加400 mL 20%乙醇溶解,分别以1.0 mL/min 流量上样64 mL。用20%乙醇以1 mL/min的流速洗脱5 BV,然后以80%乙醇洗脱4 BV,收集洗脱液,减压干燥,得甘草总黄酮。结果如表2所示,AB-8树脂分离纯化甘草总黄酮的纯度为65.68%,收率为89.15%,表明该纯化工艺收率高,稳定性较好。
3 结论
该研究运用大孔吸附树脂分离纯化甘草废渣中的总黄酮,确定的最佳分离纯化工艺为:20 mL AB-8型大孔吸附树脂,甘草黄酮粗提物以20%乙醇溶解,上样体积为64 mL,浓度为2.345~3.126 mg/mL,上样速度为1.0~1.5 mL/min;洗脱时采用20%乙醇洗脱5 BV去除杂质,再用4 BV 80%乙醇洗脱甘草总黄酮,最终所得总黄酮纯度为65.68%。该工艺成本低廉、简单易行,适合工业化生产,为甘草资源的综合利用提供了一条新的途径。
参考文献
[1] 国家药典委员会.中华人民共和国药典:2020年版 一部[S].北京:中国医药科技出版社,2020:88-89,370.
[2] 朱志飞,刘有志,樊启猛,等.经典名方身痛逐瘀汤小考[J].时珍国医国药,2023,34(4):958-963.
[3] 陈国宝,张家蓉.甘草制品在食品中的应用[J].食品安全导刊,2023(16):190-192.
[4] 杨琳,车庆明,孙启时.RP-HPLC法测定甘草废渣及不同产地甘草中甘草查耳酮A[J].中草药,2006,37(12):1881-1883.
[5] 王晓雅.甘草药渣发酵预处理、总黄酮提取及生物活性研究[D].石河子:石河子大学,2022.
[6] 杨琳,车庆明,毕诚,等.甘草废渣中黄酮成分的研究[J].中草药,2007,38(5):671-673.
[7] 李红,李炳奇,刘红,等.甘草渣中黄酮和多糖的提取及含量测定[J].中国食品添加剂,2006(6):193-196,107.
[8] 张腊腊,胡浩斌,王宗博,等.紫外分光光度法测定甘草渣中总黄酮含量[J].安徽农业科学,2017,45(9):123-124,131.
[9] 赵虹,蒋江涛,郑秋生.甘草查耳酮A药理作用研究进展[J].中国中药杂志,2013,38(22):3814-3818.
[10] 朱惠,邵国泉,王文建.甘草中提取光甘草定的研究进展[J].化学工程与装备,2018(9):280-281.
[11] 王世苗,张晓妍,李紫薇.甘草黄酮提取分离及药理活性研究进展[J].伊犁师范大学学报(自然科学版),2021,15(4):35-42.
[12] 崔永明.甘草黄酮的分离鉴定、药效及其指纹图谱研究[D].武汉:华中科技大学,2008.
[13] 刘丹,吴叶红,李玮桓,等.大孔吸附树脂在天然产物分离纯化中的应用[J].中草药,2016,47(15):2764-2770.
[14] 金慧鸣,郭红英,谭兴和,等.大孔吸附树脂—聚酰胺联用纯化茅岩莓总黄酮工艺优化[J].食品科学,2016,37(12):13-18.
[15] 舒祝明,蒋剑平,王建平,等.大孔树脂纯化胡柚皮总黄酮的工艺研究[J].中国现代应用药学,2017,34(5):645-653.
[16] 李岩,赵欣,李晓静,等.大孔树脂分离纯化天仙子总生物碱的研究[J].中成药,2015,37(1):89-94.
作者简介 范博(1988—),男,甘肃张掖人,工程师,从事中药及天然产物分离纯化研究。
收稿日期 2023-07-20

