巧用假想中间态模型解答平衡中比较类问题
王杏林
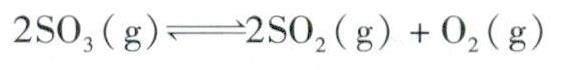

化学平衡(特别是等效平衡)是高中化学知识体系中的重难点,而假想中间态模型是解答等效平衡问题的有效方法。本文提出假想中间态模型,构建不同投料比、不同状态下的假想中间态模型,用以分析并快速解答化学平衡中的比较类问题。
一、假想中间态模型的适用情境
对于同一个可逆反应,以不同投料比或在不同状态下进行投料分别建立平衡,可通过构建假想中间态模型比较最终平衡状态各物理量(百分含量、转化率等)的大小关系。运用此模型进行分析时,需要利用假想的平衡移动过程,但并不解释条件改变后平衡的真实移动方向。
例题1 对反应:
初始投入2 mol SO3后建立平衡,平衡后SO3的转化率为α,百分含量为6;之后再向此平衡体系中投入2 mol SO3。问:①投料后平衡向什么方向移动?②再次建立平衡后SO3的转化率、百分含量较初次平衡大小关系如何比较?
分析①此問考查条件改变后平衡的真实移动方向。向平衡体系中再次加入反应物,使正逆反应速率不再相等,打破原有平衡状态使平衡发生移动,可以从速率-时间图像、浓度商和平衡常数大小关系、勒夏特列原理等方面解释说明,得出结论:平衡正向移动。
②比较两次平衡状态相关物理量(SO3的转化率、百分含量)的大小关系,可以构建假想中间态模型进行分析。
二、假想中间态模型的构建
1.恒温恒容条件下,比较倍数比投料平衡状态
恒温恒容条件下,对于气相反应:
建立倍数比投料下的“假想中间态模型”。初始投料按照反应物的化学计量数(a mol A和b molB)进行投料,建立平衡状态Ⅰ。为便于学生理解模型建构原理,以最基础的2倍投料为例构建假想中间态模型,建立平衡状态Ⅱ。
建构模型如图1所示,以初始投料建立平衡状态Ⅰ,以2倍投料建立假想过程(倍数比投料→构建假想中间态→建立假想平衡状态Ⅰ→抽隔板→加压→平衡移动),到平衡状态Ⅱ。本文选取平衡时各物质的百分含量(a% A、b% B、c% C和d% D)对倍数比投料平衡状态进行分析。任意倍数投料过程分析与之相似。
(1)模型结论:恒温恒容条件下,倍数比投料后平衡状态等效于对原平衡增大压强,根据勒夏特列原理可知,增大压强使平衡向气体系数和小的方向移动。
(2)平衡状态对比分析:
若a+b=c+d,增大压强平衡不移动,所建立平衡Ⅱ与Ⅰ为等效平衡,则a% =a1%
若a+b>c+d,增大压强平衡正向移动,所建立平衡Ⅱ与Ⅰ不是等效平衡,a% >a1%。
若a+b<c+d,增大压强平衡逆向移动,所建立平衡Ⅲ与Ⅰ不是等效平衡,a% <a1%。
假想中间态模型的建立可解决例题1中提出的倍数比投料问题,对于反应
再次建立平衡后,使SO3平衡转化率下降、百分含量增大。
2.恒温恒压条件下,比较倍数比投料平衡状态
类比上述分析过程,在恒温恒压条件下,对于气相反应:
可建立倍数比投料下的“似想中间态模型”。初始投料按照反应物的化学计量数(a mol A和b mol B)进行投料,建立平衡状态Ⅰ。倍数比投料设计为2倍投料,建立如图2所示的假想过程(倍数比投料→构建假想中间态→建立假想平衡状态Ⅰ→抽隔板),可得到平衡状态Ⅱ。
(1)模型结论:恒温恒压条件下,由于压强恒定,抽隔板后无需压缩为原体积,得到的平衡状态与原平衡等效。
(2)平衡状态对比分析:倍数比投料下所建立的平衡Ⅱ与Ⅰ为等效平衡,则a%=a1%:
例题2 恒温恒压条件下,将一定体积的SO3充入密闭容器中,发生反应:
并建立平衡。保持温度不变,再充入一定量的SO3,达到新平衡后,下列物理量与原平衡相比增大的是( )。
分析 再充入一定量的SO3,分析平衡状态各物质含量,需要用到假想中间态模型。恒温恒压条件下,倍数比投料与原平衡等效,反应物转化率不变,故B选项错误。各物质百分含量不变,则浓度比值不变,故C选项错误。倍数比投料后体系中各物质的物质的量均加倍,故A选项正确。D选项为平衡常数倒数的表达式,只与温度有关,故D选项错误。
答案:A。
三、构建假想中间态模型,巧解环境对比类问题
1.比较恒温恒容和恒温恒压条件下的平衡状态
对于气相反应:
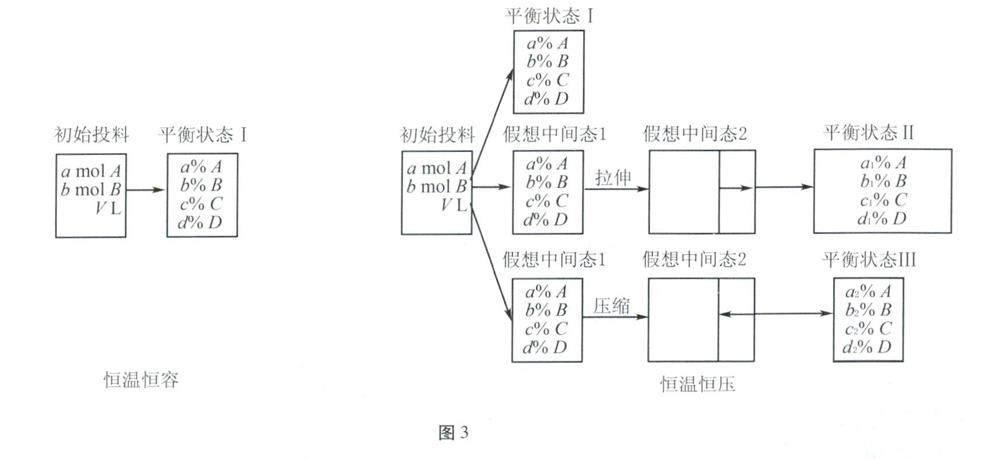
按照反应物的化学计量数(a mol A和b mol B)进行投料,建立不同状态下的“假想中间态模型”,如图3所示。
恒温恒压条件下,对于气体分子数增大(a+bc+d)的反应容器体积减小(对应平衡状态Ⅲ),基于此,对比恒温恒容下的平衡状态Ⅰ运用假想过程(构建假想中间态Ⅰ→拉伸/压缩→假想中间态2→平衡移动),从而可分别得到平衡状态Ⅱ和Ⅲ。
(1)平衡状态对比分析
若a+b=c+d,相较恒容体系,恒压体系在反应过程中体积不变,所建立平衡与恒温恒容条件下的平衡等同。
若a+b<c+d(气体系数和增大),相较恒容体系,恒压体系在反应过程中体积增大,可假想成在平衡状态Ⅰ基础上进行拉伸处理,相当于减压,减压导致平衡向着气体系数大的方向即正向移动,则a%>a1%。
若a+b>c+d(气体系数和减小),相较恒容体系,恒压体系在反应过程中体积减小,可假想成在平衡状态Ⅰ基础上进行压缩处理,相当于加压,加压导致平衡向着气体系数小的方向即正向移动,则a%>a2%。
(2)得出结论:起始投料相同时,若a+b=c+d,两次平衡为等效平衡,两体系中反应物转化率相等;若a+b≠c+d,两次平衡不是等效平衡,恒温恒压体系中反应物转化率较恒温恒容体系大。
3)特别注意:起始投料若为反向投料,此结论不适用,但可利用本文提出假想中间态模型进行分析推导,可用于实际教学中学生模型应用能力的培养与检验。
2.比较恒温恒容和绝热恒容条件下的平衡状态
对于气相反应:
按照反应物的化学计量数(a mol A和b mol B)进行投料,建立不同状态下的“假想中间态模型”。具体而言,恒温恒容条件下,建立平衡状态Ⅰ。根据图4所示,绝热恒容条件下,对于正反应放热的化学反应而言,反应过程中体系温度升高(对应平衡状态Ⅱ),对于正反应吸热的化学反应而言,反应过程中体系温度降低(对应平衡状态Ⅲ),基于此,对比恒温恒容条件下的平衡状态Ⅰ,可运用假想过程(构建假想中间态1→升温/降温→平衡移动),从而可分别得到平衡状态Ⅱ和Ⅲ。
(1)平衡状态对比分析:
若正反应放热,绝热体系在反应过程中温度升高,相当于在平衡状态→基础上进行升温处理,升温导致平衡向着吸热方向即逆向移动,a%
若正反应吸热,绝热体系在反应过程中温度降低,相当于在平衡状态→基础上进行降温处理,降温导致平衡向着放热方向即逆向移动,a%
(2)得出结论:起始投料相同时,恒温恒容体系中反应物的转化率较绝热恒容体系大。
(3)特别注意:起始投料若为反向投料,此结论不适用,但可利用本文提出的假想中间态模型进行分析推导,可用于实际教学中学生模型应用能力的培養与检验。
例题2 在甲、乙、丙3个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):
相关数据见表1,问:3个体系中平衡时AB3浓度的大小关系。
分析 本题3种状态投料方向不同,不可直接利用本文所得结论。但可依据本文所建立的方法进行分析。运用等效平衡中的“一边倒,全相等”规律可知:在环境状态相同情况下,甲、乙、丙3种投料方式所建立平衡状态等同。在此基础上再依据条件进行分析,以恒温恒容体系(甲)作为标准建立平衡状态Ⅰ,恒温恒压体系(丙)初始投料为2 mol AB3,发生反应:
在反应过程中体积增大,可假想成在平衡状态Ⅰ基础上进行拉伸及减压处理,减压导致平衡向着生成A2和B2的方向移动,使AB3浓度减小。类似的,以恒温恒容体系(甲)作为标准建立平衡状态Ⅰ,绝热恒容体系(乙)初始投料为2 mol AB3,发生反应
在反应过程中吸热使体系温度降低,可假想成在平衡状态Ⅰ基础上进行降温处理,降温导致平衡向着生成AB3的方向移动,使AB3浓度更大,三个体系均达到平衡时,AB3浓度关系为乙>甲>丙。
通过推导不难发现,反向投料后反应物转化率的大小关系与本文正向投料所得结论恰好相反。
(收稿日期:2023-12-07)

