基于思维模型构建的高三电化学复习难点突破策略
冯美红


电化学是氧化还原反应原理的重要应用之一,高三学生在复习过程中,往往容易将原电池和电解池中相似的知识点混淆,相关复习难点突破策略列举如下。
一、打通原电池与电解池原理的隔阂
学生在高一学段已经获得“氧化还原反应”这一知识模型,并将其内涵总结为“升失氧化、降得还原”;在高二学段则存化学反应与能量的相互转化章节中分开学习了原电池和电解池知识,复习过程中若不能将新旧知识进行有效整合(如图1所示),则容易引起思维的混乱。
二、从微观角度探析池中离子移动方向问题
1.电子的移动方向
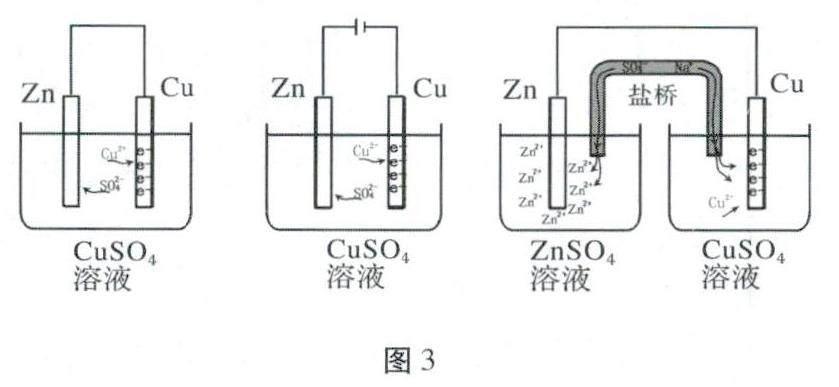
以锌铜电池为例,根据电化学的基本原理,电子从负极或阳极流出,最终进入正极或阴极,如图2所示:可以认为电子“布满”了正极或阴极(即本例中的Cu电极),Cu2-则移向电子“布满”的电极附近并得到电子变成Cu附着。因此,只要认准电子流入的电极,即可快速判断发生还原反应的电极。
对比前两个图,也可以理解形成原电池可以加快反应速率的原因:Zn电极失去电子后形成Zn2+进入溶液中,若未构建原电池形成的基本条件——闭合同路,则电子依然聚集在Zn电极上,因此Cu2+需要克服Zn2+的排斥才能“艰难”得到电子;而有不同电极和闭合回路后,电子沿着导线从负极出发,移动到正极,Cu2+更容易从正极上得到电子,宏观上体现出来的就是反应速率加快。
2.离子的移动方向
在理清电子移动的基础上,只要结合物理上带电微粒的相互作用原理——“同性相斥、异性相吸”就可以简单判断。结合化学学科知识,离子移动方向的分为以下3类情况:
思维模型Ⅰ:离子参与某电极反应——移动到该电极
中学各版本教材中的“铅蓄电池”就是典型例子,放电时正负极分别为:
负极:Pb+ SO42- - 2e =PbSO4
正极:PbO2+4H++SO42- +2e=PbSO4 +2H2O
由电极反应式可知,SO42-均参与正负反应,则应移动到这两个电极附近。
思维模型Ⅱ:离子不参与电极反应——被电子吸引或排斥
电化学中的“闭合回路”由2部分組成——电子在电极、导线上的定向移动和电解质溶液中阴阳离子的定向移动。因此,未参与电极反应的离子的定向移动有着重要的意义,甚至为了增强溶液的导电性,会加入一些“无关”离子。判断这类离子的移动的方向,关键在于看“电子在哪里?”与电子带同种电荷的阴离子会被电子排斥,远离电子;和电子带异种电荷的阳离子则被吸引而朝电子方向移动。盐桥中的离子用于维持溶液的电中性,也可以用这种方法来判断,如图3所示。
思维模型Ⅲ:含“膜”的装置中离子移动方向
为了避免副反应、限定某些离子的移动,电化学中常会涉及各种离子交换膜、双极膜等,能选择性地允许离子通过,起到平衡电荷、形成闭合回路的作用,解题过程中往往需要根据离子的移动方向来判断膜的种类。例如,电渗析法淡化海水的装置如图4所示。电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离,电解结果如图5所示。
三、复杂电极反应式的书写
对于复杂的电极,尤其是锂离子电池、有机物参与的电极反应,元素价态较难判断,可结合原子守恒、电荷守恒用“待定系数一配平法”来解决。
大多数锂离子电池基于电化学“嵌入/脱嵌”反应原理,替代了传统的“氧化还原反应”,其原理类似“浓差电池”,即在两极形成的电压的驱动下,Li+可以从电极材料提供的“空间”中“嵌入”或“脱嵌”。锂离子电池的正极材料一般为含Li+的化合物,已商业化的正极材料有LiFePO4、LiCoO2、LiMn2O4等。
例题1 某品牌全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图6所示,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应为:
电极反应式的书写思维模型:
第1步,根据总反应明确电极反应前后物质的变化,初步写出两极对应产物:

