接种AMF 对西部煤矿区紫穗槐根系分布和水分利用效率的影响
毕银丽 ,杨 伟 ,柯增鸣 ,武 超 ,李明超
(1.西安科技大学 西部矿山生态环境修复研究院, 陕西 西安 710054;2.西安科技大学 地质与环境学院, 陕西 西安 710054;3.中国矿业大学(北京) 煤炭资源与安全开采国家重点实验室, 北京 100083)
0 引 言
随着我国中东部地区煤炭资源的枯竭和开采条件日益复杂,位于西部的陕、蒙、晋、甘、宁成为我国当前主要的产煤基地,其煤炭开采强度一直居于高位水平[1]。然而该区域大规模井工开采导致了大范围采煤沉陷区的出现,采煤沉陷会产生大量的地表裂缝,使原有土体结构遭到破坏,导致土壤保肥保水能力下降[2]。煤炭开采后的地面不均匀沉降会降低土壤酶活、损伤植物根系、引起植物萎蔫甚至造成植物死亡等[3-4],这对脆弱的矿区环境造成了严重威胁,因而,在采煤沉陷区进行必要的植被恢复和生态治理具有重要意义。丛枝菌根真菌(Arbuscular Mycorrhizal Fungi,AMF)作为一种自然界中普遍存在的重要土壤微生物,可与大多数陆地植物物种形成良好的共生关系[5-7]。研究表明,接种AMF 可有效促进宿主植物根系的发育,增强植物对土壤水分、养分的吸收,加速植物种群的建立,明显的改良土壤质量,同时还能提升植物对干旱、盐碱、重金属胁迫等的耐受力[8-11]。基于此,将以AMF 为核心的微生物复垦技术应用在矿区复垦、采煤沉陷区植被恢复等方面具有巨大潜力[12-13]。
紫穗槐(Amorpha fruticosa Linn)为豆科紫穗槐属多年生木本植物,广泛分布于亚洲和美洲。由于其耐旱、耐寒、耐盐碱、抗风沙、抗逆性极强,对沉陷区土壤具有较好的修复作用,能广泛适应矿区干旱、土壤肥力低下的严酷条件,现已被优选为西部矿区植被复垦的先锋物种[14-15]。近年来,对于紫穗槐的研究主要集中于紫穗槐的育苗技术、生长特性、抗盐碱胁迫能力等方面[16-18],但对于接种AMF 后紫穗槐根系分布以及水分利用效率(Water Use Efficiency,WUE)的变化却鲜有报道。笔者以紫穗槐为供试植物,以AMF 为供试微生物,利用室内土柱试验模拟西部采煤沉陷区干旱缺水、土壤贫瘠的特点,通过对植物生长指标、根系指标,土壤不同层位水分等的监测,明确菌根对紫穗槐促生及水分利用效率的影响机理,为高效、无污染的菌根资源大范围应用推广提供科学指导,为西部采煤沉陷区生物联合修复技术提供技术支持。
1 材料与方法
1.1 试验装置
试验中使用的土柱如图1 所示,高55 cm,内径15 cm,其材质为透明的有机玻璃。为方便试验结束后分层收集根系样品,土柱分为5 节,顶部一节为15 cm,其余都为10 cm,土柱底部为密封,顶部开口。同时,在每一节土柱中间对称位置处各开2 个直径为1.5 cm的小孔(前后左右共4 个),便于试验结束后分层分区收集土壤样品。土柱顶部预留5 cm 以方便紫穗槐幼苗生长过程中进行水分管理。
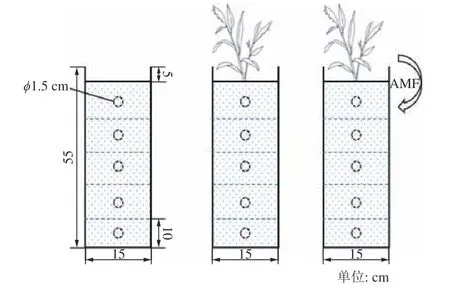
图1 试验装置Fig.1 Experimental setup
1.2 试验设计
试验共设置3 组处理:不种植紫穗槐幼苗(CK1)、种植紫穗槐幼苗处理(CK)、种植紫穗槐幼苗并接种AMF 处理(+AM),每组处理3 个重复。
1.3 试验管理
试验于2022 年6 月8 日—8 月24 日在西安科技大学西部矿山生态环境修复研究院温室进行,试验期间日均温为27.5 ℃,平均湿度为46.0%。试验中的供试土壤为砂土(模拟西部风积沙区土壤),其设计容重、电导率、最大持水量、有机质含量分别为1.55 g/cm3、158.50 μS/cm、18.83%、0.84 g/kg,速效磷与速效钾含量分别为1.84、12.35 mg/kg,土壤砂粒含量为75.30%,属于中砂。供试砂土自然风干后过2 mm筛,经121 ℃、100 kPa 高温蒸汽灭菌90 min 后风干备用。由于供试砂土肥力低下,在土壤中加入养分作为底肥,养分由NH4NO3、KH2PO4、K2SO4配制而成,其用量控制为N、P、K 质量分数分别为100、30、150 mg/kg,和砂土混合均匀。试验中土壤装填高度为50 cm,按设计容重从下向上分层称重装填,每层装填完进行打毛处理以便上下层之间接触均匀。
供试植物选择长势均一、大小一致(总长15~20 cm,茎粗2~3 mm)的半年生紫穗槐幼苗,种植前对无须根和无茎叶的幼苗进行24 h 泡水处理。幼苗种植后第2 天即进行接菌处理,在土壤表层0~20 cm 层位加入50 gAMF 菌剂,与砂土充分混合,并在其它两组处理中加入等量灭活菌剂。试验中使用的AMF 菌种为摩西管柄囊霉(Funneliformis mosseae),其为扩繁后含有真菌孢子、菌丝和侵染根段的根土混合物[7]。
1.4 试验过程
整个试验过程持续75 d,前60 d 保证植物正常生长,后15 d 模拟矿区环境对植物进行干旱胁迫,不再进行水分灌溉。土柱表层土壤(0~20 cm)的初始含水量控制为砂土最大持水量的60%±3.1%,每3 d浇一次水,前3 周每周补一次营养液,水分和营养液浇灌量均为每次50 mL,营养液配制浓度和土壤底肥浓度相同。在植株干旱胁迫期间,表层土壤的平均质量含水率为4.5%±0.56%,低于砂土最大持水量的30%,达到重度干旱胁迫[19]。
1.5 测定指标及方法
1.5.1菌根侵染率
试验结束收取紫穗槐根系时随机取少量细根根样(约25 根),冲洗干净,用10% KOH 溶液浸泡并水浴锅加热(90 ℃)1.5 h,清水冲洗数次备用,后使用酸性品红乳酸甘油染色液法染色、脱色,完成后制片,并在显微镜((Motic Panthera Client))下观察测定紫穗槐根系的菌根侵染率。
1.5.2紫穗槐生长指标
紫穗槐株高、冠幅使用钢卷尺测定(精度1 mm), SPAD 值使用SPAD-502 Plus 叶片叶绿素仪(KONICA MINOLTA, INC.Japan)测定。根系样品按每10 cm 分层取出,根系形态特征通过将根系清洗干净,展开平铺在透明的根盘中,扫描获得根系的数 字 图 像(Microtek Scanmaker i800 plus)。利用RhizoPheno 根系处理软件分析数字图像获得根尖数、根长度、根表面积、根体积及平均直径。将植物地上部分和分层收取的根系清洗干净置于70 ℃烘箱中烘干至恒重,用以测地上生物量和地下生物量。研究中使用的根系分布指标计算公式如下:
式中:RMD 为根质量密度,g/cm3;RLD 为根长密度,cm/cm3;RAD 为根表面积密度cm2/cm3;RVD 为根体积密度,cm3/cm3;Wr为单位体积壤中的根生物量,g;Lr为单位体积壤中的根长,cm;Ar为单位体积壤中的根表面积,cm2;Vr为单位体积壤中的根体积,cm3;V为根系所占的土壤体积,研究中为单层土柱的容积。
1.5.3土壤含水率和电导率
含水率的测定。土壤样品按5×3 的网格法取样,土壤含水率采用烘干法测定。
电导率的测定。待测样品按同上方法取出,风干后过1 mm 筛,取5 g 放于50 mL 烧杯中,加入25 mL蒸馏水,配成1∶5 的土水混合液,充分搅拌3 min 后静置半小时,用电导率测定仪(SevenExcellence™ 多参数测试仪pH/EC)测定电导率。
1.5.4紫穗槐的水分利用效率
植物的水分利用效率(Water Use Efficiency,WUE)指植物消耗单位质量水分TE所积累的干物质的质量。研究中WUE 的具体计算公式如下:
式中:WF,WL,ΔSWS分别为起始土壤含水量,收获时土壤含水量和生长期补水量,g。以上含水量均由称重法获得。
式中,EWU为水分利用效率;Y为总生物量,g。
1.5.5氢氧同位素和叶片的碳同位素
土壤和紫穗槐木质部中的水分采用LI-2100 全自动真空抽提系统(LICA United Technology Limited,China)提取。紫穗槐木质部水、土壤水的δD 和δ18O 使用液态水同位素分析仪(LGR912-0008, ABB Ltd, Canada) 进行分析,其测量精度分别为±0.1‰(δD和±0.3‰(δ18O)。紫穗槐叶片的碳同位素使用元素分析仪-同位素比质谱仪(EA-IRMS,Germany)测定,仪器的测量精度为±0.001‰,测定使用的具体公式如下:
式中,Rsa和Rst分别为待测样品和标准样中的重同位素的和轻同位素的比值(18O/16O、2H/1H、13C/12C)。氢氧同位素的标准品为维也纳标准平均海水(VSMOW),碳同位素的标准品为美国南卡罗来纳州白垩系皮狄组地层中的美洲拟箭石(VPDB)。
1.6 数据处理
使用Microsoft Excel 2019 整理数据;利用IBM SPSS Statistics 26 对数据进行独立样本t 检验和单因素方差分析,显著性水平α=0.05;使用R4.1.1 软件进行土壤水分氢氧同位素的差异性分析与植物水分来源的MIXSIAR 模型估计;使用Orgin2021 绘图,并使用其中的Correlation Plot 插件进行数据的相关性分析和热图绘制、使用Principal Component 插件进行主成分分析。
2 结果与分析
2.1 接菌对植物生长的影响
表1 为不同处理下紫穗槐的生长指标和菌根效应。可以看出,接种AMF 使紫穗槐的株高、SPAD值、地上生物量和地下生物量分别提升38.5%、27.5%、11.1%、69.4%,这表明接菌对紫穗槐具有明显的促生作用。对比不同处理下的菌根侵染率,发现+AM 处理的侵染率显著高于CK 处理,表明人为接种AMF的侵染结果较好。图2 为紫穗槐根系中AMF 的定殖结构,可以明显观察到AMF 的菌丝和泡囊结构。

表1 不同处理下紫穗槐的生长指标和菌根效应Table 1 Growth indices and mycorrhizal effects of Amorpha fruticosa L under different treatments
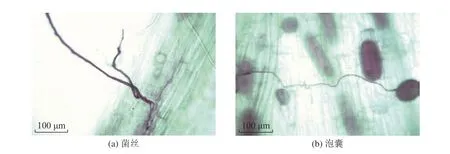
图2 紫穗槐根系的AMF 定殖结构Fig.2 AMF colonization structure of roots of Amorpha fruticosa L
2.2 接菌对植物根系分布的影响
2.2.1接菌对总根系指标的影响
根系是植物吸收和利用土壤水分、养分的关键部位,定量化表征根系指标对研究植物生长具有重要意义,图3 为不同处理下紫穗槐的总根系指标。结果表明,接种AMF 显著增加了紫穗槐的总根系长度和根尖数,相比于CK 处理,接菌使总根系长度和根尖数分别增加了329.0%和586.1%,这表明接菌对植物根系具有明显的促生作用。此外,接菌使紫穗槐的平均根直径显著减小22.9%,说明接菌更有利于紫穗槐细根的发育。
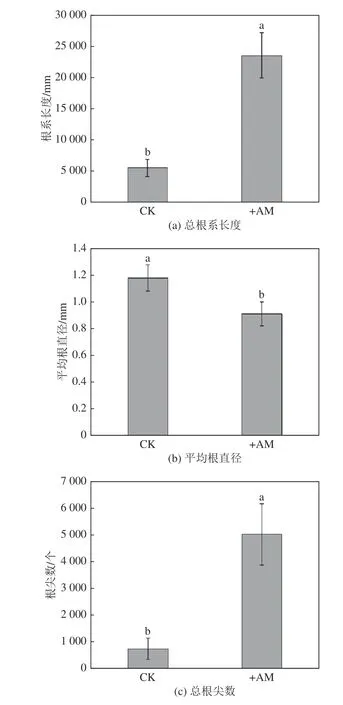
图3 不同处理下紫穗槐的总根系指标Fig.3 Total root indices of Amorpha fruticosa L under different treatments
2.2.2不同根径下的根系形态特征
表2 为不同根径下的根系形态特征参数。研究中将根系分为3 种类型:细根(0~1.0 mm)、中细根(1.0~2.0 mm)、粗根(>2 mm)[20]。由表2 可知,接菌处理不同根系直径下的根系长度、根表面积和根体积均有所提高,在4 种根系直径下的根长度+AM 处理较CK 处理分别提高761.1%、357.2%、151.5%、44.1%,而根表面积、根体积也有类似的结果。明显的,接种AMF 对2 mm 以下细根的根系特征参数提升更为显著,其根长比例较CK 处理提升370.1%。此外,还发现两种处理中0.5~1.0 mm 的根在两者总根长中都占比最多,但根表面积和根体积的分布却与此不同。

表2 不同根径下根系特征参数的比较Table 2 Comparison of root characteristic parameters under different root diameters
2.2.3不同深度下的根系分布特征
采用RMD、RLD、RAD、RVD 表征不同处理下根系的垂向分布。从图4 可以看出,接种AMF 明显改善了不同深度下紫穗槐的根系分布特征,尤其在10~20 cm 土层,+AM 处理的RMD、RLD、RAD、RVD 均显著高于CK 处理。此外,接菌处理中根系可伸长至30 cm 处,CK 处理在同深度内未发现根系,表明菌根在水平向改善紫穗槐根系分布的同时,也促进了植物根系向更深土壤层位的生长,这将更有利于植物对深层土壤水分的利用。

图4 不同深度下根系的分布特征Fig.4 Distribution characteristics of roots at different depths
2.3 土壤水分和电导率的分布特征
图5 为不同处理土壤剖面含水率的变化。可以看出,不同处理的土壤含水率随深度增加而不断增大,其中CK1 处理的平均含水率在不同深度上均大于其它处理,这与CK1 处理中无植物和AMF 真菌有关。+AM 与CK 处理相比,在0~10、10~20 cm土层的平均含水率分别提高8.9%、7.8%;而在20~50 cm 的深层土壤中,土层的平均含水率又分别降低了16.8%、4.0%、11.6%。该结果一方面表明了接菌后根与菌丝组成的复合体增加了植物对深层水分的利用,减少了对浅层土壤水分的利用;同时也表明接菌增加了紫穗槐根系的提水作用,促进了植物根系对土壤水分的再分配作用。

图5 不同处理土壤剖面含水率的变化Fig.5 Variation of soil profile moisture content in different treatments
土壤的电导率随土壤深度增加而逐渐增大(图6),这与土壤含水率的变化趋势相同。土壤电导率变化是土壤盐分分布的直接表征,以电导率为142.0 μS/cm的盐分基准线为例,可以看到,从CK1 到+AM 处理,3 种处理下土壤盐分的积聚层位在逐渐上升,这与根系和AM 菌丝吸收水分密切相关。此外,在更深的盐分淋滤层(>30 cm),各处理之间的电导率差异不大。
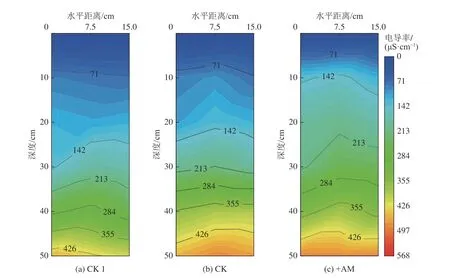
图6 不同处理土壤剖面电导率的变化Fig.6 Variation of soil profile conductivity in different treatments
2.4 接菌对紫穗槐根系吸水来源的影响
2.4.1紫穗槐根系用水层位
由于土壤水分从植物根系向木质部输送过程中不存在同位素组分分馏,木质部水的δ18O、δD 反映了植物对水源的利用。“直接相关法”是将植物和土壤水分的氢氧稳定同位素线组合在一起,两者相交的部分即为植物的主要供水层位[19]。
图7 为不同处理下土壤水和紫穗槐木质部水的δ18O 和δD。可以看出,CK 处理和+AM 处理与土壤氢氧同位素变化曲线的交点在0~5 cm 土壤层位,表明两种处理下植物的最大用水层位最有可能为该层位。此外,接菌处理下木质部与土壤氢氧同位素的交点随土壤深度有所下移,表明接菌加深了植物的潜在用水层位。

图7 不同处理下土壤水和紫穗槐木质部的 δ18O 与 δDFig.7 δ18O and δD of soil water and xylem of Amorpha fruticosa L under different treatments
2.4.2不同层位吸水比例
利用MIXSIAR 模型具体量化了不同处理下紫穗槐从土壤各层中的吸水比例(图8),从图中可以看出,CK 处理和+AM 处理对0~5 cm 土壤层位的用水比例最多,分别为51.6% 和26.1%,这和利用直接相关法所判断的结果一致。此外,紫穗槐对其他层位的土壤水分也有利用,在表层5 cm 以下的5~30、30~50 cm 层位,接菌后紫穗槐吸水比例分别增加15.4%、9.9%,这与接菌后紫穗槐根系特征参数的显著改善和菌丝对水分的吸收作用有关。
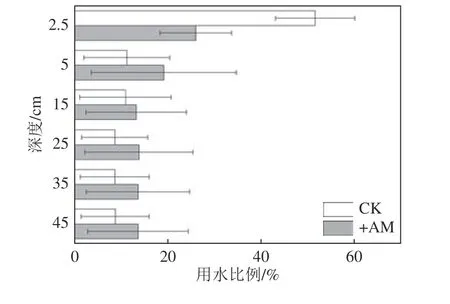
图8 紫穗槐各层的用水比例Fig.8 Proportion of water used in each layer of Amorpha fruticosa L
2.5 接菌对紫穗槐WUE 和叶片δ13C 的影响
图9 为不同处理下紫穗槐的水分利用特征。可以看出接种AMF 增加了紫穗槐的WUE(图9a),增加幅度为27.5%。图9b 为不同处理下紫穗槐叶片的δ13C 值,CK 和+AM 处理叶片的δ13C 值分别在-26.989‰~-27.229‰和-25.489‰~-25.549‰之间,可以看出接菌处理之后紫穗槐叶片的δ13C 值也有所增大,这和接种AMF 后紫穗槐WUE 增大的结果一致。紫穗槐叶片δ13C 值越负,其自身WUE 越低,δ13C 值指示了不同处理植物的WUE 差异。
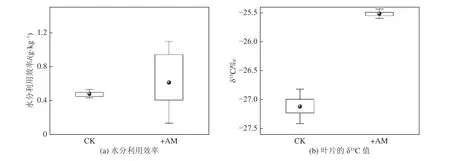
图9 不同处理下紫穗槐的水分利用特征Fig.9 Water use characteristics of Amorpha fruticosa L under different treatments
2.6 根系分布与植物水分利用效率之间的相关性分析
图10 为紫穗槐根系分布与WUE 之间的相关性分析,其中株高和总根长、根尖数、细根长、根表面积、根尖数、根体积之间呈现显著正相关关系(P<0.05);平均根直径和总根长、根尖数、细根长、根表面积、叶片δ13C 值之间均呈现显著负相关关系;而WUE 与总根长、根尖数、平均根直径、细根长、根表面积、根体积之间的相关系数分别为0.49、0.54、-0.47、0.48、0.66、0.89;此外,WUE 与叶片δ13C 值之间的相关系数为0.38。

图10 根系分布与植物水分利用效率之间的相关性分析Fig.10 Correlation analysis between root distribution and plant WUE
2.7 接菌对紫穗槐WUE 影响的关键根系特征分析
通过上一步的结果发现,紫穗槐的WUE 和根系形态参数指标之间具有较高的相关性。接种AMF影响了紫穗穗的根系形态特征,为了明确接菌后那种根系特征直接影响了紫穗槐的WUE,利用根系形态特征参数与紫穗槐WUE 进行了主成分分析(图11)。

图11 紫穗槐根系对水分利用效率影响的主成分分析Fig.11 Principal component analysis of effect of roots of Amorpha fruticosa L on water use efficiency
对RT(根尖数)、RL(总根长)、FRL(0.50~1.00 mm的细根长)、RA(根表面积)、RV(根体积)、RMD(根质量密度)、MRD(平均根直径)、SM(土壤含水率)8个指标进行主成分分析。由主成分的特征值及贡献率结果可知,前2 个主成分解释了91% 的紫穗槐WUE,达到了累计贡献率>80% 的要求。其中,RL、RT、FRL 对第一主成分的影响较大,对第二主成分影响最大的指标分别为RMD、MRD。以上结果表明,根系中0.50~1.00 mm 的细根长和根尖数可能是接种AMF 后提升植物WUE 的关键根系特征。
3 讨 论
3.1 接种AMF 对紫穗槐生长和根系分布的影响
接种AMF 可以提高紫穗槐的生物量并改善紫穗槐的根系结构[21],陈婕等研究表明紫穗槐在水分胁迫条件下接种AMF 可表现出较高的菌根侵染率和生物量[22],这和研究的结果一致。研究中接菌处理显著提高了AMF 在紫穗槐根系中的侵染率,紫穗槐根系与AMF 形成菌根共生体后表现出明显的促生效应,+AM 处理的生物量较CK 处理更高,这对紫穗槐应对矿区干旱的环境具有积极意义。
AMF 能够促进紫穗槐根系生长并改变根系分布。根系作为植物吸收养分、水分以及各种微量元素的主要器官,根系形态特征可以反映植株的生长状况[23]。研究中+AM 处理的根系特征参数均显著优于CK 处理,这是由于接菌处理促进了植物体内生长素类似物IBA 的合成,该类物质可引起植物根系形态发生显著变化[24];同时吴强盛等[25]研究发现接种AMF 对白三叶草的根系构型,如根长度、根表面积、根体积、根尖数、根分支数和交叉数都有显著的促进作用,这支持了研究结果。此外,研究中还发现接种AMF 显著减小了紫穗槐的平均根直径,且明显促进了2 mm 以下细根的生长,这与毕银丽、刘凯洋等的研究结果类似[26-27]。细根作为植物根系系统中生理活性最高的成分,主要负责吸收大量水分和养分[28],尤其接菌后对细根根系特征参数的显著改善,能够在水分亏缺状态下使得更多土壤水分被植被利用。另外,接菌后土壤不同深度下的根系参数指标(RMD、RLD、RAD、RVD)也得到了显著改善,尤其在20 cm以下层位。同时接菌后紫穗槐的根系到达了更深的土壤层位,这对其利用更深层的土壤水分至关重要。
3.2 接种AMF 对土壤水分盐分分布的影响
土壤水分、盐分分布与紫穗槐根系和AM 菌丝对水分的吸收作用密切相关,研究中土壤水分与盐分分布分别与土壤深度呈正相关关系。值得注意的是,相较于CK 处理,接菌增加了浅层土壤0~20 cm的土壤含水率,而减小了深层20~50 cm 的含水率。分析原因有以下两点:其一,接菌形成的菌丝网络协助植物根系到达了更深的土壤层位,同时菌丝可以伸长至根系无法到达的更深层土壤,两者协同促进了植物对深层土壤水分的吸收,使对应层位的土壤含水率减小[29];其二,接菌加强了紫穗槐根系的提水作用,植物根系及庞大的菌丝网络在夜间将深部的土壤水分携带运输并释放至干燥的浅层土壤中,增加了浅层土壤的含水率[30]。此外,植物种植和接菌使土壤中的盐分积聚层位有所上升,在0~30 cm 土壤层位表现最为明显。研究表明,根长密度对土壤盐分分布具有重要影响,较大的根长密度增加了对土壤水分的吸收,引起土壤孔隙中溶质浓度增加,进而造成土壤盐分积聚[7,31]。研究中接菌处理不同层位的RLD 均大于未接菌处理,因而其在土壤剖面中出现了明显的盐分积聚,CK1 处理由于未种植植物,其土壤盐分随表层浇灌水一直被淋洗到土壤最深层,因而其在0~30 cm 土层盐分含量最低。
通过以上分析,接种AMF 改变了紫穗槐根系分布和土壤水分、盐分的空间分布,那么必然会影响植物吸水深度及比例的变化。研究中发现土壤水中的同位素组成随着土壤深度的增加而逐渐减小。当接种AMF 时,紫穗槐木质部水同位素值向更负值方向偏移,这主要是由于接菌增加了植物对更深层土壤水分的利用。在5 ~30 cm 根系的主要影响区、>30cm 的根系弱影响区,接菌均增加了土壤水分的吸收比例,这与接菌后土壤水分的空间分布结果一致。这主要是由于在5~30 cm 层位,接菌显著增加了细根根长、根表面和根体积;而在>30 cm 的更深层位,菌丝协助植物吸收了更深层的土壤水分[29]。在干旱和蒸发强烈的矿区,浅表层土壤水分受蒸散发影响严重,一般难以维系矿区复垦植被的生长。因而想要取得良好的复垦效果,植被利用更深层的土壤水分至关重要。SONG 等[32]研究表明,在干旱半干旱地区,深部土壤水分已经成为植物抵御干旱胁迫和维持生存的重要水源。研究中,接种AMF 恰好增加了紫穗槐对深部土壤水分的吸收比例,这对矿区复垦植被抵御干旱胁迫和提升抗逆性具有重要作用。
3.3 接种AMF 对紫穗槐WUE 的影响
在西部干旱半干旱煤矿区,水分是影响植被恢复和生态复垦的关键核心因子[33],如何有效增加复垦区植被对土壤水分的利用效率,成为当前背景下的研究热点问题。研究中接种AMF 提升了紫穗槐植株的WUE,增加了植物在干旱缺水环境下的生产能力。这是由于AMF 侵染紫穗槐根系后,扩大了植物对土壤水分和养分的吸收面积[34],同时接菌植物通过提升叶片的光合速率而增加了自身的碳储备量,即增加植物干物质的积累并对地上生物量和地下生物量进行重新组配[35],使植物根冠协调生长进而综合提高了植株的WUE。研究中,具体表现为+AM处理具有更大的SPAD 值、生物量、根冠比等。此外,研究中发现,根尖数和0.5~1.0 mm 细根长的显著增加是接菌后紫穗槐WUE 提升的关键因素,这和毕银丽等[19]在研究土层重构模式下接种深色有隔内生真菌(DSE)对玉米水分利用影响时的结果类似。另外,利用植物叶片的碳同位素值(δ13C)来表征植株的长期水分利用效率,已得到广泛研究和应用[36]。研究中发现WUE 和叶片的δ13C 值具有一定的相关性,且接菌后两者都有所增大,这与前人的研究结果类似[37]。邢丹、PENUELAS 等[38-39]研究表明,叶片的δ13C 值反映了净光合速率和气孔导度两个量的相对大小,所以可以推测,研究中接菌通过提升以上两者而增加了植物的WUE[40],这与紫穗槐植株基于个体水平所反映的WUE 结果一致。另外,不难看出,基于个体水平的植物WUE 由于需要定量测量植株的生物量和耗水量,这在矿区植被恢复过程中几乎难以实现,但高效、无损的碳同位素技术却为定量化表征复垦后植被的水分利用状况提供了一种新途径。
4 结 论
1)接种AMF 有效促进了紫穗槐的生长,相较于CK 处理,其株高、SPAD 值、地上生物量和地下生物量分别提升38.5%、27.5%、11.1%、69.4%。
2)接种AMF 改变了紫穗槐的根系分布及土壤水分利用模式,提高了紫穗槐抵御干旱胁迫的能力。接种AMF 后使总根系长度和根尖数分别增加329.0%和586.1%,使平均根直径显著减小22.9%。此外,接菌增加了紫穗槐对表层5 cm 以下土壤水分的利用比例,在5~30、30~50 cm 分别提升15.4%、9.9%,AMF 菌剂在提高紫穗槐抗旱能力中表现出很大的潜力。
3)接菌增加了紫穗槐植株的WUE,这对“以水量植”的矿区复垦意义重大。紫穗槐根系中的细根长(0.5~1.00 mm)和根尖数是干旱胁迫下接种AMF对土壤水分高效利用的关键根系特征,这将为评价微生物菌剂在干旱半干旱区的应用情况提供重要的参考依据。
研究是在基于室内土壤灭菌条件下进行的,其对于复杂气候条件(干旱少雨、蒸发强烈)和原生土壤菌群相互作用下的西部矿区是否完全适用,有待进一步研究。

