淀山湖浮游植物群落结构特征及水生态健康评价
李强 伦凤霞 葛婷婷

摘要:淀山湖是黄浦江上游重要的饮用水源地保护区和生态涵养区,评估淀山湖水生态健康状况,可为淀山湖水环境改善及水资源保护提供基础资料。2013年、2016年、2019年和2022年4个年度的6月和9月在淀山湖布设6个站位进行浮游植物样品采集及水体理化指标监测,分析淀山湖夏初、秋初浮游植物的种类组成、数量和多样性等群落结构特点,并采用冗余分析法(RDA)探讨群落结构与环境因子的关系。调查期间共检出浮游植物7门80属169种,其中绿藻门占绝对优势,其次为硅藻门、蓝藻门和裸藻门,甲藻门、隐藻门和金藻门种类数较少;铜绿微囊藻(Microcystis aeruginosa)和尖尾蓝隐藻(Chroomonas acuta)的优势最明显,其中铜绿微囊藻是引起淀山湖水华的主要物种,且易在9月湖区的西南方引起蓝藻水华;6月和9月浮游植物密度变动范围分别为1.69×106~3.08×106个/L和1.31×106~128.67×106个/L,6月在湖区东北方的平均密度最高,9月在湖区西南方的平均密度最高;水华暴发年份(2016年和2019年)9月平均密度明显高于同年6月,水华未暴发年份(2013年和2022年)9月平均密度则低于同年6月;冗余分析结果显示水温、溶解氧、透明度、总磷、总氮和高锰酸盐指数等是主要环境影响因子;浮游植物群落主要受磷营养限制,其物种数量、密度及优势种主要受水温影响;采用不同指数法评价水质,发现Shannon-Wiener指数和Pielou指数对淀山湖蓝藻水华的指示比综合营养状态指数更灵敏。根據研究结果可以判断淀山湖夏秋季水体总体上处于轻―中度富营养化水平,且呈轻污染程度。
关键词:浮游植物;群落结构;环境因子;水生态健康;淀山湖
中图分类号:Q948.8;X826 文献标志码:A 文章编号:1674-3075(2024)02-0010-10
浮游植物作为水域生态系统的初级生产者,在系统物质循环及能量流动过程中起基础作用(Torres et al,2008),其群落结构、数量变化及生物多样性特征能直接反映水域生态环境质量的优劣、水体营养状态等(刘建康,1999;Tavernini et al,2005;邓春凯,2007;Suikkanen et al,2007),因此不少学者利用浮游植物作为指示生物来监测生态环境变化(Warwick,1981;冯天翼等,2011;朱海涛等,2020;郝雅宾等,2021)。
淀山湖位于太湖流域苏沪边界地区,是上海市境内最大的天然淡水湖泊,面积63.7 km2,平均水深约2.1 m,最大水深3.6 m,具有防洪、供水、航运、旅游、灌溉、养殖等多种功能,是黄浦江上游重要的饮用水源地保护区和生态涵养区,在上海市社会和经济发展中具有重要地位(阮仁良和王云,1993;由文辉,1997; 疏正宏等,2021)。近20年来,随着环湖地区社会经济的快速发展,淀山湖水体呈现出不同程度的富营养化状态。水体富营养化极易引起蓝藻水华暴发。据已有记录,1985年淀山湖首次暴发大面积蓝藻水华,之后每年均有不同程度蓝藻水华现象出现,至2007年淀山湖再次暴发大规模蓝藻,严重威胁到饮用水安全(由文辉,1995;程曦和李小平,2008;朱梦杰等,2010;王丽卿等,2011)。因此,上海市针对蓝藻水华问题实施了生物治理、内源污染控制等富营养化防治及生态修复措施。2008-2018年淀山湖富营养化程度呈改善趋势,生态系统在逐步恢复(李宏祥等,2012;康丽娟,2020)。
随着水华暴发频次的增多,政府部门及科研院所也加大了对淀山湖浮游植物群落的监测及水华发生机制的研究力度,尤其是2007年蓝藻水华大规模暴发后,在政府主导实施生态修复治理措施的同时,部分学者对湖内浮游植物进行了较为密集的研究(杨虹等,2010;朱梦杰等,2010;王丽卿等,2011;徐春燕等,2012;张琪等,2016;杨丽等,2018),但浮游植物群落结构及多样性在生态修复工程后有无长期改善还未见持续跟踪研究报道,且对湖内浮游植物与水体理化因子关系的研究较少。根据笔者多年监测了解到淀山湖每年6月至9月易发生蓝藻水华,6月和9月气候适宜、水文条件稳定,一般是湖区蓝藻水华发生的起点和终点。因此,6月和9月浮游植物生态学特点能较好地代表淀山湖水生态健康状况。本文以无水华发生的2013年和2022年及有水华发生的2016年和2019年这4个年度的6月和9月生态调查资料为依据,分析了淀山湖夏秋季浮游植物群落结构特征及与水体理化因子的关系,并采用不同方法对其生态健康状况进行了初步评价,以期为淀山湖的水环境改善及水资源保护提供基础资料。
1 材料与方法
1.1 调查区域与方法
根据淀山湖水文、地形和浮游植物监测的要求,共布设6个站位,其中S2和S3靠近进水口,S1和S6靠近出水口,S4和S5受进出水口影响小(图1)。采样工作于2013年、2016年、2019年和2022年4个年度的6月和9月进行,共采样8次。定性样品用25号浮游生物网在水下0.5 m至水面作“∞”状拖动3~5 min,将浓缩水样保存于标本瓶中, 加15%样品体积的鲁哥氏液固定。定量样品用有机玻璃采水器取水面下0.5 m层水样5 L,摇匀后装取1 L的水样,用15%样品体积的鲁哥氏液固定。样品带至实验室静止沉淀48 h后浓缩并定容至50 mL供镜检。用0.1 mL浮游植物计数框在10×40倍光学显微镜下进行观察计数。每个样品计数2片,取其平均值作为最终结果。若2片计数结果相差15%以上,则进行第3片计数,取其中个数相近的2片计数平均值。浮游植物生物量依据细胞体积法推算(章宗涉和黄祥飞,1991;赵文,2005)。浮游植物标本分类与鉴定参照文献(胡鸿钧和魏印心,2006;水利部水文局和长江流域水环境监测中心,2012)进行。参照水利、环境行业或国家相关标准对水温(WT)、溶解氧(DO)、pH、透明度(SD)、高锰酸盐指数(CODMn)、五日生化需氧量(BOD5)、总磷(TP)、总氮(TN)、氨氮(NH4+-N)、硝酸盐(NO3--N)和叶绿素a等水质理化指标进行检测。
1.2 数据处理与分析
运用Shannon-Wiener指数(H′)、Pielou指数(J′)、Margalef指数(d)和优势度(Y)对调查数据进行分析(钱迎倩和马克平,1994)。计算公式如下:
式中:Pi为第i种个体数占总个体数的比例,S为总种数,N为总个体数,ni为第i种的个体数,fi为第i种在各站点出现的频率,当某种浮游植物Y≥0.02时,则为优势种。
应用Shannon-Wiener指数(H′)对淀山湖水质进行评价,H′值在0~1为重污型,在1~3为中污型,>3为轻污―寡污型;根据Pielou指数(J′)评价淀山湖水质,J′值在0~0.3为重污染,0.3~0.5为中污染,0.5~0.8为轻污―寡污型,0.8~1.0为清洁型;按照Margalef指数(d)评价等级,d值在0~1为重污染型,1~2为中污染型,2~3为轻污染型,>3为清洁型(吴天浩等,2019)。
运用综合营养状态指数法对淀山湖富营养化进行评价。综合营养状态指数计算公式为:
式中:TLI(∑)为综合营养状态指数,TLI(j)为第j种参数的营养状态参数,Wj为第j种参数营养状态指数的相关权重,具体计算公式见相关文献(王明翠等,2002)。参考《中国水资源公报》(中华人民共和国水利部,2005)中湖泊、水库富营养化评分与分类标准将湖泊营养状态分成5级,TLI(∑)<30为贫营养,30≤TLI(∑)≤50为中营养,50
采用冗余分析法(RDA)探究浮游植物群落特征与环境因子的关系,RDA分析在CANOCO5.0软件中完成。环境因子(除pH外)通过ln(x+1)转化以满足数据的正态分布并增加数据的同质性。采用Origin2021等软件对相关数据进行处理和绘图,数据显著性分析采用t检验法。
2 结果与分析
2.1 种类组成
8次监测共采集并检出浮游植物80属169种,隶属于7个门,其中绿藻门占绝对优势,有74种,占总种类数的43.8%;硅藻门有40种,占23.7%;蓝藻门24种,占14.2%;裸藻门19种,占11.2%;甲藻门、隐藻门和金藻门种类数较少,分别有6种(3.6%)、4种(2.4%)和2种(1.2%)(图2)。2013年和2022年的9月浮游植物种类数要明显多于同年6月(P<0.05),2016年和2019年則不同,6月种类数要略多于同年9月。从空间分布看,S3和S4种类数相对较多,平均有44.3种和46.3种,种类数较少的站位是S1和S2,仅有39.4和37.4种(图2)。
2.2 优势种
8次调查共出现浮游植物优势种20种,其中蓝藻门7种,硅藻门6种,隐藻门和绿藻门各3种,甲藻门1种(表1)。铜绿微囊藻(Microcystis aeruginosa)和尖尾蓝隐藻(Chroomonas acuta)是最主要的优势种,成为优势种的频次最高,且优势度也相对较高。2013年和2016年的6月以尖尾蓝隐藻的优势度最高,2019年和2022年的6月分别以铜绿微囊藻和水华长孢藻(Dolichospermum flos-aquae)的优势度最高;2013年、2016年、2019年和2022年的9月则均以铜绿微囊藻的优势度最高。水华束丝藻(Aphanizomenon flos-aquae)、汉氏冠盘藻细弱变种(Stephanodiscus hantzschii f. tenuis)、小球藻(Chlorella vulgaris)、四角十字藻(Crucigenia quadrata)和双对栅藻(Scenedesmus bijuga)仅在6月为优势种,啮蚀隐藻(Cryptomonas erosa)、裸甲藻(Gymnodinium aeruginosum)和梅尼小环藻(Cyclotella meneghiniana)仅在9月为优势种。
2.3 密度和生物量
8次调查浮游植物的平均密度为(19.03±55.40)×106个/L,6月和9月平均密度分别为2.27×106个/L(1.69×106~3.08×106个/L)和35.79×106个/L(1.31×106~128.67×106个/L)(表2)。2013年和2022年的6月平均密度要高于同年9月,2016年和2019年的9月平均密度要明显高于同年6月(P<0.05),其中2016年9月的密度明显高于其他调查时期(表2)。浮游植物的平均生物量为(2.87±5.24) mg/L,6月和9月平均生物量分别为0.84 mg/L(0.55~1.56 mg/L)和4.90 mg/L(0.39~13.86 mg/L),其变化趋势与密度基本一致(表2)。
6月多以蓝藻数量占优势,蓝藻数量占比逐步增大。2013年6月蓝藻不如隐藻数量多,而2016年6月蓝藻数量与绿藻数量相当;2019年和2022年的6月蓝藻分别占总密度的62%和78%,其次是硅藻,其他占比较小,均占10%以下(图3)。9月均以蓝藻对总密度的贡献值最大,占总密度的47%~95%,其次是2019年9月和2022年9月的隐藻及2013年9月的绿藻,分别占总密度的25%、23%和16%,2022年9月的硅藻占比也相对较高,占19%,其他占比相对较小(图3)。浮游植物密度的空间分布存在一定差异(图4)。6月,S6平均密度最高,明显高于S1和S3(P<0.05),其次是S2和S5。9月,S1平均密度最高,其次是S2,S4密度最低。2016年9月S1~S3以及2019年9月S1站位的密度明显高于其他站位,分别达到重度和轻度水华程度。
2.4 基于生物多样性和综合营养状态指数的水质评价
8次调查的Shannon-Wiener指数(H′)、Margalef指数(d)、Pielou指数(J′)和综合营养状态指数(TLI)的时空变化见表3。H′和J′总平均值分别为3.18±0.84和0.59±0.14,可以判断淀山湖总体上属于轻污-寡污型水体。2016年9月的H′值和J′值较低,仅为1.77和0.32,属于中污型水体,接近重污染状态,这可能与蓝藻暴发式增长密切相关。2019年6月的H′值和J′值也比较低,属于中污型水体。其他多为轻污-寡污型状态。TLI总平均值为56.0±3.9,淀山湖总体属于轻度富营养化。2016年9月的TLI值较高,属于中度富营养化状态。2019年6月TLI值接近中营养水平,与H′值和J′值所反映水质状况不一致。应用d值判断淀山湖水质,均属于清洁型水体,说明d值对淀山湖水质变化反应不灵敏。
2013年9月和2022年9月H′值、d值和J′值均高于同年6月,而2016年6月H′值、d值和J′值均明显高于同年9月;2019年9月的H′值和J′值比6月高,d值则不如6月高。2016年9月和2019年9月的TLI值均比同年6月高,2013年和2022年则没有明显变化规律。从空间分布看(表3),S4的3项多样性平均值最高,其次是S5和S3;S1的H′和J′平均值相对较低,均指示为中污型水体;S2的H′平均值相对较低,指示为中污型水体;S6的d平均值最低。各站位TLI平均值变化不明显,在56.0~56.7间变动。
2.5 与环境因子的关系
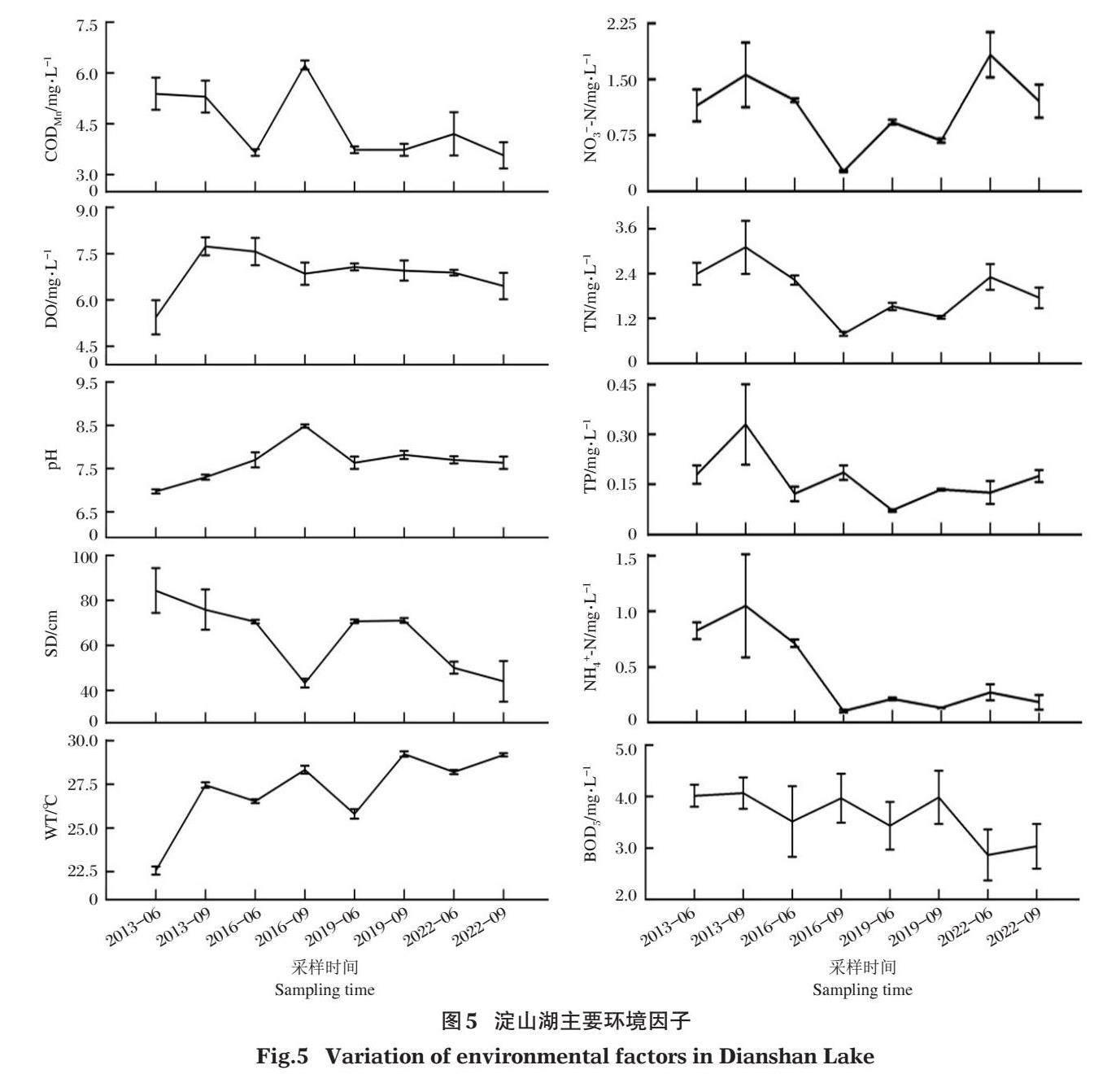
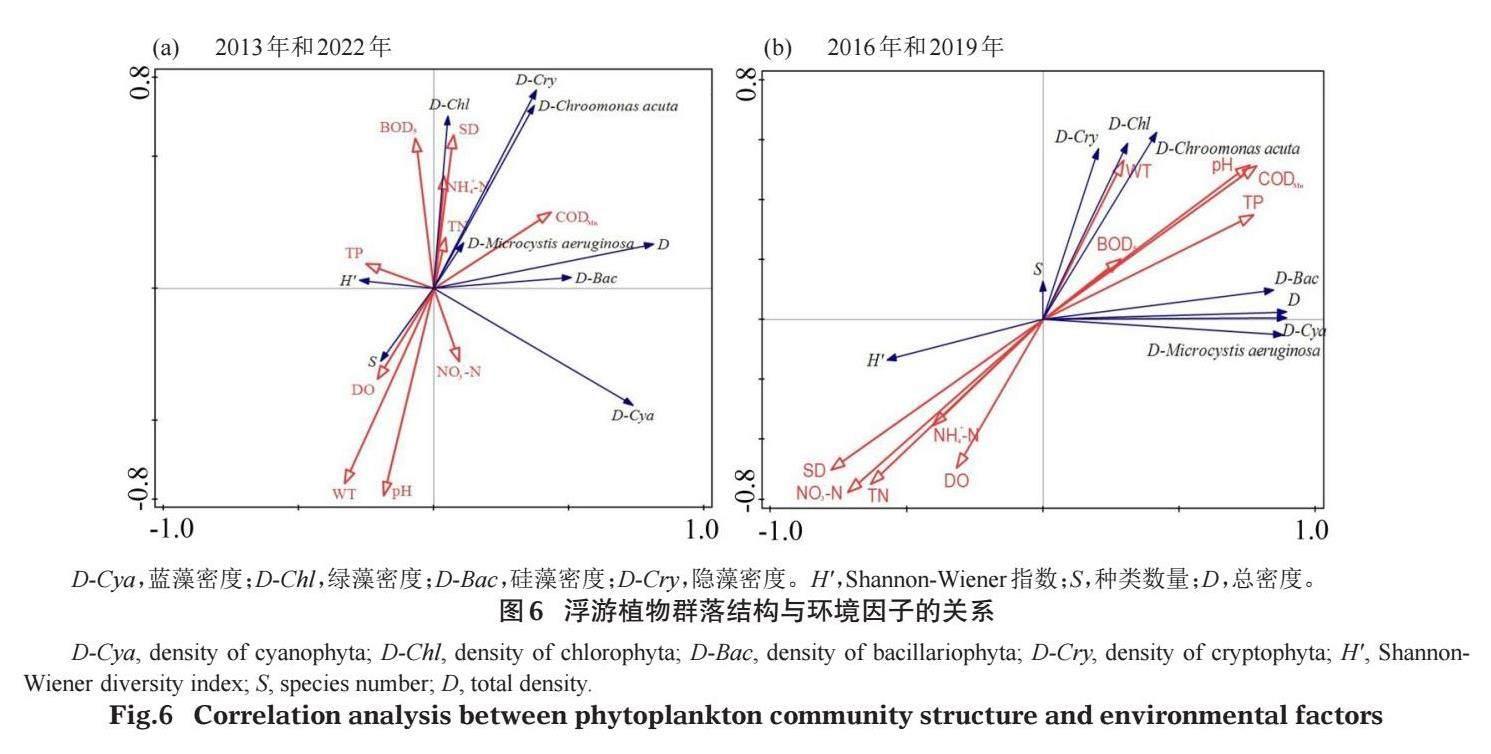
淀山湖水温、溶解氧、透明度等环境因子的检测结果见图5。经RDA分析(图6-a),淀山湖水华未暴发年份(2013年和2022年)的物种数量与溶解氧、水温和pH等呈正相关,与总氮、氨氮、透明度和高锰酸盐指数等呈负相关;绿藻密度、隐藻密度和铜绿微囊藻密度对环境因子的响应与物种数量相反;硅藻密度和总密度主要受高锰酸盐指数的影响,表现为正相关关系;蓝藻密度与硝酸盐氮呈正相关,H′与总磷呈正相关。水华暴发年份(2016年和2019年),物种数量、隐藻密度和绿藻密度与水温、pH和高锰酸盐指数等存在正相关关系,与溶解氧、透明度及氮营养盐等呈负相关;总密度、硅藻密度和蓝藻密度与总磷、pH和高锰酸盐指数等呈正相关,与溶解氧、透明度及氮营养盐等也呈负相关;H′则与溶解氧、透明度及氮营养盐等呈正相关(图6-b)。
3 讨论
3.1 淀山湖浮游植物群落结构特点
淀山湖地处亚热带季风气候区,为浅水型湖泊,具有水体较稳定、水深较浅、年平均温度较高和日照时间较长等特点,这些均适宜浮游植物的生长和繁殖(程曦和李小平,2008;杨虹等,2010)。近30年,淀山湖浮游植物群落呈现出种类数增多、绿藻门和蓝藻门种类数占比逐步增大、硅藻门种类数占比渐小的趋势;群落以绿藻、硅藻和蓝藻种类为主,三者占比一直维持在80%以上,且绿藻已具有绝对优势(由文辉,1995;朱梦杰等,2010;王丽卿等,2011;杨丽等,2018)。据本研究发现,淀山湖夏秋季浮游植物种类数较多,群落结构以绿藻门种类数占绝对优势,且绿藻、硅藻和蓝藻三者占比为81.7%,与之前相比变化不大,这说明淀山湖群落结构处于较稳定状态。水华暴发年份(2016年和2019年)绿藻、硅藻和蓝藻三者占比(87.0%)要高于水华未暴发年份(2013年和2022年)(80.9%)。水华暴发年份6月种类数要多于同年9月;水华未暴发年份则相反,9月种类数要明显多于同年6月。在数量上,水华暴发年份9月的平均密度高于同年6月十倍或百倍以上,且均达107个/L以上,导致部分水域出现蓝藻水华现象,而水华未暴发年份6月的平均密度高于同年9月仅1倍多,均不足107个/L。
淀山湖夏秋季浮游植物以铜绿微囊藻的优势最明显,其次是尖尾蓝隐藻,两者在6月和9月成为优势种的概率均达87.5%。这与PEG模型(Sommer et al,1986)中“夏季绿藻占优势,夏末秋初则是蓝藻占优势”的浮游植物群落季节演替规律不完全一致。这可能与PEG模型主要反映中营养水平湖泊的情况有关。淀山湖蓝藻大量出现的时间点较早且持续时间长,这可能与水体富营养化有密切關系。淀山湖6月与9月的水温更适宜蓝藻生长繁殖,且蓝藻对隐藻具有竞争优势,其分泌的化感物质会严重影响隐藻的生长(Suikkanen et al,2005)。微囊藻对环境的适应能力强,在高温、高营养盐条件下易在群落中处于统治地位,其产生的微囊藻毒素会抑制其他藻类的生长(杨柳燕等,2019)。因此,铜绿微囊藻易在夏秋季成为淀山湖最主要的优势种,且易在温度较高的9月形成水华。
3.2 淀山湖浮游植物与环境因子的关系
浮游植物的种类组成和数量结构主要受光照、水温、营养盐含量、浮游动物和滤食性鱼类摄食等多种因素影响(王丽卿等,2011;Du et al,2019)。有学者研究发现淀山湖浮游植物功能群主要受水位波动、光衰减系数、溶解氧、水温、总磷、电导率、透明度和总氮等的影响(张琪等,2016;杨丽等,2018)。本研究发现,水温、溶解氧、pH、透明度、总磷、总氮和高锰酸盐指数等与淀山湖浮游植物群落结构关系较为密切,且这种关系在水华未暴发年份与水华暴发年份存在一定差异。
影响淀山湖夏秋季浮游植物物种数量及密度的主要环境因子是水温。水温通常是浮游植物生长的限制性因子,不同浮游植物有着不同的最适温度范围,对多数浮游植物来说,其最适生长温度在18~25℃波动(颜天等,2002)。蓝藻、绿藻适宜在较高的水温条件下生长,硅藻则适宜生活在较低的水温环境中(沈韫芬等,1990)。蓝藻的光合速率和生长速率在25℃以上显著增加(Visser et al,2016),最适生长温度在27~37℃(Paerl,2014)。本研究中,8次调查水温为22.2~29.4℃,适宜许多浮游植物物种的生存与生长,且在水华未暴发年份呈现出温度越高物种越多的特点。水华暴发年份温度较高的9月物种数量不如同年6月多,这可能与9月铜绿微囊藻暴发式增长时产生微囊藻毒素并造成水体溶解氧和透明度降低从而影响其他藻类存活与生长有关(朱伟等,2018;杨柳燕等,2019)。2013年6月所测水温在23.0℃以下,尖尾蓝隐藻优势度最高;2016年和2019年6月水温在25.4~26.7℃,优势度最高的物种分别为尖尾蓝隐藻和铜绿微囊藻;2022年6月水温在28.0~28.4℃,水华长孢藻优势度最高;9月水温在27.2~29.4℃,优势度最高的物种均为铜绿微囊藻。由此可以判断,水温决定淀山湖夏秋季浮游植物群落的最主要优势种,且当水温>27℃时,蓝藻门物种的优势度最高。
氮、磷是藻体构成的重要营养元素,被认为是浮游植物生长及水华发生的重要限制因子(朱旭宇等,2013)。水体中的N:P大于20:1时被认为是磷限制性的,小于10:1时被认为是氮限制性的,该比率在10:1~20:1时限制性因素就变得不确切(Schanz & Juon,1983)。本研究8次调查的氮磷比平均值为30.8:1,RDA分析发现在水华暴发年份总磷与浮游植物的总密度、蓝藻密度和硅藻密度等密切相关,在水华未暴发年份总磷与H′呈正相关,可以推断淀山湖夏秋季浮游植物群落主要受磷营养限制。Gibson等(2000)指出湖泊中总氮、总磷浓度分别超过0.15 mg/L和0.01 mg/L即有可能发生蓝藻水华。曹晶等(2022)研究确定了太湖蓝藻水华暴发的总磷和总氮控制阈值分别为0.05~0.06 mg/L和1.71~1.72 mg/L。许海等(2019)研究发现水体氮、磷浓度过高或过低均不易产生蓝藻优势,氮、磷营养盐浓度偏低的水体蓝藻易成为优势种。本研究水华暴发年份水体总氮含量相对较低,与浮游植物的现存量呈负相关;而在水华未暴发年份总氮相对较高,与蓝藻、綠藻及隐藻的密度等呈正相关。这说明氮、磷等营养物质含量在水体中超过一定浓度后,氮营养盐含量过高反而不利于蓝藻水华的形成。
透明度能直观反映湖水的清澈和浑浊程度,对浮游植物的生长存在一定影响(张运林等,2003;杨丽等,2018)。溶解氧对维系水体生态健康具有重要作用,丰富多样的水生植物可使水体保持较高的溶解氧,而藻类过量会对水体产生负影响(赵海超等,2011)。蓝藻水华发生时会造成水体溶解氧和透明度等降低,从而出现影响其他藻类存活的负反馈机制(朱伟等,2018;杨柳燕等,2019)。本研究RDA分析结果也验证了这种负反馈机制的存在,部分生物指标如绿藻和隐藻的密度在水华暴发年份与透明度呈负相关,而在水华未暴发年份与透明度呈正相关;物种数量在水华暴发年份与溶解氧呈负相关,而在水华未暴发年份与溶解氧呈正相关。高锰酸盐指数是反映水体受到有机污染物和还原性无机物污染程度的综合指标,与浮游植物的生长呈显著正相关关系(于洋等,2017)。本研究发现水华暴发年份和水华未暴发年份的浮游植物现存量均与高锰酸盐指数呈正相关关系。因此,高锰酸盐指数也是影响淀山湖夏秋季浮游植物群落的一个重要因素。
3.3 淀山湖浮游植物水生态健康评价
藻类在水体中生物量最大,为水体生态系统的食物网和能量流动的基础(钱迎倩和马克平,1994),其种类和数量变化直接反映水质状况(张觉明和何志辉,1991)。一般情况下,在清洁水体中浮游生物呈现为种类多、数量少的特点,在富营养化水体中往往有些耐污种类形成优势种群,而在重度污染水体几乎所有水生生物都难以生存(陈光荣等,2008)。本研究所检获优势种有微囊藻、平裂藻、蓝隐藻、隐藻、直链藻等,它们多被认为是富营养水体的指示物种(Einsle,1983;况琪军等,2005;李为星等,2013)。其中,铜绿微囊藻和尖尾蓝隐藻均喜栖于富营养水体中(温明章,2003;冯天翼等,2011),其数量在群落中占绝对优势,这表明淀山湖水体处于富营养化状态。
对比本研究应用的水质评价方法,发现Shannon-Wiener指数(H′)和Pielou指数(J′)对淀山湖蓝藻水华发生的指示比综合营养状态指数更灵敏。2016年9月出现较严重的蓝藻水华,H′和J′值指示淀山湖为中污染状态,TLI值也较高,指示淀山湖为中度富营养化状态。2019年9月在S1出现轻度水华,H′和J′值指示该水域为中污染状态,而TLI值指示该水域仍为轻度富营养化状态。由此可以推断,综合营养状态指数对轻度水华的指示不灵敏。Margalef指数(d)对8次调查的淀山湖水体状况均指示为清洁型水体,说明该指数不适用于淀山湖夏秋季的水质评价,这可能与淀山湖夏秋季浮游植物物种数量较多有关。因此,对易出现水华的湖泊进行水生态健康评价,应采用多个指标进行综合评价。本研究8次调查淀山湖浮游植物的H′、J′和TLI平均值分别为3.18±0.84、0.59±0.14和56.0±3.9,结合水域中既出现大量铜绿微囊藻和尖尾蓝隐藻等富营养指示种,也出现金藻等寡污带物种,可以判定淀山湖夏秋季水体为轻-中度富营养化水平,总体呈现为轻污染状态。
淀山湖具备大规模、大面积暴发蓝藻水华的条件(由文辉,1997;程曦和李小平,2008;杨虹等,2010)。根据笔者近10年的跟踪监测,淀山湖在9月极易发生蓝藻水华,而引起蓝藻水华的物种是铜绿微囊藻,这与铜绿微囊藻适应能力强的生理特性、淀山湖夏秋季较高的水温及氮磷营养盐含量密切相关。蓝藻水华暴发是多项环境因子共同影响的结果,防治淀山湖蓝藻水华,根据本文研究结果可以采取以下措施:(一)严格控制易发水华期磷营养盐的入湖排放量,以降低水体总磷的浓度;(二)采取种植水草、放养滤食性鱼类等生态措施,以降低蓝藻的种间竞争优势;(三)结合水质理化因子、水文条件和气象条件等进行长期综合性研究,以弄清蓝藻水华发生机制。
参考文献
曹晶,田泽斌,储昭升,等,2022.太湖蓝藻水华暴发的氮磷控制阈值分析[J].湖泊科学,34(4):1075-1089.
陈光荣,钟萍,张修峰,等,2008.惠州西湖浮游动物及其与水质的关系[J].湖泊科学,20(3):351-356.
程曦,李小平,2008.淀山湖氮磷营养物20年变化及其藻类增长响应[J].湖泊科学,20(4):409-419.
邓春凯,2007.生物的指示作用与水环境[J].环境保护科学,33(4):114-117.
冯天翼,宋超,陈家长,2011.水生藻类的环境指示作用[J].中国农学通报,27(32):257-265.
郝雅宾,贺文芳,练青平,等,2021.金华地区浮游植物群落结构特征及其对水质的指示作用[J].水生态学杂志,42(6):70-76.
胡鸿钧,魏印心,2006.中国淡水藻类——系统、分类及生态[M].北京:科学出版社.
康丽娟,2020. 淀山湖富营养化进程及水生态效应研究[J].环境科学与管理,45(6):171-174.
李宏祥,田华,梁国康,2012.淀山湖富营养化现状及生态修复措施分析[J].水资源保护,28(3):83-87.
李为星,徐玉萍,王丽卿,等,2013.上海市城郊河道夏季浮游植物群落结构及水质评价[J].上海海洋大学学报,22(3):357-363.
刘建康,1999.高级水生生物学[M].北京:科学出版社.
阮仁良,王云,1993.淀山湖水环境质量评价及污染防治研究[J].湖泊科学,5(2):153-158.
钱迎倩,马克平,1994.生物多样性研究的原理与方法[M].北京:中国科学技术出版社:141-165.
沈韫芬,章宗涉,龚循矩,1990.微型生物监测新技术[M].北京:中国建筑工业出版社.
疏正宏,胡险峰,吴兆丹,等,2021. 长三角示范区跨界河湖治理长效机制探索与实践[J]. 水利发展研究,(12):48-54.
水利部水文局,长江流域水环境监测中心,2012.中国内陆水域常见藻类图谱[M].武汉:长江出版社.
王丽卿,施荣,季高华,等,2011.淀山湖浮游植物群落特征及其演替规律[J].生物多样性,19(1):48-56.
王明翠,刘雪芹,张建辉,2002.湖泊富营养化评价方法及分级标准[J].中国环境监测,18(5):47-49.
吴天浩,刘劲松,邓建明,等,2019.大型过水性湖泊——洪泽湖浮游植物群落结构及其水质生物评价[J].湖泊科学,31(2):440-448.
温明章,2003.饮用水水源地生物资源及其在水质保护中的作用[D].武汉:武汉大学.
徐春燕,俞秋佳,徐凤洁,等,2012.淀山湖浮游植物优势种生态位[J].应用生态学报,23(9):2550-2558.
许海,陈洁,朱广伟,等,2019.水体氮、磷营养盐水平对蓝藻优势形成的影响[J].湖泊科学,31(5):1239-1247.
颜天,周名江,錢培元,2002.赤潮异湾藻Heterosigma akashiwo 的生长特性[J].海洋与湖沼,33(2):209-214.
杨虹,由文辉,汪益嫔,等,2010.淀山湖夏季蓝藻时空分布研究[J].安徽农业科学,38(21):11411-11413.
杨丽,张玮,尚光霞,等,2018.淀山湖浮游植物功能群演替特征及其与环境因子的关系[J].环境科学,39(7):3158-3167.
杨柳燕,杨欣妍,任丽曼,等,2019.太湖蓝藻水华暴发机制与控制对策[J].湖泊科学,31(1):18-27.
由文辉,1995.淀山湖的浮游植物及其能量生产[J].海洋湖沼通报,(1):47-53.
由文辉,1997.淀山湖水生态系统的物质循环[J].中国环境科学,17(4):293-296.
于洋,彭福利,孙聪,等,2017.典型湖泊水华特征及相关影响因素分析[J].中国环境监测,33(2): 88-94.
张觉明,何志辉,1991.内陆水域渔业自然资源调查手册[M].北京:农业出版社.
张琪,蒋跃,靳士科,等,2016.上海市淀山湖春夏季浮游植物功能群组研究[J].华东师范大学学报(自然科学版),(6):54-64.
张运林,秦伯强,陈伟民,等,2003.太湖水体透明度的分析、变化及相关分析[J].海洋湖沼通报,(2):30-36.
章宗涉,黄祥飞,1991.淡水浮游生物研究方法[M].北京:科学出版社.
赵海超,王圣瑞,赵明,等,2011.洱海水体溶解氧及其与环境因子的关系[J].环境科学,32(7):1952-1959.
赵文,2005.水生生物学[M].北京:中国农业出版社.
中华人民共和国水利部,2005.中国水资源公报[M].北京:中国水利水电出版社.
朱海涛,湛若云,彭玉,等,2020.澜沧江源区浮游植物群落特征及其对水质的指示作用[J].水生态学杂志,41(1):16-21.
朱梦杰,汤琳,吴阿娜,等,2010.近10年淀山湖浮游植物群落结构特征及变化趋势探讨[J].上海环境科学,(4):153-156,173.
朱伟,谈永琴,王若辰,等,2018.太湖典型区2010-2017年间水质变化趋势及异常分析[J].湖泊科学,30(2):296-305.
朱旭宇,黄伟,曾江宁,等,2013.氮磷比对冬季浮游植物群落结构的影响[J].应用与环境生物学报,19(2):293-299.
况琪军,马沛明,胡征字,等,2005.湖泊富营养化的藻类生物学评价与治理研究进展[J].安全与环境学报,5(2):87-91.
Du H B, Chen Z N, Mao G Z, et al, 2019. Evaluation of eutrophication in freshwater lakes: A new non-equilibrium statistical approach[J]. Ecological Indicators, 102: 686-692.
Einsle U, 1983. Long-term changes in planktonic associations of crustaceans in Lake Constance and adjacent water and their effects on competitive situations[J]. Hydrobiologia, 106: 127-134.
Gibson G, Carlson R, Simpson J, et al, 2000. Nutrient criteria technical guidance manual lakes and reservoirs[M]. Washington D.C.: EPA.
Torres M A, Barros M P, Campos S C, et al, 2008. Biochemical biomarkers in algae and marine pollution: A review[J]. Ecotoxicology and Environmental Safety, 71(1): 1-15.
Paerl H W, 2014. Mitigating harmful cyanobacterial blooms in a human-and climatically-impacted world[J]. Life, 4(4): 988-1012.
Schanz F, Juon H, 1983. Two different methods of evaluting nutrent limitation of periphyton bioassays using water from the River Rhine and eight of its tributaries[J]. Hydrobiologia, 102: 187-195.
Sommer U, Gliwicz Z W, Lampert W, et al, 1986. The PEG-model of seasonal succession of planktonic events in fresh waters[J]. Archiv für Hydrobiologie, 106(4): 433-471.
Suikkanen S, Fistarol G O, Graneli E, 2005. Effects of cyanobacterial allelochemicals on a natural plankton community[J]. Marine Ecology Progress Series, 287: 1-9.
Suikkanen S, Laamanen M, Huttunen M, 2007. Long-term changes in summer phytoplankton communities of the open northern Baltic Sea[J]. Estuarine, Coastal and Shelf Science, 71: 580-592.
Tavernini S, Mura G, Rossetti G, 2005. Factors influencing the seasonal phenology and composition of zooplankton communities in mountain temporary pools[J]. International Review of Hydrobiology, 90:358-375.
Visser P M, Verspagen J M H, Sandrini G, et al, 2016. How rising CO2 and global warming may stimulate harmful cyanobacterial blooms[J]. Harmful Algae, 54: 145-159.
Warwick R M, 1981. The nematode/copepod ratio and its use in pollution ecology[J]. Marine Pollution Bulletin, 12(10): 329-333.
(責任编辑 熊美华)
收稿日期:2023-01-29 修回日期:2023-12-15
基金项目:上海市水务局科研项目(沪水科2021-10)。
作者简介:李强,1978年生,男,工程师,从事浮游生物方面的研究。E-mail:shlq1978@126.com

