蓝圆鲹分离蛋白酶解产物的制备及其抗大米淀粉老化特性
孙乐常, 孙小舒, 林端权, 陈玉磊,翁 凌, 缪 松,4, 曹敏杰*
(1. 集美大学海洋食品与生物工程学院,福建 厦门 361021;2. 集美大学,水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021;3. 大连工业大学,海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034;4. 爱尔兰农业部农业与食品发展局Teagasc 食品研究中心,爱尔兰 科克 999014)
婴幼儿辅助食品(辅食)是除母乳外,为满足婴幼儿营养与生长发育需要而添加的其他食物[1]。大米作为谷物类辅食——婴幼儿米粉的主要原料,富含淀粉、蛋白质及维生素等营养物质,是婴幼儿首选添加的辅食[2]。然而大米淀粉经烹饪糊化后易迅速老化,老化淀粉不仅会使食品质地和味道变差,降低产品质量,还会降低其消化吸收率,这可能为婴幼儿脆弱的消化系统带来负担[3]。国内外研究显示,通过向淀粉中添加蛋白质或蛋白水解物,可以一定程度上延缓或抑制淀粉的老化行为,从而可能减少婴幼儿米粉类食品的品质劣化。肖瑜等[4]研究了不同蛋白质对大黄米淀粉老化的抑制机制,发现淀粉-蛋白质能够由氢键作用而紧密相连,而且蛋白质的加入可以降低体系老化焓,抑制大黄米淀粉重结晶,从而延缓其老化。Niu 等[5]发现猪血浆蛋白水解物可以与直链淀粉相互作用,减少玉米淀粉间的氢键结合,对抑制淀粉短期老化具有重要作用。Niu 等[6]使用复合蛋白酶制备米糠蛋白水解物,发现其能够分散于糊化大米淀粉分子之间,阻止氢键形成,具有抑制大米淀粉短期和长期老化的作用。
海洋鱼类蛋白具有营养价值高、易消化等优点,是理想的优质蛋白资源。将鱼类蛋白应用于婴幼儿米粉类产品中,不仅能赋予产品更丰富的风味,还能提高产品的营养价值,满足婴幼儿对优质蛋白摄入的营养要求。为了进一步提高鱼类蛋白的可应用性,国内外研究学者通过等电点沉淀法制备分离蛋白,不仅有效回收鱼肌肉中的优质蛋白,还可去除脂肪、骨刺等杂质[7]。然而,制备获得的鱼类分离蛋白经干燥后溶解性差,直接添加进米粉,容易发生絮凝、分层等现象,必须进行一定的改性以提高溶解性。针对这一问题,目前国内外主要采用单酶或多酶酶解的方法进行改性。Alahmad 等[8]使用无花果蛋白酶对鳙(Hypophthalmichthys nobilis)蛋白酶解改性,发现改性后其溶解度在所有水解度和pH 范围内可达到84.88%~95.48%,极大提高了鳙蛋白的可应用性。Hemker 等[9]对尼罗罗非鱼(Oreochromis niloticus)副产物分离蛋白进行压力辅助酶解改性,显著改善了酶解产物的溶解性、乳化性和抗氧化活性。Yathisha 等[10]使用碱性蛋白酶酶解沙带鱼(Lepturacanthus savala)蛋白,发现酶解能够显著影响蛋白质二级结构,进而提高酶解产物的溶解性、持油力、ACE-Ⅰ抑制和DPPH 自由基清除活性。蓝圆鲹(Decapterus maruadsi)又称巴浪鱼,是我国重要的低值海洋经济鱼类之一。2022 年蓝圆鲹全国捕捞总量达39.5 万t,其中福建省捕捞量19.0 万t,居全国首位[11]。前期研究发现利用酶解可有效提高蓝圆鲹分离蛋白的溶解性、乳化性、起泡性等功能特性,且溶解度随酶解程度的增加而增加[12]。
本实验以蓝圆鲹分离蛋白为对象,以可溶性蛋白回收率(氮溶指数)为酶解改性的评价指标,采用响应面法优化酶解工艺参数,将得到的酶解产物按不同添加量添加于大米淀粉中,以研究酶解产物对大米淀粉短期老化行为的影响,旨在为水产蛋白在食品配料蛋白中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
冰鲜蓝圆鲹(每条约重150 g)购于厦门市高崎水产批发市场。大米淀粉购于无锡金农生物科技有限公司。木瓜蛋白酶、风味蛋白酶、碱性蛋白酶、中性蛋白酶,广西南宁庞博生物工程有限公司。考马斯亮蓝R-250,兴隆达公司。色谱级甲醇、乙腈,美国Fisher Chemical 公司;标准牛血清白蛋白(BSA),美国Sigma 公司。
1.2 仪器与设备
Avanti J-26S XP 大型台式高速冷冻离心机,美国Beckman 公司。759 s 紫外可见分光光度计,上海棱光技术有限公司。GF-1260 高效液相色谱仪,美国Agilent 公司。Mini-PROTEAN 蛋白质电泳装置,美国Bio-Rad 公司。Alpha 1-4 LDplus 冷冻干燥机,德国Christ 公司。Phenom Pro 台式扫描电子显微镜,荷兰Phenom-World Pr 公司。DHR-2流变仪、Q2000 差示扫描量热仪,美国TA 仪器公司。
1.3 实验方法
提取蓝圆鲹分离蛋白 参考孙乐常等[8]的方法,采用碱溶解-等电点沉淀法制备蓝圆鲹分离蛋白。所有操作均在4 ℃进行。取蓝圆鲹背部肌肉,加入8 倍体积冰水组织捣碎,调节pH 至11.0,搅拌后离心回收上清液,继续调节pH 至5.5,离心回收沉淀。得到的沉淀加入一定量NaHCO3调节pH 至中性,于-20 ℃保存备用。实验过程中操作人员严格遵守实验动物伦理规范,并按照集美大学科技伦理委员会制定的规章制度执行。
蓝圆鲹分离蛋白酶解物的制备 将蓝圆鲹分离蛋白与一定体积超纯水混合并均质,蛋白悬浊液在酶解温度下预热20 min,在不同酶解条件下进行反应。酶解结束后沸水加热10 min 灭酶,离心回收蓝圆鲹分离蛋白酶解上清液(BPIH),低温保存备用。
氮溶指数(NSI)的测定 参考Sukkhown等[13]的方法,并做一定修改,具体:取100 μL 分离蛋白悬浊液,加入2 倍体积蛋白溶解液[20 mmol/L Tris-HCl (pH 8.0),含8 mol/L 尿 素,2%SDS] ,完全溶解后得到总蛋白样品。将酶解上清液和总蛋白样品稀释一定倍数后,参考Lowry 等[14]的方法测定蛋白含量,以牛血清蛋白(BSA)绘制标准曲线。NSI (%)计算公式:
式中,m1为酶解上清液样品的蛋白含量(mg/mL);m2为酶解前样品的总蛋白含量(mg/mL)。
水解度的测定 响应面优化后酶解产物的水解度(DH,%)参考Nielsen 等[15]的OPA 法进行测定,并略作修改。以0.1 mg/mLL-丝氨酸溶液为标准品,取400 μL 待测样品与3 mL OPA 试剂混匀,室温下避光反应2 min 后测量其在340 nm下的吸光度,以去离子水为空白对照。
式中,Asample、Astandard和Ablank分别表示酶解上清液样品、标准溶液样品和空白对照在340 nm 的吸光值;V表示样品体积(L);N表示稀释倍数;X表示样品质量(g);P表示样品中所含蛋白质的质量分数;β查表得0.40;α查表得1.00;h表示每克蛋白质中断裂的肽键数(mmol/g);htot表示原料总肽键数,查表得8.6 mmol/g。
筛选最适用酶 本实验共选用4 种蛋白酶(木瓜蛋白酶、风味蛋白酶、碱性蛋白酶和中性蛋白酶),以酪蛋白为底物测定蛋白酶活性。此步骤固定酶解反应条件为酶底比5 000∶1 (U/g)、反应时间4 h、料液比1∶4,酶解温度和pH 均控制为蛋白酶最适条件(表1)。以酶解上清液氮溶指数评价不同酶的酶解效果,筛选出最合适的酶进行酶解工艺优化。

表1 4 种蛋白酶的活性及最适酶解条件Tab. 1 Enzymatic activities of the four proteases and their optimal hydrolysis conditions
单因素试验 设置试验初始酶解条件为酶底比5 000∶1 (U/g)、料液比1∶4、酶解温度50 ℃、酶解pH 6.0、酶解时间4 h。依次以酶底比(1 000∶1、3 000∶1、5 000∶1、7 000∶1、9 000∶1、11 000∶1 U/g)、料液比(1∶2、1∶3、1∶4、1∶5、1∶6)、酶 解 温 度(35、40、45、50、55、60、65 ℃)、酶解pH (5.0、5.5、6.0、6.5、7.0、7.5、8.0)和酶解时间(1、2、3、4、5、6 h)为单一变量,考察不同条件对酶解物NSI 值的影响。
响应面法优化 在单因素试验基础上,选择料液比(A)、酶解温度(B)和酶解pH (C)为响应因素,酶解物NSI 值(Y)为响应值,以Box-Benhnken 设计原理进行响应面分析试验设计,因素和水平见表2。运用Design Expert 12 软件拟合因素与响应值之间的函数关系,分析回归方程从而预测最优工艺参数。
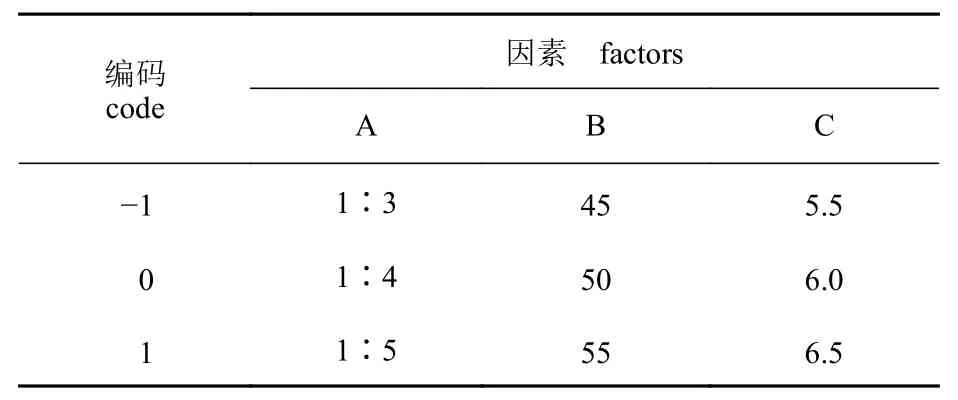
表2 响应面试验因素与水平设计表Tab. 2 Response surface experiment factor and levels
酶解物分子质量分析 采用高效凝胶过滤色谱法测定酶解产物的分子质量分布,参考Wu等[16]的方法,并作适当修改。使用TSK gel G2000 SWXL (φ7.8 mm×300 mm)色谱柱,检测波长为220 nm,流速设定为0.5 mL/min,柱温为25 ℃,上样量10 μL。结果利用GPC offline 软件进行分析,计算得到酶解物不同分子质量分布比例。
Tricine-SDS-PAGE 参考Schägger[17]的方法进行Tricine-SDS-PAGE 分析。将未酶解和酶解后样品的蛋白含量稀释至1 mg/mL,经SDS 化后上样进行电泳。
酶解物冷冻干燥 以响应面法优化条件酶解蓝圆鲹分离蛋白,离心后回收酶解上清液。上清液预冻后真空冷冻干燥48 h,粉末样品于低温干燥处保存备用。
淀粉糊凝沉性测定 参照赵小梅等[18]的方法并做适当修改,取0.3 g 大米淀粉(RS)悬浮在30 mL 超纯水中,而后将3%、6%和9%的BPIH(以淀粉干基计,质量分数)添加至淀粉悬浊液中,沸水加热20 min 糊化。将淀粉糊转移至40 mL 黑盖玻璃瓶中,30 ℃下静置,每隔1 h 记录上层清液高度(H1)和淀粉糊总高度(H0),共记录8 h。用上清液的体积分数随时间的变化来绘制曲线,从而表示淀粉糊的凝沉性,公式:
式中,H1为每小时上清液高度(cm);H0为黑盖玻璃瓶中淀粉糊总高度(cm)。
淀粉糊动态黏弹性测定 参考Niu 等[5]的方法并做改进,使用40 mm 平行铝板进行扫描,间隙为1.0 mm。制备质量分数为5%的RS 悬浊液,分别加入淀粉干基重量的3%、6%和9%BPIH,漩涡振荡5 min 后,立即转移至流变仪帕尔贴板,样品边缘用硅油液封以防止水分蒸发。测量开始前,设置帕尔贴板温度为95 ℃,加热20 min 使淀粉悬浊液充分糊化,之后立即将温度降至4 ℃。在4 ℃条件下,将储能模量(G′)、损耗模量(G″)和损耗角正切(tanδ)作为时间的函数记录3 h。恒定应变和恒定频率分别设置为5%和1 Hz (线性黏弹区范围)。
热力学性质测定 利用差示扫描量热仪(DSC),在超高纯氮气环境下分析RS 和RS-BPIH的热转变温度进行扫描。参考Niu 等[5]的方法,具体操作:称取3 mg RS 于铝坩埚中,加入不同浓度BPIH 溶液6 μL,使BPIHs 终浓度为3%、6%和9% (淀粉干基,质量分数)。所有铝坩埚在室温下密封12 h 以充分水合。在30~90 ℃,以10 ℃/min的恒定加热速率进行热扫描,执行糊化过程,记录热转变温度(T0、Tp、Tc)和糊化焓(ΔHg)。糊化后的样品在4 ℃下储存5 h,以加速淀粉老化。然后,10 ℃/min 的恒定速率从30~90 °C 再次扫描老化样品,记录热转变温度和老化焓(ΔHr)。
老化淀粉的SEM (scanning electron microscope)分析 参考董慧娜等[19]的方法并作适当修改。配制质量分数为7%的RS 悬浊液,分别加入淀粉干基重量的3%、6%和9% BPIH,糊化后于4 ℃放置10 h,然后取出进行真空冷冻干燥。取冻干的老化淀粉样品,真空条件下喷金75 s 后,于电镜中放大1 000 倍观察微观结构。
1.4 数据分析
实验采用Design-Expert 12 软件进行响应面试验设计与分析,采用Excel 和Origin 2021 软件绘图,采用SPSS 17.0 软件的Duncan 氏检验进行差异显著性分析(P<0.05 为显著差异)。实验数据均重复3 次,数据以平均值±标准偏差表示。
2 结果
2.1 最适用酶的筛选
经风味蛋白酶、碱性蛋白酶、中性蛋白酶和木瓜蛋白酶酶解后,其产物NSI 值分别为51.50%±0.81%、66.71%±1.20%、65.11%±0.68%和69.37%±0.36%,其中木瓜蛋白酶为最高值,碱性蛋白酶和中性蛋白酶次之,风味蛋白酶最低 (图1-a)。与未酶解的对照组相比,酶解4 h 后,木瓜蛋白酶酶解的蛋白剩余量最少(图1-b),表明酶解最充分,与图1-a 结果一致。综合以上结果,选择木瓜蛋白酶进行后续的工艺优化。
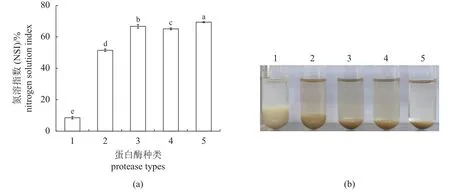
图1 不同酶酶解的NSI (a)与酶解样品(b)1. 对照组,2. 风味蛋白酶,3. 碱性蛋白酶,4. 中性蛋白酶,5. 木瓜蛋白酶。不同字母表示差异显著(P<0.05),NSI. 氮溶指数,下同。Fig. 1 The NSI (a) and enzymolysis samples (b) hydrolysed by different proteases 1. control group, 2. flavourzyme, 3. alcalase, 4. neutral protease, 5. papain. Different letters indicate significant differences (P<0.05), NSI. nitrogen solution index; the same below.
2.2 单因素试验
对酶底比、料液比、温度、酶解时间和pH进行单因素试验。如图2-a 所示,NSI 值随着加酶量的增加而呈现上升趋势,但在酶底比为5 000∶1 (U/g)之后,NSI 值则基本保持稳定。为了控制成本,酶底比选择5 000∶1 (U/g)。

图2 不同因素对NSI 的影响(a) 酶底比,1. 1 000∶1,2. 3 000∶1,3. 5 000∶1,4. 7 000∶1,5. 9 000∶1;(b) 料液比;(c) 酶解温度;(d) 酶解pH;(e) 酶解时间。不同字母表示差异显著(P<0.05)。Fig. 2 Influence of different factors on NSI(a) enzyme substrate ratio, 1. 1 000∶1, 2. 3 000∶1, 3. 5 000∶1, 4. 7 000∶1, 5. 9 000∶1; (b) solid-liquid ratio, (c) enzymolysis temperature, (d)enzymolysis pH, (e) enzymolysis time. Different letters indicate significant differences (P<0.05).
随着料液比的增加,NSI 值缓慢增加并趋于平缓(图2-b)。在料液比1∶4 时达到NSI 值拐点,考虑到经济成本,确定料液比为1∶4。
酶解温度对NSI 值的影响如图2-c 所示,NSI 值随温度的增加而先增加后略微降低,在50 ℃时达到最大值71.57%。因此,确定最佳酶解温度为50 ℃。
pH 6.0 时酶解产物的NSI 值达到最大值72.04% (图2-d),显著高于其他条件(P<0.05),所以选择pH 6.0 为最适酶解pH。
酶解时间结果显示,NSI 值随酶解时间的延长而逐渐增加并趋于平稳,在3 h 时达到最大值70.97%,所以选择最佳酶解时间为3 h (图2-e)。
2.3 响应面优化试验
响应面试验结果 响应面试验遵循Box-Benhnken 设计原则,在酶底比为5 000∶1 (U/g)、酶解时间3 h 的条件下,考察料液比(A)、温度(B)和pH (C)对蓝圆鲹分离蛋白酶解物NSI (Y)的影响,响应面试验设计及结果如表3 所示。
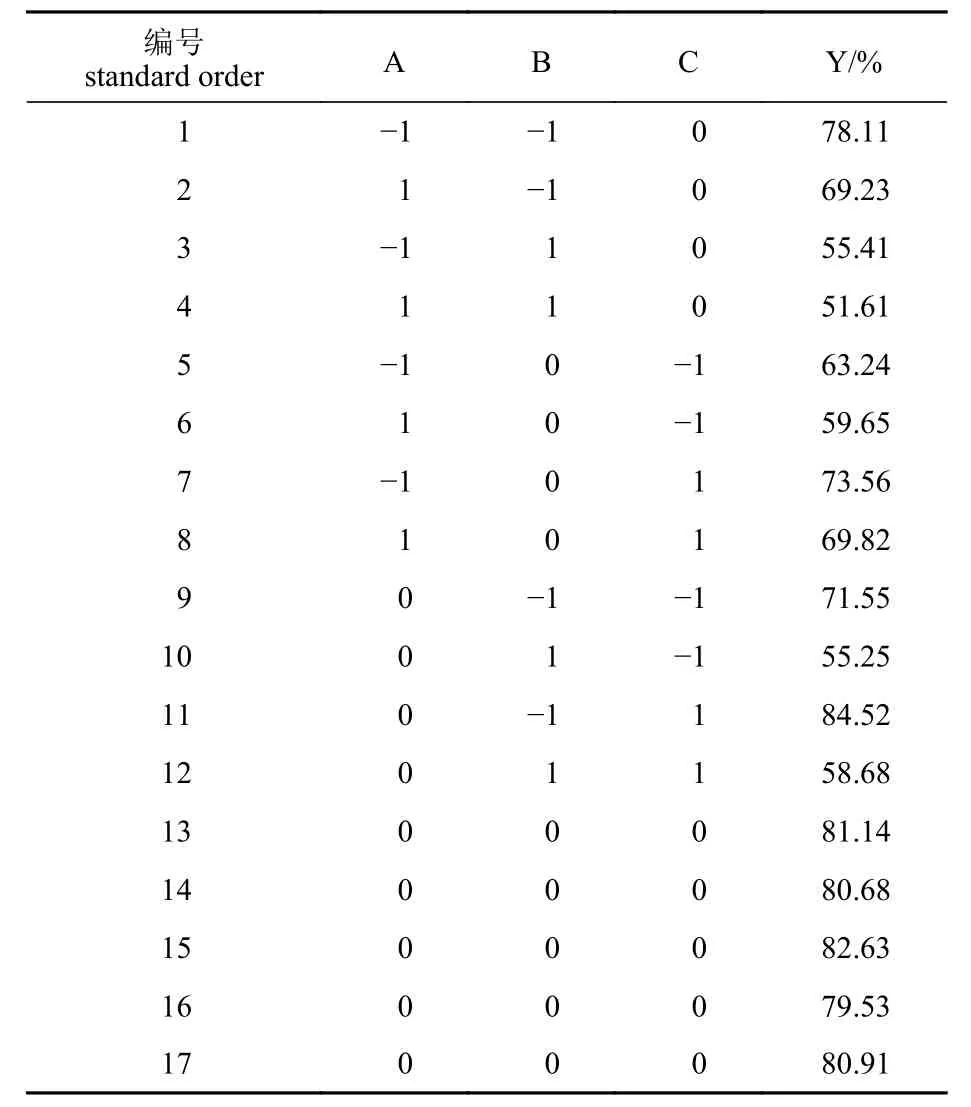
表3 响应面试验设计及结果Tab. 3 Response surface experimental design and results
回归模型拟合 运用Design Expert 12 软件对表3 结果进行多元回归拟合,建立NSI (Y)对料液比(A)、酶解温度(B)、酶解pH (C)和酶解时间(D)的多元二次回归方程:
方差分析 回归模型方差分析如表4 所示,模型F值为136.51,F值由于噪声而引起的可能性仅为0.01%,回归模型P<0.000 1,二者表明该模型是显著的。模型失拟项F值为1.64,意味着样本之间的变化相对于纯误差并不显着;失拟项P=0.315 2>0.05 为不显著,对模型是有利的。R2接近1 时,模型可以更好地拟合实际实验数据。本研究模型决定系数R2为0.994 3,这表明99.43%的行为变化可由拟合模型解释,拟合度较高。预测R2=0.946 1 与调整R2=0.987 1 差异小于0.2,二者合理一致。信噪比为34.01,大于临界值4.0,表明信号充足,模型合理、可用。

表4 响应面模型方差分析Tab. 4 Response surface model analysis of variance
自变量影响显著性 根据表4 可知,A、B、C 对NSI 值有极显著影响(P<0.01),且由F值可以确定,三个因素对模型的影响显著性顺序为温度(B)> pH (C)>料液比(A)。交互项中,仅有温度/pH (BC)交互作用极显著(P<0.01),其余均无显著影响(P>0.05)。
因素交互作用分析 图3 为根据上述的多元二次回归方程及模型方差分析得到的拟合模型响应曲面图和等高线图,其形状可反映交互作用的强弱,椭圆表示交互作用显著,圆形则表示不显著[20]。由图可知,温度和pH 的交互作用对NSI 有显著影响,而料液比与温度、料液比与pH的交互作用对NSI 值的影响不显著,与表4 结果一致。
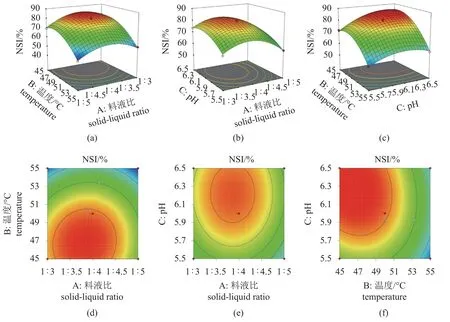
图3 料液比、温度和pH 交互作用的响应面图和等高线图Fig. 3 Response surface and contour lines of the interactions between solid-liquid ratio, temperature and pH
响应面优化工艺参数及验证 由回归模型预测的蓝圆鲹分离蛋白最优酶解工艺参数为料液比1.00∶3.81、酶解温度46.36 ℃、酶解pH 6.30,模型得到的NSI 预测值为86.37%。考虑到实际操作的可实施性,在酶底比为5 000∶1(U/g)、酶解时间3 h、料液比1.00∶3.80、酶解温度46.40 ℃、酶解pH 6.30 条件下进行验证试验,通过3 组平行试验,得到BPIH 的NSI 平均值为85.41%±0.82%,与预测值接近,表明拟合模型可靠。在此酶解条件下得到的BPIH 水解度为21.62%。
2.4 分子质量分析
利用高效液相色谱法和Tricine-SDS-PAGE 分析BPIH 的分子质量分布,由图4-a 可见,BPIH的出峰时间主要集中在14~30 min。BPIH 为分子质量小于3 000 u 的短肽,其中小于1 000 u 的肽占79.94%,小于500 u 的肽占56.44% (表5),说明在响应面优化的酶解条件下,蓝圆鲹分离蛋白被充分酶解为小分子的低聚寡肽,这与图4-b 的Tricine-SDS-PAGE 的结果一致。
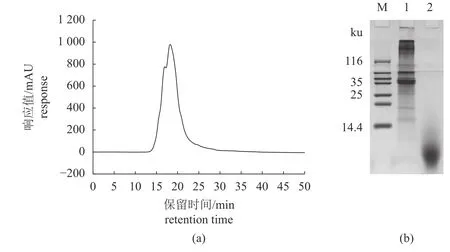
图4 BPIH 分子质量分析(a) BPIH 的高效液相色谱图;(b) 蓝圆鲹分离蛋白及BPIH 的Tricine-SDS-PAGE 分析,M.标准蛋白Marker,1.未酶解,2.酶解后。Fig. 4 Molecular weight analysis of BPIH(a) HPLC of BPIH; (b) Tricine-SDS-PAGE analysis of the blue round scad protein isolate and BPIH, M. standard protein Marker, 1. unenzymatic digestion, 2. after enzymatic digestion.
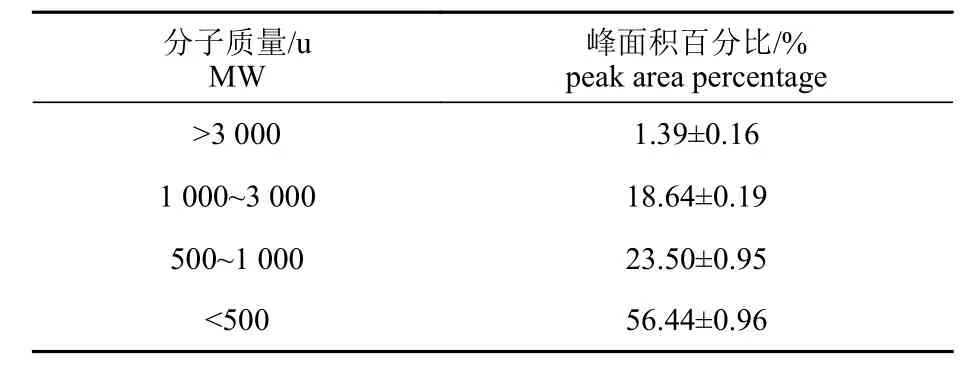
表5 BPIH 分子质量分布比例Tab. 5 Molecular weight distribution ratio of BPIH
2.5 淀粉糊凝沉性
淀粉糊随着时间的延长而逐渐凝沉,在2~5 h 时凝沉速率较快,5 h 后逐渐趋于平稳,在凝沉8 h 后,所有样品上清液体积比均达到50%以上(图5)。RS-BPIH 样品上清液体积分数在所有时间下均低于RS 样品,并且随着BPIH 浓度的增加,上清液体积分数逐渐降低。

图5 不同浓度BPIH 对大米淀粉糊凝沉性的影响(a) 淀粉糊凝沉性随时间的变化;(b) 淀粉糊静置0 h 和8 h 的凝沉情况,1~4 依次表示RS、RS-3% BPIH、RS-6% BPIH、RS-9% BPIH。Fig. 5 Effects of different concentrations of BPIH on the retrogradation of rice starch paste(a) changes in the retrogradation of starch pastes over time; (b) retrogradation of starch paste after standing for 0 h and 8 h, 1-4 indicates RS, RS-3%BPIH, RS-6% BPIH, RS-9% BPIH, respectively.
2.6 淀粉糊动态黏弹性测定
淀粉糊化后立即降温至4 ℃进行动态时间扫描,以分析淀粉糊在3 h 短期老化过程中的黏弹性变化。RS 的G′在3 h 内持续增长,其中最初1 h 内快速上升,而后增速逐渐减慢并趋于平稳(图6-a)。与RS 相比,RS-BPIH 的G′增长趋势与RS 相似,但均小于RS,且初始G′随着BPIH 添加量的增加而逐渐降低,G′的增长斜率逐渐变得平缓。RS 和RS-BPIH 的tanδ<1,随时间的增加而降低后逐步趋于平稳(图6-b),说明G′>G″,样品弹性占主导[21]。另外,RS-BPIH 的tanδ 值高于RS,并且随着BPIHs 添加量的增加而增加,说明RSBPIH 中的弹性组分较RS 更少,与G′的变化规律一致。
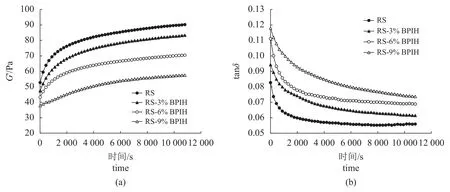
图6 不同浓度BPIH 对老化淀粉G′(a)和tanδ(b)的影响Fig. 6 Effects of different concentrations of BPIH on G′ (a) and tanδ (b) of retrograded starch
2.7 DSC 分析
所有样品在70~80 ℃均可观察到明显的吸热峰,随着BPIH 浓度的增加,峰值温度(Tp)逐渐升高,糊化焓值(ΔHg)逐渐降低(图7-a)。在加入9% BPIH 时,峰值温度从RS 的(69.99±0.26) ℃提高到(74.43±0.39) ℃,而糊化焓从(4.05±0.05) J/g降低至(3.11±0.11) J/g (表6)。
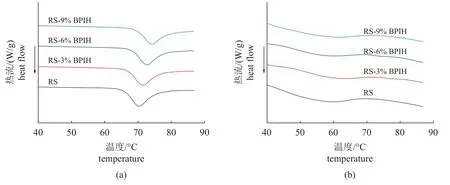
图7 不同浓度BPIH 对糊化淀粉(a)和老化淀粉(b)热分析图谱的影响Fig. 7 Effects of different concentrations of BPIH on the thermal analysis patterns of gelatinized starch (a) and retrograded starch (b)

表6 不同浓度BPIH 对糊化淀粉和老化淀粉转变温度和转化焓的影响Tab. 6 Effects of different concentrations of BPIH on the transformation temperature and enthalpy of gelatinized starch and retrograded starch
将糊化后的淀粉样品在4 ℃下保存5 h 后,再次执行DSC 升温程序,与糊化过程的趋势不同,老化淀粉中只观察到一个轻微的吸热峰(图7-b)。对照组RS 吸热峰出现在37.73~67.30 ℃,峰值温度为(57.15±0.27) ℃,老化焓为(1.16±0.08) J/g (表6)。添加BPIH 后显著增加了老化RS 的T0,降低了Tp、Tc和老化焓(P<0.05)。
2.8 老化淀粉SEM 分析
图版为扫描电镜观察的RS 与RS-BPIH 经4 ℃10 h 短期老化的微观结构。老化的RS 与RSBPIH 具有清晰的三维凝胶网络(图版)。其中对照组RS 孔洞细小,明显形成了更加致密的凝胶网络,出现老化的典型状态(图版-1);而加入BPIH后,凝胶网络的孔隙随着BPIHs 添加量的增加而增加(图版-2~4)。
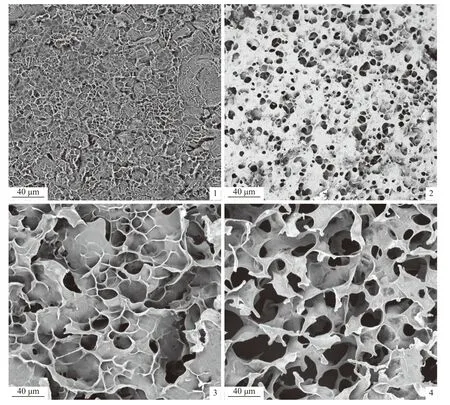
图版 大米淀粉-蓝圆鲹分离蛋白酶解粉复合物短期老化扫描电镜图1~4 依次表示短期老化的RS、RS-3% BPIH、RS-6% BPIH、RS-9% BPIH。Plate Image of short-term retrogradation of RS and RS-BPIH 1-4 in order indicates RS, RS-3% BPIH, RS-6% BPIH, RS-9% BPIH for short-term retrogradation.
3 讨论
3.1 筛选最适用酶
NSI 是通过测定蛋白质在溶液中的含量来评价蛋白质溶解度的方法,在酶解反应中具有与水解度相同的变化趋势[13]。经过4 种不同蛋白酶酶解后,产物NSI 值出现显著差异(P<0.05),说明不同酶对蓝圆鲹分离蛋白酶解效果不同。高NSI的蛋白质或肽显示出良好的溶解性,因此木瓜蛋白酶酶解产物具有相对更好的溶解性,即为4 种蛋白酶中最适合酶解蓝圆鲹分离蛋白的一种[13]。
不同蛋白酶酶解效果的差异可能归因于蛋白底物的氨基酸组成和不同蛋白酶酶切位点的差异[22]。风味蛋白酶是一种来自米曲霉发酵的内切蛋白酶和外肽酶混合物,主要从多肽链末端切割氨基酸,酶解可用的-NH2端数量有限,所以可能造成酶解速率相对缓慢[23]。碱性蛋白酶、中性蛋白酶和木瓜蛋白酶均属于内切酶,具有广泛的催化活性,其中碱性蛋白酶对羧基端为芳香族或强疏水性氨基酸残基的肽键有着更高的水解优先性,而木瓜蛋白酶的酶解位点主要为赖氨酸、精氨酸和甘氨酸的-COOH 端[24-25]。孙乐常等[7]通过比较不同方法制备的蓝圆鲹分离蛋白的性质差异,并对分离蛋白氨基酸组成进行分析,发现碱溶解-等电点沉淀法提取的分离蛋白中赖氨酸、精氨酸和甘氨酸具有较高含量,因此相比之下,木瓜蛋白酶更适合酶解蓝圆鲹分离蛋白,故选择其进行后续响应面试验优化。
3.2 单因素试验及响应面优化
在单因素试验中,木瓜蛋白酶添加量和料液比是工艺成本的可控因素。加酶量较小时,蛋白底物相对过量,随着加酶量增加,更多底物被酶解为可溶性短肽,NSI 值随之增加。当继续提高加酶量,底物中可酶解位点便趋于饱和,NSI 值增速降低[26]。由图2-a 可知,本实验木瓜蛋白酶最适酶底比为5 000∶1 (U/g)。料液比方面,当料液比较低时,体系中蛋白底物浓度过高,较少的液体含量限制了酶与蛋白质的相互作用,导致酶解不充分[27]。随着水量增加,反应体系流动性提高,但水量的持续增加并不会对NSI 值带来持续的积极影响。因此,为了节约成本,选择最佳料液比为1∶4 (图2-b)。酶解温度过低及过高均会影响蛋白酶的作用效果,当温度为50 ℃时,木瓜蛋白酶达到最适作用温度(图2-c)。pH 变化可能会导致蛋白酶空间构象的变化,从而降低酶活性,并影响酶与底物的结合状态,因此过酸或过碱的条件均不利于酶解反应进行[28]。本实验中选择pH 6.0 为木瓜蛋白酶的最适pH (图2-d)。当酶解反应时间为1~3 h 时,反应速率与时间正相关,NSI 值随酶解时间的延长而逐渐增加;之后随着时间的延长,NSI 值增势渐近稳定,3~6 h 内无显著增加(P>0.05),所以酶解时间选择3 h (图2-e)。
考虑到实际应用中的经济成本,本研究固定酶底比为5 000∶1 (U/g),酶解时间3 h,使用Design Expert 12 软件分析料液比、温度和pH 的因素交互作用。软件拟合的回归模型P<0.000 1,表明该模型显著;失拟项P=0.315 2>0.05 为不显著,可用该回归方程代替试验真实点对实验结果进行分析[29]。分别将回归模型料液比(A)、温度(B)、pH (C)因素中的一个固定在0 水平,可以得到另外两个因素的交互作用对模型的影响关系[26]。由响应曲面图和等高线图可见,将料液比固定于1∶4 的条件下,温度取任意水平时,NSI 值随着pH 的升高而逐渐增大。当pH 不变时,NSI 值随着温度的降低而增加,二者交互作用显著(图3)。料液比与温度、料液比与pH 的交互作用对NSI值的影响不显著,与表4 结果一致。响应面模型预测的最优工艺参数为料液比1.00∶3.81、酶解温度46.36 ℃、酶解pH 6.30,在该条件下得到的BPIH 实际NSI 值为85.41%±0.82%,与预测值接近。
3.3 BPIH 的抗淀粉老化特性
在以上结果的基础上,将冷冻干燥后的BPIH与大米淀粉按不同比例混合,考察其对大米淀粉短期老化的影响。淀粉老化是指经过糊化的淀粉在室温或低于室温放置后,出现的不透明甚至凝结而沉淀的现象[30]。这是由于直链淀粉分子间依靠氢键作用形成较大的颗粒或束状结构,当体积增大到一定程度时,就形成了沉降[18]。这种淀粉分子链间的相互吸引与排列,重新聚集成致密、高度结晶化、不溶性的淀粉分子微晶束的过程,即为淀粉的老化过程[17,31-35]。加入BPIH 能明显减少糊化RS 上清液析出(图5),凝沉性减弱,表明淀粉稳定性有所提高,即添加BPIH 可以有效抑制淀粉的老化现象[31]。
动态黏弹性测定中,储能模量(G′)代表糊化淀粉分子网络结构的弹性特性,是监测淀粉老化进程的重要指标[33]。损耗模量(G″)表示淀粉糊老化过程中的黏性行为变化。损耗因子(tanδ)为G″与G′的比值,表示物质变形所损失能量的比例,是反映样品黏弹性行为的重要指标[21]。RS 与RSBPIH 在实验时间内G′持续上升(图6-a),tanδ均小于1 且大幅降低(图6-b),表明所有样品均发生了淀粉老化。Niu 等[5]在研究猪血浆蛋白水解物时也得出了相似的实验结果。这一现象与直链淀粉的聚集密切相关。在淀粉老化的初期,主要发生的是和直链淀粉有关的短期老化,由直链淀粉的快速重结晶引发一系列重排,聚集在一起的分子形成了能让淀粉凝胶弹性更强的三维网状结构[4-5,19]。Dun 等[34]还提出,G′随时间延长持续增加,表明交联直链淀粉网络的形成是冷却后淀粉老化的典型特征。加入BPIH 后,大米淀粉的初始G′随着BPIH 添加量增加而逐渐降低,G′增长斜率也逐渐变得平缓(图6-a);tanδ随着BPIHs 添加量的增加而增加(图6-b)。这些结果表明,添加BPIH 抑制了直链淀粉的重结晶,延缓了直链淀粉凝胶网络的形成,证明BPIH 具有抑制大米淀粉短期老化的作用,且该作用存在剂量相关性[5]。
DSC 分析中,加入BPIH 改变了RS 的糊化性质,糊化峰值温度(Tp)升高,焓值(ΔHg)降低(图7-a)。这一现象可能是淀粉的不完全糊化所导致。淀粉的水分含量对其糊化过程有重要影响,含水量越多,淀粉越易糊化[35]。蓝圆鲹分离蛋白经充分酶解后,蛋白分子链断裂、伸展,被掩埋的亲水侧链得以暴露。当把酶解产物加入淀粉中时,这些亲水侧链与淀粉竞争结合水分,减少了淀粉的糊化水量,限制了淀粉与水的相互作用,从而导致淀粉的不完全糊化,因此吸热峰值温度向更高温度方向移动[5,35-36]。淀粉的不完全糊化改变了微晶与非晶态基体之间的作用力,熔化需要较低的热能[5],所以加入BPIH 后糊化焓显著降低(P<0.05)。将经过糊化的淀粉样品在4 ℃下短期老化5 h,再次进行DSC 分析,发现添加BPIH 后增加了老化RS 的T0,降低了Tp、Tc和老化焓(ΔHr) (图7-b)。淀粉老化形成重结晶,此时须外加能量,才能熔化淀粉分子微晶,因此老化后的淀粉在DSC 中会出现吸热峰,且淀粉老化程度越大,吸热峰越大,熔融焓也越高[32,37]。因此Tp和ΔHr 的降低表明BPIH 抑制了RS 在4 ℃储存期间微晶结构的形成,阻碍RS 的短期老化行为,且BPIH 浓度越高,抑制作用越明显。BPIH 能够抑制RS 短期老化可能是由于其具有活性多羟基,它们可能与直链淀粉形成氢键,从而阻断了淀粉分子间及与水分子间的氢键作用,抑制重结晶[6,32]。此外,ΔHr 的降低还可能归因于RS 不完全糊化,导致淀粉链的流动性受限[5]。淀粉老化过程需要水分参与,水分不仅为淀粉老化提供液体环境,而且参与淀粉分子重结晶[37]。添加BPIH 会与RS竞争吸附水分[35],降低淀粉链的流动性,从而阻碍RS 的短期老化。
使用SEM 观察淀粉短期老化后的微观结构,淀粉凝胶网络的孔隙随着BPIH 添加量的增加而增加(图版)。淀粉老化后吸水能力下降,水分析出散失[32]。孔洞的形成是冷冻干燥过程将水分冻结为冰晶升华所致,因此冻干前淀粉样品持水能力越强,则冻干后样品孔洞越多[19]。加入BPIH后凝胶网络孔隙增加,说明BPIH 提升了糊化淀粉保留内部水分的能力,同时BPIH 还可能限制了淀粉分子间的聚集,抑制了凝胶网络形成,一定程度上延缓了大米淀粉的短期老化。
综上所述,利用响应面法优化木瓜蛋白酶酶解蓝圆鲹分离蛋白的工艺参数,制备得到的BPIH 具有抗淀粉老化特性,能够显著抑制或延缓RS 的短期老化,且该作用存在剂量正相关性。这可能是由于BPIH 抑制了淀粉分子内和分子间氢键的形成,限制淀粉分子聚集,阻碍了直链淀粉的重结晶。因此,蓝圆鲹分离蛋白酶解物与大米淀粉的复配组合,既丰富了大米淀粉营养价值,又使其具备了抗淀粉老化能力。本研究可为蓝圆鲹分离蛋白酶解物作为食品蛋白配料提供理论参考。
(作者声明本文无实际或潜在的利益冲突)

