美洲鳗鲡腺瘤病毒(AEAdoV)普通PCR 和SYBR Green I实时荧光定量PCR 检测方法的建立及应用
孔文迪, 陈 曦, 杨金先, 葛均青
(福建省农业科学院生物技术研究所,福建 福州 350003)
中国具有世界上规模最大的鳗鲡养殖产业,养殖区集中在福建省和广东省,主要的养殖品种为日本鳗鲡(Anguillajaponica)和美洲鳗鲡(A.rostrata)等[1]。自2015 年以来,美洲鳗鲡已成为福建省主要的鳗鲡养殖品种。近年来,养殖的美洲鳗鲡陆续出现一种持续时间长(3~6 个月),累计死亡率高(20%~50%)的传染性疾病。患病鳗鲡的主要发病特征为鳃丝密布针尖大小出血点,因此命名为 “出血性烂鳃”[2]。在前期研究中,利用鳗鲡卵巢细胞(eel ovary cell line, EO),从患 “出血性烂鳃” 美洲鳗鲡体内分离鉴定出一种新的病毒,命名为美洲鳗鲡腺瘤病毒(American eel adomavirus,AEAdoV)[2]。为进一步研究AEAdoV 的致病性及其流行状况,需要建立灵敏、特异的AEAdoV 检测方法。
AEAdoV 病毒粒子为二十面体结构,直径75~85 nm,为无囊膜dsDNA 病毒,隶属于罗韦病毒目(Rowavirales) 瘤病毒科(Adomaviridae) β 腺瘤病 毒 亚 科(Beta-adomaviruses)[3]。AEAdoV 与β 腺瘤病毒亚科的其他成员都编码superfamily 3 helicases (S3H)复制酶,与花鳗腺瘤病毒(marbled eel adomavirus,MEAdoV)的S3H 基因具有同源性[4]。基于普通PCR 和qPCR 的分子生物学检测方法具有特异性强和灵敏度高等优点,广泛应用于水产病毒的检测[5-7]。为建立AEAdoV 的分子生物学检测方法,根据AEAdoV 的S3H 基因序列,通过比对分析,获得了与MEAdoV 序列同源率低且与β腺瘤病毒亚科中的其他病毒成员无同源性的片段,根据该片段设计引物,构建了AEAdoV 的普通PCR 和SYBR Green I qPCR 检测方法,并对上述方法的灵敏性、特异性及重复性进行了评价。利用建立的普通PCR 和qPCR 检测方法对收集的美洲鳗鲡 “出血性烂鳃” 病料进行了检测,明确了AEAdoV 在鳗鲡体内的分布情况,为深入开展该病毒的流行病学和致病机理研究奠定基础。
1 材料与方法
1.1 细胞系与病毒株
鳗鲡卵巢细胞系(EO)、鲤上皮瘤细胞系(Epithelioma papilloma cyprinid cell line, EPC)由本实验室保存,美洲鳗鲡腺瘤病毒福建株(AEAdoV-FJ)、蛙虹彩病毒(Rana grylio virus, RGV)[8]、鳗鲡疱疹病毒(Anguillid herpesvirus, AngHV)和鲤疱疹病毒(Koi herpes virus, KHV)[9]由本实验室分离或保存,对 虾 白 斑 综 合 征 病 毒(White spot syndrome virus,WSSV)、日本鳗鲡内皮细胞坏死病毒(Japanese eel adomavirus, JEAdoV)和花鳗鲡腺瘤病毒(Marbled eel adomavirus, MEAdoV) 基因组DNA 均由本实验室提取并保存。
1.2 主要仪器及试剂
2 ×TaqMaster Mix (Dye Plus)、DNA Marker、TaqPro SYBR qPCR Master Mix 试 剂 盒 和pCE2-TA/Blunt 载体购自诺唯赞(南京)生物科技股份有限公司;限制性核酸内切酶EcoRI 购自宝日医生物技术(北京)有限公司。病毒基因组DNA/RNA提取试剂盒和血液/细胞/组织DNA 提取试剂盒均购自天根生化科技(北京)有限公司。琼脂糖凝胶DNA 回收试剂盒、质粒提取试剂盒购自广州美基生物科技有限公司。引物均由生工生物工程(上海)股份有限公司合成。主要仪器包括PCR 仪
(Applied Biosystems Veriti PCR,Thermo Fisher Scientific)、 qPCR 仪(QuantStudio 3, Thermo Fisher Scientific)、超微量紫外可见分光光度计(DA-11,DeNovix)、凝胶成像分析系统(WD-9413C,北京六一生物科技有限公司)等。
1.3 引物的设计与优化
根据AEAdoV-FJ 的S3H 序列,分别设计用于普通PCR 和qPCR 特异性扩增S3H 序列的引物对AEAdoV-FW/AEAdoV-RW 和AEAdoV-qF/AEAdoV-qR,其序列和目的片段长度见表1。
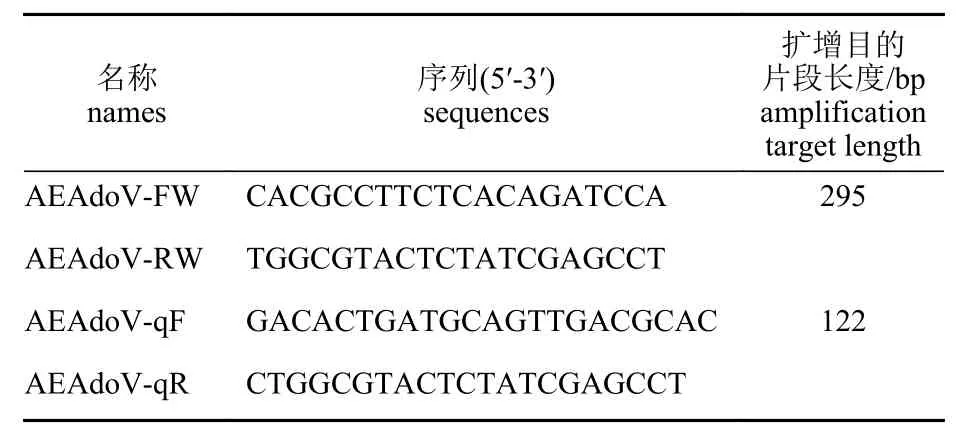
表1 普通PCR 和SYBR Green Ⅰ qPCR 引物序列Tab. 1 Primer sequences used for routine PCR and SYBR Green Ⅰ qPCR detection
1.4 普通PCR 检测方法的建立
将AEAdoV-FJ 接种EO 细胞系,待细胞产生典型病变后,收集细胞,离心取上清液,用病毒基因组DNA/RNA 提取试剂盒提取总DNA,用引物对AEAdoV-FW/AEAdoV-RW 对提取的DNA 进行普通PCR 扩增,扩增产物用1.5%琼脂糖凝胶电泳检测,割胶回收并纯化目的片段,并将目的片段克隆至pCE2-TA/Blunt 载体,用质粒提取试剂盒提取质粒后再进行酶切、测序鉴定。反应体系:AEAdoV-FJ 基因组DNA 1 μL,2×TaqMaster Mix 12.5 μL, AEAdoV-FW 和 AEAdoV-RW(10 μmol/L)各1 μL、加ddH2O 补液至25 μL;反应程序:95 °C 预变性5 min;95 °C 变性30 s,56 °C退火30 s,72 °C 延伸20 s,共30 个循环;最后72 °C 延伸7 min。
1.5 qPCR 检测方法的建立
取构建的pCE2-TA/Blunt-S3H 质粒DNA,用超微量紫外分光光度计测定其浓度和纯度,用DNA/RNA Copy Number Calculator (http: //www.endmemo.com/bio/dnacopynum.php)计算单位体积(μL) DNA 样品中质粒的拷贝数,作为标准品,分装后保存于-80 °C 备用。以提取的AEAdoV-FJ 基因组为模板,用引物对AEAdoV-qF/AEAdoV-qR使用TaqPro Universal SYBR qRCR Master Mix 试剂盒进行qPCR 扩增,每个浓度设3 个重复,阴性对照用ddH2O 代替模板,制作qPCR 标准曲线。反 应 体 系:AEAdoV-FJ 基 因 组DNA 1 μL,2×qPCR Master Mix 10 μL,AEAdoV-qF 和AEAdoV-qR(10 μmol/L)各0.4 μL,ddH2O 8.2 μL;反应条件:95 °C 预变性30 s;95 °C 5 s,60 °C 34 s,40 个循环。
1.6 普通PCR 和qPCR 检测方法的特异性评价
灵敏性检测 以梯度稀释的pCE2-TA/Blunt-S3H 为模板,利用设计的引物对AEAdoVFW/AEAdoV-RW 和AEAdoV-qF/AEAdoV-qR 分别进行普通PCR 和qPCR 扩增,分析比较2 种方法所能检测的最低AEAdoV-FJ 拷贝数。
特异性检测 取AEAdoV-FJ、AngHV、RGV 和KHV 细胞培养上清液,利用病毒基因组DNA/RNA 提取试剂盒提取DNA,以上述病毒DNA 及实验室保存的WSSV、JEAdoV 和MEAdoV基因组DNA 作为模板,用建立的普通PCR 和qPCR 方法进行扩增,评价2 种检测方法的特异性。
重复性检测 分别取105和104拷贝/μL的pCE2-TA/Blunt-S3H 作为模板,进行qPCR 扩增,每个浓度设3 个重复,根据阈值循环数 (cycle threshold value,Ct) 的变异系数分析该方法的组内重复性。重复实验3 次,分析组间重复性。
1.7 普通PCR 和qPCR 检测方法的应用
取实验室收集的35 份疑似美洲鳗鲡 “出血性烂鳃” 病料,取肝脏、脾脏、肾脏等内脏组织,用血液/细胞/组织DNA 提取试剂盒提取DNA,用超微量紫外分光光度计测定其纯度和浓度,分别用建立的普通PCR 和qPCR 检测方法对样品进行检测,统计2 种检测方法的AEAdoV-FJ 检出率。取AEAdoV 阳性的黑仔期美洲鳗鲡,取鳍、鳃、表皮黏液、皮肤、肌肉、心脏、肝脏、脾脏、肾脏、脑和肠道等部位组织,分别用血液/细胞/组织DNA 提取试剂盒提取的DNA 作为模板,用建立的qPCR 方法检测各部位的病毒载量,分析病毒的分布情况,重复3 次。采用SPSS 19.0 软件对所得数据进行单因素方差分析,Duncan 氏法进行多重比较,当P<0.05 时差异显著,数据用 “平均值±标准差” 表示。实验期间,操作者严格遵守实验动物福利伦理规范。
2 结果
2.1 AEAdoV S3H 基因片段的普通PCR 扩增和克隆
取提取的AEAdoV-FJ 基因组DNA,用引物对AEAdoV-FW/AEAdoV-RW 进行普通PCR 扩增,获得与预期大小一致的约300 bp 的特异性条带(图1-a)。进一步回收该片段,克隆至pCE2-TA/Blunt 载体,经单酶切及测序鉴定,获得质粒pCE2-TA/Blunt-S3H (图1-b)。

图1 AEAdoV S3H 基因片段的PCR 扩增和克隆(a) AEAdoV S3H 基因片段的PCR 扩增,M. DNA marker,1. AEAdoV-FJ,2. 阴性对照;(b) pCE2-TA/Blunt-S3H 的单酶切鉴定,M. DNA marker,1. Eco R I 酶切,箭头所示为目的片段。Fig. 1 PCR amplification and cloning of AEAdoV S3H gene fragments(a) PCR amplification partial of the AEAdoV S3H gene, M. DNA marker, 1. AEAdoV-FJ, 2. negative control; (b) restriction enzyme digestion of the plasmid pCE2-TA/Blunt-S3H, M. DNA marker, 1. single enzyme digestion by Eco R I, the arrow represents the target gene.
2.2 AEAdoV SYBR Green Ⅰ qPCR 标准曲线的建立
以108~101拷贝/μL 10 倍比稀释的质粒pCE2-TA/Blunt-S3H 作为模板,用引物对AEAdoVqF/AEAdoV-qR 进行qPCR 扩增,用质粒拷贝数与Ct值绘制标准曲线,质粒拷贝数与Ct值的线性关系为y=-3.206x+38.140,相关系数R2为0.999,扩增效率为105.067%,线性关系较好。熔解曲线图显示,不同拷贝数质粒的熔解曲线均只有1 个熔解峰,Tm值为85.33~85.78 °C,表明反应均为特异性扩增,无非特异性扩增或引物二聚体产生(图2)。

图2 AEAdoV SYBR Green Ⅰ qPCR 检测的熔解曲线Fig. 2 Melting curve plot of the AEAdoV SYBR Green Ⅰ qPCR assay
2.3 AEAdoV 普通PCR 和SYBR Green ⅠqPCR 检测方法的特性评价
以108~100拷贝/μL 10 倍比稀释的质粒pCE2-TA/Blunt-S3H DNA 作为模板,分别进行普通PCR和SYBR Green Ⅰ qPCR 扩增。结果显示,普通PCR 的最低检出的病毒拷贝数为100 个(图3-a),而SYBR Green I qPCR 的最低检出为10 个(图3-b),表明SYBR Green I qPCR 法比PCR 法的灵敏性高10 倍。

图3 AEAdoV 普通PCR 和SYBR Green I qPCR 检测的灵敏性(a) AEAdoV 普 通PCR 检 测的 灵敏 性,M. DNA marker,1~9 依 次为108~100 个拷贝的重组质粒,10 为阴性对照;(b) AEAdoV 的SYBR Greeen I qPCR 检测灵敏性,1~9 依次为108~100 个拷贝的重组质粒,10 为阴性对照。Fig. 3 Sensitivity of routine PCR assay and SYBR Green I qPCR assay for the detection of AEAdoV(a) AEAdoV routine PCR assay, M. DNA marker,lanes 1-9 represent recombinant plasmid ranging from 108-100 copies, lane 10. negative control;(b) detection sensitivity of the AEAdoV qPCR assay, plot 1-9 represent recombinant plasmid ranging from 108-100 copies, lane 10. negative control.
以 AEAdoV-FJ、 AngHV、 RGV、 KHV、WSSV、JEAdoV 和MEAdoV 的 基 因 组DNA 和pCE2-TA/Blunt-S3H 重组质粒为模板,进行普通PCR 和SYBR Green I qPCR 扩增的特异性检测。普通PCR 结果显示,AEAdoV-FJ 和pCE2-TA/Blunt-S3H 均扩增出特异性目的条带,AngHV、RGV、KHV、WSSV、JEAdoV 和MEAdoV则均呈阴性(图4-a, b)。qPCR 结果显示,AEAdoVFJ 和pCE2-TA/Blunt-S3H 均有扩增曲线产生,而其他模板均无特异性扩增信号(图4-c, d)。上述结果表明,建立的AEAdoV 普通PCR 和SYBR Green I qPCR 检测方法特异性良好。

图4 AEAdoV 的普通PCR 和SYBR Green I qPCR 检测特异性(a)用细胞扩繁的病毒进行AEAdoV 的普通PCR 特异性检测,M. DNA marker,1. AEAdoV-FJ,2. pCE2-TA/Blunt-S3H,3. AngHV,4. RGV,5. KHV,6. 阴性对照;(b)以组织提取的病毒DNA 为模板进行AEAdoV 的普通PCR 特异性检测,M. DNA marker,1. AEAdoV-FJ,2. pCE2-TA/Blunt-S3H,3. WSSV,4. JEAdoV,5. MEAdoV,6. 阴性对照;(c)以细胞扩繁的病毒DNA 为模板进行AEAdoV 的qPCR 特异性检测,M. DNA marker,1. AEAdoV-FJ,2. pCE2-TA/Blunt-S3H,3. AngHV,4. RGV,5. KHV,6. 阴性对照;(d)以组织提取的病毒DNA 为模板进行AEAdoV 的qPCR 特异性检测,M. DNA marker,1. AEAdoV-FJ,2. pCE2-TA/Blunt-S3H,3. WSSV,4. JEAdoV,5. MEAdoV,6. 阴性对照。Fig. 4 Detection specificity of the AEAdoV routine PCR assay and SYBR Green I qPCR assay(a) detection specificity of the AEAdoV routine PCR assay using cell propagated viral DNA. M. DNA marker, 1. AEAdoV-FJ, 2. pCE2-TA/Blunt-S3H,3. AngHV, 4. RGV, 5. KHV, 6. negative control; (b) detection specificity of the AEAdoV routine PCR assay using tissue extracted viral DNA. M. DNA marker, 1. AEAdoV-FJ, 2. pCE2-TA/Blunt-S3H, 3. WSSV, 4. JEAdoV, 5. MEAdoV, 6. negative control; (c) detection specificity of the AEAdoV qPCR assay using cell propagated viral DNA. M. DNA marker, 1. AEAdoV-FJ, 2. pCE2-TA/Blunt-S3H, 3. AngHV, 4. RGV, 5. KHV, 6. negative control; (d)detection specificity of the AEAdoV qPCR assay using tissue extracted viral DNA. M. DNA marker, 1. AEAdoV-FJ, 2. pCE2-TA/Blunt-S3H, 3. WSSV,4. JEAdoV, 5. MEAdoV, 6. negative control.
分别取105和104个拷贝的重组质粒进行SYBR Green I qPCR 的重复性检测。结果显示,组内变异系数均小于1%,分别为0.08%和0.47%;组间变异系数均小于2%,分别为1.50%和0.22%(表2),表明qPCR 方法的重复性好,可保证检测结果的稳定性和可靠性。

表2 AEAdoV SYBR Green I qPCR 检测的重复性Tab. 2 Detection repeatability of the AEAdoV SYBR Green I qPCR assay
2.4 AEAdoV 普 通 PCR 和 SYBR Green I qPCR 方法的应用
分别用建立的普通PCR 法和SYBR Green I qPCR 法对收集的35 份疑似鳗鲡 “出血性烂鳃” 病料进行检测。结果显示,普通PCR 法共检出29份阳性样品,阳性检出率为82.8%;而qPCR 法检出34 份阳性样品,阳性检出率为97%,AEAdoV检出率高于普通PCR 法。
用建立的AEAdoV SYBR Green I qPCR 方法检测AEAdoV 感染鳗鲡主要组织内的AEAdoV 含量,结果显示,在检测的所有组织中均可检测到AEAdoV,其中心脏、肝脏、鳃和鳍的AEAdoV含量较高,心脏中的含量可达109.12±1.42拷贝,与其他组织均差异极显著(P<0.001),而体表(黏液和皮肤)以及脾脏含量相对较低(102.61±0.38~103.53±0.08),显著低于其他组织(P<0.05) (图5)。

图5 AEAdoV 在感染鳗鲡主要组织内的分布情况1. 心 脏,2. 肝 脏,3. 鳃,4. 鳍 条,5. 肾 脏,6. 肠 道,7. 脾 脏,8. 黏液,9. 皮肤,10. 脑,11. 肌肉。不同字母表示差异显著(P<0.05)。Fig. 5 Distribution of AEAdoV in the main tissues of the infected eels 1. heart, 2. liver, 3. gill, 4. fin, 5. kidney, 6. intestine, 7. spleen, 8. mucus,9. skin, 10. brain, 11. muscle; different letters mean significant differences (P<0.05).
3 讨论
近年来,美洲鳗鲡 “出血性烂鳃” 频发,已经成为养殖美洲鳗鲡的重要疾病[10-11]。其临床病征,与日本鳗鲡内皮细胞坏死病毒(JEAdoV)和花鳗鲡腺瘤病毒(MEAdoV)引起的内皮细胞坏死症(VECNE)类似[12-14]。为研究AEAdoV 的流行情况和病原学情况,本研究建立了AEAdoV 的普通PCR 和SYBR Green Ⅰ qPCR 检测方法。结果显示,普通PCR 检测方法和qPCR 检测方法对AEAdoV都具有良好的特异性,与几种常见的水生动物DNA病毒(AngHV、RGV、KHV、WSSV、JEAdoV、MEAdoV)无交叉反应;qPCR 法重复性佳,组间和组内变异系数均小于2%;qPCR 检测方法可以检测到10 个病毒拷贝数,其检测灵敏度高于普通PCR;在临床样品的应用检测中,AEAdoV 的qPCR 检测阳性检出率远高于普通PCR 检测,证明该方法更加灵敏、有效。AEAdoV 在 “出血性烂鳃” 病料中的高检出率表明,AEAdoV 在患 “出血性烂鳃” 的美洲鳗鲡中普遍存在,与疾病的发生存在正相关关系。AEAdoV 对于鱼体的致病力,以及是否存在其他病原共感染,需要深入研究。
腺瘤病毒存在潜伏感染特性,病毒在宿主体内长期存在而不致病,如MEAdoV[15]、JEAdoV[16]等。前期研究显示,美洲鳗鲡腹腔注射AEAdoV 35 d 后,可检测到病毒,但鱼体无可见表观症状和病理变化[2]。因此,推断AEAdoV 可潜伏感染,难以通过体表病理变化判断鱼体的感染状况。建立AEAdoV 的qPCR 检测方法,可在病毒潜伏期以及无临床症状的鱼体中准确检测AEAdoV,有利于尽早发现病毒感染,从而采取积极的防控措施,同时也有助于避免引入潜伏感染AEAdoV的苗种,减少病毒的传播。
明确病毒在不同组织的分布情况,对于研究病毒的致病机制和入侵规律具有重要意义[17-20]。鳗鲡在感染AngHV 后,鳃和皮肤黏液内的病毒含量远高于其他组织,表明上述器官可能是AngHV入侵和感染的主要靶器官[5,21]。本研究显示,感染AEAdoV 的美洲鳗鲡内脏组织中的AEAdoV 相对含量较高,特别是心脏中AEAdoV 含量远高于其他组织,而体表(黏液和皮肤)的病毒含量相对较低,因此可以判断体表并非AEAdoV 感染和增殖的主要组织。当病毒在某组织中含量较高时,会引起相应组织发生病变,如鱼呼肠孤病毒(piscine reovirus, PRV),主要分布在大西洋鲑 (Salmo salar)的心脏中,可引起鱼体发生心肌炎症,造成包括心脏苍白、心包出血、腹水等[22-23]等病变。但在感染了AEAdoV 的美洲鳗鲡组织(如心脏、肝脏)中,并未观察到类似病变,AEAdoV 的致病性还需要进一步的研究。此外,了解AEAdoV 在鱼体内的分布状况,可指导疑似病例检测样品的采集;采集心脏等内脏组织进行检测,可以有效降低假阴性的概率,提高检测的准确性。
(作者声明本文无实际或潜在的利益冲突)

