牛磺酸缓解脂质氧化日粮对黄河鲤生长性能和肠道健康的负面影响
刘 丹, 米佳丽, 王俊丽, 闫 潇, 秦超彬,杨丽萍, 徐歆歆, 聂国兴*
(1. 河南师范大学生命科学学院,河南 新乡 453007;2. 河南师范大学水产学院,河南 新乡 453007)
脂质作为鱼类饲料中必不可少的营养素,为鱼类生长发育提供必需营养物质,是鱼类重要的能量来源[1]。然而,脂类在饲料的制备、加工和储存过程中会产生许多氧化产物,主要包括初级氧化产物(氢过氧化物)和次级氧化产物(羟基醛),会对水产动物的健康造成严重伤害[2]。鱼油是商业饲料中最重要的脂质来源之一,因其富含长链多不饱和脂肪酸(主要是DHA 和EPA),较其他油源更容易被氧化[3]。氧化脂质不仅会损伤细胞生物膜、破坏饲料的营养成分,对水产动物的健康也会产生许多负面影响[2]。据报道,用脂质氧化饲料饲喂拉氏鱥(Rhynchocypris lagowski)会显著降低其生长性能、饲料效率和蛋白质效率[4]。此外,脂质氧化饲料也会对鱼类肠道健康带来不良影响。研究表明,用氧化脂质饲料饲喂尼罗罗非鱼(Oreochromis niloticus) 12 周后,会降低其抗氧化水平,破坏肠道的结构完整性,诱导肠道炎症,引起肠道菌群的失调[5]。因此,有必要寻找合适的饲料添加剂来缓解脂质氧化饲料对鱼类带来的不利影响。
牛磺酸(2-氨基乙基磺酸)是从牛胆汁中首次发现的一种以游离氨基酸形式存在的非蛋白氨基酸,占总氨基酸库的30%~50%[6-7]。水产养殖研究的最新进展强调了饲料中牛磺酸对水生动物多种生理功能的重要性,包括促进黄鳝(Monopterus albus)和鲤(Cyprinus carpio)的生长性能[8-9],改善革胡子鲇(Clarias gariepinus)的抗氧化和免疫能力[10],提高虹鳟(Oncorhynchus mykiss)的细胞渗透调节能力[11]。此外,牛磺酸对鱼类肠道健康也有重要的调节作用。在高碳水化合物饲料中添加牛磺酸可以提高黄鳝肠道菌群的多样性[8]。添加牛磺酸可降低氧化鱼油饲料对肠道微生物组成和种群间相互作用的负面影响,恢复鱼类肠道菌群的功能[12]。但是对牛磺酸在鱼类肠道健康方面的研究仍然非常有限,有待进一步研究。本研究以黄河鲤为对象,从生长性能、抗氧化性能、消化能力、肠道组织形态以及微生物组成的角度,探究牛磺酸对氧化脂质饲料饲喂下黄河鲤生长性能和肠道健康的影响。此外,本研究为脂质氧化饲料对水产动物的危害提供了有效应对策略,并为进一步研究牛磺酸对鱼类肠道健康调节提供了理论基础。
1 材料与方法
1.1 实验饲料
以鱼粉为主要蛋白源、鱼油为主要脂肪源、小麦粉为糖源制作5 组等氮等脂饲料。本实验所用的正常鱼油购自新乡东祥化工有限公司,氧化鱼油由正常鱼油制备。参考Long 等[13]描述的方法制备氧化鱼油。基础对照饲料中添加3%正常鱼油,其余4 组饲料中分别添加等量氧化鱼油和0%、0.4%、0.8%和1.2%牛磺酸。表1 展示具体的饲料配方。将饲料原料粉碎后,过60 目筛,采用逐级混匀的方法均匀混合,制成1.5 mm 粒径的饲料,待自然风干后保存于-20 °C 冰箱中。

表1 实验组饲料配方及营养组成Tab. 1 Experimental group feed formula and nutritional composition %
1.2 实验管理及样品采集
由河南省水产科学研究院提供实验用黄河鲤,在漯河养殖基地户外大型鱼塘的网箱中进行养殖实验。正式实验前,所有实验鱼用商品饲料(购于通威股份有限公司)驯化2 周以适应环境。选取225 尾初始体重为(8.74±0.01) g,大小均一、体格健全的黄河鲤,随机分为5 个实验组,共15 个网箱(2.0 m×2.0 m×1.5 m),每个实验组设置3 个重复。每天按体重的3%~5% 分3 次投喂(每天7:30、11:30 和17:30),根据每周实验鱼体重对投喂量进行调整,持续10 周。养殖期间,水体溶解氧含量为(9.0±1.1) mg/L,水温为26~28 °C、pH 为7.4±0.2、亚硝酸盐浓度小于 0.1 mg/L、氨氮含量小于 0.2 mg/L。本实验获得河南师范大学动物实验伦理委员会的授权(HNSD—2024BS—0108),实验过程中操作人员严格遵守河南师范大学伦理规范,并按照河南师范大学动物实验伦理委员会制定的规章制度执行。
养殖实验结束禁食24 h 后,用麻醉剂(MS-222, 0.02%)麻醉实验鱼,记录每个网箱实验鱼总数和体重,并随机测量其中3 尾实验鱼的体长,然后解剖并分离出完整的肠道,取中肠的相同部位(约1 cm)固定于4%多聚甲醛溶液,用来对肠道组织形态进行分析。每个处理组选择9 条实验鱼,在冰上解剖后迅速分离肝胰脏和肠道,立即放入无菌无酶1.5 mL 离心管中,在液氮中短暂冷冻,保存于-80 °C 用于实时荧光定量PCR 分析。各实验组随机选取3 尾实验鱼,用无菌解剖工具在冰上分离黄河鲤肠道组织,并小心取出内容物,混匀装入1.5 mL 无菌离心管后保存于-80 °C,用来进行肠道菌群16SrRNA测序。
1.3 氧化鱼油的制备
制备实验饲料之前,按照Long 等[13]描述的方法制备氧化鱼油:将400 g 正常鱼油放入500 mL 烧杯中,插入空气泵管,在55 °C 恒温水浴中持续加热搅拌5 d。氧化过程结束后,按照中国食品安全国家标准(GB/T 5 009.37—2003)对鱼油的过氧化值进行测定,每份饲料和鱼油样品均重复测定3 次,新鲜鱼油的过氧化值为(2.51±0.11)meq O2/kg,氧化鱼油的过氧化值为(175.39±3.83)meq O2/kg。
1.4 饲料常规成分的检测
根据Mi 等[14]描述的方法对饲料的水分、粗蛋白、粗脂肪和粗灰分进行检测。在-50 °C 下将饲料冷冻干燥至恒重以检测水分。分别用凯氏定氮法(GB/T6432 —2018),索氏提取仪(SX-360,OPSIS,瑞典)和550 °C 马弗炉煅烧法(GB/T 212—2008)来测定饲料中粗蛋白、粗脂肪和粗灰分的含量。
1.5 生长性能相关指标的计算
按照下列公式对生长性能相关指标进行计算:
式中,W0和Wt分别表示初始体重和终末体重(g),N0和Nt分别代表初始实验鱼和终末实验鱼尾数,t为养殖周期(d),F为摄食量(g),L为体长(cm)。
1.6 肠道的消化酶活性测定
肠道组织的总蛋白(total protein,TP,货号A045-4-2)、胰蛋白酶(trypsin,货号A080-2-1)、淀粉酶(amylase,AMS,货号C016-1-1)和脂肪酶(lipase,LPS,货号C016-1-1)均使用南京建成生物工程研究所的试剂盒,按照相应的说明书进行检测。
1.7 肠道组织形态的分析
从固定液中取出肠道组织后,用PBS 缓冲液冲洗3 遍,用不同浓度的乙醇溶液逐级脱水,用二甲苯溶液进行透明处理,最后将样品包埋固定于石蜡中。用切片机(ZEISS,德国)将石蜡组织块连续切成5 μm 薄片后,用苏木精-伊红染色试剂盒(索莱宝,北京)进行染色。最终使用光学显微镜(Carl Zeiss Micro GmbH,德国)对切片进行观察和拍照,用ZEN 2 lite 软件测量肠绒毛长度、肠绒毛宽度和肌层厚度。
1.8 实时荧光定量PCR (qRT-PCR)
样品的总RNA 用trizol 试剂(TaKaRa, 日本)提取后,分别用分光光度计(Nano Drop 2 000C)和1%琼脂糖凝胶电泳检测RNA 的浓度和质量。使用PrimeScript™ RT Reagent 试剂盒(TaKaRa, 日本)去除基因组DNA 并反转录。用LightCycler 480 仪器(Roche,瑞士)测定所有基因的mRNA表达水平,反应体系为:5 μL 2×ChamQ Universal SYBR qPCR Master Mix (诺唯赞,中国),0.3 μL正向引物和0.3 μL 反向引物,0.1 μL cDNA 模板和4.3 μL 无菌水。扩增程序为:95 °C 下3 min,95 °C 下30 s,循环40 次。以18SrRNA(18S)作为内参,具体引物序列如表2 所示。

表2 实时荧光定量PCR 引物序列Tab. 2 The primers of qRT-PCR
1.9 肠道菌群 16S rRNA 测序
对黄河鲤肠道内容物样本进行 16SrRNA测序分析,该工作由上海派森诺生物科技股份有限公司执行。原始序列通过质量初筛后,按照index和Barcode 进行文库和样本划分,并去除barcode 序列。通过QIIME2 dada2 的分析流程进行序列OTU 聚类。采用QIIME2 的classify-sklearn 算法进行物种注释分析(https: //github.com/QIIME2/q2-feature-classifier)。使用QIIME2 (2019.4)软件,对未抽平的OUT 数据进行抽平处理,分析菌群alpha 多 样 性 (Chao1 index、 Observed species、Shannon index 和Simpson index)。依据序列物种分类学注释的结果,统计所有样本在门水平和属水平的分布情况。最后使用R 语言和pheatmap 软件包,根据丰度排名前15 的差异菌属制作物种组成热图。
1.10 数据分析
用SPSS 23.0 软件(IBM,美国)对实验数据进行独立样本t检验分析(students't-test),结果用平均值±标准误(mean±SE)表示。用GraphPad 6.02软件(GraphPad Software Inc.,美国)进行图形表示。OFO 组与FO 组的独立方差t检验结果用星号 “*” 表示,T0.4、T0.8 和T1.2 组与OFO 组的独立方差t检验结果用井号 “#” 表示。显著性水平设为P<0.05,用 “*” 或 者 “#” 表示。极 显 著 水 平 设 为P<0.01,用 “**” 或者 “##” 表示。
2 结果
2.1 生长性能
相比于FO 组,OFO 组的FBW、WGR、SGR和FE 均显著降低(P<0.05)。对比OFO 组,T0.4组和T0.8 组中上述指标均显著得到提高(P<0.05),T1.2 组的FE 和FBW 也显著上升(P<0.05)。各组之间的SGR 和CF 没有显著差异(P>0.05) (表3)。
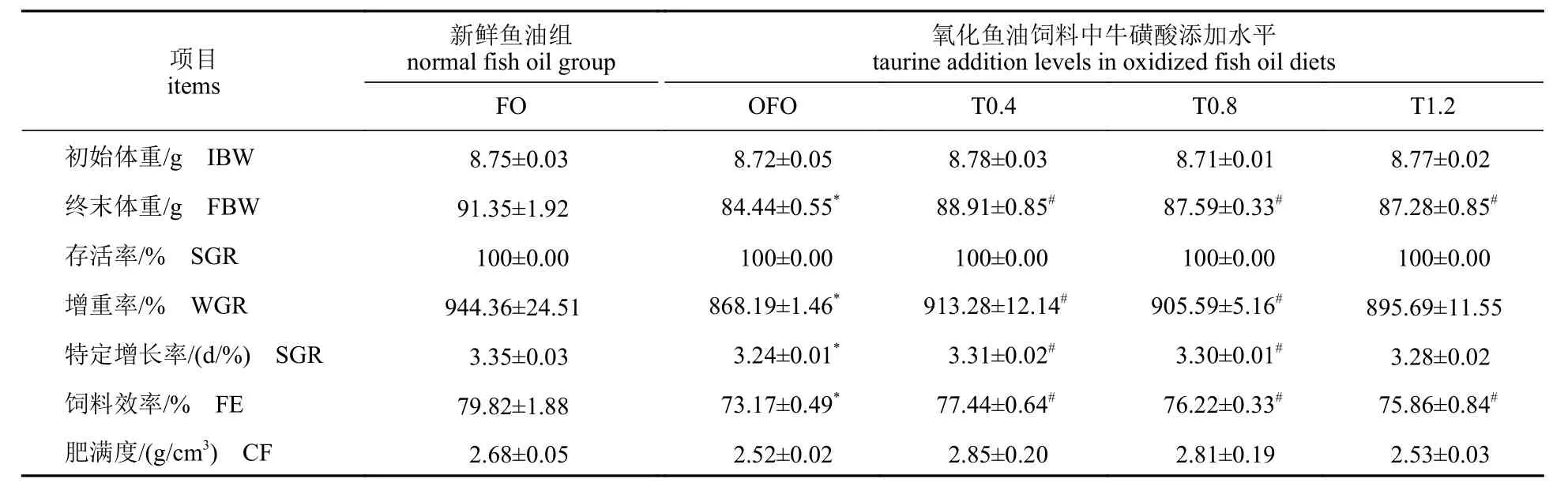
表3 各实验组黄河鲤生长性能Tab. 3 Growth performance of C. carpio in all experimental groups
2.2 抗氧化相关基因表达水平
与氧化鱼油组相比,添加0.8%牛磺酸可显著提高肠道组织中gpx和grmRNA 表达水平(P<0.05)。肝胰脏中抗氧化相关基因表达结果显示,与正常鱼油组相比,氧化鱼油显著下调了grmRNA的表达(P<0.05)。与氧化鱼油组相比,添加3 种不同浓度的牛磺酸均显著上调grmRNA 的表达(P<0.05)。各处理组中,T0.4 组肝胰脏sod和gpxmRNA 表达水平最高,显著高于OFO 组(P<0.05)。另外,肝胰脏keap1 mRNA 表达水平在T0.8 组和T1.2 组中显著低于其在OFO 组中的表达水平(P<0.05) (图1)。

图1 各实验组黄河鲤肠道(a)和肝胰脏(b)抗氧化相关基因的相对表达量Fig. 1 Relative expression levels of antioxidant-related genes in the intestinal (a) and hepatopancreas (b) of C. carpio in every group
2.3 肠道消化酶活性
OFO 组中的脂肪酶和淀粉酶活性分别显著(P<0.05)和极显著(P<0.01)低于FO 组,说明氧化鱼油降低了黄河鲤的消化能力。相比于OFO 组,脂肪酶活性在添加牛磺酸后均极显著提高(P<0.01)。胰蛋白酶活性在T0.8 组达到最高水平,并极显著高于OFO 组(P<0.01) (表4)。
2.4 肠道组织形态
饲料中添加氧化鱼油破坏了中肠组织结构的完整性,补充牛磺酸可缓解氧化鱼油对中肠组织结构的破坏(图版)。相比于FO 组,OFO 显著降低了中肠绒毛高度、绒毛宽度以及肌层厚度(P<0.05)。反之,补充牛磺酸后上述指标均提高,其中,添加1.2% 牛磺酸可显著增加肠绒毛高度和宽度(P<0.05),添加0.8%牛磺酸可显著增加中肠肌层厚度(P<0.05) (表5)。

表5 各实验组黄河鲤肠绒毛高度、宽度和肌层厚度Tab. 5 Intestinal villus height, intestinal villus width and muscle thickness of C. carpio in all experimental groups μm

图版 各实验组黄河鲤中肠组织结构图1~5 分别代表FO、OFO、T0.4、T0.8 和T1.2 组;A 和B 分别代表肠绒毛高度和肌层厚度。Plate Midgut tissue morphological structure of C. carpio in every group 1-5 respectively represent FO, OFO, T0.4, T0.8 and T1.2 groups; A and B represent intestinal villus height and muscular thickness, respectively.
2.5 肠道菌群
FO、OFO、T0.4、T0.8 和T1.2 组OTU 数目分别为8 647、6 285、5 668、7 995、6 547 个,其中共有的 OTU 数目为314 个,各自独有的OTU数目分别为8 333、5 971、5 354、7 681 和6 233个(图2)。分析黄河鲤肠道菌群α-多样性指数发现, OFO 组Observed species 指 数 和Simpson 指数显著低于FO 组(P<0.05),Shannon 指数极显著低 于FO 组(P<0.01)。相 比 于OFO 组, Shannon 指数在T0.8 组中显著增高(P<0.05),Chao1 指数在T0.8 组和T1.2 组均显著提高(P<0.05)。补充牛磺酸后Observed species 指数均高于OFO 组(P>0.05) (图3)。
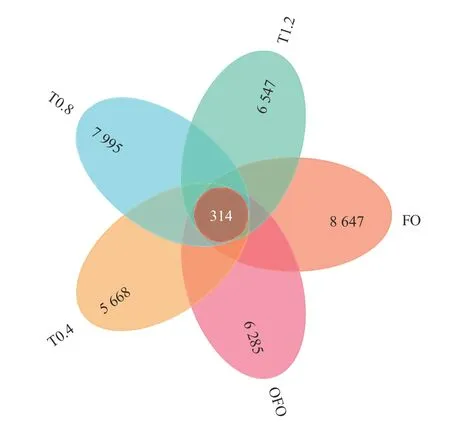
图2 黄河鲤肠道微生物 OTU 韦恩图Fig. 2 OTU Venn diagram of intestinal microbiota in C. carpio

图3 黄河鲤肠道微生物α 多样性Fig. 3 Alpha-diversity of intestinal microbiota in C. carpio
黄河鲤的肠道微生物在门水平上主要由厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)组成(图4-a)。与正常鱼油组相比,氧化鱼油组厚壁菌门(从60.98%下降到20.18%)、放线菌门(从11.06%下降到5.56%)、拟杆菌门(10.00%下降到4.10%)的相对丰度显著降低,而变形菌门(从8.58%上升到57.13%)的相对丰度显著上升。在属水平上,气单胞菌属(Aeromonas)和乳酸菌属(Lactobacillus)为丰度最高的属(图4-b)。
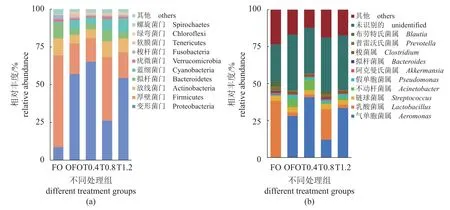
图4 在门(a)和属(b)水平上的黄河鲤肠道微生物相对丰度Fig. 4 Relative abundance of intestinal species of C. carpio at phylums (a) and genus (b) levels
为了进一步比较不同处理组间的物种组成差异,筛选出丰度排名前15 的差异菌属并制作了相对丰度热图(图5)。结果显示,OFO 组中梭杆菌属(Fusobacterium)、 气单胞菌属、梭菌属(Clostridium)、分枝杆菌属(Mycobacterium)、不动杆菌属(Acinetobacter)、芽孢杆菌属(Bacillu)的相对丰度比FO 组高,而乳酸菌属、别样棒菌属(Allobaculum)、普雷沃氏菌属(Prevotella)、鲸杆菌属(Cetobacterium)、布劳特氏菌属(Blautia)、拟杆菌属(Bacteroides)、阿克曼氏菌属(Akkermansia)的相对丰度比FO 组低。补充0.8%牛磺酸后,梭杆菌属、气单胞菌属、分枝杆菌属、梭菌属的丰度均显著降低,乳酸菌属、别样棒菌属、布劳特氏菌属、普雷沃氏菌属、阿克曼氏菌属、拟杆菌属、鲸杆菌属的丰度均明显得到提高。另外,在氧化鱼油饲料中补充4%~12%牛磺酸后,肠道中芽孢杆菌属和不动杆菌属的丰度均明显降低。
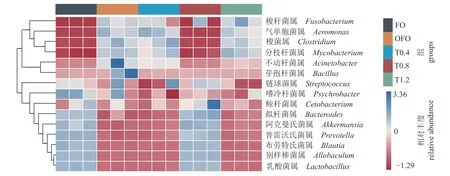
图5 黄河鲤肠道菌群中差异菌属的聚类热图蓝色代表相对丰度较高,颜色越深表示相对丰度越高;红色代表相对丰度较低,颜色越深代表相对丰度越低。Fig. 5 Clustering heat map of differential bacterial genera in the gut microbiota of C. carpio Blue represents the relative abundance is higher, the darker the color the higher the relative abundance; red represents lower relative abundance, and darker colors represent lower relative abundance.
3 讨论
3.1 牛磺酸可提高脂质氧化饲料饲喂下黄河鲤的生长性能
在本研究中,使用脂质氧化日粮饲喂黄河鲤后,会表现出较低的成长性能和饲料效率。这与在其他水生动物中的报道基本一致[4,15]。抑制生长的原因可能是脂质氧化过程中产生的醛类、酮类和酸类等有害物质降低了饲料的营养价值,从而降低黄河鲤的饲料效率,导致生长性能下降[15]。脂质氧化产生的有害物质会引起体内氧化应激,破坏动物生理稳态,抑制生长[5]。进一步研究发现,在脂质氧化饲料中补充牛磺酸会促进黄河鲤的生长性能,提高饲料效率。与本研究结果一致的是,在高植物蛋白饲料[10]、高碳水化合物饲料[8]及正常配合饲料[16]中补充一定量的牛磺酸,均可改善水产动物的生长性能。牛磺酸促进生长的能力可能归因于其对抗氧化能力的提高和肠道消化酶活性的增强[9]。
3.2 牛磺酸可改善脂质氧化饲料饲喂下黄河鲤的抗氧化水平
抗氧化能力与生长密切相关,可以反映水生动物的健康状况[17]。在抗氧化防御系统中,谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)可以保护机体抵抗氧化应激,是重要的抗氧化酶,并受到相应基因的调控[18]。有研究表明,氧化脂质饲料饲喂虹鳟12 周后,显著降低了其肝胰脏cat、gpx等抗氧化相关基因表达水平[19]。此外,氧化鱼油饲料对黄颡鱼(Pelteobagrus fulvidraco)的肠道带来了严重的氧化损伤,降低了sod和catmRNA 表达水平,抑制了抗氧化酶的活性[20]。牛磺酸作为一种抗氧化剂,可以显著降低氧化鱼油对鱼类组织的氧化损伤[6]。饲料中添加牛磺酸可以提高黄鳍棘鲷(Acanthopagrus latus)的生长速率,同时提高鱼的抗氧化能力和消化酶活性[21]。在本研究中,脂质氧化饲料降低了肝胰脏grmRNA 的表达水平,但是补充牛磺酸提高了肝胰脏和肠道组织中gpx和grmRNA 表达水平。这表明在脂质氧化饲料中补充牛磺酸可以改善黄河鲤的抗氧化性能,进而有利于鱼体健康。
3.3 牛磺酸可提高脂质氧化饲料饲喂下黄河鲤的肠道消化能力
消化酶是指消化系统和消化腺分泌的酶,可促进营养物质的消化和吸收,是反映鱼类消化能力、营养状况和生长性能的重要指标[22]。脂肪酶、淀粉酶和胰蛋白酶是鱼类肠道的主要消化酶。脂肪酶可促进肠道对食物中脂肪的消化和吸收,尤其是三酰甘油[23]。淀粉酶参与膳食碳水化合物的分解,其活性取决于鱼类的食性[24]。胰蛋白酶在蛋白质水解过程中起关键作用,同时也参与氨基酸的消化过程[24]。在对半滑舌鳎(Cynoglossus semilaevis)幼鱼的研究中发现,鱼类生长性能与胰蛋白酶和脂肪酶的活性密切相关[25]。在本研究中,氧化鱼油可显著抑制鱼类肠道中淀粉酶和脂肪酶的活性,推测这可能是降低黄河鲤生长性能的主要原因。在对尼罗罗非鱼[5]和罗氏沼虾(Macrobrachium rosenbergii)[26]的研究中也得到类似的结果。在本研究中,添加牛磺酸后可显著提高消化酶活性,缓解脂质氧化饲料对脂肪酶和淀粉酶活性的抑制作用。在以往的研究中发现,饲料中添加牛磺酸可以提高黄河鲤肠道消化能力,促进饲料中碳水化合物、脂肪和蛋白质的分解,从而提高饲料利用率,最终提高鱼类的生长性能[9]。有理由推测,消化酶活性的增强提高了食物的消化率,从而提高了营养物质的利用率,这可部分解释牛磺酸提高生长性能的原因。
3.4 牛磺酸可缓解脂质氧化饲料对黄河鲤肠道组织的损伤
肠道是鱼类消化吸收营养物质的主要场所,其消化水平与组织形态和微生物组成密切相关[27]。肠道绒毛高度、绒毛宽度和肌层厚度是评估肠道健康状态和功能的重要指标,肠绒毛面积越大,肠道吸收面积就越大,机体的消化吸收能力也就越强[28]。本研究发现,氧化鱼油降低了黄河鲤肠道绒毛高度、绒毛宽度和肌层厚度,这表明饲料中氧化鱼油可破坏肠道形态结构的完整性,减少营养物质吸收的表面积。在对尼罗罗非鱼[5]的研究中也发现,氧化鱼油饲料可降低肠绒毛的高度和宽度。对团头鲂(Megalobrama amblycephala)[15]的研究表明,氧化鱼油饲料明显损伤了肠道组织结构。进一步研究发现,补充牛磺酸可提高肠绒毛高度和宽度,改善肠道组织形态。与本研究结果一致的是,在高脂肪日粮中添加牛磺酸,显著增加了黄鳝肠道绒毛的长度,减轻了高脂饮食对肠道物理屏障的损伤[29]。牛磺酸添加组中鲤的肠道组织形态明显得到改善,说明牛磺酸有效地缓解了氧化鱼油对肠道的损伤,能够更好地促进营养物质的吸收和利用,这些结果与消化酶活性测定结果一致。
3.5 牛磺酸可缓解脂质氧化饲料对黄河鲤造成的肠道菌群紊乱
肠道微生物组被生动地描述为宿主的外部器官或第二基因组[30],通过影响宿主肠道功能从而影响宿主健康,在动物宿主的营养、免疫和防御功能中发挥着重要作用[31]。Alpha 多样性是判断肠道微生物群落动态平衡的重要指标之一,其中Observed species 和Chao1 指数分别表示微生物群落的OTU 数和物种丰度。微生物群落的多样性常用Simpson 和Shannon 指数来表征。在本研究中,脂质氧化饲料显著降低了肠道微生物群落的Observed species、Shannon 和Simpson 指数,表明脂质氧化饲料可降低肠道菌群的物种多样性和丰度,这与对黄鳝的研究结果一致[12]。在本研究中,补充牛磺酸可明显提高肠道菌群物种丰度和多样性。进一步分析菌群的具体组成发现,黄河鲤的优势菌门主要由变形菌门和厚壁菌门组成,这与对大菱鲆(Scophthalmus maximus)的研究结果相一致[32]。有研究表明,变形菌门的相对丰度增加与肠道疾病和菌群失调密切相关[33]。厚壁菌门和拟杆菌门的大部分微生物具有分解碳水化合物的能力,参与食物的消化吸收和代谢,可提高宿主的消化能力[28]。与正常鱼油组相比,氧化鱼油组中变形菌门的丰度大幅度提升,而拟杆菌门和厚壁菌门的丰度却明显下降,初步证明脂质氧化饲料可改变黄河鲤肠道菌群的组成。
条件致病菌和益生菌的比例失调,会破坏肠道的稳定状态,诱导各种肠道疾病的发生[32]。有报道称,乳酸菌是一种益生菌,能够产生丁酸,广泛应用于水产养殖中,具有提高生长性能、免疫力、抗氧化能力和抗病能力的作用[34]。鲸杆菌属能产生维生素B12,在一定程度上可抑制病原菌的繁殖,增强机体的免疫能力,是鲤肠道的优势菌群[35]。阿克曼氏菌能促进鲤的糖原合成和糖酵解相关基因的表达,提高葡萄糖的转运能力[36]。普雷沃氏菌可协助分解蛋白质和碳水化合物,提高机体对糖类的吸收和利用[37]。拟杆菌属则参与肠道的消化过程,可以分泌大量蛋白以分解多糖和代谢糖类物质[38]。气单胞菌是鲤肠道中最常见的致病菌,鱼类感染后会出现败血症、肠炎和皮肤溃烂等疾病,严重威胁鱼类的健康[39]。不动杆菌和分枝杆菌是大多数鱼类的条件致病菌,会威胁鱼类的机体健康[40]。本研究发现,脂质氧化饲料可降低乳酸菌属、普雷沃氏菌属、鲸杆菌属、阿克曼氏菌属和拟杆菌属的丰度,提升不动杆菌属、气单胞菌属和分枝杆菌属的丰度,这说明脂质氧化饲料会减少有益菌丰度,增加条件致病菌丰度,导致肠道菌群紊乱。在对杂交石斑鱼[褐点石斑鱼(Epinephelus fuscoguttatus♀)×鞍带石斑鱼(E.lanceolatus)♂] 的研究中得到相反的结果,在脂质氧化饲料的应激下,乳酸菌的丰度不仅没有减少反而增加[41]。造成这一现象的原因可能是肠道菌群通过增加乳酸菌含量来应对肠道的氧化应激,但具体机制有待进一步研究。本研究表明,在氧化脂质饲料中添加牛磺酸可恢复黄河鲤肠道菌群组成,改善脂质氧化饲料带来的肠道菌群紊乱。这一结果与牛磺酸在黄鳝肠道菌群中的研究结果一致[12]。
综上所述,脂质氧化饲料可抑制黄河鲤的生长,降低抗氧化和消化能力。然而,补充适量牛磺酸可以促进黄河鲤的生长性能、提高抗氧化和消化能力。此外,牛磺酸可通过提升有益菌丰度,降低条件致病菌丰度来缓解氧化脂质诱导的肠道组织损伤和肠道菌群的紊乱,维持肠道内环境的稳态。本研究中,结合生长性能、消化水平、肠道形态学指标和肠道菌群组成,在氧化鱼油饲料中的牛磺酸适宜添加剂量为0.4%~0.8%。
(作者声明本文无实际或潜在的利益冲突)

