Hh信号通路分子TPX2对口腔鳞癌增殖的作用探讨
张洪瑞,苏本香,庞艳,孙月茹
呼伦贝尔职业技术学院口腔教研室,内蒙古呼伦贝尔 021000
口腔癌是发生于口腔黏膜的恶性肿瘤,主要包括唇颊黏膜、舌前2/3、硬腭、牙龈以及口底等部位,其中病理类型以鳞癌最常见。印度、东南亚为口腔癌的高发区,男性发病率约为女性的2倍[1]。目前口腔鳞癌的治疗方案多为以手术为主的放化疗等综合治疗,但是很难持续改善患者的预后,并且大多数进展期患者在治疗后仍然复发[2]。因此需要识别促进口腔鳞癌增殖的分子,从而研制有效的靶向治疗药物治疗口腔鳞癌,降低疾病的复发率和病死率[3]。口腔鳞癌发生的分子机制仍然不清楚,有研究表明叉头盒M1(Forkhead Box Protein M1,FOXM1)是癌胚转录因子及细胞周期的调节因子,靶向Xklp2靶蛋白(Targeting Protein for Xenopus Kinesin-like Protein 2, TPX2)是有丝分裂的关键癌基因,但是如何促进口腔鳞癌发生与发展仍不明确[4-5]。本研究选取2022年1月—2023年7月呼伦贝尔职业技术学院口腔教研室培养的6株CAL-27人口腔鳞癌细胞株为研究对象,旨在探讨与分析Hedgehog(Hh)信号通路分子TPX2对口腔鳞癌增殖的作用,以明确TPX2的作用机制。现报道如下。
1 材料与方法
1.1 材料与试剂
CAL-27人口腔鳞癌细胞株(美国ATCC);DMEM培养基(美国Gibco);GANT61及cyclopamine(美国Sigma-Aldrich);Puromycin(北京Solarbio);转染试剂lipofectamine 2000 transfection reagent和总RNA提取试剂(美国Thermo Fisher Scientific);DMEM细胞培养基(美国Gibco);FOXM1抗体、TPX2抗体(英国Abcam)。
1.2 方法
1.2.1 TPX2 shRNA获取及RT-qPCR Genbank数据库确定人TPX2的基因序列,针对TPX2的基因序列设计1条shRNA,shTPX2序列:5'-AGCCAAGTTGTGCAATGTTC-3',由苏州吉玛基因公司设计合成。采用TRIzol法提取试剂盒对细胞总RNA进行提取,RNA的纯度和浓度的测定应用紫外分光光度计,取2 μl RNA,在反转录酶作用下合成cDNA,再取2 μl反转录产物PCR扩增,以磷酸甘油醛脱氢酶(Glyceraldehyde 3-Phosphate Dehydrogenase, GAPDH)为内参照,PCR反应条件:①95℃ 5 min,②95℃ 30 s,③60℃ 30 s,④72℃ 30 s,⑤72℃ 5 min;其中②、③、④为40个循环。
1.2.2 细胞分组与转染 把CAL-27细胞随机分为两组:对照组与Lv-shTPX2组。取对数生长期细胞,待细胞融合度达到70.0%~80.0%后,对照组与Lv-shTPX2组分别用lipofectamine 2000细胞转染试剂转染Lv-pc3.0 vector与Lv-pc3.0-shTPX2,转染终浓度为10 nmol/L,转染后12 h更换培养液。
1.2.3 细胞增殖 将转染后培养48 h的细胞消化离心,显微镜下计数,以细胞5 000个/孔的密度接种于96孔板,24 h后培养基中加入50 μmol/L Edu再孵育1~4 h,每次实验每孔重复3次,只显示1个有代表性的区域。
1.2.4 流式细胞仪分析细胞周期 将细胞消化、传代、培养24 h后换液,继续培养至72 h,0.25%胰酶消化成单细胞悬液,磷酸缓冲生理盐水(Phosphate Buffer Saline, PBS)洗涤2次,1 000 r/min离心5 min,弃去上清,缓慢加入-20℃预冷的75%乙醇,4℃保存,取细胞悬液,PBS洗涤,2 000 r/min离心5 min后,弃去上清液,碘化丙啶(Propidium Iodide, PI)染液1 mL,染30 min,每样本收集10 000个荧光信号,得出各期细胞数占细胞总数的百分率,每组重复3次。
1.2.5 蛋白印迹法检测目的蛋白的表达 培养细胞经预冷的PBS漂洗2次,吸净PBS,加入预冷的裂解液置于冰上。将研磨液置于离心管中震荡,间断吹打,共约30 min,反复吹打,超声破碎,置于4℃离心机中,以13 000 r/min的转速离心15 min,取上清液置于新的EP管中,加入蛋白上样缓冲液,反复吹打,利用BCA法定量蛋白,制备10%SDS-PAGE凝胶,上样,转膜,5%牛奶在室温孵育2 h,TBST洗3次,10 min/次,单克隆抗体GLI2、FOXM1以及TPX2(1 ∶ 3 000),GAPDH(1 ∶ 5 000),在4℃摇床过夜,TBST洗3次,10 min/次。二抗孵育:膜与相应的二抗在室温下孵育2 h。显色剂混合,滴于膜上。
1.3 观察指标
比较两组细胞的TPX2表达水平、细胞增殖指数、细胞周期(G1期、S2期、G+M期)相对比例、目的蛋白(GLI2、FOXM1)相对表达水平。
1.4 统计方法
使用SPSS 24.0统计学软件进行数据分析。符合正态分布的计量资料(TPX2表达水平、细胞增殖指数、细胞周期相对比例、目的蛋白相对表达水平)用(±s)表示,行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组细胞TPX2表达水平对比
转染后24、48 h,Lv-shTPX2组的TPX2 mRNA与蛋白相对表达水平低于对照组,差异有统计学意义(P均<0.05)。见表1。
表1 两组细胞TPX2表达水平对比(±s)
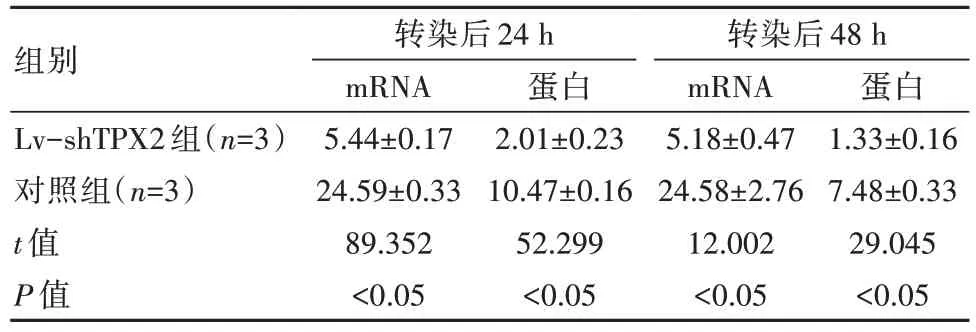
表1 两组细胞TPX2表达水平对比(±s)
组别Lv-shTPX2组(n=3)对照组(n=3)t值P值转染后24 h mRNA 5.44±0.17 24.59±0.33 89.352<0.05蛋白2.01±0.23 10.47±0.16 52.299<0.05转染后48 h mRNA 5.18±0.47 24.58±2.76 12.002<0.05蛋白1.33±0.16 7.48±0.33 29.045<0.05
2.2 两组细胞增殖指数对比
转染后24、48 h,Lv-shTPX2组的细胞增殖指数低于对照组,差异有统计学意义(P均<0.05)。见表2。
表2 两组细胞增殖指数对比[(±s),%]
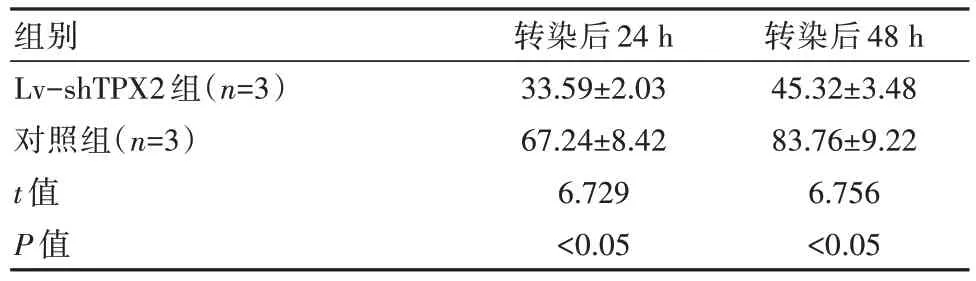
表2 两组细胞增殖指数对比[(±s),%]
组别Lv-shTPX2组(n=3)对照组(n=3)t值P值转染后24 h 33.59±2.03 67.24±8.42 6.729<0.05转染后48 h 45.32±3.48 83.76±9.22 6.756<0.05
2.3 两组细胞周期相对比例对比
转染48 h后,Lv-shTPX2组的G2+M期细胞相对比例高于对照组,S期细胞相对比例低于对照组,差异有统计学意义(P均<0.05)。见表3。
表3 两组细胞周期相对比例对比[(±s),%]
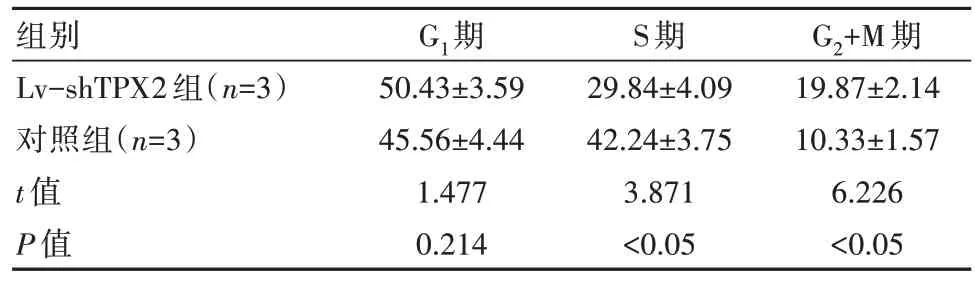
表3 两组细胞周期相对比例对比[(±s),%]
组别Lv-shTPX2组(n=3)对照组(n=3)t值P值G1期50.43±3.59 45.56±4.44 1.477 0.214 S期29.84±4.09 42.24±3.75 3.871<0.05 G2+M期19.87±2.14 10.33±1.57 6.226<0.05
2.4 两组细胞目的蛋白相对表达水平对比
转染48 h后,Lv-shTPX2组的GLI2、FOXM1蛋白相对含量低于对照组,差异有统计学意义(P均<0.05)。见表4。
表4 两组细胞目的蛋白相对表达水平对比[(±s),%]
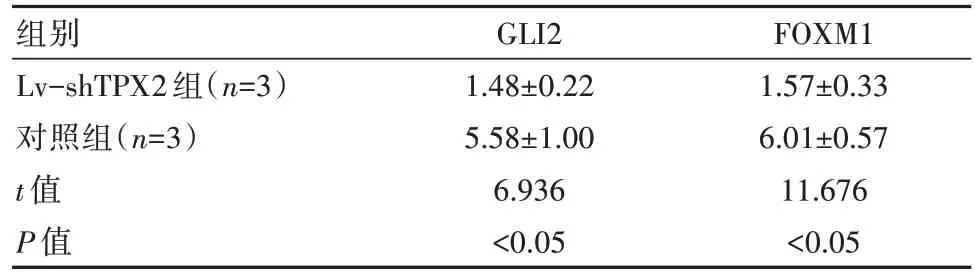
表4 两组细胞目的蛋白相对表达水平对比[(±s),%]
组别Lv-shTPX2组(n=3)对照组(n=3)t值P值GLI2 1.48±0.22 5.58±1.00 6.936<0.05 FOXM1 1.57±0.33 6.01±0.57 11.676<0.05
3 讨论
口腔鳞癌是头颈部最常见的恶性肿瘤之一,80.0%发生于口腔黏膜的癌症为鳞癌[5]。口腔鳞癌患者的预后比较差,5年生存率不到50.0%[6-7],肿瘤转移和放化疗耐受是口腔鳞癌致死的主要原因,为此需要为治疗口腔鳞癌寻找一条新的途径。有研究证实口腔鳞癌中Hh信号通路处于异常激活状态,但Hh信号通路如何调节肿瘤生长需要进一步研究[8]。同时目前有多种靶向抑制Hh通路的药物,主要为环靶明,但研究报道肿瘤细胞对环靶明产生耐药,因此需要进一步研究Hh信号通路下游分子,寻找直接导致口腔鳞癌细胞增殖和生长的原因,从而针对性研制出靶向治疗药物[9]。
TPX2是一种在多种肿瘤中呈高表达的癌基因,可促进有丝分裂纺锤体的形成,在细胞分裂及肿瘤的形成中也发挥有重要的作用,然而TPX2的表达调节机制仍不清楚[10]。本研究结果显示,转染后24、48 h,Lv-shTPX2组的TPX2 mRNA[(5.44±0.17)、(5.18±0.47)]与蛋白相对表达水平[(2.01±0.23)、(1.33±0.16)]低于对照组的TPX2 mRNA[(24.59±0.33)、(24.58±2.76)]与蛋白相对表达水平[(10.47±0.16)、(7.48±0.33)](P均<0.05);在尹颂豪等[11]的相关研究中显示,在转染TPX2-siRNA后,TPX2 mRNA在48 h后表达下调(F=224.8,P<0.001);TPX2蛋白质在72 h后表达下调(F=10.69,P=0.022)。Lv-shTPX2组的细胞增殖指数低于对照组(P<0.05),表明抑制Hh信号通路分子TPX2的表达可抑制口腔鳞癌细胞增殖。当前也有研究显示,TPX2持续高表达后,Edu染色、细胞增殖曲线及克隆形成实验证实口腔鳞癌细胞生长加速,sonic hedgehog (Shh)信号通路通过TPX2促进口腔鳞癌细胞增殖[12]。
在口腔鳞癌所有异常调节的信号通路中,Hh信号通路对肿瘤的增殖有重要的作用,TPX2是Hh信号通路的下游的靶基因[8]。GLI是重要的转录因子,调控Hh信号由胞质到胞核中,敲除GLI,TPX2的表达下降,GLI异常激活,TPX2的表达升高。激活Hh配体,Shh、TPX2表达亦升高[13]。FOXM1在高度分化和未分化的组织细胞中没有表达,而在增殖的上皮细胞和间充质细胞表现出高度活性,加速细胞周期进程,在正常组织受到损伤后,FOXM1的表达直接参与损伤后修复,为此异常激活的FOXM1作为癌基因而促进癌症的发生发展[14]。本研究结果显示,转染48 h后,Lv-shTPX2组的G2+M期细胞相对比例高于对照组,S期细胞相对比例低于对照组,Lv-shTPX2组的GLI2、FOXM1蛋白相对含量更低,(P均<0.05),表明抑制Hh信号通路分子TPX2的表达可抑制GLI2、FOXM1蛋白表达,还可调节细胞周期状况。
综上所述,抑制Hh信号通路分子TPX2的表达可抑制口腔鳞癌细胞增殖,也可抑制GLI2、FOXM1蛋白表达,还可调节细胞周期状况,可为治疗口腔鳞状细胞癌提供新的途径。

