ProGRP、CEA、CA153联合检验在乳腺癌初诊者中的表达意义分析
李高堂
东明县人民医院检验科,山东菏泽 274500
乳腺癌是一种发生率较高的恶性肿瘤,我国作为一个癌症高发国家,乳腺癌疾病的发病率呈明显增长趋势。早期诊断技术、综合性治疗方法的应用,可有效改善乳腺癌患者的生存率[1-2]。血清肿瘤标志物在肿瘤疾病早期诊断过程中发挥着积极作用,然而在诊断乳腺癌过程中缺少较高灵敏度、特异度的肿瘤标志物。其中癌胚抗原(Carcinoembryonic Antigen, CEA)以及糖类蛋白153(Carbohydrate Antigen-153, CA153)作为乳腺癌疾病临床诊断、预后效果评估中使用率较高的肿瘤标志物,其阳性表达率较低,进而导致临床使用范围受到限制[3-4]。因此,需进一步寻找具备较高特异度、灵敏度的肿瘤标志物,以此来提升乳腺癌临床诊断效果。鉴于此,本研究选取2019年11月—2022年11月东明县人民医院检验科收治的90例乳腺癌初诊者与90例良性肿瘤者作为研究对象,分析诊断过程中采取血清胃泌素释放肽前体(Pro-gastrinreleasing Peptide, ProCRP)、CEA以及CA153联合检验方式在疾病中的表达意义,现报道如下。
1 资料与方法
1.1 一般资料
选取本院收治的90例乳腺癌初诊者(病理确诊为乳腺癌,为乳腺癌组)与90例良性肿瘤者(同期收治;为良性肿瘤组)作为研究对象。乳腺癌组中年龄29~76岁,平均(57.15±1.48)岁;初诊例数56例,复发转移例数34例;学历:初中及以下23例,高中52例,本科及以上15例;体质指数(Body Mass Index, BMI)23~28 kg/m2,平均(25.64±1.02)kg/m2。良性肿瘤组中年龄22~81岁,平均(58.09±1.23)岁;学历:初中及以下21例,高中49例,本科及以上20例;BMI 21~29 kg/m3,平均(25.76±1.13)kg/m2。两组患者一般资料对比,差异无统计学意义(P>0.05),具有可比性。本研究通过医院医学伦理委员会批准(东明人医[2019]19号)。
1.2 纳入与排除标准
纳入标准:①乳腺癌初诊者通过乳腺癌切除术或者在B超引导下进行穿刺活检术,其临床病理结果表示疾病为乳腺癌,其中主要涉及浸润性或者非浸润性癌;②乳腺良性癌患者在通过乳腺癌切除术治疗或者B超引导下穿刺活检术后,被诊断为良性肿瘤;③患者在手术前没有开展辅助放疗或者化疗治疗;④临床资料与随访资料均无异常缺失;⑤对本研究内容(检查指标、检查操作等)知情同意。
排除标准:①身体重要脏器功能异常者;②不是初诊患者或者在手术前实施化疗、放疗治疗者;③合并患有其他恶性肿瘤疾病者;④中途退出本研究者;⑤临床配合度与依从性较差者。
1.3 方法
于清晨采集初诊者空腹状态下的静脉血液样本(约为5 mL),进行离心处理(转速3 500 r/min,时间为10 min),在分离结束后裁切机血清样本,并且在3 h内及时上机检验。使用电化学发光法分别对ProGRP、CEA以及CA153指标表达水平检查。
1.4 观察指标
①血清胃泌素释放肽前体(Pro-gastrinreleasing Peptide, ProGRP)、癌胚抗原(carcinoembryonic antigen, CEA)以及糖类蛋白153(carbohydrate antigen-153, CA153)指标表达水平比较:ProGRP指标水平参考值范围为0~63 pg/mL;CEA指标水平参考值范围为0~4.3 ng/mL;CA154指标水平参考值范围为0~25 U/mL[5]。
②单项、多项联合检测对乳腺癌临床诊断价值评估:其中主要涉及ProGRP、CEA、CA153单项检测;ProCRP+CEA、ProCRP+CA153、CEA+CA153、ProGRP+CEA+CA153多项联合检测。如果单独诊断超过正常参考值,视为阳性;联合诊断下,如有任意1项诊断超过正常参考值,视为阳性。灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%[6-7]。准确度=(真阳性例数+真阴性例数)/(真阳性例数+假阳性例数+假阴性例数+真阴性例数)×100%。
1.5 统计方法
采用SPSS 25.0统计学软件进行数据处理,ProGRP、CEA及CA153指标表达水平为计量资料,且符合正态分布,以(±s)表示,行t检验;诊断结果、诊断效能为计数资料,以例数(n)和率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者ProGRP、CEA及CA153指标表达水平比较
乳腺癌组的ProGRP、CEA及CA153指标水平均高于良性肿瘤组,差异有统计学意义(P均<0.05)。见表1。
表1 两组患者ProGRP、CEA及CA153指标表达水平比较(±s)
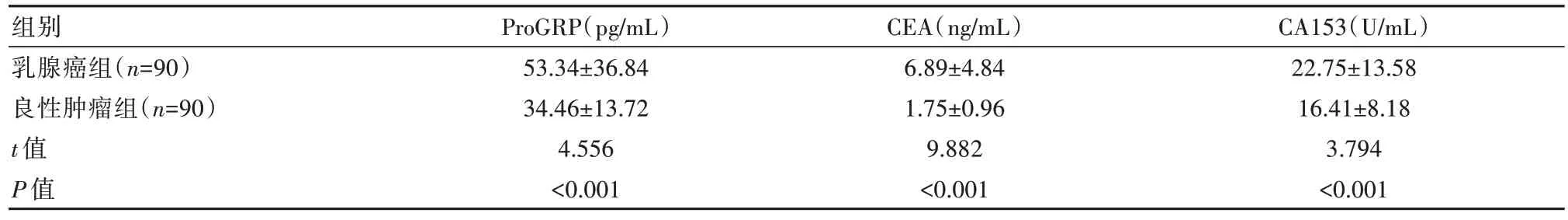
表1 两组患者ProGRP、CEA及CA153指标表达水平比较(±s)
注:ProGRP:血清胃泌素释放肽前体,CEA:癌胚抗原,CA153:糖类蛋白153。
组别乳腺癌组(n=90)良性肿瘤组(n=90)t值P值CA153(U/mL)22.75±13.58 16.41±8.18 3.794<0.001 ProGRP(pg/mL)53.34±36.84 34.46±13.72 4.556<0.001 CEA(ng/mL)6.89±4.84 1.75±0.96 9.882<0.001
2.2 单项、多项联合诊断效能对比
与CEA、CA153指标水平相比,ProGRP指标水平的灵敏度、特异度均更高;3项联合检测的灵敏度、特异性以及准确率均更高。见表2。

表2 单项、多项联合检测效能对比
3 讨论
临床研究表明,多项血清肿瘤标志物使用于恶性肿瘤疾病早期诊断、预后效果检测中具备较为突出的临床使用价值与意义[8-9]。胃泌素释放肽(Gastrin-releasing Peptide, GRP)最早出现在哺乳动物胃肠道之中,并且在神经系统与肺组织中均存在较高的表达情况,同时对肿瘤的进展可起到一定的控制作用。然而GRP在血液中半衰期时间相对较短,ProGRP具备突出的稳定性,其能够有效反映血清GRP指标水平及有关基因表达的变化情况,可将其视为小细胞肺癌临床诊断与预后效果检测的一项重要的血清肿瘤标志物[10]。有研究表明,在胃肠道肿瘤与卵巢癌等有关肿瘤疾病中,ProGRP指标水平较高,并且该项指标表达水平和临床病理学有关参数、预后检测、疾病复发检测等内容存在密切关联性,为此其临床应用价值较高[11-12]。
相关乳腺癌临床特点与病理学特点均可视为疾病重要预后评估指标,如淋巴结参与转移情况、分子病理相关参数等[13-14]。其中血清肿瘤标志物CEA与CA153指标水平对于检测乳腺癌预后效果均具有一定的临床价值,并且对于不同亚型的乳腺癌而言,其CEA1与CA153指标水平存在明显的差异性,同时指标水平较高和肿瘤负荷存在内在联系。有研究结果表明,HER-2阳性乳腺癌患者CEA指标水平呈明显的增长趋势,但是ER阴性乳腺癌患者其CA153指标水平增长情况更加显著。究其原因,CEA与CA153指标水平为乳腺癌初期诊断、预后效果评估中使用率较高的血清肿瘤标志物之一,然而上述指标在乳腺癌灵敏度与特异度较差,在早期乳腺癌阳性表达检测率较低。本研究结果显示,与乳腺良性组相比,乳腺癌组的ProGRP(53.34±36.84)pg/mL vs (34.46±13.72)pg/mL、CEA(6.89±4.84)ng/mL vs (1.75±0.96)pg/mL及CA153(22.75±13.58)U/mL vs(16.41±8.18)U/mL指标水平均更高(P均<0.05),并且3项指标联合检测的灵敏度(95.56%)与特异度(98.89%)均更高。由此可见,可将上述指标视为临床诊断乳腺癌患者的有效血清肿瘤标志物,且联合检测能够提高乳腺癌疾病临床诊断质量,这与刘冰玉[15]的研究结果[CA153灵敏度(56.67% vs 19.66%)、特异度(46.67% vs 49.61%)、准确度(51.11% vs 49.63%);CEA灵敏度(54.44% vs 16.21%)、特异度(47.56% vs 50.91%)、准确度(52.22% vs 48.89%);CA153+CEA灵敏度(82.22% vs 26.55%)、特异度(53.50% vs 58.31%),准确度(59.44% vs 61.85%)]类似。可见,ProGRP、CEA、CA153指标水平联合诊断,临床应用价值较高。然而,本研究还存在一定局限性,如样本观察时间较短,样本量较少,在后续研究中需进一步延长研究时间,增加样本量,以此来验证本研究结论。
综上所述,ProGRP、CEA、CA153指标联合用于乳腺癌患者临床诊断中,其临床诊断效果良好,并且ProGRP指标水平在此疾病患者中表达水平较高,且和肿瘤负荷与TNM分期等相关病理参数存在紧密联系,并且3项指标联合检测的灵敏度与特异度均更高。

