Neuritin野生型蛋白的制备及活性、稳定性的检测及分析
朱礼彦 孟平平 李煜 宋丹丹 孙嘉伟 汪海燕 朱金辉 魏韬艺 杨磊

摘要:目的 制備符合药典结构要求的无标签Neuritin野生型(wild type,WT)蛋白,并完成其存在形式、活性及稳定性鉴定及分析。方法 利用基因重组技术构建符合药典结构要求的Neuritin WT酵母重组子,利用SDS-PAGE还原电泳及Western blot对其进行高表达筛选及鉴定;摸索建立无标签Neuritin WT蛋白纯化方法,对纯化后的蛋白进行SDS-PAGE还原电泳分子量鉴定、Western blot免疫原性鉴定、SEC-HPLC精细鉴定及宿主DNA、宿主蛋白残留量检测;利用SDS-PAGE非还原电泳完成存在形式的鉴定;通过参照药典建立的重组Neuritin蛋白活性鉴定方法,检测并分析Neuritin WT纯化蛋白的活性,并观察37℃下不同时间Neuritin WT纯化蛋白的稳定性。
结果 制备了纯度高达98%以上的Neuritin WT纯化蛋白,蛋白相对分子质量为9.7 kDa,宿主DNA残留量为0.009 4 ng/剂,宿主蛋白残留量占比0.000 8%;经检测,该纯化蛋白存在单体、二聚体2种形式。活性鉴定结果表明该蛋白具有维持神经元存活的生物学活性;且37 ℃下3 d内降解率小于10%、7 d内未到达半衰期(蛋白降解率小于35%)。
结论 成功制备了纯度高达98%、杂质含量及结构符合药典要求的无标签Neuritin WT蛋白,分析了Neuritin WT蛋白的存在形式,并明确了该蛋白具有较好的生物学活性及稳定性,为Neuritin进一步功能、药学研究及生物制品的研制提供了物质基础。
关键词:Neuritin野生型蛋白;纯度;存在形式;神经元存活;稳定性
中图分类号:中图分类号R34文献标志码:A文献标识码
Preparation and activity, stability detection and analysis of Neuritin wild-type protein
ZHU Liyan1,MENG Pingping1,LI Yu1,SONG Dandan2,SUN Jiawei1,WANG Haiyan2,ZHU Jinhui1 ,WEI Taoyi1,YANG Lei2*
(1 School of Medicine, Shihezi University, Shihezi,Xinjiang 832000,China;
2 Department of Medicine, Hangzhou Normal University, Hangzhou,Zhejiang 310036,China)
Abstract: Objective To prepare unlabeled Neuritin wild-type (WT) protein that meets the structural requirements of the pharmacopoeia, and complete its identification and analysis of its form, activity, and stability.Methods Neuritin WT yeast recombinants conforming to pharmacopoeia structure were constructed by gene recombination technology, and the high-expression strains was screened and identified by SDS-PAGE reduction electrophoresis and Western blot. The unlabeled Neuritin WT protein purification method was established. The purified proteins were identified by SDS-PAGE reduction electrophoresis for molecular weight, Western blot for immunogenicity, SEC-HPLC for fine identification, and host DNA and host protein residues for quality inspection. The existence form was identified by SDS-PAGE non-reduction electrophoresis. The activity of Neuritin WT purified protein was detected and analyzed by establishing a method for identifying the activity of recombinant Neuritin protein in accordance with the requirements of the pharmacopoeia, and the stability of Neuritin WT purified protein at different times at 37 ℃ was observed.Results Neuritin WT purified protein with a purity of more than 98% was prepared, the relative molecular weight of protein was 9.7 kDa, the residual amount of host DNA was 0.009 4 ng/agent and the residual amount of host protein accounted for 0.000 8%. The purified protein was detected in the form of monomer and dimer. The activity identification results indicate that the protein has biological activity to maintain neuronal survival; The degradation rate within 3 days at 37 ℃ is less than 10%, and the half-life is not reached within 7 days (the protein degradation rate is less than 35%).Conclusion Neuritin WT unlabeled protein with purity up to 98%, impurity content and structure meeting pharmacopoeia requirements was successfully prepared. The existence form of Neuritin WT protein was analyzed, and it was confirmed that the protein has good biological activity and stability. Neuritin provides material basis for further functional, pharmaceutical and biological products development.
Key words: Neuritin wild-type protein;purity;existence form;neuron survival;stability
Neuritin是一种在中枢神经系统发育和可塑性中发挥重要功能的神经营养因子[1-2],能够促进神经突起生长、成熟[3-5]和神经元迁移[6],维持神经元存活[2]。研究发现Neuritin可能参与糖尿病周围神经病变[7-9]及创伤性脑损伤后的神经再生和修复过程[10]、并改善抑郁[11-12]和阿尔茨海默症造成的认知障碍[13-15]。我们开展了一系列Neuritin功能机制研究,发现外源性Neuritin可以促进神经再生和神经功能恢复,进而改善脊髓损伤[16],以上研究提示,Neuritin在神经损伤修复中发挥重要作用,有望成为治疗神经损伤的靶点药物。
本课题组前期用于开展Neuritin功能机制研究的Neuritin蛋白,均为利用基因工程技术制备的带有His标签的重组蛋白[17]。标签的存在既便于目的蛋白的表达纯化,又利于区别于内源性蛋白,实现示踪技术的应用,因此,带有标签的重组蛋白被广泛用于蛋白功能与机制的基础研究。但对于生物制剂的制备而言,标签的存在不仅会影响蛋白天然结构,对蛋白结构研究造成阻碍。更重要的是,《中国药典》规定重组蛋白类生物制品中不得带有融合标签[18]。因此,前期制备的带有His标签的Neuritin蛋白不符合重组蛋白生物制剂的结构要求,必须制备符合中国药典要求的高纯度、有活性的Neuritin 野生型(wild type,WT)蛋白,方可进行系列的药学研究。
本研究重新构建了符合药典结构要求的Neuritin WT酵母表达系统,对获得的无标签Neuritin WT蛋白进行纯化,分别对纯化蛋白的纯度、免疫原性、宿主DNA及宿主蛋白残留量进行检定,鉴定并分析其存在形式、生物学活性及稳定性,为Neuritin蛋白进一步的功能及药学研究奠定基础。
1 材料与方法
1.1 主要试剂及仪器
AKTA Start、XK26/20层析柱、疏水层析填料介质Phenyl Sepharose 6 Fast Flow(高取代(high sub, HS))购自GE公司,彩色预染蛋白marker 26616购自赛默飞公司,兔抗Neuritin抗体由华安公司制备,山羊抗兔IgG购自中杉金桥公司,高效液相色谱仪与分子尺寸排阻色谱柱购自Waters公司;毕赤酵母残留DNA检测试剂盒购自湖州申科生物科技有限公司;毕赤酵母宿主蛋白残留Elisa试剂盒购自Cygnus公司,BCA试剂盒购自碧云天公司,CCK-8试剂盒购于碧云天公司。
1.2 Neuritin WT酵母重组子的构建及鉴定
以本课题组前期构建的pPIC9K-his-Neuritin重组质粒为模板,使用PCR技术构建pPIC9K-Neuritin WT重组质粒,引物上游序列:5′-GAGGCTGAAGCTGCCGGTAAGTGTGATGCT-3′,下游序列:5′-ACACTTACCGGCAGCTTCAGCCTCTCTTTT-3′。将重组质粒线性化后通过电转技术与毕赤酵母GS115同源重组,利用含有G418的YPD平板对酵母重组子进行抗性筛选,利用PCR技术对酵母重组子进行基因型鉴定,详细操作见参考文献[17]。
1.3 Neuritin WT酵母重组子的鉴定及高表达筛选
1.3.1 Neuritin WT酵母重组子的发酵
挑取Neuritin WT酵母重组子置于BMGY培养基中扩大培养,30℃,220 r·min-1摇菌至OD600为2。收集菌液,4 500 r·min-1离心10min,留沉淀,使用BMMY培养基重悬菌体。30℃,220 r·min-1摇菌,每隔24h补加1%甲醇。72h后收集菌液,4℃,4 000 r·min-1离心15 min,留上清。
1.3.2 Neuritin WT酵母重组子发酵液预处理
发酵液经6 000 r·min-1,15min离心处理,取上清;纯水冲洗平板过滤器,将0.45μm孔径水系滤膜放置于夹具中,拧紧螺丝,调节支架使平板保持水平,进料口连接蠕动泵,出料口用容器盛装,过滤前后料液容器均冰上放置,保持低温,打开蠕动泵电源,将酵母发酵上清以40mL·min-1速度过滤至澄清。
1.3.3 Neuritin WT酵母重组子发酵产物的SDS-PAGE还原电泳鉴定
样品按照5∶1比例加入5×变性还原型loading buffer,置于100℃加熱器中加热10 min,使蛋白充分变性。使用4%~20%梯度胶进行SDS-PAGE电泳,160 V,50min。将凝胶置于考马斯亮蓝快速染色液中,于摇床上室温染色,60 r·min-1,30~60min。将凝胶置于纯水中,于60 r·min-1摇床上室温脱色,直至胶上条带清晰,使用凝胶成像仪中拍照保存。
1.3.4 Neuritin WT酵母重组子发酵产物的Western blot鉴定
电泳结束后,进行半干转实验,15 V,30 min,将蛋白转至PVDF膜上;将膜置于5%脱脂奶粉室温封闭2h,加入兔抗Neuritin抗体(1∶500稀释)4℃孵育过夜,TBST缓冲液洗涤3次,加入HRP山羊抗兔IgG(1∶10 000稀释)室温孵育2h,TBST缓冲液洗涤3次,ECL显色,化学发光仪拍照并储存。
1.4 Neuritin WT酵母发酵液的疏水层析纯化
连接AKTA和Unicorn系统,使用0.5 mol·L-1氢氧化钠冲洗层析柱,约3个柱体积(bed volume, BV);使用纯水冲洗层析柱,约3BV,完成柱再生;以含0.1 mol·L-1柠檬酸的0.2 mol·L-1磷酸钠缓冲液(pH=4.73)作为基础缓冲液,使用含有0.25 mol·L-1硫酸铵的基础缓冲液,柱平衡约3BV;在预处理后的发酵上清中缓慢分次加入0.25 mol·L-1硫酸铵,搅拌至完全溶解,于4℃下静置1h,作为纯化上样液,将纯化上样液,通过上样泵流入层析柱中;待上样完毕后,再次使用含有0.25 mol·L-1硫酸铵的基础缓冲液,柱平衡约3BV;使用基础缓冲液上样约3BV,完成第一步洗杂;将基础缓冲液电导率稀释至为0.34 ms·cm-1(约稀释十倍),上样约3BV,完成第二步洗杂;使用纯水洗脱目的蛋白,根据A280紫外吸光度收集目的蛋白(以上操作流速均为5mL·min-1)。
1.5 Neuritin WT纯化蛋白的蛋白含量测定
BCA试剂盒测定纯化产物蛋白质含量。
1.6 Neuritin WT纯化蛋白的Western blot分析
方法同1.3.2。
1.7 Neuritin WT纯化蛋白的SEC-HPLC纯度检测
疏水层析纯化產物经0.22μm滤膜过滤后,置于进样瓶中;流动相为磷酸氢二钠及磷酸二氢钠配置100mmol·L-1磷酸钠缓冲液(pH=7);流速0.86 mL·min-1;检测波长280nm;进样量10μL;洗脱方式为等度洗脱,通过观察色谱图出峰情况对纯化产物进行纯度鉴定。
1.8 Neuritin WT纯化蛋白的SDS-PAGE非还原电泳分析
样品中按照5∶1比例加入5×变性非还原型loading buffer,并置于100℃加热器中加热10 min,使蛋白充分变性。用4%~20%梯度胶进行SDS-PAGE电泳,160 V,50min。将凝胶置于考马斯亮蓝快速染色液中,于摇床上室温染色,60 r·min-1,30~60min。将凝胶置于纯水中,于60 r·min-1摇床上室温脱色,直至胶上条带清晰,使用凝胶成像仪中拍照保存。
1.9 Neuritin WT蛋白相关杂质的检测
使用毕赤酵母残留DNA检测试剂盒和毕赤酵母宿主蛋白残留ELISA试剂盒,分别检测纯化产物中的宿主残留DNA和宿主残留蛋白。
1.10 Neuritin WT蛋白对HT22细胞存活影响的检测
使用CCK-8法测定Neuritin WT蛋白对HT22细胞存活的影响,具体操作见参考文献[19]。
1.11 Neuritin WT蛋白的热稳定性分析
将2μg Neuritin WT纯化蛋白置于37℃水浴锅中,于0、1、3、5、7 d取出等体积蛋白,通过SDS-PAGE还原电泳(实验步骤同1.3.3),观察Neuritin WT纯化蛋白降解情况。
2 结果
2.1 Neuritin WT酵母表达系统的构建
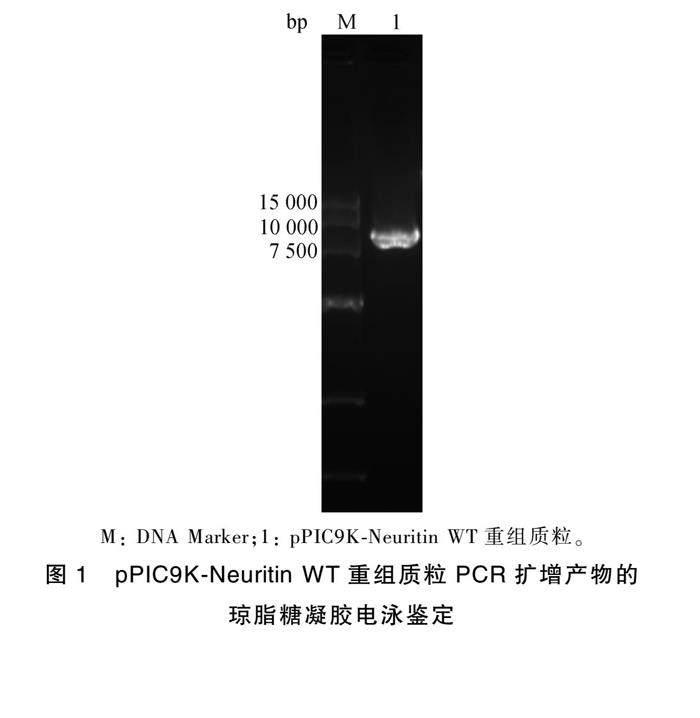
pPIC9K-Neuritin WT重组穿梭质粒PCR扩增的琼脂糖凝胶电泳鉴定结果显示,在9 558 bp左右出现特异性条带(图1),与预期分子量一致,表明Neuritin WT成功插入pPIC9K质粒。
2.2 Neuritin WT酵母重组子的高表达筛选
Neuritin WT酵母重组子发酵产物的SDS-PAGE还原电泳鉴定结果表明:阳性重组子均在10 kDa处出现条带,与Neuritin WT蛋白理论分子量相符;且Western blot特异性鉴定结果表明均为Neuritin蛋白。比较各阳性重组子表达量的差异,综合筛选2号菌株为高表达Neuritin WT蛋白的菌株(图2)。
2.3 Neuritin WT蛋白纯化工艺的建立
Neuritin WT蛋白纯化工艺的确立过程见图3,针对不同层析介质,摸索了其结合条件、洗杂条件、洗脱条件,最终明确Neuritin WT蛋白的疏水层析纯化工艺的条件:Phenyl Sepharose 6 Fast Flow(HS)作为层析填料,0.25 mol·L-1硫酸铵作为结合条件,基础缓冲液和10%基础缓冲液作为洗杂条件,纯水作为洗脱条件。Neuritin WT蛋白的纯化结果见图4,峰3为目的蛋白洗脱峰,峰1和峰2为杂质峰。
2.4 Neuritin WT纯化蛋白的分子量鉴定
利用SDS-PAGE还原电泳对Neuritin WT纯化产物进行分子量鉴定,结果显示仅10 kDa处出现一处条带,条带位置与预期分子量相符(图5),且灰度值扫描初步分析纯度在99%以上。
2.5 Neuritin WT纯化蛋白的免疫原性鉴定
Neuritin WT纯化产物免疫原性鉴定结果显示,在约10 kDa处可见特异性结合条带,与预期值相符(图6),表明该纯化产物为Neuritin蛋白。
2.6 Neuritin WT纯化蛋白的存在形式鉴定
Neuritin WT纯化产物SDS-PAGE非还原电泳结果显示,在10 kDa、15 kDa位置出现两处条带(图7),结合SDS-PAGE还原电泳结果(图5),我们判断10 kDa处为Neuritin蛋白单体形式,15 kDa处为Neuritin蛋白二聚体形式。
2.7 Neuritin WT纯化蛋白的精细鉴定
SEC-HPLC对Neuritin WT纯化产物精细鉴定结果显示,色谱图中共出现两个色谱峰,出峰时间分别为8.397min(峰1)和9.613min(峰2)。峰1对应15 kDa,峰2对应10 kDa;结合图6的结果,确定峰1为Neuritin蛋白二聚体形式,峰2为Neuritin蛋白单体形式(图8),对两峰面积进行归一化计算,结果显示纯化产物纯度为98%。
2.8 Neuritin WT纯化蛋白中宿主DNA残留量检测结果
以毕赤酵母宿主残留DNA检测试剂盒中的标准品建立标准曲线(图9),将浓度为0.6mg·mL-1的Neuritin WT蛋白稀释10倍,qPCR测得样品Ct平均值为31.74,代入标准曲线,测得宿主DNA残留量为0.0047 ng·mL-1(表1),按照每剂安瓶中加入2mL蛋白原液,则安瓶中宿主DNA的残留含量为0.0094 ng·剂-1,符合2020版的《中国药典》小于10 ng·剂-1的要求。
2.9 Neuritin WT纯化蛋白中宿主蛋白残留量检测结果
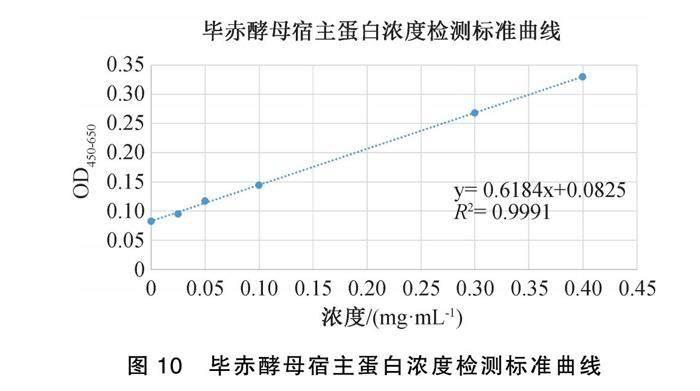
以毕赤酵母宿主残留蛋白检测试剂盒中标准品浓度与相应OD450-650值建立标准曲线,结果见图10。将浓度为0.6mg·mL-1的Neuritin WT蛋白稀释20倍,测得宿主蛋白OD450-650值为0.2152、0.2162、0.2154,代入标准曲线中可得宿主蛋白残留含量为4.86、4.92、4.87 ng·mL-1,占总蛋白含量的0.0008%,符合2020版《中国药典》小于0.5%的要求,详见表2。
2.10 Neuritin WT纯化蛋白的活性分析
不同浓度的Neuritin WT纯化蛋白作用HT22细胞,细胞存活结果显示,Neuritin WT浓度从15.625 ng·mL-1起开始发挥其维持神经元存活的作用,在浓度达到1 000 ng·mL-1时,细胞存活率最高;且在有效作用浓度内,Neuritin WT純化蛋白浓度与HT22细胞存活存在剂量效应关系(图11)。
2.11 Neuritin WT纯化蛋白的稳定性检测
Neuritin WT纯化蛋白稳定性检测结果显示,该蛋白在37℃下,3 d内,蛋白降解率不到10%;5 d时,蛋白降解率16%左右;7 d时,蛋白降解率34%左右(图12)。
3 讨论
本研究首先构建了无标签Neuritin WT酵母表达系统,建立了区别于标签蛋白的Neuritin WT蛋白纯化方法,获得了纯度达到98%的Neuritin WT纯化蛋白,经鉴定,该蛋白具有活性,37℃ 7 d内蛋白降解率小于50%,且杂质含量符合药典对生物制剂的要求。本研究为Neuritin的结构及药学研究奠定了基础。
纯化是无标签重组蛋白制备过程中的关键环节。在完成无标签Neuritin WT酵母表达系统构建后,本课题组通过ExPASY ProtScale,首先对Neuritin活性片段的理化性质进行理论预测分析,结果显示Neuritin消光系数小于1.5,属于较稳定蛋白,且其结构中疏水区大于亲水区[20],这提示我们可以根据Neuritin WT蛋白与其他杂质疏水性的差异进行分离纯化。因此,本研究选择疏水层析作为Neuritin WT蛋白的首选纯化方法。
影响疏水层析纯化效果的主要因素有介质类型、盐种类及盐离子强度等。疏水层析实验中最常用的介质是琼脂糖层析介质(Phenyl Sepharose),因此选用Phenyl Sepharose 6 Fast Flow(HS)作为层析介质;缓冲液中盐离子的强度对目的蛋白的结合和洗脱具有重要影响,SO42-可以提高蛋白构象稳定性,使其溶解度下降,增强蛋白和固定相的疏水作用,因此我们选择0.25 mol·L-1硫酸铵作为结合条件;盐离子强度对疏水作用的影响体现在盐浓度越高,蛋白疏水性越强,越不易洗脱。因此,当盐浓度逐渐降低时,疏水性不同的物质会先后与介质分离,在以基础缓冲液和10%基础缓冲液作为洗杂条件时,Neuritin WT蛋白中的杂质被解吸,而在以纯水作为洗脱条件时,目的蛋白被成功洗脱,初步纯度鉴定结果显示,纯度在99%以上(图5)。最终我们建立了以0.25 mol·L-1硫酸铵作为结合条件,基础缓冲液和10%基础缓冲液作为洗杂条件,纯水作为洗脱条件的Neuritin WT蛋白的疏水层析纯化工艺。
通过以上纯化工艺获得的纯化产物,其免疫原性鉴定结果显示,条带单一,确定为Neuritin蛋白。接下来,我们对纯化产物进行存在形式鉴定,SDS-PAGE非还原电泳结果显示,在10 kDa及15 kDa处出现条带(图7),而经还原后,仅10 kDa一条带(图5),说明它们均为Neuritin蛋白,只是存在形式不同;结合分子量的理论推测,基本认定它们分别为二聚体和单体两种存在形式。纯化产物进一步SEC-HPLC的精细鉴定显示,色谱图中出现10 kDa和15 kDa两个色谱峰(图8),与存在形式鉴定结果一致,即Neuritin单体和二聚体。两峰相对峰面积计算结果显示,纯化产物纯度达到98%。
按照药典要求,随后我们对Neuritin WT纯化蛋白中的杂质含量进行检测,结果显示该纯化蛋白中,宿主DNA残留量及宿主蛋白残留量均符合药典要求。
最后,我们对Neuritin WT纯化蛋白分别进行了活性及稳定性鉴定,利用本课题组前期建立的一种分析重组人Neuritin蛋白生物学活性的方法[19],通过检测Neuritin对HT22细胞存活的维持作用,鉴定并分析Neuritin WT纯化蛋白的活性,探讨了Neuritin WT纯化蛋白与HT22细胞的存活率之间的量效关系,确定了Neuritin WT纯化蛋白的活性及有效浓度范围,证明本研究制备的Neuritin WT纯化蛋白具有较好的生物学活性。
蛋白质在生理温度(37℃)下的稳定性对其在体内发挥活性功能至关重要,Neuritin WT纯化蛋白的热稳定性鉴定结果显示,该蛋白于37℃,3 d内降解率小于10%,说明该蛋白三天内很稳定;7 d时蛋白降解不到35%,未到达其半衰期(<50%)。该结果为Neuritin蛋白在细胞水平和动物水平的功能研究,提供了重要的用药剂量和用药时间的依据。
综上所述,本研究制备的无标签Neuritin WT蛋白,经鉴定,该蛋白的纯度及杂质含量均符合药典要求,具有较好的生物学活性,且37℃下7天内基本稳定。该蛋白不仅适用于开展系列的药学研究,也为其深入的功能研究以及生物制剂的研制提供了重要的物质条件。
参考文献(References)
[1] YAO J J, ZHAO Q R, LU J M, et al. Functions and the related signaling pathways of the neurotrophic factor neuritin[J]. Acta Pharmacologica Sinica, 2018, 39(9): 1414-1420.
[2] FUJINO T, WU Z, LIN W C, et al. cpg15 and cpg15-2 constitute a family of activity-regulated ligands expressed differentially in the nervous system to promote neurite growth and neuronal survival[J]. Journal of Comparative Neurology, 2008, 507(5): 1831-1845.
[3] NAEVE G S, RAMAKRISHNAN M, KRAMER R, et al. Neuritin: A gene induced by neural activity and neurotrophins that promotes neuritogenesis[J]. Proceedings of the National Academy of Sciences, 1997, 94(6): 2648-2653.
[4] CAPPELLETTI G, GALBIATI M, RONCHI C, et al. Neuritin (cpg15) enhances the differentiating effect of NGF on neuronal PC12 cells[J]. Journal of Neuroscience Research, 2007, 85(12): 2702-2713.
[5] JAVAHERIAN A, CLINE H T. Coordinated motor neuron axon growth and neuromuscular synaptogenesis are promoted by CPG15 in vivo[J]. Neuron, 2005, 45(4): 505-512.
[6] ZITO A, CARTELLI D, CAPPELLETTI G. Neuritin 1 promotes neuronal migration[J]. Brain Structure & Function, 2014, 219(1): 105-118.
[7] YIN Y, QU H, YANG Q, et al. Astragaloside IV alleviates Schwann cell injury in diabetic peripheral neuropathy by regulating microRNA-155-mediated autophagy[J]. Phytomedicine, 2021, 92: 153749.
[8] ZHANG Z, LIU Y, ZHOU J. Neuritin promotes bone marrow-derived mesenchymal stem cell migration to treat diabetic peripheral neuropathy[J]. Molecular Neurobiology, 2022, 59(11): 6666-6683.
[9] SHI M, ZHANG X, ZHANG R, et al. Glycyrrhizic acid promotes sciatic nerves recovery in type 1 diabetic rats and protects Schwann cells from high glucose-induced cytotoxicity[J]. Journal of Biomedical Research, 2022, 36(3): 181-194.
[10] HE Y, YANG G, WANG Y, et al. Expression of candidate plasticity-related gene 15 is increased following traumatic brain injury[J]. Neurological Research, 2013, 35(2): 174-180.
[11] SON H, BANASR M, CHOI M, et al. Neuritin produces antidepressant actions and blocks the neuronal and behavioral deficits caused by chronic stress[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(28): 11378-11383.
[12] LEE S H, KIM N S, CHOI M, et al. LGI1 governs neuritin-mediated resilience to chronic stress[J]. Neurobiology of Stress, 2021, 15: 100373-100373.
[13] CHANDLER D, DRAGOVIC' M, COOPER M, et al. Impact of Neuritin 1 (NRN1) polymorphisms on fluid intelligence in schizophrenia[J]. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 2010, 153(2): 428-437.
[14] SONG D, LI G, HONG Y, et al. miR 199a decreases Neuritin expression involved in the development of Alzheimer′s disease in APP/PS1 mice[J]. International journal of molecular medicine, 2020(1): 46.
[15] AN K, JUNG J H, JEONG A Y, et al. Neuritin can normalize neural deficits of Alzheimer′s disease[J]. Cell Death & Disease, 2014, 5(11): e1523-e1523.
[16] GAO R, LI X, XI S, et al. Exogenous neuritin promotes nerve regeneration after acute spinal cord injury in rats[J]. Human Gene Therapy, 2016,27(7): 544.
[17] 张树军, 赵臣, 狄建军, 等. Neuritin毕赤酵母表达系统的构建及其对PC12细胞的影响[J]. 生物技术通报, 2013(10): 148-152.
ZHANG S J, ZHAO C, DI J J, et al. Constuction the pichia pastoris expression system of neuritin and its impacts on PC12 cell[J]. Biotechnology Bulletin,2013(10): 148-152.
[18] 國家药典委员会. 中国药典[M]. 北京:中国医药科技出版社, 2020.
[19] 王宿洁, 宋丹丹, 李煜, 等. 重组人Neuritin蛋白生物学活性的定量分析方法[J]. 石河子大学学报(自然科学版), 2022, 40(5): 611-619.
WANG S J, SONG D D, LI Y, et al. Methods about quantitative analysis of biological activity of recombinant human Neuritin protein[J]. Journal of Shihezi University(Natural Science), 2022, 40(5): 611-619.
[20] 李煜, 孟平平, 王宿洁, 等. Neuritin结构组成分析及其相互作用蛋白生物信息学预测[J]. 石河子大学学报(自然科学版), 2023,41(1): 87-92.
LI Y, MENG P P, WANG S J,et al. Structural composition analysis of Neuritin and bioinformatics prediction of its interactive protein[J]. Journal of Shihezi University(Natural Science), 2023,41(1): 87-92.
(责任编辑:编辑唐慧)

