白桦脂醇酯类衍生物合成及体外抗氧化活性评价
张彦南,张欣,邹梓萱,余梓楷,王涛(广州中医药大学,广东 广州 510006)
白桦脂醇是含C-30骨架的羽扇烷型五环三萜成分,在桦木树皮、石榴树皮和叶,以及酸枣仁、天门冬、大枣等[1]中药中广泛存在。白桦脂醇有清热解毒、调血脂、消炎、抗痢疾、提高免疫力和抑制一氧化氮等作用[2]。但白桦脂醇属于亲脂性物质(油水分配系数lgP=5.34),其在体内存在溶解度低、吸收较差、生物利用度低等缺陷[3],因此,以白桦脂醇为先导化合物开展结构修饰对克服其缺陷,获得高活性化合物具有重要研究意义。已有研究显示采用前药拼接原理合成的白桦脂醇酯类衍生物,可以改善其药代动力学参数,增加渗透性及提高原药的生物活性[4-6]。
内源性或外源性活性氧的侵袭与系列疾病,如心脑血管疾病、癌症、白内障等的产生息息相关,及时对这些活性氧进行清除是维持正常生理过程的关键。白桦脂醇发挥抗肿瘤、抗炎作用等均与其抗氧化作用相关[7-9]。白桦脂醇酯类衍生物抑制活性氧自由基形成的能力也被证实,白桦脂醇及其衍生物对肾小管上皮细胞抗氧化状态(TEAC)、脂质过氧产物丙二醛(MDA)以及抗氧化酶(SOD、CAT和GPX)的影响存在差异,提示这些化合物在发挥抗肿瘤作用时产生肾毒性的不同[10]。白桦脂醇清除羟自由基的能力为其作为潜在天然抗氧化剂提供了实验佐证[11],使白桦脂醇在食品、化妆品、医药行业中的应用受到了广泛关注。白桦脂醇的结构是其抗氧化作用的基础,其常见的修饰位点(3位羟基和28位羟基)与抗氧化作用关系的研究未见报道。
本研究通过控制变量,探究不同溶剂、温度等条件下对白桦脂醇3-,28-位的不同位点开展修饰,通过考察白桦脂醇及其酯类衍生物对体外自由基1,1-二苯基-2-三硝基苯肼自由基(DPPH)的清除作用,进而评价其体外抗氧化活性,并探究不同位点修饰对于体外抗氧化活性的影响,为白桦脂醇衍生物的研究及开发提供实验依据和指导。
1 实验材料
1.1 仪器Bruker Avance 400核磁共振仪器,美国Bruker公司;X-6显微熔点测定仪,北京泰克仪器有限公司;PT-104/35S电子分析天平,美国康州HZ电子有限公司;AB SCIEX Triple TOF5600+LC-MS/MS System,美国AB Sciex公司;WFH-203B暗箱式紫外分析仪,广州东巨实验仪器有限公司;DNM-9606型酶标分析仪,北京普朗新科技有限公司;DHG-9070A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;DLSB-10/20低温冷却液循环泵,巩义市予华仪器有限责任公司。
1.2 试剂白桦脂醇,南京泽郎生物科技有限公司,纯度>95%;其余试剂均为国产分析纯试剂。1,1-二苯基-2-三硝基苯肼(DPPH),美国Sigma公司,纯度>97%。
2 实验方法
2.1 白桦脂醇衍生物的合成见图1。
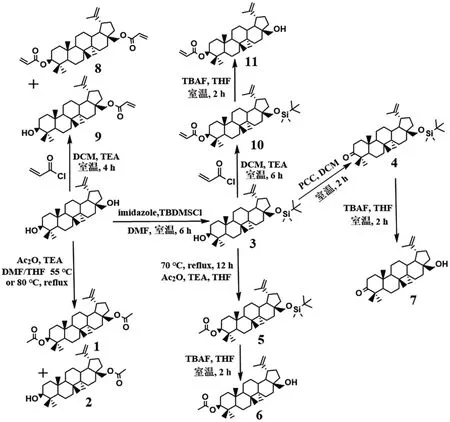
图1 白桦脂醇衍生物的合成Figure 1 Synthesis of derivatives of betulin
2.1.13,28-二乙酰基白桦脂醇(1)与28-乙酰基白桦脂醇(2)的合成 反应瓶中各加入白桦脂醇0.2 g(0.45 mmol),分别取5 mL二甲基甲酰胺(DMF)和预先用4Å分子筛干燥的5mL四氢呋喃(THF)加入瓶中使白桦脂醇充分溶解;再分别加入乙酸酐(AC2O)98μL(1.04 mmol)和乙酸酐213μL(2.26 mmol);最后加入三乙胺(TEA)125μL(0.90 mmol),瓶中放入磁力搅拌子,55℃水浴下反应12 h。反应结束,得到黄褐色液体。反应液依次用饱和碳酸氢钠(30 mL)、蒸馏水(3×30 mL)、饱和食盐水(30 mL)洗涤,有机层用无水硫酸钠干燥,过滤,减压蒸馏。经过200~300目硅胶柱层析梯度洗脱纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶45→1∶15)得到白色固体1与2。化合物1的熔点为216~218℃。1H NMR(400 MHz,Chloroform-d)δ:4.68(d,J=2.3 Hz,1H),4.61-4.56(m,1H),4.46(dd,J=10.1,5.9 Hz,1H),4.25(dd,J=11.1,1.9 Hz,1H),3.85(d,J=11.0 Hz,1H),2.44(td,J=11.0,5.8 Hz,1H),2.06(s,3H),2.04-2.03(m,3H),1.98-1.75(m,3H),1.68(s,3H),1.66-1.59(m,5H),1.58-1.45(m,2H),1.42-1.36(m,5H),1.29-1.22(m,6H),1.22-1.17(m,1H),1.06(d,J=3.7 Hz,2H),1.03(s,3H),0.96(s,3H),0.86-0.82(m,9H);13C NMR(101 MHz,Chloroformd)δ:171.7(C=O),171.1(C=O),150.3(C20),110.1(C30),81.1(C3),62.9(C28),55.5(C5),50.4(C9),48.9(C19),47.8(C18),46.4(C17),42.8(C14),41.1(C8),38.5(C1),37.9(C13),37.7(C4),37.2(C10),34.7(C22),34.3(C7),29.9(C16),29.7(C21),28.1(C15),27.2(C12),25.3(C24),23.8(C2),21.4(),21.2(C11),20.9(),19.2(C29),18.3(C23),16.6(C6),16.3(C25),16.2(C26),14.9(C27)。ESI-HRMSm/zcalced for:C34H54O4[M+K]+565.366 5,found:565.365 4。化合物2的熔点为209~211℃。1H NMR(400 MHz,Chloroform-d)δ:4.69(d,J=2.3 Hz,1H),4.59(dt,J=2.3,1.4 Hz,1H),4.24(dd,J=11.1,1.9 Hz,1H),3.86(dd,J=11.0,1.4 Hz,1H),3.18(dd,J=11.2,4.9 Hz,1H),2.44(td,J=11.0,5.8 Hz,1H),2.07(s,3H),2.00-1.74(m,3H),1.68-1.67(m,3H),1.65-1.59(m,3H),1.59-1.46(m,5H),1.44-1.35(m,6H),1.28-1.19(m,5H),1.07(dt,J=11.0,2.1 Hz,2H),1.03(s,3H),0.97(s,3H),0.96(s,3H),0.82(s,3H),0.76(s,3H);13C NMR(101MHz,Chloroform-d)δ:171.9(C=O),150.3(C20),109.9(C30),79.1(C3),62.9(C28),55.4(C5),50.5(C9),48.9(C19),47.8(C18),46.5(C17),42.8(C14),41.0(C8),39.0(C13),38.9(C1),37.7(C4),37.3(C10),34.7(C22),34.3(C7),29.9(C16),29.7(C21),28.1(C15),27.6(C2),27.2(C12),25.3(C23),21.2(C11),20.9(-COCH3),19.3(C24),18.4(C29),16.2(C25),16.2(C26),15.5(C6),14.9(C27)。ESI-HRMSm/zcalced for:C32H52O3[M+Na]+507.381 5,found:507.380 9。
2.1.23-乙酰基白桦脂醇(6)的合成
2.1.2.128-二甲基叔丁基硅氧基白桦脂醇(3)的合成取白桦脂醇0.2 g(0.45 mmol)溶解在10 mL DMF中,随后在0℃下,向反应瓶中加入叔丁基二甲基氯硅烷(TBDMSCl)81 mg(0.54 mmol)与咪唑92 mg(1.36 mmol),瓶中放入磁力搅拌子,室温搅拌反应6 h。反应结束后,用蒸馏水(3×30 mL),乙酸乙酯(50 mL)萃取,合并有机层。饱和食盐水(30 mL)洗涤有机层,加入无水硫酸钠干燥,过滤,减压浓缩,经过200~300目硅胶柱层析纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶17)得到化合物3为白色固体(0.24 g),熔点为250~252℃,产率:94.8%。
2.1.2.23-乙酰基-28-二甲基叔丁基硅氧基白桦脂醇(5)的合成 取化合物30.21 g(0.38 mmol)溶解在10 mL THF中,加入乙酸酐106μL(1.13 mmol)、TEA 104μL(0.75 mmol),瓶中放入磁力搅拌子,70℃油浴下回流12 h。反应结束,依次用饱和碳酸氢钠(30 mL)、蒸馏水(3×30 mL)、饱和食盐水(30 mL)洗涤,有机层用无水硫酸钠干燥,过滤,滤液减压蒸馏。经过200~300目硅胶柱层析纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶45)得到化合物5为白色固体(73.2 mg),产率:32.4%。
2.1.2.33-乙酰基白桦脂醇(6)的合成取化合物573.2 mg(0.12 mmol),加入四丁基氟化铵(TBAF,1 mol·L-1的四氢呋喃溶液)1.0 mL,瓶中放入磁力搅拌子,室温搅拌反应2 h。反应结束后,用蒸馏水(3×30 mL),乙酸乙酯(50 mL)萃取,合并有机层。饱和食盐水(30 mL)洗涤有机层,加入无水硫酸钠干燥,过滤,滤液减压浓缩,经过200~300目硅胶柱层析纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶17)得到化合物6为白色固体(57.9 mg),产率:97.7%,熔点为257~259℃。1H NMR(400 MHz,Chloroform-d)δ:4.68(d,J=2.4 Hz,1H),4.58(dt,J=2.5,1.4 Hz,1H),4.47(dd,J=10.5,5.6 Hz,1H),3.79(dd,J=10.8,1.9 Hz,1H),3.33(dd,J=10.8,1.2 Hz,1H),2.37(t,J=11.4,5.6 Hz,1H),2.04(s,3H),1.96-1.82(m,3H),1.68(s,3H),1.65-1.60(m,5H),1.58(s,1H),1.43-1.36(m,6H),1.33(s,1H),1.30-1.23(m,7H),1.22-1.20(m,1H),1.02(s,3H),0.97(s,3H),0.84(d,J=1.3 Hz,6H),0.83(s,3H);13C NMR(101 MHz,Chloroform-d)δ:171.2(C=O),150.6(C20),109.9(C30),81.1(C3),60.7(C28),55.5(C5),50.5(C9),48.9(C18),47.9(C19,C17),42.9(C14),41.1(C8),38.5(C1),37.9(C10),37.3(C4,C13),34.2(C22,C7),29.9(C21),29.3(C16),28.1(C15),27.2(C24),25.3(C12),23.8(C2),21.5(),21.0(C11),19.2(C29),18.3(C23),16.6(C6),16.3(C25),16.1(C26),14.9(C27)。ESI-HRMSm/zcalced for:C32H52O3[M+H]+485.400 0,found:485.398 9。
2.1.33-羰基白桦脂醇(7)的合成
2.1.3.13-羰基-28-二甲基叔丁基硅氧基白桦脂醇(4)的合成 取化合物30.2 g(0.36 mmol)溶解在5 mL二氯甲烷(DCM)中,加入氯铬酸吡啶鎓盐试剂(PCC试剂)116.1 mg(0.54 mmol),瓶中放入磁力搅拌子搅拌,室温下反应2 h。反应结束,用蒸馏水(3×30 m L),乙酸乙酯(50 m L)萃取,合并有机层。饱和食盐水(30 mL)洗涤有机层,加入无水硫酸钠干燥,过滤,滤液减压浓缩,经过200~300目硅胶柱层析纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶40)得到化合物4为白色透明油状液体(0.19 g),产率:96.9%。
2.1.3.23-羰基白桦脂醇(7)的合成 取化合物40.19 g(0.35 mmol),加入1 mol·L-1四丁基氟化铵(TBAF)的四氢呋喃溶液2 mL,瓶中放入磁力搅拌子,室温搅拌反应2 h。反应结束后,用蒸馏水(3×30 mL),乙酸乙酯(50mL)萃取,合并有机层。饱和食盐水(30mL)洗涤有机层,加入无水硫酸钠干燥,过滤,滤液减压浓缩,经过200~300目硅胶柱层析纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶13)得到化合物7为白色固体(0.15 g),产率:95.4%,熔点为200~201℃。1H NMR(400MHz,Chloroform-d)δ:4.68(d,J=2.3 Hz,1H),4.58(dq,J=2.8,1.4 Hz,1H),3.79(dd,J=10.9,1.9 Hz,1H),3.34(dd,J=10.8,1.2 Hz,1H),2.53-2.32(m,3H),1.96-1.85(m,3H),1.68-1.67(m,3H),1.66-1.59(m,2H),1.59-1.48(m,3H),1.43(m,J=13.5,8.7,4.4,2.3 Hz,6H),1.37-1.22(m,6H),1.09(dd,J=4.4,2.6 Hz,2H),1.06(s,6H),1.02(s,3H),0.98(d,J=1.0 Hz,3H),0.92(s,3H);13CNMR(101MHz,Chloroform-d)δ:217.1(C=O),149.4(C20),108.7(C30),59.5(C28),53.9(C5),48.7(C9),47.7(C18),46.7(C19),46.3(C17),41.8(C4),39.9(C14),38.6(C8),36.4(C1),35.9(C13),33.1(C10),32.9(C22),32.5(C2),28.7(C7),28.7(C21),28.1(C16),26.0(C15),25.6(C12),24.2(C23),20.4(C24),20.0(C11),18.6(C6),18.1(C29),14.9(C26),14.8(C25),13.7(C27)。ESI-HRMSm/zcalced for:C30H48O2[M+H]+441.373 3,found:441.372 7。
2.1.43,28-二烯丙酰基白桦脂醇(8)与28-烯丙酰基白桦脂醇(9)的合成 反应瓶中分别加入白桦脂醇0.2 g(0.45 mmol),溶解在5 mL DCM中,加入丙烯酰氯73μL(0.9 mmol),最后加入TEA 125μL(0.9 mmol),瓶中放入磁力搅拌子,室温下反应4 h。反应结束后,用蒸馏水(3×30 mL),乙酸乙酯(50 mL)萃取,合并有机层。饱和食盐水(30 mL)洗涤有机层,加入无水硫酸钠干燥,过滤,滤液减压浓缩,经过200~300目硅胶柱层析纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶40)得到淡黄色油状液体8(87.2 mg),产率:35.0%。1H NMR(400 MHz,Chloroform-d)δ:6.38(m,J=17.3,13.7,1.6 Hz,2H),6.12(m,J=17.3,11.4,10.4 Hz,2H),5.81(m,J=12.2,10.4,1.5 Hz,2H),4.69(d,J=2.3 Hz,1H),4.59(t,J=1.9 Hz,1H),4.55(dd,J=10.8,5.4 Hz,1H),4.36(dd,J=11.2,1.9 Hz,1H),3.93(dd,J=11.1,1.3 Hz,1H),2.47(td,J=11.1,5.8 Hz,1H),2.01-1.78(m,3H),1.69(s,3H),1.67-1.60(m,5H),1.60-1.46(m,2H),1.45-1.37(m,5H),1.34-1.23(m,6H),1.22-1.14(m,1H),1.12-1.06(m,2H),1.04(s,3H),0.98(s,3H),0.88-0.85(m,9H);13CNMR(101MHz,Chloroform-d)δ:166.8(C=O),166.2(C=O),150.3(C20),130.6(-CH=),130.2(-CH=),129.3(-=CH2),128.8(-=CH2),110.1(C30),81.2(C3),63.0(C28),55.5(C5),50.4(C9),48.9(C19),47.9(C18),46.6(C17),42.9(C14),41.0(C8),38.5(C13),38.1(C4),37.7(C1),37.2(C10),34.7(C22),34.3(C7),29.9(C16),29.7(C21),28.1(C15),27.2(C12),25.3(C23),23.8(C2),20.9(C11),19.3(C29),18.3(C24),16.7(C6),16.3(C25),16.2(C26),14.9(C27)。
同法洗脱得到9为淡黄色油状液体(55.3 mg),产率:24.6%。1H NMR(400 MHz,Chloroform-d)δ:6.40(dd,J=17.4,1.5 Hz,1H),6.14(dd,J=17.3,10.4 Hz,1H),5.83(dd,J=10.4,1.5 Hz,1H),4.70(d,J=2.3 Hz,1H),4.59(q,J=1.7 Hz,1H),4.35(dd,J=11.2,2.0 Hz,1H),3.94(dd,J=11.2,1.4 Hz,1H),3.18(dd,J=11.2,4.9 Hz,1H),2.47(td,J=11.1,5.7 Hz,1H),2.00-1.79(m,3H),1.69-1.68(m,3H),1.67-1.58(m,5H),1.52(dd,J=8.1,5.3 Hz,2H),1.43-1.38(m,5H),1.26(d,J=3.0 Hz,6H),1.20(d,J=4.1 Hz,1H),1.12-1.06(m,2H),1.04(s,3H),0.98(s,3H),0.96(s,3H),0.82(s,3H),0.76(s,3H);13C NMR(101 MHz,Chloroform-d)δ:166.8(C=O),150.3(C20),130.6(-CH=),128.8(-=CH2),110.0(C30),79.1(C3),63.0(C28),55.5(C5),50.5(C9),49.0(C19),47.9(C18),46.7(C17),42.9(C14),41.0(C8),39.0(C4),38.9(C13),37.8(C1),37.3(C10),34.7(C22),34.3(C7),30.0(C16),29.8(C21),28.1(C15),27.6(C2),27.2(C12),25.4(C23),22.8(C11),20.9(C24),19.3(C29),18.4(C6),16.2(C25),16.2(C26),14.9(C27)。
2.1.53-烯丙酰基白桦脂醇(11)的合成
2.1.5.13-烯丙酰基-28-二甲基叔丁基硅氧基白桦脂醇(10)的合成 取化合物30.21 g(0.38 mmol)溶解在5 mL DCM中,加入丙烯酰氯46μL(0.57 mmol)、TEA 52μL(0.38 mmol),瓶中放入磁力搅拌子,室温搅拌反应6 h。反应结束后,用蒸馏水(3×30 mL),乙酸乙酯(50 mL)萃取,合并有机层。饱和食盐水(30 mL)洗涤有机层,加入无水硫酸钠干燥,过滤,滤液减压浓缩,经过200~300目硅胶柱层析纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶40)得到化合物10为白色固体(118.4 mg),产率:51.4%。
2.1.5.23-烯丙酰基白桦脂醇(11)的合成 取化合物10118.4 mg(0.19 mmol),加入四丁基氟化铵(TBAF,1 mol·L-1的四氢呋喃溶液)1.0 mL,瓶中放入磁力搅拌子,室温搅拌反应2 h。反应结束后,用蒸馏水(3×30 mL),乙酸乙酯(50 mL)萃取,合并有机层。饱和食盐水(30 m L)洗涤有机层,加入无水硫酸钠干燥,过滤,滤液减压浓缩,经过200-300目硅胶柱层析纯化(洗脱剂:V乙酸乙酯∶V石油醚=1∶20)得到化合物11为油状液体(92.3 mg),产率:95.9%。1H NMR(400 MHz,Chloroform-d)δ:6.40(dd,J=10.2,1.5 Hz,1H),6.11(dd,J=17.3,10.4 Hz,1H),5.79(dd,J=10.4,1.7Hz,1H),4.68(d,J=2.3Hz,1H),4.58(d,J=2.1 Hz,1H),4.54(dd,J=7.4,3.9 Hz,1H),3.80-3.77(m,1H),3.34(s,1H),2.63-2.57(m,1H),2.03-1.96(m,3H),1.68(s,3H),1.64(m,5H),1.56-1.52(m,2H),1.40(m,5H),1.33(m,6H),1.23(d,J=1.9 Hz,1H),1.07-1.05(m,2H),1.00(s,3H),0.98(s,3H),0.96(s,3H),0.87(s,3H),0.86(s,3H);13CNMR(101MHz,Chloroform-d)δ:166.9(C=O),150.6(C20),130.2(-CH=CH2),129.3(-CH=CH2),110.0(C30),81.2(C3),58.9(C28),52.0(C5),50.4(C9),49.5(C18),48.9(C19),47.9(C17),42.9(C14),41.1(C8),38.5(C4),38.1(C1),37.4(C13),37.2(C10),34.3(C22),34.1(C7),29.8(C21),29.8(C16),27.2(C15),24.3(C23),23.8(C12),22.8(C2),21.0(C11),19.8(C29),18.3(C24),16.7(C6),16.3(C25),16.1(C26),14.3(C27)。
2.2 DPPH法抗氧化活性测试
2.2.1溶液的配制 DPPH溶液:精密称取5 mg DPPH,用适量无水乙醇溶解,定容于25 mL的棕色容量瓶中,充分摇匀后,得0.2 mg·mL-1的DPPH溶液。测定时,将该溶液稀释至40μg·mL-1使用。
维生素C溶液:精密称取1 mg维生素C,用适量无水乙醇溶解,定容于50 mL的棕色容量瓶中,充分摇匀后,得0.02 mg·mL-1的维生素C对照液。
2.2.2样品测定 以乙醇为溶剂,分别配制浓度依次为0.1、0.2、0.3、0.4、0.5 mg·mL-1的白桦脂醇和白桦脂醇酯衍生物溶液。精密量取1.4 mL所配制的DPPH溶液于样品瓶中,再分别加入1.4 m L供试品溶液,混匀,避光37℃放置15 min,在517 nm波长处测定吸光度(A1)。同法测定以1.4 mL所配制的DPPH溶液及1.4 mL乙醇混合的吸光度(A),以1.4 mL供试品溶液与1.4 mL乙醇混合的吸光度(A0)。
DPPH自由基清除率(P)=[1-(A1-A0)/A]×100%。
每份样品平行测定3次,取平均值,并计算其RSD。实验同时设置维生素C作为阳性对照。
2.2.3体外抗氧化作用结果 见表1。所有待测化合物清除DPPH的活性均弱于维生素C,其中,3-羰基白桦脂醇(7)与3,28-双酰基(乙酰基或烯丙酰基)取代白桦脂醇(1、8)无明显清除DPPH的作用。白桦脂醇、3或28位-单酰基取代白桦脂醇衍生物(2、6、9、11)对DPPH均有一定的清除作用。随着浓度的增加,DPPH的清除率缓慢上升,3-乙酰基白桦脂醇(6)与白桦脂醇的清除效果相近,28-乙酰基或烯丙酰基白桦脂醇(2、9)对DPPH的清除效果优于白桦脂醇及3-乙酰基或烯丙酰基白桦脂醇(6、11)。可见,28位是白桦脂醇发挥抗氧化作用的重要修饰位点,28位增大基团吸电子作用(如引入烯基)有利于抗氧化活性的提升。

表1 白桦脂醇衍生物对DPPH清除结果(n=3)Table 1 DPPH clearance results of betulin derivatives(n=3)
3 讨论
在白桦脂醇酰化合成中,探究了不同反应条件(溶剂、温度、原料投入量)对反应的影响,反应结果见表2。另外,选择乙腈(ACN)作溶剂,发现形成了非均相体系,考虑到此情况下反应产率低,故而乙腈做溶剂的反应未进一步探讨。
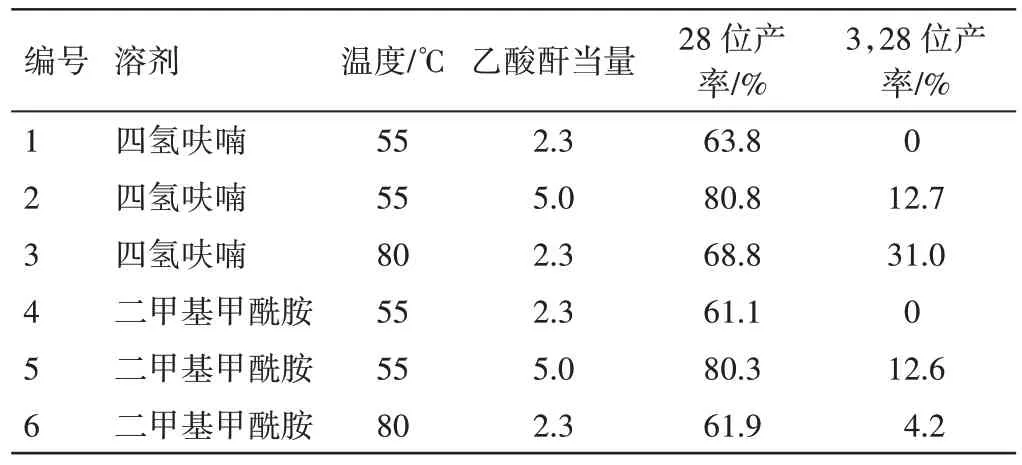
表2 不同溶剂、乙酸酐当量、温度下的反应情况Table 2 Reactions under different solvents,acetic anhydride equivalents,and temperatures
由表2可见,白桦脂醇酰化在非质子溶剂中是比较有利的,尽管DMF是万能溶剂,且由于其结构中含有醛基和二甲胺基团,也是各种化学转化的催化剂以及合成中许多官能团的供体,常用作Me2NH的“原位”来源。但是,在本反应中,相对于DMF而言,THF作为反应溶剂使后处理条件更为简便,是白桦脂醇乙酰化的首选溶剂。白桦脂醇的28号位是伯醇,其活性更好,无论是乙酰化反应还是与TBDMSCl反应,都体现其更好的反应活性。低温且可控制原料的用量,可实现白桦脂醇28位的单取代;当乙酸酐投料增大或反应温度提高时,白桦脂醇双取代几率提高。但以DMF为溶剂、80℃为反应条件,白桦脂醇乙酰化反应的产率与以THF为溶剂的产率存在差异,推测是高温下,反应体系中存在TEA,DMF遭到了破坏,导致原本产生的28-乙酰基白桦脂醇发生其他反应,最终产率下降。
体外抗氧化测试结果显示,28位是白桦脂醇发挥抗氧化作用的重要修饰位点,28位增大基团吸电子作用(如引入烯基)有利于抗氧化活性的提升。
大量针对白桦脂醇的结构修饰研究表明,通过对白桦脂醇3,28位两位点的结构改造可增强母体抗肿瘤、抗炎、抗糖尿病等活性[12]。考虑到这些药理活性的产生均与其抗氧化相关,探讨白桦脂醇骨架中这两个位点与抗氧化之间的关系,可为白桦脂醇衍生物的进一步研发奠定基础。本研究围绕白桦脂醇骨架上3,28位这两个重要修饰位点,采用分别修饰及同时修饰的策略获得7个白桦脂醇衍生物,通过体外抗氧化活性的筛选,证明白桦脂醇28-位羟基是提高抗氧化能力的重要修饰位点。

