基于生物信息学探讨中风醒脑液对脑出血后神经系统及免疫系统的影响
余剑媛,周惠芬,郭建文,杨洁红,万海同(1.浙江中医药大学中医心脑血管病研究院,浙江 杭州 310053;2.浙江省全省中医心脑血管病重点实验室,浙江 杭州 310053;3.广州中医药大学第二附属医院省部共建中医湿证国家重点实验室,广东 广州 510120;4.广州中医药大学第二附属医院脑病中心,广东 广州 510120)
脑出血(intracerebral hemorrhage,ICH)是一种神经系统疾病,由脑实质内出血引起,具有高死亡率和高致残率特征。2019年全球疾病负担研究(Global burden disease,GBD)数据显示卒中是导致我国成年人死亡和致残的首要原因,其中脑出血是卒中复发率最高的类型[1-2]。脑出血发生后,幸存患者很可能出现不同程度的认知和躯体障碍。然而,目前脑出血的治疗方式有限,仍以手术清除血肿为主,其遗留症状难以恢复,严重影响患者后期生活质量。
中风醒脑液(Zhongfeng XingnaoLiquid,ZFXN)是为治疗急性脑卒中后继发性损伤所创立的,并获国家专利(专利号:ZL01823262.0)的中药复方制剂。全方由红参、大黄、三七、川芎组成,红参补益元气;三七、川芎行血活血,针对离经之血,发挥化瘀作用,且三七亦能化瘀止血,减轻活血导致动血出血的潜在危险;大黄通腑泻热,四者合用,体现脑出血后“扶正固本,标本兼顾”的治疗思想。
神经炎症贯穿脑出血疾病的发生发展,影响疾病预后。临床研究证明中风醒脑液能有效改善脑出血患者症状,发挥脑出血后抗炎作用,减轻炎症损伤[3-4]。目前中风醒脑液治疗对脑出血后免疫系统和神经系统的影响尚不明确,因此,本研究将从网络药理学、分子对接技术和动物实验验证探讨中风醒脑液对脑出血后神经系统和免疫系统的影响,为其临床应用及机制研究提供依据。
1 材料与方法
1.1 中风醒脑液有效活性成分及潜在靶点筛选通过中药系统药理数据库和分析平台(Traditional Chinese Medicine Database and Analysis Platform,TCMSP,https://old.tcmsp-e.com/tcmsp.php)检索红参、三七、川芎及大黄有效活性成分,根据口服生物利用度(oralbioavailability,OB)≥30%及类药性(drug-likeness,DL)≥0.18为条件筛选,删除重复。结合TCMSP和SwissTargetPrediction(http://www.swisstargetprediction.ch)数据库预测有效活性成分作用靶点。通过Uniprot(https://www.uniprot.org)数据库对靶点进行标准化处理。
1.2 脑出血与神经系统及免疫系统靶点筛选利用药物靶标在线数据库(Therapeutic Target Database,TTD,https://db.idrblab.net/ttd/),人类在线孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,https://www.omim.org/),GeneCards(https://www.genecards.org/)、DisGeNET(https://www.disgenet.org/)和Drugbank(https://go.drugbank.com/)数据库,以“Intracerebral Hemorrhage”和“CerebralHemorrhage”为检索词获取脑出血相关靶点。运用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG,https://www.genome.jp/kegg/)数据库收集神经系统和免疫系统相关靶点。运用Uniprot数据库进行标准化处理,删除重复值。
1.3 作用靶点筛选与蛋白质-蛋白质互作网络分析运用在线绘制文氏图平台(http://www.bioinformatics.com.cn/static/others/jvenn/example.htm l)[5]分别获取“中风醒脑液-脑出血-神经系统”和“中风醒脑液-脑出血-免疫系统”交集靶点,即中风醒脑液对脑出血后神经系统与免疫系统的作用靶点。分别将上述获得的交集靶点导入STRING数据库(https://cn.string-db.org/,设置参数“medium confidence,0.400”,物种“Homo sapiens”,其余默认),获取蛋白互作信息。运用Cytoscape 3.9.0软件中CytoHubba工具计算网络,MCC法筛选排前10位的靶点为核心靶点。
1.4 药物-有效活性成分-交集靶点-信号通路构建将“1.3”项获得的交集靶点导入STRING数据库,设置参数同“1.3”项,导出信号通路部分。根据FDR值从小到大排序,筛选前10条信号通路为主要通路。将药物、有效活性成分、交集靶点、信号通路,根据对应关系导入Cytoscape 3.9.0软件,构建“药物-有效活性成分-交集靶点-信号通路”网络图,并计算网络度值(Degree)。
1.5 中风醒脑液有效活性成分和核心靶点分子对接根据“1.4”项网络图度值结果,将排前10位的有效活性成分与“1.3”项获得的核心靶点进行分子对接分析。首先从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/),Chemicalbook数据库(https://www.chemicalbook.com/ProductIndex.aspx)获得药物有效活性成分3D结构。通过PDB数据库(https://www.rcsb.org/)下载核心靶点结构并运用PyMol 2.5.5软件处理。运用Autodock 1.5.6软件转化核心靶点与有效活性成分文件格式,最后运用Autodock Vina进行分子对接[6],记录每个核心靶点与有效活性成分的分子结合能。对接结果用PyMol 2.5.5软件可视化处理。
1.6 中风醒脑液治疗脑出血的体内实验验证
1.6.1实验动物 健康SD大鼠,雄性,SPF级,6~7周龄,体质量(230±20)g,由浙江中医药大学动物实验中心提供,生产许可证号:SCXK(浙)2019-0002,动物质量合格证号:20220506Aazz0100018421。SPF级实验环境温度(23±1)℃,相对湿度(55±5)%,光照12 h模拟昼夜交替。本研究动物实验部分严格按照浙江中医药大学动物实验伦理委员会相关规定执行,伦理批准号:20220214-25。
1.6.2药物及试剂 中风醒脑液,组方为红参、大黄、三七、川芎,由广东省中医院提供,批号:FYTF-919 104647,4℃恒温冰箱储存;胶原酶Ⅶ型,美国Sigma公司,货号:C0773;异氟烷,批号:045742,北京易则佳科技有限公司;RNA提取试剂盒,南京诺唯赞生物科技股份有限公司,货号:RC112-01;逆转录试剂盒,南京爱必梦生物材料有限公司,货号:G490;扩增试剂(2X Universal SYBR Green Fast qPCR Mix),武汉爱博泰克生物科技有限公司,货号:RK21203;引物均由生工生物工程(上海)有限公司设计与合成,引物序列见表1。

表1 引物序列信息Table 1 Primer sequences information
1.6.3仪器 E03275-002序列脑立体定位仪,深圳市瑞沃徳生命科技有限公司;TJ-2A型注射泵控制器,保定兰格恒流泵有限公司;R407小动物呼吸机,深圳市瑞沃德生命科技有限公司;10μL微量进样器,上海高鸽工贸有限公司;QuantStudio 3型实时荧光定量PCR仪,美国赛默飞世尔科技公司;Nanodrop one型微量核酸蛋白分析仪,美国热电公司。
1.6.4模型[7-8]复制与分组 SD雄性大鼠适应性喂养1周后,随机分为5组:空白组,模型组,中风醒脑液低、中、高剂量组(4.5、9、18 mL·kg-1)。该实验中风醒脑液给药剂量根据临床给药剂量等量转换。
大鼠采用异氟烷空气麻醉,用4%异氟烷诱导,2%异氟烷与空气混合使用维持麻醉状态,流量0.7~0.8 L-1·min。使用脑立体定位仪固定大鼠,用颅钻在前囟前0.5 mm,中线右旁开3 mm处钻直径约为1 mm大小孔洞,将微量注射器针头缓慢刺入深度5.5 mm处,用1μL胶原酶Ⅶ型无菌生理盐水溶液(0.5 U·μL-1)以0.2μL·min-1速度注射入右侧尾状核处,诱导脑出血。缝合切口并消毒。空白组以同样方式注射等量无菌生理盐水。大鼠苏醒后出现神经功能缺损症状则表明模型复制成功。每日予以中风醒脑液治疗,空白组与模型组大鼠予以等量生理盐水灌胃。连续灌胃5 d。
1.6.5神经功能损伤评估 给药5 d后,运用Bederson评分评估大鼠神经功能损伤程度[9-10]。无神经损伤表现记0分,出现前肢屈曲记1分,侧推抵抗力下降记2分,出现转圈现象记3分。分数越高表明神经损伤越严重。
1.6.6脑组织学观察 末次给药后4 h,将大鼠腹腔注射戊巴比妥钠30 mg·kg-1麻醉后,进行心脏采血。运用0.9%生理盐水(4℃)灌注,待流出血液成淡粉色液体后换4%多聚甲醛进行灌注,直至大鼠四肢微微僵硬。收集血肿周边脑组织在4%多聚甲醛中固定进行脱水、石蜡包埋,切片进行HE染色,光学显微镜下观察脑组织病理切片的形态学变化。
1.6.7实时荧光定量聚合酶链式反应检测核心靶点表达 末次给药后4 h,各组大鼠进行心脏采血,予以0.9%生理盐水灌注,待流出淡粉色液体后颈椎脱臼处死大鼠,分离右侧脑组织。称量10~15mg右侧脑组织提取RNA并转录成cDNA,再将其按扩增试剂要求设置扩增条件进行扩增。以GAPDH作为内参进行计算。用2-ΔΔCt法计算核心靶点mRNA的相对表达量。
1.6.8统计学处理方法 运用GraphPad Prism 8.0.1分析所有数据。首先对数据进行正态分布与方差齐性检验,数据符合正态分布且方差齐则运用单因素方差分析,数据不符合正态分布或方差不齐则采用非参数检验,对组间进行多重比较。以P<0.05为差异有统计学意义。
2 结果
2.1 中风醒脑液有效活性成分和靶点筛选见图1和表2。按“1.1”项下条件与方法筛选后得中风醒脑液中红参有效活性成分4种,对应靶点48个;大黄有效活性成分有16种,对应靶点94个;三七有效活性成分有8种,对应靶点192个;川芎有效活性成分有7个,对应靶点105个。其中,红参与三七共有有效活性成分2个,为β-谷甾醇(beta-sitosterol)、人参皂苷rh2(ginsenoside rh2);三七与川芎共有有效活性成分1个,为亚油酸乙酯(Mandenol);红参、三七与大黄共有有效活性成分1个,为β-谷甾醇(betasitosterol),合并去重后共获取全方有效活性成分31种,相关靶点303个。

图1 中风醒脑液“药物-有效活性成分-有效活性成分对应靶点”网络图Figure 1 “Drugs-active components-targets”network of Zhongfeng Xingnao Liquid

表2 中风醒脑液有效活性成分表Table 2 Active components in Zhongfeng Xingnao Liquid

(续表2)
2.2 脑出血靶点、神经系统与免疫系统靶点的获取GeneCards数据库中获得脑出血相关靶点1 625个;DisGeNET数据库中获得170个;TTD数据库中获得2个;DrugBank数据库中获得34个;OMIM数据库中检索得到8个。去除重复值后共获得1 680个脑出血相关靶点。KEGG数据库获得免疫系统相关靶点1 193个,神经系统相关靶点538个。
2.3 作用靶点筛选及网络构建分析图2结果显示,中风醒脑液、脑出血与神经系统交集靶点共有33个;中风醒脑液、脑出血与免疫系统交集靶点共有68个,即中风醒脑液治疗脑出血后神经系统和免疫系统的作用靶点分别有33、68个。将获得的33个和68个靶点分别运用STRING数据库进行蛋白互作分析,利用Cytoscape 3.9.0软件构建PPI网络图,利用CytoHubba插件对PPI网络进行网络拓扑分析,运用MCC算法计算节点分值。分值越高,颜色越接近红色,表明靶点越重要,更有可能是中风醒脑液调控脑出血后神经系统或免疫系统的作用靶点。图3结果表明,与免疫系统相关PPI网络图中,分值前10位的靶点为肿瘤坏死因子(TNF)、白细胞介素6(IL-6)、基质金属蛋白酶9(MMP9)、信号转导及转录激活蛋白3(STAT3)、白细胞介素1β(IL-1β)、丝氨酸/苏氨酸激酶1(AKT1)、前列腺素内过氧化物合酶2(PTGS2)、CXC基序趋化因子配体8(CXCL8)、白细胞介素10(IL-10)和胱天蛋白酶3(CASP3);与神经系统相关PPI网络图中,分值前10位的靶点为肿瘤蛋白P53(TP53)、丝裂原活化蛋白激酶1(MAPK1)、CASP3、非受体酪氨酸激酶(SRC)、Fos原癌基因(FOS)、核转录因子κB p65(NF-κB p65,RELA)、蛋白激酶Cδ(PRKCD)、PTGS2、蛋白激酶Cα(PRKCA)和NFKB抑制因子α(NFKBIA)。选取以上核心靶点作为后续分子对接研究。
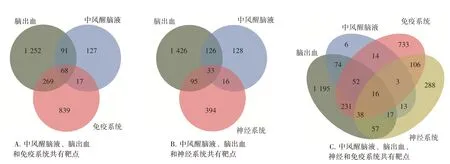
图2 中风醒脑液、脑出血、免疫系统和神经系统共有靶点Figure 2 Common targets of immune system,nervous system,intracerebral hemorrhage and Zhongfeng Xingnao Liquid
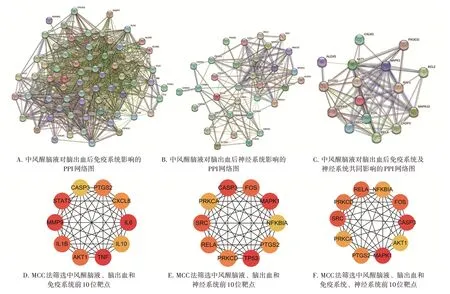
图3 中风醒脑液对脑出血后神经系统与免疫系统影响的蛋白互作网络图与核心靶点图Figure 3 Protein-protein interaction network and key targets of Zhongfeng Xingnao Liquid in the treatment of immune system and nervous system after intracerebral hemorrhage
2.4 药物-有效活性成分-交集靶点-信号通路构建结果见图4。按照“1.4”项方法构建“药物-有效活性成分-交集靶点-信号通路”网络图。红色三角形节点表示药物,绿色方形节点表示大黄有效成分,橙色方形表示川芎有效成分,湖蓝色方形表示红参有效成分,土黄色方形表示三七有效成分,鹅黄色方形表示两者或两者以上药物共有成分,蓝色菱形表示交集靶点,粉色圆形表示STRING数据库根据FDR值排序前10位的信号通路。运用CytoHubba插件进行网络拓扑分析,同“2.3”项下方法计算排前10位的有效活性成分。图4结果表明,与免疫系统相关的网络中,分值前10位的有效活性成分为槲皮素(quercetin),洋川芎醌(senkyunone),β-谷甾醇(beta-sitosterol),人参皂苷rh2(ginsenoside rh2),掌叶二蒽酮A(palmidin A),芦荟大黄素(aloeemodin),人参皂苷f2(ginsenoside f2),泽兰黄醇素(EUPATIN),豆甾醇(Stigmasterol),杨梅酮(Myricanone);与神经系统相关的网络中,分值前10位的有效活性成分为槲皮素(quercetin),β-谷甾醇(beta-sitosterol),洋川芎醌(senkyunone),豆甾醇(Stigmasterol),芦荟大黄素(aloe-emodin),人参皂苷rh2(ginsenoside rh2),掌叶二蒽酮A(palmidin A),食脂素(DFV),亚油酸乙酯(Mandenol),(-)-儿茶素[(-)-catechin]。选取以上有效活性成分分别与“2.3”项下核心靶点进行分子对接。
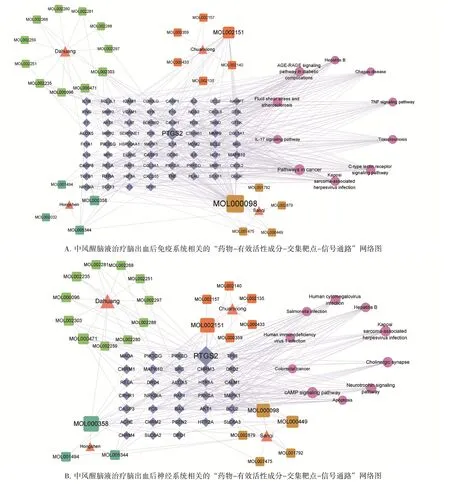
图4 中风醒脑液治疗脑出血后神经系统和免疫系统“药物-有效活性成分-交集靶点-信号通路”网络图Figure 4 “Drugs-active components-intersection targets-signaling pathway”network of Zhongfeng Xingnao Liquid in the treatment of immune system and nervous system after intracerebral hemorrhage
另外,中风醒脑液能调控脑出血后免疫系统相关通路,如IL-17信号通路、TNF信号通路、癌症信号通路等;亦能介导脑出血后神经系统相关通路,如神经营养因子信号通路、cAMP信号通路、凋亡通路等。
2.5 中风醒脑液有效活性成分和核心靶点分子对接结果见图5和图6。分别将“2.3”项获得的核心靶点与“2.4”项获得的排前10位的有效活性成分进行分子对接,结合能见图5。结合能数值小于-5 kcal·mol-1则认为该靶点与该有效活性成分有良好的结合力,结合更稳定。除亚油酸乙酯(Mandenol)与TP53结合能数值大于-5 kcal·mol-1外,其余有效活性成分与核心靶点结合能均小于-5 kcal·mol-1,说明核心靶点与有效活性成分之间更有可能产生相互作用。其中,掌叶二蒽酮A(palmidin A)、人参皂苷f2(ginsenoside f2)、杨梅酮(Myricanone)等有效活性成分与核心靶点的亲和力较高。部分分子对接模型如图6所示。

图5 中风醒脑液治疗脑出血后有效活性成分与神经系统和免疫系统中核心靶点的分子对接结合能(kcal·mol-1)Figure 5 Molecular docking binding energy of active components in Zhongfeng Xingnao Liquid and key targets of immune system and nervous system in the treatment of intracerebral hemorrhage(kcal·mol-1)
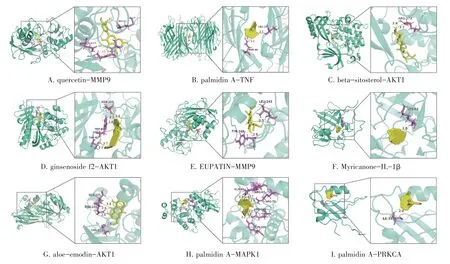
图6 中风醒脑液治疗脑出血有效活性成分与部分核心靶点的分子对接模型Figure 6 Dockingmodelsofactive ingredientsand paryialkey targetsof Zhongfeng Xingnao Liquid in the treatmentofintracerebralhemorrhage
2.6 动物实验结果
2.6.1中风醒脑液对脑出血大鼠神经功能的影响 见图7。术后第5天,与空白组比较,模型组大鼠神经功能严重缺损,差异有统计学意义(P<0.001);与模型组比较,中风醒脑液治疗5 d后,中风醒脑液高剂量组大鼠前肢屈曲,对侧转圈现象减少,高剂量中风醒脑液能显著下调大鼠神经功能缺损评分(P<0.01),差异有统计学意义。
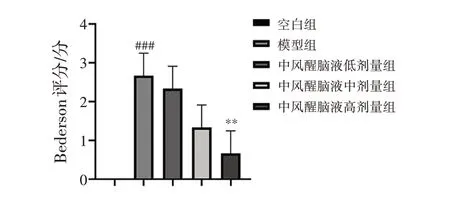
注:与空白组比较,###P<0.001;与模型组比较,**P<0.01图7 中风醒脑液对脑出血后第5天大鼠神经缺损评分的影响(±s,n=3)Figure 7 Effect of Zhongfeng Xingnao Liquid alleviates neurological deficit score of rats at day 5 after intracerebral hemorrhage(±s,n=3)
2.6.2中风醒脑液对血肿周围组织结构的影响 见图8。与空白组比较,模型组大鼠血肿周围组织肿胀,组织间隙增大,细胞排列呈疏松、紊乱状态,大量细胞核发生固缩伴细胞形态发生改变。用不同剂量中风醒脑液治疗后,细胞变形程度减轻,发生核固缩的细胞数量减少,说明不同剂量中风醒脑液可以改善血肿周围组织病理损伤程度。

图8 各组大鼠脑组织病理结构表现(HE染色,×200)Figure 8 Histopathologicalmorphology of rat brains in each group(HE staining,×200)
2.6.3中风醒脑液对血肿周围核心靶点基因表达的影响 见图9。与空白组比较,模型组大鼠血肿周围CASP3、IL-1β、IL-6、PRKCA、PRKCD、RELA、TP53、MAPK1、TNF的mRNA表达明显增加,AKT1、NFKBIA的mRNA表达显著降低,差异均具有统计学意义(P<0.05,P<0.01,P<0.001);与模型组比较,中剂量和高剂量中风醒脑液治疗后,CASP3、IL-1β、IL-6、PRKCA、PRKCD、RELA、TP53、MAPK1、TNF的mRNA表达降低,AKT1、NFKBIA的mRNA表达升高,其中高剂量中风醒脑液对核心靶点调控差异均具有统计学意义(P<0.05,P<0.01,P<0.001)。
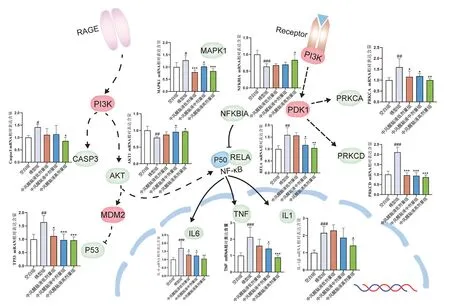
注:与空白组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001图9 中风醒脑液对大鼠脑出血后核心靶点表达的影响(±s,n=6)Figure 9 Effects of Zhongfeng Xingnao Liquid on key targets expression of rats after intracerebral hemorrhage(±s,n=6)
3 讨论
脑出血继发性损伤的发生发展与神经炎症反应密切联系,其机制错综复杂[11-12]。血液进入脑实质内,能迅速激活中枢神经系统中免疫细胞,如小胶质细胞,被激活的免疫细胞释放大量炎症因子,加重神经炎症反应,造成持续性脑损伤,比如血脑屏障功能破坏,脑水肿,神经元凋亡[13-15]。可见,脑出血后继发性损伤与机体神经系统与免疫系统均密切相关。
中风醒脑液已被证明具有多种药理活性,如前期动物实验证明其能上调黏附蛋白ZO-1的表达以恢复血脑屏障紧密连接[16],降低实验动物颅内高压从而减轻脑水肿及增加出血灶周围吞噬细胞数量,促进血肿清除[17]。目前已有临床研究表明中风醒脑液能减小脑出血患者血肿体积,改善患者神经功能[18],可见中风醒脑液是治疗脑出血的有效汤剂。然而中风醒脑液对脑出血后免疫系统及神经系统的作用影响尚未可知。基于此,本项研究运用网络药理学方法预测中风醒脑液对脑出血后免疫系统与神经系统的影响并对核心靶点进行了实验验证。
本研究通过分析“药物-有效活性成分-交集靶点-信号通路”网络发现,槲皮素、β-谷甾醇、人参皂苷rh2、掌叶二蒽酮A、芦荟大黄素、豆甾醇等活性成分可能是中风醒脑液影响脑出血后免疫和神经系统的关键成分。近年来,槲皮素在抗炎、抗凋亡、抗氧化应激方面的作用受到广泛关注。研究发现,槲皮素能通过调整凋亡相关蛋白表达(Bax,Bcl-2),抑制神经细胞凋亡,减轻脑出血大鼠神经损伤[19];槲皮素还能减少脑出血后血肿周围IL-1β、IL-6、TNF-α的表达,有效对抗炎症反应,助力于神经功能恢复[20];芦荟大黄素是一种蒽醌类化合物,其能通过抑制核因子κB(NF-κB)信号通路来抑制小胶质细胞向M1表型转变,减少神经炎症反应[21];β-谷甾醇可能通过抑制IL-17-p53信号通路来减轻神经炎症和细胞凋亡[22],其还能降低氧化应激反应和抑制NF-κB激活引起炎症反应[23]。
本研究分别对脑出血后免疫系统和神经系统相关关键活性成分和核心靶点进行了分子对接验证。根据配体-受体结合构象的稳定性和相互作用的可能性随着结合能的降低而增加[24],说明人参皂苷f2对脑出血后免疫系统核心靶点具有很强的结合亲和力,掌叶二蒽酮A对脑出血后神经系统核心靶点具有很强的结合亲和力。此结果表明,人参皂苷f2和掌叶二蒽酮A可能是中风醒脑液治疗脑出血过程中发挥主要作用的活性化合物。另外,分子对接结果表明,中风醒脑液的关键有效活性成分如槲皮素、泽兰黄醇素可以直接作用于MMP9靶点,β-谷甾醇、人参皂苷f2、芦荟大黄素可以直接作用于AKT1靶点,掌叶二蒽酮A可以直接作用于MAPK1、PRKCA靶点。但此仅基于计算机技术,仍需通过相关实验进一步验证。
本研究显示,转录因子NF-κB激活后释放IL-6、IL-1β、TNF炎症因子,参与炎症反应发生。现有研究表明脑出血发生后,NF-κB的激活在细胞凋亡和炎症调控中发挥关键作用[25-26],RELA(NF-κB p65)是NF-κB的一部分。在本次实验中,脑出血模型大鼠RELA、IL-6、IL-1β、TNFmRNA表达升高,经中风醒脑液治疗后其表达均降低,与已有研究[27-28]结果一致,说明中风醒脑液能减轻炎症反应。NF-κB的激活受NF-κB抑制因子α(NFKBIA)调控,沉默NFKBIA转录能促进NF-κB激活[29],和空白组比较,模型组大鼠NFKBIA mRNA表达降低,中风醒脑液能促进大鼠NFKBIA mRNA表达,从而抑制NF-κB的激活。蛋白激酶B(PKB,同AKT)有三种亚型,其中AKT1能介导细胞增殖和存活,当选择性敲除内皮细胞中AKT1表达会延迟血管生成[30],并且表达在血管平滑肌细胞中的AKT1能维持血管稳定性[31]。中风醒脑液治疗后,治疗组大鼠AKT1 mRNA表达有所增加,中风醒脑液可能通过增加细胞中AKT1的表达发挥保护作用,但需要进一步实验验证。肿瘤蛋白P53(TP53,同P53)是一种转录因子,能激活许多促凋亡基因(如Bax),调控“转录依赖性/非依赖性P53介导凋亡”凋亡通路[32],研究[33]表明抑制TP53的激活可以促进脑出血大鼠神经功能的恢复。另外,P53是AKT1下游基因之一,其生化活性受MDM2蛋白限制,中风醒脑液治疗后TP53表达降低,可能通过调控细胞凋亡来减轻脑出血后损伤。丝裂原活化蛋白激酶1(MAPK1)是一种丝氨酸/苏氨酸激酶,参与细胞生长、存活和分化,并和中枢神经系统的各种生理病理过程相联系[34]。现有研究[35]表明脑出血后PMAPK1表达显著增加并促进了神经炎症。中风醒脑液治疗后降低了MAPK1表达。蛋白激酶C(PKC)家族能调控细胞增殖和细胞周期进程[36],PRKCA(PKCα)和PRKCD(PKCδ)是其两种亚型,均参与神经系统疾病发生,影响神经炎症[37-39]。有研究[40]发现脑出血7 d后PRKCD mRNA表达升高,造成神经炎症。中风醒脑液治疗后降低了PRKCA和PRKCDmRNA表达,说明中风醒脑液可能通过抑制PRKCA和PRKCD的活性发挥抗炎作用。而且,中风醒脑液能一定程度上改善脑出血后脑组织损伤的病理表现,促进大鼠神经功能恢复。
综上所述,本研究利用网络药理学、分子对接技术初步预测了中风醒脑液治疗脑出血后神经系统和免疫系统的有效活性成分及作用靶点,同时预测了部分有效活性成分与核心靶点之间的结合位点,体现了中医药治疗疾病“多成分、多靶点、多通路”特色。体内实验结果表明,中风醒脑液对脑出血后RELA、IL-6、IL-1β、TNF等具有抑制作用,初步证实中风醒脑液能调控脑出血后神经系统与免疫系统靶点,减轻神经炎症反应,发挥治疗作用,为脑出血的临床治疗提供了思路和依据。但本研究仅检测了中风醒脑液对脑出血后免疫系统和神经系统核心靶点mRNA表达的影响,其确切的相互作用机制有待进一步探索。

