杜仲汤对去卵巢大鼠骨质疏松症的影响及机制研究
罗兰兰,张宇静,任明诗,傅芸瑛,陈泽彬,陈明,刘波(.江西中医药大学药学院,江西 南昌 0004;2.江西省中医药管理局中药防治老年性疾病重点研究室,江西 南昌 0004;.南昌大学第一附属医院骨科医院,江西 南昌 0006)
骨质疏松症(Osteoporosis,OP)是一种以骨量低下及骨微结构损坏而导致骨脆性增加、易发生骨折的一种常见慢性疾病[1]。我国是骨质疏松症高发病率的国家,40岁以上人群的发病率达25%[2],中老年人尤其是绝经后女性更为常见[3]。随着社会老龄化进程加快,骨质疏松症的防治成了全世界亟待解决的问题[4]。研究[5]发现,氧化应激反应是影响骨质疏松症发病的重要机制,通过调控成骨细胞、破骨细胞和骨髓间充质干细胞的增殖和代谢,影响体内骨平衡,导致骨形成和骨吸收失耦联,从而引起骨质疏松症。
骨质疏松症属中医学的“骨痹”“骨痿”等范畴,肾精亏损是骨质疏松症的主要病机[6],临床治疗多采用补肾填精之法。杜仲味甘,性温,入肝、肾经,有补肝肾、强筋骨的作用[7]。研究[8]表明,杜仲能促进成骨细胞分化,加速骨形成,调节骨代谢平衡。复方杜仲健骨颗粒、全杜仲胶囊等杜仲制剂在治疗骨质疏松症方面具有较好的临床疗效[9-10]。古籍记载的杜仲汤有多个不同版本,本研究所用杜仲汤出自清代梁廉夫的《不知医必要》,以川杜仲(盐水炒去丝)入药,主治肾虚腰痛脚软。目前尚未见有关杜仲汤防治骨质疏松症的基础研究报道。故本研究拟从氧化应激角度出发,探讨杜仲汤对去卵巢骨质疏松症模型大鼠的作用及机制,以期为其临床应用提供实验依据。
1 材料与方法
1.1 动物42只雌性SD大鼠,SPF级,180~220 g,购自江西中医药大学实验动物中心,实验动物生产许可证号:SCXK(赣)2018-0003。实验动物使用许可证号:SYXK(赣)2022-0002,饲养条件:温度为(24±2)℃,湿度为(55±10)%,自由饮水、进食。本动物实验经江西中医药大学实验动物伦理委员会审批,伦理批文号:JZLLSC-202101020。
1.2 药物及试剂杜仲(批号:2112012),购自江西樟树天齐堂中药饮片有限公司,经江西中医药大学药学院中药资源组付小梅教授鉴定为正品。将杜仲饮片上喷洒含盐度为2%的盐水,充分拌透吸收,晾干后,置于烘箱内烘制。先采用80℃、1 h烘制进行去湿处理(期间进行翻面),再用100℃烘制至断丝和杜仲表面呈棕褐色后,取出,常温晾凉[11]。将黄酒∶清水按1∶1比例浸泡中药30min,液体浸过药面5 cm;用武火煮沸后改为文火,煎煮约20 min,勿使焦枯;煎煮2次,煎法如前。合并2次煎煮药液,-20℃冰箱保存。
谷胱甘肽过氧化物酶(GSH,批号:20220629)、骨保护素(OPG,批号:H286-1-2)、抗酒石酸酸性磷酸酶(TRACP,批号:H377-1-2)检测试剂盒,均购自南京建成生物工程研究所;异氟烷(批号:21111401),瑞沃德生命科技有限公司;戊酸雌二醇片(批号:646A),德国拜尔医药保健有限公司;谷胱甘肽片(批号:21040610),重庆药友制药有限责任公司;高效RIPA组织/细胞快速裂解液(批号:R0010),北京索莱宝科技有限公司;骨形态发生蛋白2(BMP-2)一抗(批号:ab14933)、OPG一抗(批号:ab183910)、一型胶原(COL1)一抗(批号:ab270993),均购自英国Abcam公司;β-actin一抗(批号:4970S),美国Cell-singal公司;Goat Anti-Rabbit IgG(H+L,批号:20000673),美国Proteintech公司;总RNA提取试剂盒(批号:0000495807),普洛麦格(北京)生物技术有限公司;反转录试剂盒(批号:ALG2080A),日本Takara公司;实时荧光定量PCR试剂盒(批号:22LK2802),北京聚合美生物科技有限公司。
1.3 主要仪器SONTU100-RAD型骨密度仪,深圳深图医学影像设备有限公司;RM2235型轮转切片机,德国Leica公司;Mini-PROTEAN型电泳仪、垂直电泳槽、垂直转膜槽,美国Bio-Rad公司;FlexA-200HT型酶联免疫分析仪,杭州奥盛仪器有限公司;Nanodrop型分光光度计、Applied Biosystems热循环仪、Applied Biosystems PCR仪,德国Thermo Fisher Scientific公司。
1.4 分组、模型复制及给药将SD大鼠随机分7组,即假手术组、模型组、阳性药组(戊酸雌二醇,0.09 mg·kg-1)、谷胱甘肽组(36 mg·kg-1)及杜仲汤低、中、高剂量组(生药0.54、1.08、2.16 g·kg-1),每组6只。假手术组暴露卵巢后复位缝合,不摘除双侧卵巢;其余各组大鼠均从肋下1 cm、脊柱两侧1.5 cm处做一切口(约1.5 cm),彻底摘除两侧卵巢;结扎后将脂肪组织放回腹腔,缝合切口。大鼠术后连续3 d大腿肌肉注射青霉素钠抗感染,每只大鼠4×104U·d-1。手术后第2天起,每日进行大鼠阴道涂片检查,连续观察7 d,不出现动情周期变化为模型复制成功。
模型复制成功后开始灌胃给药,假手术组和模型组均灌服生理盐水,给药组按照设定剂量灌胃给药,灌胃体积为10 mL·kg-1,每日1次,连续给药200 d。
1.5 大鼠血清GSH、TRACP、OPG含量检测大鼠腹主动脉取血,室温下静置2 h后,以3 000 r·min-1(离心半径10 cm)离心20 min,取血清,置于-80℃冰箱备用。严格按照试剂盒说明书步骤操作,采用生化试剂盒检测大鼠血清GSH含量,采用ELISA试剂盒检测大鼠血清TRACP、OPG含量。
1.6 大鼠股骨骨密度检测取大鼠左侧股骨,将其周围组织剔除干净后,整齐摆放在骨密度仪的吸收测量平台上。采用计算机在小动物梯级标准分析软件模式下,自动记录股骨整体、股骨近端(股骨近侧干骺端1/3)及股骨远端(股骨远侧干骺端1/4)的骨密度,并求平均值。
1.7 HE染色法观察大鼠胫骨组织病理变化取各组大鼠右侧胫骨,使用10%EDTA-NA缓冲液进行脱钙处理;梯度乙醇脱水后,使用石蜡纵向包埋,进行常规切片;经过HE染色,脱水、透明、封片后,在光学显微镜下进行病理观察。
1.8 Western Blot法检测骨组织中BMP-2、OPG、COL1蛋白表达水平将各组大鼠股骨去掉转子部位,取股骨上端,用液氮进行研磨,加裂解液裂解后,以4℃、12 000 r·min-1离心(离心半径5 cm)30 min,取上清液,采用BCA法测定蛋白浓度。加Loading Buffer后,100℃煮10 min,-20℃下保存备用。采用10%聚丙烯酰胺凝胶电泳进行蛋白分离(100 V恒压,100 min);电泳结束后转移至PVDF膜上[250mA恒流,45min(检测OPG、BMP-2)或100min(检测COL1)];室温下用5%脱脂奶粉封闭2 h。一抗孵育:5%脱脂奶粉稀释一抗[COL1(1∶1 000)、OPG(1∶1 000、BMP-2(1∶500)、β-actin(1∶1 000)],4℃下摇床孵育过夜;TBST漂洗3次,每次10 min,加入HRP标记的对应二抗(1∶5 000),室温下摇床孵育1 h;TBST漂洗3次,每次10 min,将ECL发光液滴加在膜上,置于凝胶成像仪中曝光;采用ImageJ软件测定各蛋白条带灰度值,以β-actin为内参,对目的蛋白进行半定量分析。
1.9 RT-PCR法检测骨组织BM P-2、Runt相关转录因子2(RUNX2)m RNA表达水平将各组大鼠股骨去掉转子部位,取股骨上端,用液氮进行研磨;根据试剂盒说明书步骤提取股骨组织总RNA后,通过梯度PCR仪将RNA转录成cDNA。然后进行PCR扩增反应,反应条件:95℃预处理30 s,循环1次;95℃变性5 s,60℃退火30 s,72℃延伸15 s,共循环45次。采用2-ΔΔCt法进行基因表达水平的相对定量分析,以GAPDH为内参基因,假手术组基因表达量设为1。引物由宝生物工程(大连)有限公司合成,引物序列见表1。
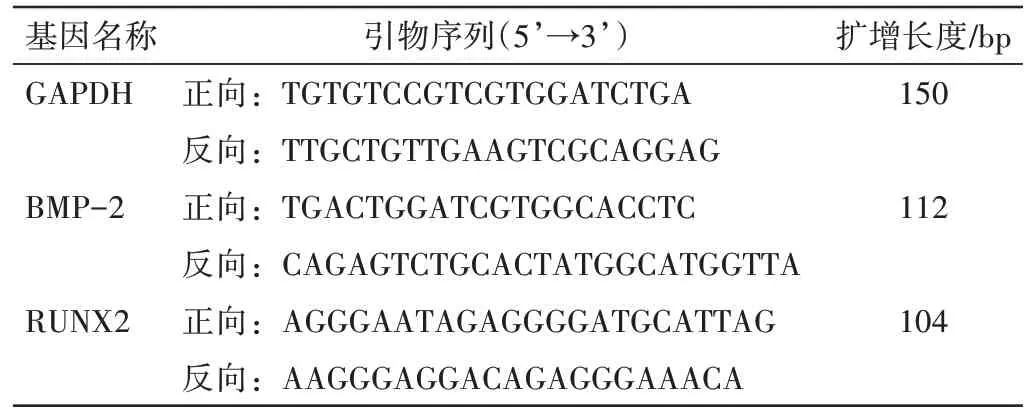
表1 引物序列表Table 1 Primer sequences table
1.10 统计学处理方法采用SPSSStatistics 21.0统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD检验;以P<0.05为差异有统计学意义。
2 结果
2.1 杜仲汤对去卵巢大鼠体质量增长值的影响结果见图1。与假手术组比较,模型组大鼠体质量增长值显著升高(P<0.01)。与模型组比较,阳性药组及杜仲汤低、中、高剂量组大鼠体质量增长值均明显降低(P<0.05,P<0.01)。结果表明,杜仲汤能降低大鼠卵巢切除引起的体质量增加。
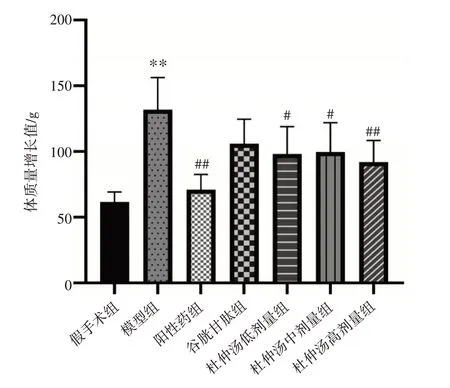
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01图1 杜仲汤对去卵巢大鼠体质量增长值的影响(±s,n=6)Figure 1 Effect of Eucommiae Cortex Decoction on the growth value of bodymass in ovariectomized rats(±s,n=6)
2.2 杜仲汤对去卵巢大鼠血清GSH、OPG、TRACP水平的影响结果见图2。与假手术组比较,模型组大鼠的血清GSH、OPG水平显著降低(P<0.05,P<0.01),TRACP水平显著升高(P<0.01)。与模型组比较,给药组大鼠的血清GSH水平均显著升高(P<0.01),杜仲汤中剂量组大鼠的血清OPG水平显著升高(P<0.01),杜仲汤低剂量组大鼠的血清TRACP水平显著降低(P<0.01)。结果表明,杜仲汤能提高去卵巢大鼠的血清GSH、OPG水平,降低TRACP水平。

注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01图2 杜仲汤对去卵巢大鼠血清GSH、OPG、TRACP水平的影响(±s,n=6)Figure 2 Effects of Eucommiae Cortex Decoction on serum GSH,OPG and TRACP levels in ovariectomized rats(±s,n=6)
2.3 杜仲汤对去卵巢大鼠骨密度的影响结果见图3。与假手术组比较,模型组大鼠的骨密度明显降低(P<0.05)。与模型组比较,谷胱甘肽组和杜仲汤低、中剂量组大鼠的骨密度显著升高(P<0.05,P<0.01)。结果表明,杜仲汤能增加大鼠骨密度,改善去卵巢引起的大鼠骨质疏松症。

注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01图3 杜仲汤对去卵巢大鼠骨密度的影响(±s,n=6)Figure 3 Effect of Eucommiae Cortex Decoction on bone mineral density in ovariectomized rats(±s,n=6)
2.4 杜仲汤对去卵巢大鼠骨组织病理变化的影响结果见图4。假手术组大鼠骨小梁组织分布均匀,无明显异常,骨小梁网状结构正常。与假手术组比较,模型组大鼠骨小梁结构不完整,出现明显断裂,骨小梁稀疏且明显变薄,骨髓腔间隙显著增大。与模型组比较,谷胱甘肽组大鼠骨小梁结构较完整,连接成网状结构;阳性药组和杜仲汤低、中、高剂量组大鼠骨小梁结构明显改善,骨小梁变粗,数量增加。
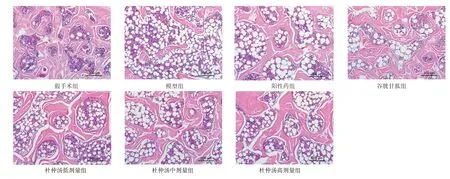
图4 杜仲汤对去卵巢大鼠骨组织病理变化的影响(HE染色,×100)Figure 4 Effect of Eucommiae Cortex Decoction on pathological changes of bone tissue in ovariectomized rats(HE staining,×100)
2.5 杜仲汤对去卵巢大鼠骨组织中BMP-2、OPG、COL 1蛋白表达的影响结果见图5。与假手术组比较,模型组大鼠骨组织中BMP-2、OPG、COL1蛋白表达水平均显著下降(P<0.01)。与模型组比较,阳性药组及杜仲汤中、高剂量组大鼠骨组织中BMP-2蛋白表达水平明显升高(P<0.05),阳性药组、谷胱甘肽组及杜仲汤低、中剂量组大鼠骨组织中OPG蛋白表达水平明显升高(P<0.05,P<0.01),谷胱甘肽组及杜仲汤低剂量组大鼠骨组织中COL1蛋白表达水平明显升高(P<0.05,P<0.01)。结果表明,杜仲汤能够通过上调骨组织中BMP-2、OPG、COL1蛋白表达量,从而促进骨形成,对去卵巢大鼠骨质疏松症起到一定的防治作用。

注:与假手术组比较,*P<0.05;#P<0.05,##P<0.01图5 杜仲汤对去卵巢大鼠骨组织中BMP-2、OPG、COL1蛋白表达的影响(±s,n=6)Figure 5 Effects of Eucommiae Cortex Decoction on the protein expressions of BMP-2,OPG and COL1 in bone tissue of ovariectomized rats(±s,n=6)
2.6 杜仲汤对去卵巢大鼠骨组织中BMP-2、RUNX2 m RNA表达的影响结果见图6。与假手术组比较,模型组大鼠骨组织中BMP-2、RUNX2 mRNA表达水平明显降低(P<0.05)。与模型组比较,各给药组大鼠骨组织中BMP-2、RUNX2 mRNA表达水平均显著升高(P<0.05,P<0.01)。结果表明,杜仲汤能提高骨组织中BMP-2、RUNX2 mRNA表达水平,从而促进骨形成的发生。
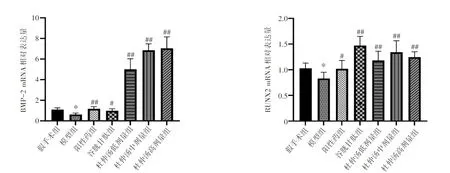
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01图6 杜仲汤对去卵巢大鼠骨组织中BMP-2、RUNX2m RNA表达的影响(±s,n=6)Figure 6 Effects of Eucommiae Cortex Decoction on mRNA expressions of BMP-2 and RUNX2 in bone tissue of ovariectomized rats(±s,n=6)
3 讨论
杜仲具有补肝肾、强筋骨等功效,是中医临床常用的补肾壮骨药物。传统中药炮制理论认为药物经盐制后入肾经[7],盐制杜仲温而不燥,可直达下焦,引药入肾,而“肾主骨”“肾充则髓实”[12-13]。酒制法在中药炮制中也是一种常用方法[14],米酒(黄酒)性温,可起到增强疗效、温补肝肾的作用,使有效成分易于溶出,从而最大限度发挥药物疗效[15]。杜仲汤中的杜仲经盐制和酒制后,有效成分充分溶出,引药入肾,从而达到补肾健骨的作用。
去卵巢大鼠体质量升高可能是机体防止骨丢失的一种代偿性机制,体质量升高可刺激骨形成,缓解骨骼系统受到的压力,但骨质疏松症患者体质量升高会增加骨折风险[16]。研究[17-18]发现,杜仲对肥胖患者体质量降低有效,可能与其有效成分绿原酸能减少外源性脂肪吸收、促进胆固醇排出有关。本研究结果显示,大鼠去卵巢后体质量显著增加,而杜仲汤治疗后体质量增长值明显降低,提示杜仲汤可以降低绝经后骨质疏松症引起的体质量增长,缓解一定的骨折风险。
骨密度是评价骨质疏松症的金指标,也是间接评价骨丢失程度的指标之一[1,19]。骨小梁微结构退变是骨质疏松症中骨组织的病理改变之一,这种内在结构的变化不仅影响骨强度,还会改变骨生物力学性能[20-21]。本研究结果表明,大鼠去卵巢后股骨的骨密度水平降低,骨小梁结构受损,血清生化指标紊乱,与临床绝经期妇女骨质疏松症的症状一致;而给予杜仲汤治疗后,股骨密度显著提高,骨小梁结构明显改善,生化指标得到一定程度的恢复,表现出抗骨质疏松样作用,与相关研究[8]结果一致。
OPG和TRACP分别为骨形成标志物与骨吸收标志物。OPG是肿瘤坏死因子受体超家族成员之一,是由成骨细胞分泌的一种糖蛋白,通过OPG/RANK信号通路抑制破骨细胞分化并诱导其凋亡,从而抑制骨吸收[22]。TRACP是酸性磷酸酶的6种同工酶之一,血清TRACP活性可以反映体内破骨细胞活性以及骨吸收状态[23],与骨质疏松症患者的骨密度呈负相关[24]。本研究结果表明,经杜仲汤治疗后,去卵巢大鼠血清TRACP水平明显降低,OPG水平明显升高,表明杜仲汤有助于维持去卵巢大鼠骨形成与骨吸收之间的平衡。BMP-2是骨形态发生蛋白家族成员之一[25],细胞膜表面的BMP配体结合BMPⅠ型和Ⅱ型受体,受体活化后启动Smad依赖型信号通路,激活的Smads转移到细胞核内诱导RUNX2在核内高表达[26]。RUNX2是成骨细胞分化所必需的主转录因子,可协同其下游的Osterix调节成骨细胞特异性基因COL1、ALP的表达[27-28],从而影响成骨细胞分化。本研究结果表明,杜仲汤能上调去卵巢大鼠骨组织中BMP-2、OPG、COL1蛋白表达以及BMP-2、RUNX2 mRNA表达,提示杜仲汤可能通过促进成骨细胞分化,加速骨形成,从而治疗骨质疏松症。
氧化应激是机体内抗氧化与氧化作用失衡所产生的一系列病理生理损伤[29-30]。研究[31-32]表明,氧化应激会导致成骨细胞活性减弱,破骨细胞活性增强。随着年龄增长,骨组织中的活性氧日益增多[33],GSH是体内抗氧化体系的主要分子,能促进成骨细胞增殖、分化[31,34]。本研究应用谷胱甘肽对去卵巢大鼠进行干预后,大鼠血清GSH水平显著升高,骨密度提高,与相关研究[35]结果一致。此外,谷胱甘肽能保护骨小梁完整性,提高OPG、COL1蛋白以及BMP-2、RUNX2 mRNA表达水平,说明抗氧化剂谷胱甘肽能够通过抑制氧化损伤来改善骨质疏松症。研究[36]表明,杜仲对氧化损伤的骨细胞具有保护作用,而杜仲水提物能降低骨细胞的氧化损伤,提高细胞存活率。本研究结果表明,杜仲汤能提高去卵巢大鼠血清GSH水平,提示其可能通过清除体内过氧化物,减轻自由基反应,保护骨髓组织。
综上所述,杜仲汤能提高去卵巢大鼠的骨密度,保护骨小梁完整性,对去卵巢大鼠骨质疏松症有一定防治作用,其机制可能与提高血清GSH、OPG水平,降低TRACP水平,上调BMP-2、OPG、COL1蛋白以及BMP-2、RUNX2 mRNA表达,从而促进骨形成有关。

