安胃汤含药血清对胃黏膜肠上皮化生模型细胞自噬及凋亡的影响
胡鑫,唐友明,郑景辉,莫云秋,梁柳观,莫少丹(.广西中医药大学,广西 南宁 53000;.广西中医药大学附属瑞康医院,广西 南宁 5300)
胃黏膜肠上皮化生(Gastric intestinalmetaplasia,GIM)是指胃泌酸细胞或胃窦部黏膜被由潘氏细胞、杯状细胞和吸收细胞组成的肠黏膜所取代,常作为慢性萎缩性胃炎(Chronic atrophic gastritis,CAG)的伴随症状出现,是肠型胃癌发生模式中的重要前驱病变[1-2]。研究[3]表明,GIM可极大增加CAG患者的癌变风险,阻止或逆转GIM是防治胃癌的关键策略之一。目前,西医对于GIM尚缺乏疗效确切的干预方法[4]。
安胃汤是在全国名老中医林沛湘教授治疗慢性胃病的有效经验方基础上化裁而来,由半夏、黄连、干姜、百合、乌药、丹参、白芍、薏苡仁、炙甘草等中药组成,具有理气化湿、祛瘀止痛、平调寒热及消痞健胃的功效,临床上治疗CAG效果显著[5]。课题组前期研究[6-7]证实,安胃汤可通过调节三叶肽家族(TFF)和胃黏膜表皮生长因子(EGF)的表达,改善胃黏膜的病理形态并增强其防御能力,从而减轻胃黏膜急慢性炎症,减缓甚至逆转胃黏膜腺体萎缩、肠上皮化生以及异型增生,起到防治CAG的作用。
细胞凋亡和自噬是与细胞生长、存活和转移相关的重要生物学过程,而癌症的发生发展也与细胞凋亡和自噬失衡有关[8]。通常情况下,细胞可通过自噬应对各种应激,并抑制细胞凋亡以避免死亡,而在特定细胞环境中,自噬又可构成另一种细胞死亡途径[9]。有研究[10]报道,自噬在癌症发生发展中具有抑癌和促癌的双重作用,这取决于不同的上游信号。因此,本研究拟建立GIM细胞模型,探讨安胃汤含药血清对其自噬及凋亡的影响。
1 材料与方法
1.1 细胞及动物人胃黏膜上皮细胞GES-1,货号:CC4026,广州赛库生物技术有限公司;人胃癌细胞MKN-45,货号:CL-0292,武汉普诺赛生命科技有限公司。
8周龄雄性Wistar大鼠,SPF级,体质量(220±20)g,由北京斯贝福生物技术有限公司提供,实验动物生产许可证号:SCXK(京)2019-0010,动物质量合格证号:110324220101880963,实验动物使用许可证号:SYXK(桂)2019-0001。本研究经广西中医药大学实验动物伦理委员会批准,批文号:DW20220426-092。
1.2 药物及试剂安胃汤组成:黄连5 g、半夏13 g、干姜5 g、白芍20 g、百合20 g、乌药7 g、丹参15 g、薏苡仁10 g、炙甘草5 g,中药饮片由广西中医药大学附属瑞康医院中药房提供,常规煎煮并浓缩。
RPMI 1640培养基,美国Gibco公司,批号:11875101;0.25%胰酶,北京索莱宝科技有限公司,批号:T1300;胎牛血清,浙江天杭生物科技股份有限公司,批号:11011-8611;鹅去氧胆酸(CDCA),上海麦克林生化科技有限公司,批号:C804610;CCK-8试剂盒,上海碧云天生物技术有限公司,批号:C0037;Annexin V-PE/7-AAD双染检测试剂盒,江苏凯基生物技术股份有限公司,批号:KGA1015;KLF4、MUC2抗体(批号:PA01524、PA01524),均购自武汉博士德生物工程有限公司;DAPI染色液(Biosharp),北京兰杰柯科技有限公司,批号:BL105A;SOX2、CDX2、LC3B、Bax、β-actin抗体(批号:GB11249-100、GB121501-100、GB113801、GB15003、GB12690),Cy3标记山羊抗大鼠IgG、FITC标记的山羊抗兔IgG(批号:GB21302、GB22303),二抗山羊抗兔、山羊抗小鼠抗体(批号:GB23303、GB23301),SYBR Green PCR试剂盒、RNA提取液、Servicebio®RT First Strand cDNA Synthesis Kit(批号:G3320、G3013、G3330),电镜固定液(批号:G1102),均购自武汉塞维尔生物科技有限公司;BCA蛋白定量检测试剂盒(批号:ZJ101)、Omni-ECLTM超灵敏化学发光检测试剂盒(飞克级,批号:SQ201),均购自上海雅酶生物医药科技有限公司;锇酸(批号:G1102),北京博蕾德生物科技有限公司。
1.3 主要仪器LSRFortessa型流式细胞细胞仪,美国BD公司;Infinite M200 PRO型全波长多功能酶标仪,美国赛默飞世尔科技公司;TCSSP5Ⅱ型激光共聚焦显微镜、EM UC7型超薄切片机,德国Leica公司;HT7800型透射电子显微镜,日本Hitachi公司;CFX Connect型荧光定量PCR仪、通用型电泳仪、ChemiDoc MP全能型成像分析系统,美国Bio-Rad公司。
1.4 GIM细胞模型复制取对数生长期的GES-1细胞,调整密度为2.0×105个·mL-1,接种2 mL于6孔板中,待贴壁完全。按照试剂说明书制备CDCA储备液,将CDCA储备液以1∶15 000溶解到完全培养基中,得到浓度150μmol·L-1的CDCA工作液。弃去原培养基,加入2 mL CDCA工作液,培养24 h,即完成GIM细胞模型的建立。以人胃癌细胞MKN-45为阳性对照,采用Western Blot法(同“1.11”项下)检测细胞MUC2、KLF4蛋白表达,以确定模型复制成功。
1.5 安胃汤含药血清制备及其最大无毒浓度计算取30只W istar大鼠,适应性喂养1周后随机分为空白组(5只)和安胃汤组(25只),安胃汤组按照生药1.545 g·kg-1剂量灌胃给予安胃汤,空白组灌胃给予等量生理盐水,每日2次,连续7 d[11]。末次给药2 h后,以1%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉大鼠;腹主动脉采血,静置2 h后以4℃、3 000 r·min-1(离心半径=8 cm)离心15 min;血清用0.22μm针式滤过器过滤、分装,-20℃保存。
取对数生长期GES-1细胞,调整细胞密度为5×103个·mL-1,分为8组,每组设4个复孔,以每孔100μL接种于96孔板。加入含不同浓度梯度的安胃汤含药血清(0.39%、0.78%、1.56%、3.13%、6.25%、12.5%、25%、50%),另设细胞常规培养孔与空白孔。分别于孵育24、48、72 h后,采用CCK-8法检测各孔吸光度(A)值,计算:细胞破坏率(%)=(A细胞组-A给药组)/(A细胞组-A空白组)×100%。根据二次回归曲线计算细胞破坏率<5%时的药物浓度,即为该含药血清的最大无毒浓度。
1.6 细胞分组及干预实验设正常组(正常胃黏膜上皮细胞GES-1常规培养)、模型组(经CDCA复制成GIM模型后常规培养)、空白对照组(GIM模型细胞以等量空白血清培养)、安胃汤组(GIM模型细胞+7%安胃汤含药血清),各组细胞干预24 h后检测。
1.7 流式细胞术(Annexin V-PE/7-AAD双染法)检测细胞凋亡用不含EDTA的胰酶消化收集各组细胞,以1 000 r·min-1(离心半径=8 cm)离心5 min后,用4℃预冷的1×PBS轻柔吹洗细胞;再次离心冲洗,重复2~3次。避光条件下,加入100μL 1×Binding Buffer吹匀悬浮细胞,并加入1μL Annexin V-PE和5μL 7-AAD混匀,室温下避光孵育10 min后,采用流式细胞仪进行分析。检测结果使用FlowJo V10软件分析。
1.8 免疫荧光双标法检测肠上皮化生相关蛋白SOX2、CDX2的表达情况按各分组条件于共聚焦培养皿中培养细胞,干预处理后弃原培养基;4℃预冷的PBS漂洗3次,用4%多聚甲醛溶液在室温下固定10 min;以0.3%Triton X-100破膜20 min后,PBS漂洗3次;加入SOX2一抗(1∶1 000),4℃下孵育过夜,PBS洗涤3次;加入FITC标记荧光二抗(1∶100),室温下避光孵育50 min,PBS洗涤3次;滴加对应TSA,避光孵育10 min后,TBST洗涤3次。重复上述步骤,加入CDX2一抗(1∶1 000)及Cy3标记荧光二抗(1∶300)。DAPI复染细胞核,抗荧光淬灭剂封片,中性树脂固定;在激光共聚焦显微镜下观察、拍摄,使用ImageJ软件分析各蛋白荧光强度。
1.9 透射电镜观察细胞超微结构及自噬情况消化收集各组细胞,加入电镜固定液,避光固定30 min后,离心收集细胞团块沉淀;用1%琼脂糖溶液包裹,1%锇酸室温下避光固定2 h后,进行梯度脱水;经渗透、包埋、切片,铀、铅双染后,在透射电子显微镜下观察并采集图像;由3位实验人员独立对各图像自噬小体结构进行观察计数。
1.10 qRT-PCR法检测细胞LC3、Bax m RNA表达情况收集各组细胞,采用Trizol法提取细胞总RNA,测定其纯度及浓度后,根据逆转录试剂盒说明书步骤进行逆转录,得到cDNA。总反应体系为20μL,扩增条件为:95℃预变性30 s,95℃变性15 s,60℃退火延伸30 s,共40个循环。细胞的LC3、BaxmRNA表达以β-actin作为内参,采用2-ΔΔCt法计算目的基因的相对表达量。引物合成由生工生物工程(上海)股份有限公司完成,引物序列见表1。
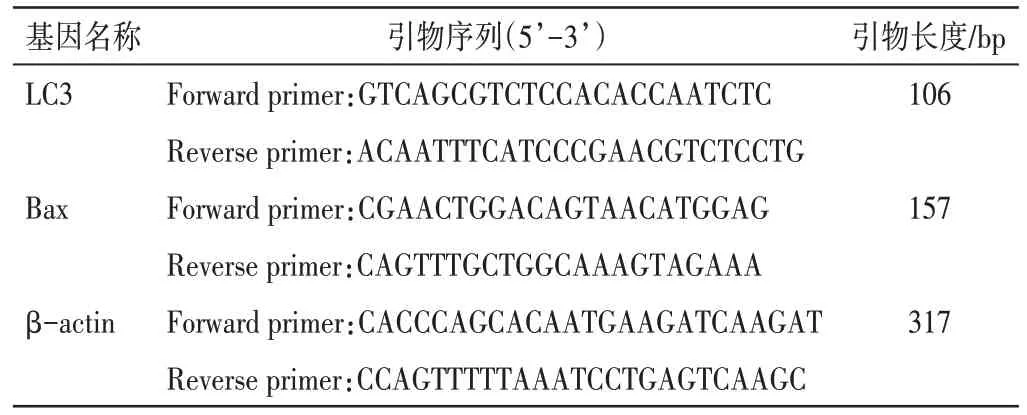
表1 PCR引物序列Table 1 Primer sequences for PCR
1.11 Western Blot法检测细胞LC3、Bax蛋白表达情况收集各组细胞,加入裂解液后,冰上裂解30 min,离心取上清。使用BCA蛋白定量试剂盒测定总蛋白浓度,按4∶1比例加入上样缓冲液,95℃金属浴变性10 min。配制分离胶,120 V恒温电泳至溴酚蓝出胶底,转膜至PVDF膜,用封闭液室温下封闭1 h。加入LC3、Bax、β-actin一抗(1∶5 000),4℃下孵育过夜。TBST洗涤PVDF膜3次后,加入对应二抗(1∶5 000),室温下孵育1 h。洗涤后采用ECL显影,扫描;采用ImageJ软件测定各蛋白条带灰度值,以β-actin为内参,对目的蛋白进行半定量分析。
1.12 统计学处理方法采用SPSS 24.0和GraphPad Prism 8.0统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 GIM模型细胞的MUC2、KLF4蛋白表达情况结果见图1。与正常组比较,阳性对照组(胃癌细胞MKN-45)及模型组细胞的MUC2、KLF4蛋白表达显著上调(P<0.01);与模型组比较,阳性对照组细胞的MUC2、KLF4蛋白表达明显上调(P<0.05)。结果提示,150μmol·L-1浓度CDCA诱导的GIM细胞模型复制成功。
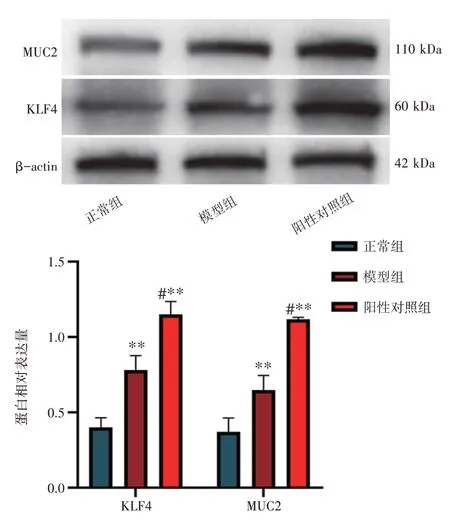
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05图1 胃黏膜肠上皮化生模型细胞的MUC2、KLF4蛋白表达情况(±s,n=3)Figure 1 Protein expressions of MUC2 and KLF4 in gastric intestinalmetaplasiamodel cells(±s,n=3)
2.2 安胃汤含药血清对GES-1细胞活性的影响结果见图2。干预时间为24 h时,不同浓度的安胃汤含药血清对GES-1细胞的破坏率较48、72 h显著降低,表明药物毒性降低。根据二次回归曲线计算,当含药血清浓度为7%时,细胞破坏率<5%。故本研究选择7%安胃汤含药血清浓度为最大无毒浓度,干预24 h作为后续实验条件。
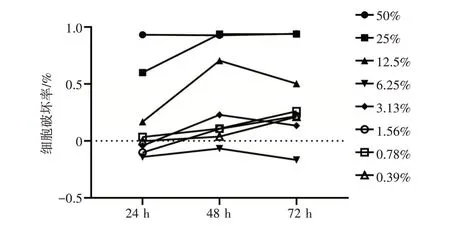
图2 安胃汤含药血清对GES-1细胞活性的影响(±s,n=3)Figure 2 Effect of serum containing Anwei Decoction on the activity of GES-1 cells(±s,n=3)
2.3 安胃汤含药血清对GIM模型细胞凋亡的影响结果见图3。与正常组比较,模型组细胞的凋亡率明显降低(P<0.05)。与空白对照组比较,安胃汤组细胞的凋亡率显著增高(P<0.01)。结果表明,安胃汤含药血清可以促进GIM模型细胞的凋亡。
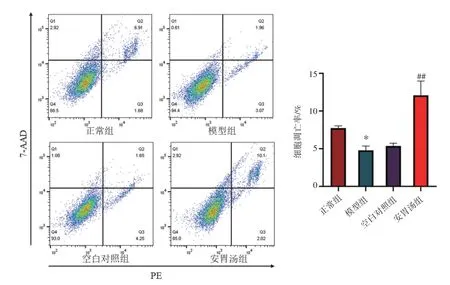
注:与正常组比较,*P<0.05;与空白对照组比较,##P<0.01图3 安胃汤含药血清对胃黏膜肠上皮化生模型细胞凋亡的影响(±s,n=3)Figure 3 Effect of serum containing Anwei Decoction on apoptosis of gastric intestinalmetaplasiamodel cells(±s,n=3)
2.4 安胃汤含药血清对GIM模型细胞SOX2、CDX2蛋白表达的影响结果见图4。SOX2-CDX2复合物的形成是肠化生中的特异性标志物之一[12]。与正常组比较,模型组细胞的SOX2荧光强度明显降低(P<0.05),CDX2荧光强度显著增高(P<0.01),结果进一步表明GIM细胞模型复制成功。与空白对照组比较,安胃汤组细胞的SOX2荧光强度显著增高(P<0.01),CDX2荧光强度明显降低(P<0.05)。结果表明,安胃汤含药血清可在一定程度上降低GIM模型细胞的肠化生程度。

注:与正常组比较,*P<0.05,**P<0.01;与空白对照组比较,#P<0.05,##P<0.01图4 安胃汤含药血清对胃黏膜肠上皮化生模型细胞SOX2、CDX2蛋白表达的影响(免疫荧光,×1 000;±s,n=3)Figure 4 Effects of serum containing Anwei Decoction on the protein expressions of SOX2 and CDX2 in gastric intestinal metaplasia model cells(IF,×1 000;±s,n=3)
2.5 安胃汤含药血清对GIM模型细胞自噬的影响结果见图5。正常组细胞整体呈纺锤形,细胞核和各细胞器结构完整,胞内可见少量自噬溶酶体结构。与正常组比较,模型组细胞结构紊乱,细胞核萎缩畸形,内质网和线粒体等细胞器肿胀破裂及空泡化严重,自噬小体及自噬溶酶体明显增多。与空白对照组比较,安胃汤组细胞结构较完整,镜下可见自噬小体和自噬溶酶体略有减少。
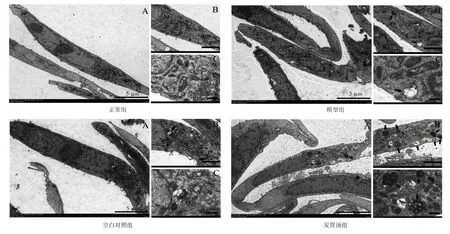
注:透射电镜观察,图A:×3 000(标尺=5μm);图B:×8 000(标尺=2μm);图C:×20 000(标尺=500 nm)图5 安胃汤含药血清对胃黏膜肠上皮化生模型细胞自噬的影响Figure 5 Effect of serum containing Anwei Decoction on autophagy of gastric intestinalmetaplasiamodel cells
2.6 安胃汤含药血清对GIM模型细胞LC3、Bax m RNA表达的影响结果见图6。与正常组比较,模型组细胞的Bax mRNA表达明显下调(P<0.05),LC3 mRNA表达显著上调(P<0.01)。与空白对照组比较,安胃汤组细胞的BaxmRNA表达显著上调(P<0.01),LC3 mRNA表达显著下调(P<0.01)。结果表明,经CDCA复制的GIM模型细胞自噬能力明显增强,而促凋亡能力明显减弱,安胃汤含药血清干预后则能够逆转上述变化。

注:与正常组比较,*P<0.05,**P<0.01;与空白对照组比较,##P<0.01图6 安胃汤含药血清对胃黏膜肠上皮化生模型细胞LC3、Baxm RNA表达的影响(±s,n=3)Figure 6 Effects of serum containing Anwei Decoction on mRNA expressions of LC3 and Bax in gastric intestinal metaplasia model cells(±s,n=3)
2.7 安胃汤含药血清对GIM模型细胞LC3、Bax蛋白表达的影响结果见图7。与正常组比较,模型组细胞的Bax蛋白表达明显下调(P<0.05),LC3Ⅱ/LC3Ⅰ蛋白表达比值显著升高(P<0.01)。与空白对照组比较,安胃汤组细胞的Bax蛋白表达显著上调(P<0.01),LC3Ⅱ/LC3Ⅰ蛋白表达比值显著降低(P<0.01)。结果表明,安胃汤干预能够抑制GIM模型细胞的自噬,并促进其凋亡。

注:与正常组比较,*P<0.05,**P<0.01;与空白对照组比较,##P<0.01图7 安胃汤含药血清对胃黏膜肠上皮化生模型细胞LC3、Bax蛋白表达的影响(±s,n=3)Figure 7 Effects of serum containing Anwei Decoction on proteins expressions of LC3 and Bax in gastric intestinal metaplasiamodel cells(±s,n=3)
3 讨论
中医将慢性萎缩性胃炎(CAG)归属于“胃痛”“痞满”“嘈杂”等范畴,外邪侵袭、内伤饮食、情志失和及先天禀赋不足、脾胃素虚等因素导致中焦气机不利、胃失和降是CAG的主要病机,临床上常表现为寒热交错、虚实相间之证[13]。安胃汤以半夏为君药,和胃降逆,燥湿除满,消痞散结;黄连、干姜配伍为臣药,寒热并施,辛开苦降;乌药、百合亦为臣药,养津护胃,行气散寒;白芍、炙甘草为佐,酸甘化阴以生津液,柔肝缓急而止疼痛;丹参活血化瘀,薏苡仁健脾清热。全方寒热并用,活血行气,畅通气机,发挥防治CAG的功效[14]。
本课题组前期研究[15-16]发现,安胃汤可通过PI3K/Akt、Fas/Fas-L、JAK1/STAT等多个信号传导通路调控胃黏膜萎缩腺体上皮细胞凋亡,改善胃黏膜的病理变化并促进胃黏膜修复及腺体再生,从而减缓甚至逆转CAG伴异型增生的病理过程。本研究采用CDCA诱导建立胃黏膜肠上皮化生(GIM)细胞模型,MUC2、KLF4蛋白表达显著上调,提示GIM细胞模型复制成功。SOX2-CDX2复合物的形成是肠化生中的特异性标志物之一,免疫荧光实验结果显示,模型组细胞的SOX2荧光强度明显降低,CDX2荧光强度显著增高,进一步表明GIM细胞模型复制成功。而安胃汤含药血清干预后,GIM模型细胞的SOX2荧光强度显著增高,CDX2荧光强度明显降低。结果表明,安胃汤含药血清可在一定程度上降低GIM模型细胞的肠化生程度。
细胞的自噬与凋亡是胃癌发生发展过程中的重要生物学进程。在CAG阶段,胃黏膜上皮细胞的过度凋亡导致胃黏膜的萎缩改变;而在不典型增生阶段,细胞凋亡发生障碍,增殖继续发生,从而引发增生[17-18]。研究[19]发现,在N-甲基-N’-硝基-N-亚硝基胍(MNNG)诱导的胃癌前病变大鼠中,自噬相关蛋白LC3、p62表达上调,而凋亡受到抑制。提示在早期胃癌发展过程中,癌变细胞可能通过自噬逃避细胞凋亡,以促进自身存活并逐渐形成肿瘤细胞。本研究通过免疫荧光法、流式细胞术、透射电镜观察等方法检测分析了自噬、凋亡相关蛋白、基因的表达情况。结果一致显示,CDCA诱导的GIM模型细胞中自噬增强,而凋亡受到抑制;经安胃汤干预后,GIM模型细胞的自噬小体数量及自噬相关蛋白表达下调,细胞凋亡率及凋亡相关蛋白表达上调。
综上所述,安胃汤可能通过调节GIM模型细胞自噬,并促进其凋亡,从而改善胃黏膜上皮细胞的肠上皮化生情况。

