东紫苏精油对间充质干细胞C3H10T1/2成脂分化的影响及机制
张梦媛,徐芳,柏桦,邹伟,刘晓颖,王琦
(昆明医科大学公共卫生学院,云南昆明 650500)
肥胖症(obesity)是由于能量摄取与消耗之间的不平衡而导致的可损害健康的异常或过多的脂肪积累,脂质代谢障碍可导致肥胖[1]。脂质代谢异常也与某些疾病密切相关,如动脉硬化、糖尿病、肥胖、老年痴呆症(Alzheimer′s disease,AD)以及肿瘤的发生和发展[2]。越来越多的证据表明,天然植物中提取的活性成分如茶叶中多酚类化合物[3]、小粒咖啡中咖啡因[4]、苦荞黄酮[5]、槲皮素[6]等都有减脂功效,其成为减脂功能食品开发的重要研究方向。
东紫苏(ElsholtizabodinieriVaniot),属于唇形科(Lamiaceae)香薷属(Elsholtzia)植物[7],别名凤尾茶、小山茶、云松茶、牙刷草、野山茶等,是源自云南的特色药食两用资源,滇南地区居民常将东紫苏泡水作为一种日常饮用的茶类饮料,认为其可以祛除火气。东紫苏含精油、黄酮类、三萜类、酚类等成分[8],具有抗氧化、抗癌、抗炎、抗病原微生物、解热、镇痛、解痉挛、增强免疫力等功效[9]。东紫苏精油作为其中的主要活性物质之一,生物活性研究报道较少。课题组前期优化提取条件并确定东紫苏精油成分后,以秀丽隐杆线虫为模式生物,通过转录组学研究发现,秀丽隐杆线虫参与脂肪酸代谢的9 个基因发生了变化,其中D2063-1、acs-2、sodh-1、sodh-2、alh-5、acdh-76 个基因表达上调,acdh-1、F25C8-1、acox-533 个基因表达下调,改变的基因隶属于NHR49 脂肪酸分解代谢通路[10]。为进一步证明东紫苏精油的减脂效果,本研究以C3H10T1/2 成脂细胞为研究对象,初步探讨东紫苏精油对细胞内脂质代谢的影响和作用机理,以期为东紫苏的食物开发和药用研究提供参考依据。
1 材料与方法
1.1 材料与试剂
小鼠间充质干细胞C3H10T1/2:中国科学院细胞库。干燥东紫苏:云南省红河州建水县。东紫苏精油由本实验室提取[东紫苏全草打碎,过100 目筛,提取条件:料液比1∶6(g/mL)、浸泡2 h、600 W 微波无溶剂提取1 h]。
奥利司他:北京索莱宝科技有限公司;四季青无支原体优级胎牛血清、蛋白酶抑制剂、RIPA 裂解液、0.25%胰酶:大连美仑生物技术有限公司;3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、牛胰岛素、地塞米松、罗格列酮、3,3′,5 三碘代-L-甲状腺原氨酸(3,3′,5-triido-L-thyronine,T3)、吲哚美辛、谷氨酸酰胺、丙酮酸钠溶液、非必需氨基酸:美国Sigma 公司;油红O、MTT、最低必须培养基(minimum essentiamedium,MEM)培养液:武汉赛维尔生物科技有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triacylglyceride,TG)检测试剂盒、总RNA 抽提试剂(total RNA extraction reagent,TRizol):南京建成生物工程研究所;SYBRPremixEXTaqⅡ:美国MCE 公司;cDNA 第1 链合成试剂盒:天根生化科技(北京)有限公司;过氧化物酶体增殖物激活受体γ(peroxideproliferator-activated receptorγ,PPARγ)兔抗、CCAAT 增强子结合蛋白α(CCAAT/enhancer-bindingproteinsα,C/EBPα)兔抗、脂肪酸结合蛋白4(fattyacid-bindingprotein4,FABP4)兔抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG 二抗:山东华安科技生物有限公司。聚合酶链式反应(polymerase chain reaction,PCR)上游引物及下游引物:生工生物工程(上海)股份有限公司。
1.2 仪器与设备
Nikon TS2R 研究级荧光倒置显微镜:日本尼康公司;Amersham GE 超灵敏多功能成像仪:美国GE 公司;LC96 实时荧光定量PCR 仪:瑞士Roche 公司;Synergy H1 多功能酶标仪:美国宝特公司;DryDIST 植物精油提取仪:意大利milestone 公司;5% CO2细胞培养箱:赛默飞世尔科技有限公司。
1.3 方法
1.3.1 细胞培养、诱导
1)C3H10T1/2 细胞培养:将含有10%胎牛血清及谷氨酸酰胺、丙酮酸钠100 mmol/L 溶液、非必需氨基酸的MEM 培养基置于37 ℃的5% CO2细胞培养箱中培养,用0.25%胰酶消化传代。
2)C3H10T1/2 细胞成脂分化诱导:取对数生长期的C3H10T1/2 细胞于6 孔板培养,5×104个/mL 接种,分为空白对照组、高脂模型组、精油处理组、阳性对照奥利司他组,生长5 d 中间不换液,第6 天空白对照组换培养液,剩余组加入诱导液I 液(含0.5 mol/L IBMX、2.5 mmol/L 地塞米松、344.38 μmol/L 胰岛素、1mmol/L罗格列酮、30.72 μmol/L T3、125 μmol/L 吲哚美辛)培养2 d,第8 天空白对照组换培养液,剩余组换诱导液II 液(含344.38 μmol/L 胰岛素、1 mmol/L 罗格列酮、30.72 μmol/L T3),继续培养2 d,第10 天空白对照组换培养液,剩余组再次换诱导液II 液培养2 d,第12 天空白对照组、高脂模型组换培养液,精油处理组加含不同浓度精油的培养液,阳性对照组加含奥利司他的培养液,均处理48 h(成脂诱导剂包括诱导I、II液,参照文献[11]进行配制)。
1.3.2 指标检测
1)东紫苏精油、奥利司他对细胞增殖的影响:C3H10T1/2 细胞以1×104/mL 的密度、200 μL/孔接种于96 孔板,在37 ℃培养箱中培养24 h 后加入不同浓度(0、100、200、400、800、1 600 μg/mL)的东紫苏精油和不同浓度(0、1、5、25、125、625 μg/mL)的奥利司他继续培养,各组3 个复孔,48 h 后弃培养液,每孔加入20 μL MTT 孵育4 h,弃MTT,加入150 μL 二甲基亚砜(methyl sulfoxide,DMSO)低速振荡10 min,在570 nm 波长处用酶标仪测量吸光度,细胞存活率(X,%)计算公式如下。
式中:A1为实验孔吸光度;A0为对照孔吸光度。
2)油红O 染色分析:细胞经上述方法诱导处理后弃上清,预冷磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗2~3 次,用4% 多聚甲醛固定液室温下固定15 min,PBS 洗2~3 次。60%异丙醇通透30~60 s,PBS洗2~3 次,加油红O 染液于室温下避光染色30 min,PBS 洗2~3 次,拍照记录分析。
3)甘油三酯(TG)、总胆固醇(TC)测定:对数生长期两种细胞按5×104个/mL 接种于6 孔板,成脂诱导后加精油、奥利司他处理48 h,弃培养液后用PBS 洗2~3 次,每孔加入200 μL 裂解液并将细胞从培养板上刮下(以上操作在冰上进行),超声破碎匀浆后以2 000 r/min 离心10 min,将上清液转移至新的1.5 mL的微量离心管(eppendorf micro test tubes,EP)中待测。按试剂盒说明书测定甘油三酯、总胆固醇含量。
4)荧光定量PCR 检测mRNA 表达:培养方法同3),按照试剂盒说明书步骤抽提总RNA,并逆转录合成cDNA。参照试剂盒说明书要求,反应体系:上游引物1 μL、下游引物1 μL、cDNA 模板2 μL、ddH2O 6 μL、SYBRPremixEXTaqⅡ10 μL。94 ℃预变性30 s,95 ℃变性5 s,50~60 ℃退火15 s,72 ℃延伸15 s,共40 个循环。每组样本设3 个复孔,2-ΔΔCt计算各基因转录水平差异。引物序列如表1 所示。
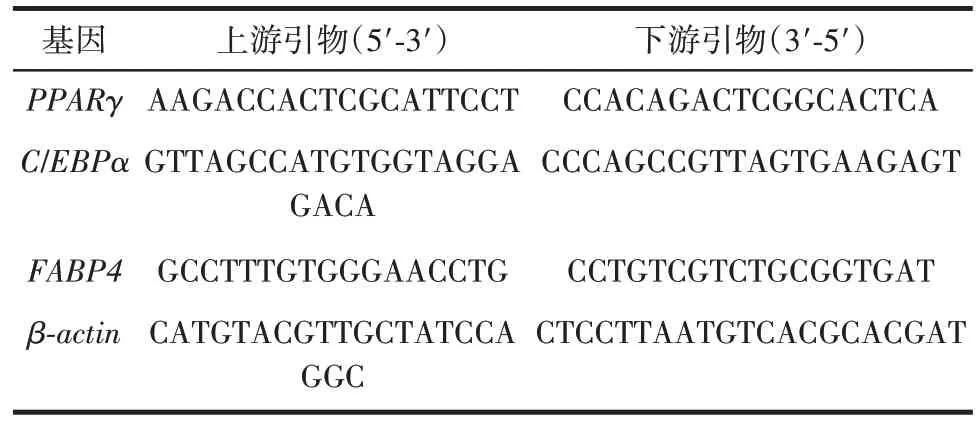
表1 引物序列Table 1 Primer sequence
5)Western blot 检测蛋白表达:细胞培养处理一定时间后,加入含有1%蛋白酶抑制剂的RIPA 裂解液裂解细胞,采用二喹啉甲酸法(bicinchoninic acid assay,BCA)法检测总蛋白浓度。蛋白上样十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamidegel electrophoresis,SDS-PAGE)后,以湿转法转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,无蛋白酶快速封闭液封闭,一抗4 ℃孵育过夜,洗膜后加入HRP 标记的二抗室温孵育2 h,化学发光液显影,扫描成像保存分析。
1.4 数据处理
统计分析采用GraphPadPrism5.0 和SPSS17.0 两种软件,采用单因素方差分析组间差异,以P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 东紫苏精油对C3H10T1/2 细胞存活率的影响
MTT 实验测不同浓度精油、奥利司他对C3H10T1/2细胞存活率的影响,结果如图1 所示。
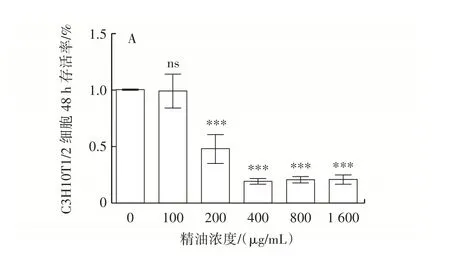
图1 东紫苏精油、奥利司他对C3H10T1/2 细胞存活率的影响Fig.1 Effect of essential oil from Elsholtiza bodinieri Vaniot and orlista on survival of C3H10T1/2 cells
由图1 可知,精油及奥利司他浓度分别小于100 μg/mL 和25 μg/mL 时,对C3H10T1/2 细胞的增殖活性与空白对照组相比几乎没有影响(P>0.05);但浓度为200~1 600 μg/mL 的精油,125~625 μg/mL 奥利司他能降低C3H10T1/2 细胞的存活率且呈现一定的剂量依赖性。因此,选择25、50、100 μg/mL 精油,25 μg/mL奥利司他进行后续C3H10T1/2 细胞减脂试验研究。
2.2 东紫苏精油对C3H10T1/2 细胞脂滴变化的影响
精油和奥利司他作用于C3H10T1/2 细胞后,观察其成脂分化后发现,成脂诱导剂会使C3H10T1/2 细胞的形态和体积发生不同程度的改变,脂滴增多,脂肪细胞增多。经过不同浓度的精油、奥利司他处理并进行油红O 染色,结果如图2 所示。
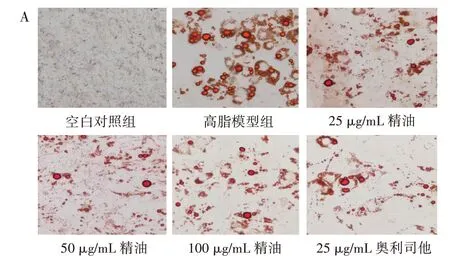
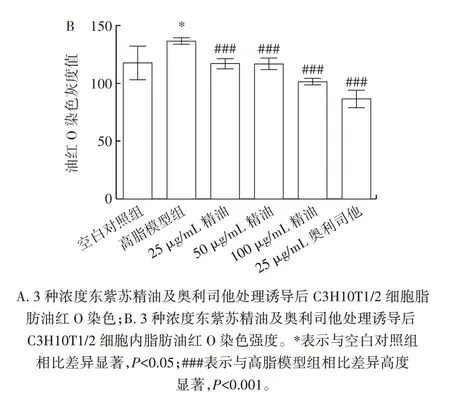
图2 东紫苏精油对C3H10T1/2 细胞脂滴变化的影响Fig.2 Effect of essential oil from Elsholtiza bodinieri Vaniot on lipid droplet of C3H10T1/2 cells
由图2 可知,空白对照组未观察到脂滴或脂肪细胞;高脂模型组经油红O 染色后,视野下呈现出深红色的即为脂肪细胞;与高脂模型组相比,低浓度(25 μg/mL)精油对C3H10T1/2 细胞的成脂分化作用并不明显,在中浓度(50 μg/mL)精油的作用下,油红O 深染的脂肪细胞和脂滴依然可见,但脂肪细胞的体积在缩小,而高浓度(100 μg/mL)精油和阳性对照奥利司他组与高脂模型组相比脂滴减少,脂肪细胞缩小。
2.3 东紫苏精油对C3H10T1/2 细胞TC、TG 的影响
精油和奥利司他对C3H10T1/2 细胞成脂分化后甘油三酯和总胆固醇含量的影响如图3 所示。
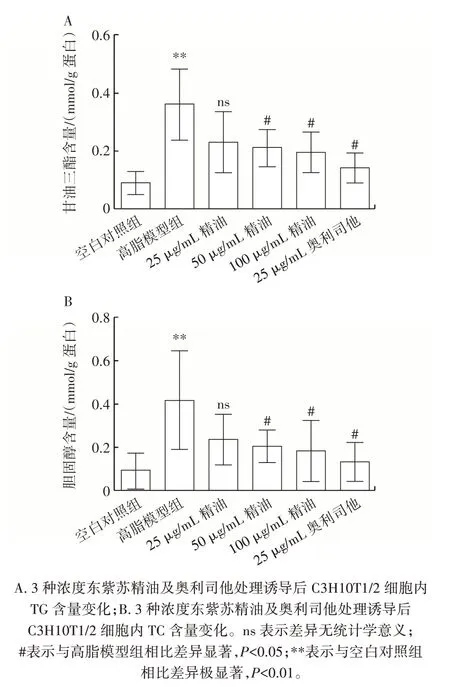
图3 东紫苏精油对C3H10T1/2 细胞甘油三酯、胆固醇含量的影响Fig.3 Effect of essential oil from Elsholtiza bodinieri Vaniot on triglyceride and cholesterols in C3H10T1/2 cells
由图3 可知,高脂模型组甘油三酯、胆固醇含量较空白对照组极显著增加(P<0.01);精油、奥利司他处理组与高脂模型组相比,C3H10T1/2 细胞中甘油三酯和总胆固醇的含量可以明显降低,其中25 μg/mL 精油处理组没有统计学上的差异。
2.4 东紫苏精油调节C3H10T1/2 细胞的成脂分化标志因子和关键转录因子基因表达
精油和奥利司他对C3H10T1/2 细胞成脂分化标志因子和关键转录因子mRNA 表达的影响如图4 所示。
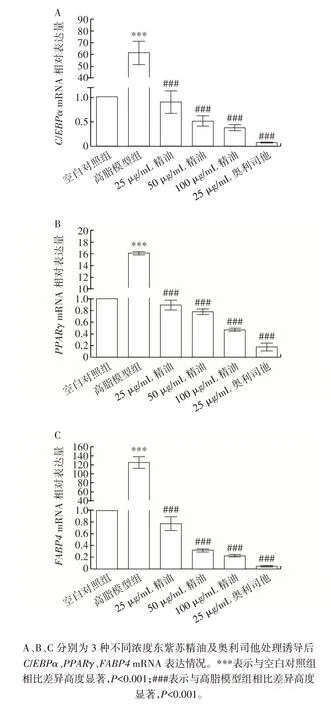
图4 东紫苏精油对C3H10T1/2 细胞脂质代谢相关基因表达的影响Fig.4 Effect of essential oil from Elsholtiza bodinieri Vaniot on expression of genes related to lipid metabolism in C3H10T1/2 cells
由图4 可知,与空白对照组相比,高脂模型组PPARγ、C/EBPα和FABP4mRNA 表达高度显著增加(P<0.001),精油、奥利司他处理组与高脂模型组相比,成脂分化标志因子和关键转录因子的表达均有高度显著降低(P<0.001),且呈现一定剂量依赖的作用。
2.5 东紫苏精油调节C3H10T1/2 细胞的成脂分化标志因子和关键转录因子蛋白表达
精油和奥利司他对C3H10T1/2 细胞的成脂分化标志因子和关键转录因子蛋白表达的影响如图5所示。
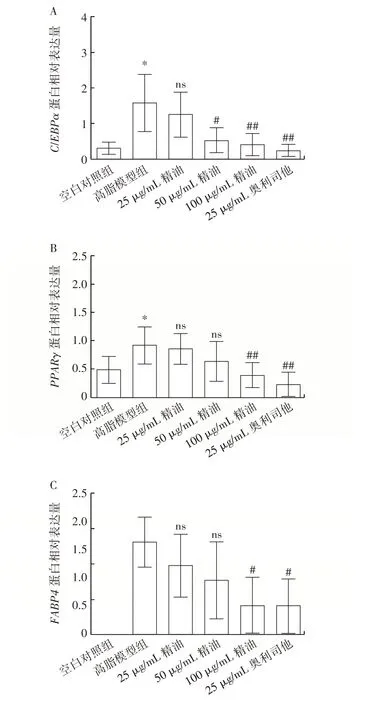
图5 东紫苏精油对C3H10T1/2 细胞脂质代谢相关蛋白表达的影响Fig.5 Effect of essential oil from Elsholtiza bodinieri Vaniot on expression of proteins related to lipid metabolism in C3H10T1/2 cells
由图5 可知,与空白对照组相比,高脂模型组的成脂关键转录因子PPARγ和C/EBPα表达均有所上升,精油、奥利司他处理组与高脂模型组相比可明显降低PPARγ、C/EBPα和FABP4蛋白的表达,其中在25 μg/mL 精油处理组中并无统计学上的差异。
3 讨论与结论
植物精油(essential oil)是由植物天然合成的、具有挥发性的化合物所构成的混合油状成分。植物精油具有抗氧化、抗肿瘤、杀虫、抗炎、降血脂等作用[12-14]。课题组前期采用微波无溶剂萃取方法提取东紫苏精油,气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)检测化学成分,结果显示:主要成分为乙酸松油酯(56.25%)、β-氧化石竹烯(4.41%)、α-松油醇(2.91%)、1,8-桉叶油醇(0.51%)等。本实验中发现东紫苏精油通过降低C3H10T1/2 细胞中成脂基因和成脂蛋白的表达来减少脂滴的积累,表明东紫苏精油能够抑制C3H10T1/2 细胞的成脂分化。结合其化学成分,推测东紫苏精油的降脂功能可能是其中一些活性成分共同作用的结果。有研究发现α-松油醇改善了高脂饮食大鼠的营养参数,重建胰岛素敏感性,并降低血清促炎细胞因子TNF-α 和IL-1β 水平[12]。此外,α-松油醇还有抗氧化、抗高血压、抗炎、抗肥胖和抗病毒活性[13-14]。石竹烯为双环倍半萜型天然产物,主要包括α-石竹烯和β-石竹烯。β-石竹烯及其氧化物具有抗炎、抗癌、抑菌、抗氧化、止痛及降脂等生物活性;可抑制高糖环境下大肠癌细胞CT26 的增殖并促进其凋亡;在预防和治疗非酒精性脂肪肝及其相关代谢紊乱方面具有潜在的功效[15-16]。1,8-桉叶油醇是东紫苏精油的主要成分之一,具有抗炎、抑菌、抗氧化作用,桉叶油醇能减弱活性氧诱导的脂质过氧化,同时提高超氧化物歧化酶和过氧化氢酶等抗氧化酶的表达[17-19]。
间充质干细胞(mesenchymstemcells,MSCs)主要来自发育早期的中胚层。最初发现于骨髓中,在体内或体外特定的诱导条件下,可分化为脂肪、骨、软骨、肌肉和肝细胞[20],成脂分化是MSCs 的一个重要分化方向,也是成体脂肪细胞更新的主要来源。间充质干细胞的成脂分化机制研究,可以帮助了解与脂肪代谢异常有关的疾病。
过氧化物酶体增殖物激活受体PPARs是配体激活的转录因子核受体超家族成员之一,包括氧化物酶体增殖物激活受体α(peroxideproliferator-activatedreceptor,PPARα)、氧化物酶体增殖物激活受体β/σ(peroxideproliferator-activatedreceptorβ/σ,PPARβ/σ)和PPARγ,是脂质代谢密切相关的转录因子,对脂肪酸和葡萄糖代谢、骨稳态、炎症反应和其他过程有不同的影响。PPARγ能够调控脂蛋白酯酶、激素敏感脂肪酶、乙酰辅酶A 合成酶等基因的表达,进一步调控脂代谢和脂肪酸氧化过程。在MSCs 分化过程中,PPARγ刺激脂肪细胞分化,抑制成骨细胞分化[21-23],被认为是脂肪细胞分化过程中必需的转录因子,PPARγ在脂肪细胞内脂滴积累中起关键作用。C/EBPα是碱性亮氨酸拉链蛋白家族的一个亚家族,是增强子结合蛋白家族中最早被发现的成员。有研究报道当C/EBPα的表达量增加时,可使前脂肪细胞向成熟脂肪细胞的分化速度加快,反之亦然。FABP4在脂肪细胞分化的后期表现极高,是细胞成脂分化的标志物之一[24-27]。
在脂肪细胞分化初期,C/EBPβ因子通过激活C/EBPα、PPARγ等因子,进入细胞分化期[28-30],C/EBPα结合并激活特异基因启动子,脂肪细胞进入终末分化阶段[31]。C/EBPα、PPARγ、FABP4的较高转录促使前脂肪细胞分化为成熟脂肪细胞,最终促使脂肪细胞增生。东紫苏精油处理后在细胞分化初期C/EBPβ 激活并下调C/EBPα、PPARγ等因子,在进入脂肪细胞终末分化阶段时下调FABP4,抑制前脂肪细胞分化为成熟脂肪细胞,最终抑制脂肪细胞生长,达到降脂目的。
本研究以C3H10T1/2 细胞建立高脂模型,从基因和蛋白质水平初步探讨东紫苏精油降脂机理。结果表明高脂模型组PPARγ、C/EBPα、FABP4mRNA 及蛋白表达与空白对照组相比均明显升高,东紫苏精油、奥利司他作用后与高脂模型组相比则降低。不同浓度东紫苏精油均可抑制C3H10T1/2 细胞的成脂分化,且高浓度的抑制效果更好;东紫苏精油可能通过调节PPARγ/C/EBPα信号通路发挥作用,但其具体机理及是否可以通过其他方式来达到降低脂肪的目的还需要后续深入系统的研究。

