乳及乳制品中乳铁蛋白含量的快速SDS-PAGE荧光检测方法
李汉芳,黄珍,路梦凡,孙娜娜,徐丹,徐秦峰
(陕西科技大学食品科学与工程学院,陕西西安 710021)
乳铁蛋白(Lactoferrin,Lf)是一种具有抗菌、抗病毒、增加成骨活性、降低腹泻发病率、促进肠道健康等多种生理活性的铁结合糖蛋白[1-3],例如最近研究发现,Lf 能够辅助治疗新冠肺炎[4]。同时,Lf 对热敏感,加工工艺不同导致不同产品中的Lf 含量差异很大,因此检测各种乳制品中Lf的含量对其营养价值和热加工风险评估具有重要意义[5,6]。
作为乳蛋白分离检测的常用方法,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl sulfate-polyacrylamide Gel Electrophoresis,SDSPAGE)[7-11]能够将Lf 与其它乳蛋白很好的分离开,无需用肝素亲和柱纯化样品,因此广泛用于乳及乳制品中Lf 含量的检测。考马斯亮蓝(Coomassie Brilliant Blue,CBB)是最常用的染色方法,但是存在染色脱色步骤繁琐、灵敏度较差的不足,如Brisson 等[12]通过还原及非还原SDS-PAGE 两种方法表征了不同铁饱和度对乳铁蛋白热聚集的影响,凝胶需要过夜固定蛋白、37 ℃染色1 h 以及多次更换乙酸脱色,李珊珊等[13]通过SDS-PAGE 法实现乳制品中Lf 的定量检测,凝胶需过夜染色、脱色2 h;邢志恩等[14]通过CBB 染色和薄层扫描测定了3 种不同来源的Lf,克服了溶剂大量损耗的缺点;但染色3 h、脱色2 h 的过程仍然烦琐耗时。
为了克服这种局限,本文采用了一种新型染色试剂Chromeo P503(P503)来替代CBB 染色,研究建立一种乳及乳制品中Lf 含量的SDS-PAGE 简便快速检测方法。由于P503 标记蛋白呈现强烈的红色荧光发射,量子产率高(>50%);而游离染料量子产率较低(<1%)[15],因此无需进行洗脱以降低背景。在优化实验条件下,该方法中蛋白染色仅需一步操作,便可直接应用于乳及乳制品中Lf 的准确定量检测,检测速度和灵敏度(30 min,5.11 μg/mL)均显著优于CBB 染色(>5 h,29 μg/mL)[13,14],可为含乳铁蛋白制品的营养价值评价、质量监管和加工工艺研究提供有力工具。
1 材料与方法
1.1 主要试剂和仪器
天然Lf(纯度≥95%),日本Wako 公司;铁饱和Lf(纯度≥85%)、β-乳球蛋白(β-Lactoglobulin,β-LG,纯度≥90%)、酪蛋白(Casein,CN)、牛血清白蛋白(Bovine Serum Albumin,BSA,纯度≥98%)、碳酸氢钠(纯度≥99.5%)、柠檬酸(纯度≥99.5%)、磷酸盐缓冲液(PBS)粉末、Chromeo P503,美国Sigma 公司;免疫球蛋白G(Immunoglobulin G,IgG,纯度≥90%),上海源叶生物科技有限公司;QC0140 肝素亲和柱,北京美正生物科技有限公司;Athena C4 色谱(250 mm×4.6 mm×5 μm,300Å),上海安谱实验科技有限公司;12%电泳预制胶、考马斯亮蓝R-250、蛋白Marker,上海生工生物工程公司;乙二胺四乙酸二钠盐(分析纯),上海生工生物工程公司;液态奶、奶粉样品购买自当地超市。
Mini-PROTEIN Tetra System 垂直电泳仪,美国Bio-Rad 公司;OS-03U 摇床,北京六一生物科技有限公司;FS5 荧光光谱仪,英国Edingburgh 公司;DK-8D 电热恒温水槽,上海精宏实验设备有限公司;OSE-470P 蓝光凝胶成像系统,北京天根生化科技有限公司;Nanodrop One 超微量紫外分光光度计、U3000 液相色谱仪(配备紫外检测器),美国Thermo Fisher Scientific 公司;BS/BT 型电子天平(精度0.000 1 g),德国Sartorius 公司;5424R 高速冷冻离心机,德国Eppendorf 公司。
1.2 实验方法
1.2.1 条件优化
1.2.1.1 铁饱和度对P503 标记Lf 的影响
参照文献[16]制备脱铁Lf,在100.0 μL 质量浓度为5 mg/mL 的Lf 中,加入乙二胺四乙酸二钠盐(0.5 mol/L)10.0 μL、柠檬酸(1 mol/L)2.0 μL,孵育1 h 后进行5 次超滤(30 ku)以除去螯合剂。Lf 的标记反应如下:1.0 μL 质量浓度为10 mg/mL的脱铁Lf、天然Lf、铁饱和Lf,加入1.0 μL 的P503(0.2 mg/mL)、2.0 μL 碳酸氢钠缓冲液(pH值9)和6.0 μL 超纯水混匀;1.0 μL 质量浓度为10 mg/mL 的脱铁Lf、天然Lf、铁饱和Lf 及P503(0.2 mg/mL),加入2.0 μL 碳酸氢钠缓冲液(pH 值9)和7.0 μL 超纯水混匀作为对照,50 ℃孵育30 min后进行光谱扫描。
荧光光谱扫描条件:激发光谱,固定最大发射波长为620 nm,激发波长范围400~580 nm,狭缝为1.5 nm;发射光谱,固定最大激发波长为500 nm,激发波长范围520~750 nm。取2.0 μL 的不同铁饱和度Lf 及P503-Lf 标记样品,在Nanodrop 仪器上进行紫外可见全光谱扫描。
1.2.1.2 P503 标记条件优化
在标记比例优化实验中,固定Lf 质量浓度终浓度为1 mg/mL,改变P503 用量使P503 染料与Lf 的摩尔比分别为1:1、2:1、4:1、5:1、6:1、8:1、10:1,孵育条件、荧光发射光谱扫描条件同1.2.1,扫描频率:每分钟一次。孵育温度实验中,Lf(10 mg/mL)取1.0 μL,加入1.0 μL 的P503(0.2 mg/mL)、2.0 μL碳酸氢钠缓冲液(pH 值9),加入超纯水至10.0 μL混匀,温度设置40、50、60、70℃,扫描频率同上。
1.2.2 P503染色检测线性范围及其与CBB染色对比
1.2.2.1 P503 染色检测线性范围
PBS(1×)稀释脱铁Lf 至1 mg/mL 后分别取0、0.2、0.4、0.6、0.8、1.0 μL,加入1.0 μL 的P503(0.2 mg/mL)、2.0 μL 碳酸氢钠缓冲液(pH 值9),加入超纯水至10.0 μL 混匀;50 ℃孵育30 min 后加 入2.5 μL 的Loading buffer,(95.0±0.5)℃孵育5 min,室温冷却;分离胶质量分数12%、浓缩胶质量分数5%;恒压电泳,浓缩电压90 V,时间30 min,分离电压120 V,时间60 min;为防止荧光光漂白,电泳过程应在避光条件下进行,通过蓝光凝胶成像系统观察实验结果。
1.2.2.2 P503 染色检测的精密度及稳定性
终质量浓度均为0.01 mg/mL 的Lf 样品(标记方法同上)在同一凝胶上做9 个平行样进行电泳,读取灰度值及计算后相对标准偏差RSD。重复1.2.2.1 标准曲线3 次并对不同凝胶上同一乳品样品采用相同方法计算RSD。
1.2.2.3 CBB 染色检测线性范围
样品除P503 染色外均与1.2.2.1 相同,电泳结束后进行CBB 染色。在半径12 cm 的培养皿里加入1×考马斯亮蓝R-250 染色液60 mL,摇床50 r/min,染色1 h,0.0、0.5、1.5、3.0 h 时各加入80 mL 脱色液(φ=40%无水乙醇、φ=10%冰乙酸、φ=50%水),过夜脱色。使用数据处理软件WCIF Image J 采集条带灰度值。
1.2.3 实际乳品样品检测
10 mg/mL 的β-LG、CN、BSA、IgG、脱铁Lf 样品分别取0.5 μL 加入1.0 μL 的P503(0.2 mg/mL)、2.0 μL 碳酸氢钠缓冲液(pH 值9)和6.0 μL 超纯水混匀;5 种蛋白各取0.5 μL 混合加入1.0 μL 的P503(0.2 mg/mL)、2.0 μL 碳酸氢钠缓冲液(pH 值9)和4.5 μL 超纯水混匀,进行SDS-PAGE 检测,检测条件同1.2.2。
奶粉样品:称取牛乳粉0.100 0 g,PBS(1×)定容至2 mL。牛乳粉12 000 r/min、4 ℃、10 min离心除脂,收集中间层,重复两次。
液态乳样品:超瞬时杀菌(Infusion Technology,INF)乳、超高温瞬时灭菌(Ultra High Temperature Treated,UHT)乳12 000 r/min、4 ℃、10 min 离心除脂,收集中间层,重复两次。随后的脱铁和P503 溶液标记反应步骤同上,P503 浓度调整为0.5 mg/mL,SDS-PAGE 检测条件同1.2.2.1。
用于高效液相色谱(High Performance Liquid Chromatography,HPLC)检测实验的乳品样品,参照肝素亲和柱产品使用说明书的步骤进行前处理和HPLC 上机检测。HPLC 检测参数:柱温30 ℃,进样量30 μL,洗脱时间18 min,洗脱程序参照美正亲和柱说明书2020 版本,检测波长280 nm。
1.3 数据处理
高效液相定量数据峰面积由Chromeleon 7 软件获得,SDS-PAGE 条带灰度值由WCIF Image J 采集;实验数据为n次重复实验的均值,数据统计分析采用Origin 9.0。
2 结果与分析
2.1 条件优化
2.1.1 铁饱和度对P503标记Lf的影响
P503 是一种伯胺标记染料,对Lf 进行标记后,显示强烈的红色荧光发射信号,如图1a 所示,与文献报道一致[15]。对于相同浓度的不同铁饱和度Lf,虽然均可观察到荧光增强,但是强度的增加却存在显著差异。缺铁Lf(Apo-Lf)、天然Lf(Native-Lf)和铁饱和Lf(Holo-Lf)的铁饱和度[16,17]分别为0.2%、14%、99.7%,其标记后对应的荧光强度逐渐降低,表明铁饱和度会对P503 标记Lf 造成影响。

图1 P503 标记不同铁饱和度Lf 的光谱图Fig.1 Spectra of P503 labeled Lf with different iron saturation (n=5)
为了探究造成荧光猝灭的原因,扫描了铁饱和Lf 的吸收光谱(图1b),结果显示其在465 nm 处有最大吸收峰,对应Lf 中铁元素的特征吸收[17-19]。该吸收峰与P503 标记Lf 的荧光激发光谱重叠(图1b),所以铁饱和Lf 会吸收P503 的激发光能量,从而导致荧光发射信号变弱(即内滤效应)。因此,在后续检测中,均采用脱铁Lf 进行检测。
2.1.2 P503标记条件优化
进一步对P503 标记Lf 的条件进行了优化,实验了P503 染料与Lf 标记比例(Dye/Protein Ratios,DPRs)、孵育时间及温度对荧光信号强度的影响,结果如图2 所示。荧光信号强度随着温度变化而不同,50 ℃孵育时信号强度最高,因此选择50 ℃作为孵育温度进行后续实验;随着染料标记比例增加,荧光强度呈现先增加后降低的趋势,导致荧光强度降低的原因可能是染料的自猝灭;当染料蛋白比例为4 时,信号较为稳定,偏差较小。荧光强度在5 min内迅速增加随后的50 min 内缓慢增加,因此选择30 min 作为孵育时间进行后续实验。
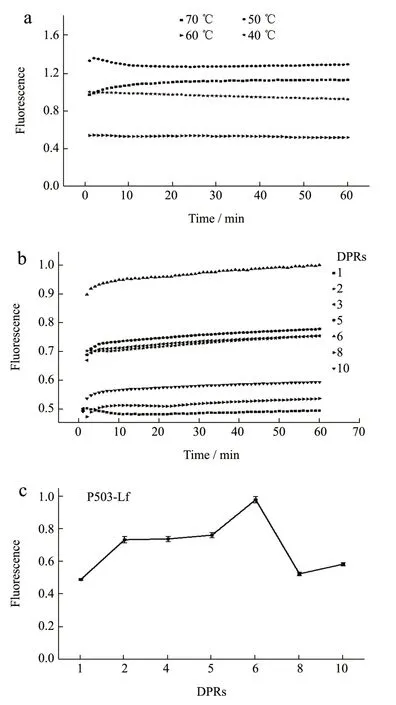
图2 染料标记Lf 条件优化Fig.2 P503 label Lf condition optimization (n=6)
2.2 P503染色检测线性范围及其与CBB染色对比
SDS-PAGE 是基于蛋白质分子量差异和凝胶的分子筛作用进行分离,通过电泳作用后染色剂显示的蛋白条带强弱不同进行定量分析。相较于传统的CBB 染色、洗脱过程,本方法所用的P503 染料在pH 值8~9 环境中标记仅需30 min,在电泳后即可通过蓝光凝胶成像系统和WCIF Image J 读取灰度值对蛋白进行定量,可以避免长达数小时的染色脱色过程。
为了验证所建立的SDS-PAGE 法可以用于Lf的定量检测,将不同质量浓度的Lf 标准品分别和P503 进行混合孵育,结合缓冲液做空白对照,采集各复合物灰度值。荧光成像后再按照传统的步骤进行CBB 染色成像,作为对照。结果如图3 所示:随Lf 质量的增加,复合物条带的荧光强度和蓝色亮度均不断增大。采集各泳道复合物灰度值,以Lf 的质量浓度为横坐标,Lf-P503 荧光强度值为纵坐标的曲线回归方程为y=1 111.428 57x-6.571 43,R2=0.966 92;CBB 染色的线性回归方程为y=134.285 71x+27.952 38,R2=0.933 39。结果表明采用P503 染色(5.11 μg/mL)的检测灵敏度和线性均优于CBB 染色(29 μg/mL)[13],并且P503 染色的时间仅为30 min,一步即可完成,操作步骤更为简便快速(CBB 染色≥5 h)。此外,同一凝胶上同一样品信号RSD 为2.26%,不同凝胶上同一样品信号RSD 均小于4.63%,相对标准偏差均≤10%,表明本方法测定乳及乳制品中乳铁蛋白具有较好的精密度和稳定性。
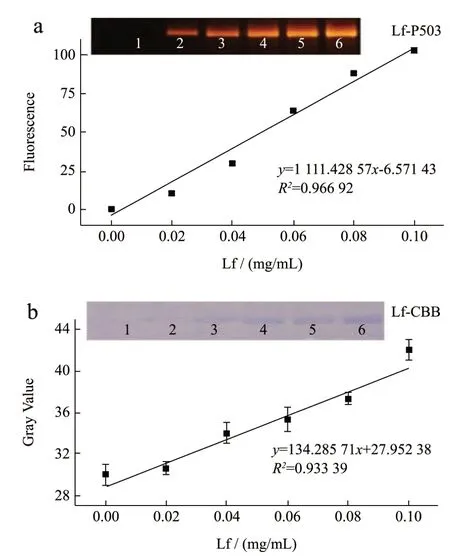
图3 不同浓度Lf 的电泳图及标准曲线图Fig.3 Electrophoretic diagram and standard curve of lactoferrin at different concentrations (n=3)
2.3 实际乳品样品检测
为了确定Lf 检测的准确性,进一步对常见乳蛋白:β-LG、CN、BSA、IgG、Lf 标准品单独样品、混合样品进行SDS-PAGE 检测,结果如图4a 所示,各蛋白与Lf 分子量差异显著,不会干扰Lf 检测。进一步验证P503 染色法可用于检测实际样品中Lf 含量,采用上述方法对市售的3 种乳制品(INF 乳、UHT 乳、牛乳粉)简单离心除脂及脱铁后,直接进行Lf 定量检测;添加Lf 标准溶液,测定加标回收率。结果如图4b 及4c 所示,相对于CBB 染色,乳品样品中P503 染色Lf 条带(78 ku)更加清晰。定量检测结果显示,INF 乳的Lf 检测值高于UHT 乳(表1),与预期相符同[20-22]。不同热加工工艺导致Lf 的热损失不同,证明本方法对于液态乳的热加工风险评估具有一定的参考意义。样品的加标回收率75.79%~108.09%(表1),表明本方法无需繁琐前处理和复杂染色脱色过程即可实现乳制品中Lf 的定量检测。

表1 P503-PAGE实际样品检测结果Table 1 P503-PAGE actual sample test results (n=3)

图4 实际样品检测电泳图Fig.4 Electrophoretic diagram of actual sample detection
将本方法与经过肝素亲和柱纯化处理的HPLC检测结果进行对比,进一步验证方法的准确性,结果见表2。P503-PAGE 与HPLC 检测值相近,表明本方法的准确性。本方法可为企业优质乳的生产过程监管以及奶粉的营养价值评估提供一定的技术支持。

表2 不同检测方法对比Table 2 Comparison of different detection methods (n=3)
3 结论
本研究通过pH 值8~9 环境中P503 快速标记Lf(0.5 h),在SDS-PAGE 后直接在蓝光凝胶成像系统下读取灰度值,通过荧光强度值和Lf 浓度呈现的良好线性关系进行定量分析,避免了CBB 染色方法冗长的染色脱色过程(≥5 h),建立了一种省时、简便、灵敏度高的Lf 快速检测方法。鉴于SDS-PAGE 仪器是各实验室最为普通和常用的设备,以及所使用的蓝光凝胶成像系统成本较低,因此建立的方法具有广泛适用性。此外,P503 染色还可以用于其它乳蛋白的快速检测,从而能够为液态乳的热加工工艺的控制以及奶粉的营养价值评估提供技术支撑。

