基于SEER 数据库相关数据构建老年女性卵巢癌不良预后预测模型
丁琨,赵蕾,程亚玉,赵淑萍
1 青岛大学附属妇女儿童医院妇科中心,山东青岛 266000;2 青岛市中心医院妇科
卵巢癌是致死率最高的女性恶性肿瘤,2020 年全球新发卵巢癌病例313 959 例、死亡207 252 例[1],2022 年国内新发病例57 090 例、死亡39 306 例[2]。随着老龄化问题日趋严峻,老年女性卵巢癌患者的诊治及预后关注倍增。老年女性卵巢癌定义为65岁及以上患者[3],发病率远远高于年轻卵巢癌患者[4]。老年女性卵巢癌患者因发展隐匿性、早期症状不明显等临床特征,诊断时往往已期别较晚,预后较差。目前,尚无有效的工具来评估老年女性卵巢癌患者的病情,有必要对老年女性卵巢癌与预后相关的危险因素进行分析,以帮助临床个性化指导。SEER 数据库是一个大型癌症患者肿瘤信息登记资料库,其登记内容涵盖人口统计数据、肿瘤数据、首次治疗过程以及存活数据,适合临床肿瘤癌症研究[5]。为建立有效的评估工具来预测老年女性卵巢癌患者的预后情况,本文通过对SEER 数据库提取的老年女性卵巢癌患者与预后可能相关的临床数据进行研究,筛选影响老年女性卵巢癌不良预后的危险因素,并构建老年女性卵巢癌预后的预测模型。
1 材料与方法
1.1 老年女性卵巢癌数据获取 所需老年女性卵巢癌数据通过SEER 数据库(申请账号为23445-Nov2021)进行下载。SEER 数据库为公开数据库,本研究无需通过伦理委员会审批。纳入标准:①初诊时原发肿瘤部位为卵巢(ICD-O-3 编码为C56.9);②确诊时间为2010—2015年。本研究共筛选老年女性卵巢癌患者16 058 例。排除标准:多个原发肿瘤者3 801例;种族信息不详者28例;TNM 分期不详者3 894 例;手术及放化疗信息不详者53 例;病理类型及肿瘤分化程度不详者3 721例;CA125信息不明者793例;生存信息不详、生存时间<30 d者212例。最终纳入患者3 556 例。将数据通过简单随机分组分为建模组2 511 例(建模组应根据生存时间6 个月、1 年、3 年继续分组)与验证组1 045 例(起到验证作用)。
1.2 老年女性卵巢癌不良预后危险因素分析 收集可能与老年女性卵巢癌预后相关的变量,包括年龄、种族、病理学类型、肿瘤分化程度、TNM 分期(AJCC 第7 版)、CA125 水平、手术及放化疗信息共11 项指标,并收集患者生存时间、生存状态及死亡原因。研究终点为总生存时间(OS),即从确诊为卵巢癌至患者死亡或最后一次随访的时间。
1.3 老年女性卵巢癌不良预后预测模型建立及验证 对建模组的临床资料数据进行单因素COX 回归分析,将所得与不良预后相关的危险因素纳入多因素COX 回归分析,筛选出卵巢癌不良预后的独立危险因素。然后基于多因素COX 回归分析结果,以独立危险因素为主要预测指标,以生存结局为预测结局,利用R4.2.2软件“rms”包将其可视化为预测6个月、1 年、3 年生存率的Nomogram 图。在应用Nomogram 图时,首先找到图中每个因素对应的值,然后将所有值相加计算总分,将总分对应相应的数值即可得到老年女性卵巢癌患者6个月、1年、3年生存情况的预测概率。总分越高,生存率越低、预后越差。对建模组进行内部验证,并使用验证组进行外部验证。建模组及验证组分别应用“rms”、“ggDCA”、“survival”软件包进行计算,可得出两组数据的应用C 指数(C-index)、受试者工作特征(ROC)曲线下面积(AUC)、临床校准曲线、决策曲线分析(DCA),以评估Nomogram 图的预测性能、校准度,评估临床实用性。
1.4 统计学方法 SEER*Stat(8.4.0.1)软件下载数据,应用Excel2021 版将下载的数据进行初步整理,计数资料以频数和百分比描述,采用SPSS22.0统计软件进行χ2检验。采用R 软件(4.2.2 版本)进行COX 风险回归分析、构建Nomogram 图并进行验证。生存曲线采用 Kaplan-Meier 绘制,组别之间差异用Log-rank进行检验。R软件使用“rms”、“survival”、“survminer”、“survivalROC”、“riskRegression”、“ggDCA”程序包。P<0.05为差异有统计学意义。
2 结果
2.1 老年女性卵巢癌不良预后危险因素 建模组中位生存时间为41 个月,6 个月生存率为93.4%(95%CI0.926~0.942),1 年生存率为87.2%(95%CI0.861%~0.883),3 年生存率为59.3%(95%CI0.577~0.609)。
随访6 个月,建模组中死亡者160 例、生存者2 351 例。死亡者年龄64~74 岁62 例、75~84 岁69例、超过85 岁29 例,生存者年龄64~74 岁1570 例、75~84 岁675 例、超过85 岁106 例;死亡者白人146例、黑人8 例、其他6 例,生存者白人2 057 例、黑人121 例、其他173 例;死亡者上皮性肿瘤141 例、非上皮性肿瘤19例,生存者上皮性肿瘤2 253例、非上皮性肿瘤98 例;死亡者肿瘤分化程度Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别5、16、76、63 例,生存者分别170、295、1 034、852 例;死亡者T1、T2、T3 分期分别15、17、128 例,NO、N1 分期分别106、54 例,MO、M1 分期分别106、54 例,生存者T1、T2、T3 分期分别464、321、1 566例,NO、N1分期分别1 768、583例,MO、M1分期分别1 889、462 例;死亡者CA125 正常9 例、升高151 例,生存者CA125 正常248 例、升高2 103 例;死亡者未手术27 例、手术133 例,无放疗或未知状态158 例、放疗2例,无化疗或未知状态66例、化疗94例,生存者未手术66 例、手术2 285 例,无放疗或未知状态2 328例、放疗23例,无化疗或未知状态373例、化疗1 978 例;两者年龄、病理学类型、TNM 分期、CA125水平、是否手术、是否化疗比较,P均<0.05。
随访1年,建模组中死亡者314例、生存者2 197例。死亡者年龄64~74岁147例、75~84岁127例、超过85岁40例,生存者年龄64~74岁1 484例、75~84 岁617 例、超过85 岁96 例;死亡者白人285 例、黑人16 例、其他13 例,生存者白人1 916 例、黑人115例、其他166例;死亡者上皮性肿瘤272例、非上皮性肿瘤42例,生存者上皮性肿瘤2 123例、非上皮性肿瘤74 例;死亡者肿瘤分化程度Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别8、22、157、127 例,生存者分别116、289、945、847例;死亡者T1、T2、T3 分期分别29、38、247 例,NO、N1 分期分别217、97 例,MO、M1 分期分别209、105例,生存者T1、T2、T3 分期分别448、306、1 443 例,NO、N1 分期分别1 655、542 例,MO、M1 分期分别1 784、413 例;死亡者CA125正常16例、升高298例,生存者CA125 正常242 例、升高1 955 例;死亡者未手术40 例、手术274 例,无放疗或未知状态310 例、放疗4 例,无化疗或未知状态97 例、化疗217 例,生存者未手术55 例、手术2142 例,无放疗或未知状态2 175例、放疗22例,无化疗或未知状态341例、化疗1 856 例;两者年龄、病理学类型、肿瘤分化程度、TNM 分期、CA125 水平、是否手术、是否化疗比较,P均<0.05。
随访3 年,建模组中死亡者1 004 例、生存者1 507 例。死亡者年龄64~74 岁577 例、75~84 岁355 例、超过85 岁72 例,生存者年龄64~74 岁1 055例、75~84 岁389 例、超过85 岁63 例;死亡者白人892 例、黑人57 例、其他55 例,生存者白人1 311 例、黑人72 例、其他124 例;死亡者上皮性肿瘤936 例、非上皮性肿瘤68例,生存者上皮性肿瘤1 458例,非上皮性肿瘤49 例;死亡者肿瘤分化程度Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别17、67、497、423 例,生存者分别108、244、605、550 例;死亡者T1、T2、T3 分期分别66、107、831例,NO、N1 分期分别688、316 例,MO、M1 分期分别704、300 例,生存者T1、T2、T3 分期分别413、231、863 例,NO、N1 分期分别1 186、321 例,MO、M1 分期分别1 291、216 例;死亡者CA125 正常45 例、升高959 例,生存者CA125 正常212 例、升高1 295 例;死亡者未手术72 例、手术932 例,无放疗或未知状态994 例、放疗10 例,无化疗或未知状态115 例、化疗889例,生存者未手术21例、手术1 486例,无放疗或未知状态1 492 例、放疗15 例,无化疗或未知状态311 例、化疗1 268 例;两者年龄、种族病理学类型、肿瘤分化程度、TNM 分期、CA125 水平、是否手术、是否化疗比较,P均<0.05。
将单因素分析有统计学差异的结果纳入多因素COX 回归分析,得出年龄、种族、病理学分型、肿瘤分化程度、T 分期、M 分期、CA125 水平、是否行手术及化疗是影响老年女性卵巢癌不良预后的独立危险因素(P均<0.05)。
2.2 老年女性卵巢癌不良预后预测模型的建立与验证 将多因素COX 回归分析所得与老年女性卵巢癌不良预后相关的9 个独立危险因素,纳入Nomogram 图的构建。通过软件计算可分别得到患者6 个月、1 年、3 年生存率的Nomogram 图。在预测模型图中,每一个变量对应到分数标尺上均得到一个得分,将所有得分相加可得到一个总分值,将总分值垂直到生存率轴上即可得出患者6 个月、1 年、3 年生存率。详见图1。

图1 老年卵巢癌不良预后Nomogram图
应用Bootstrap 法进行重复采样[6],对建模组进行内部验证、对验证组进行外部验证[7],内部验证的C-index 为0.686(95%CI0.672~0.700),外部验证的C-index 为0.681(95%CI0.659~0.703)。提示本研究建立的Nomogram 图具有较好的预测能力。建模组患者6 个月、1 年、3 年的ROC 曲线下面积AUC 分别为76.2(95%CI72.1~80.3)、73.0(95%CI70.0~76.0)、71.7(95%CI69.7~73.7)。验证组中患者6 个月、1 年、3 年的ROC 曲线下面积AUC 分别为76.2(95%CI70.1~82.3)、74.0(95%CI69.5~78.4)、70.9(95%CI67.7~74.0),提示模型具有较好的区分度。对模型拟合度验证,以3 年校准曲线为例,建模组与验证组Nomogram 图校准曲线均接近45度参考线,提示模型预测的生存情况与实际情况具有较好的一致性。临床决策曲线结果显示建模组及验证组的OS 曲线均基本位于右上方,提示本模型具有较好的临床效能。详见图2。
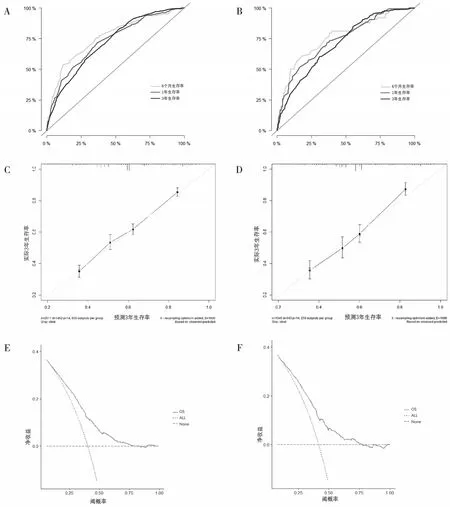
图2 建模组和验证组ROC曲线、校准曲线及决策曲线
3 讨论
Nomogram 图可将决定预后的多变量因素经复杂的COX 回归公式进行整合,变成直观可视的图形,分析肿瘤患者预后情况,预测个体生存概率,指导临床决策[8]。在肝癌、肺癌、乳腺癌、宫颈癌中均有应用[9-12]。卵巢癌中也有研究,但多都是着眼于卵巢癌患者的治疗、预后和复发情况,缺乏针对老年患者的研究。临床上治疗老年卵巢癌颇具挑战,由于临床症状不明显,老年卵巢癌往往确诊时已是Ⅲ~Ⅳ期。不少患者因为合并内科并发症或因期别较晚伴远处转移而失去手术机会。此外,年龄升高,化疗药物毒性作用及化疗后不良反应也使标准化疗困难重重。SEER 数据库具有包含病例数多、临床资料较完整特点,适合进行临床研究。因此,利用SEER数据库建立老年卵巢癌Nomogram 图对临床决策及个体化预测意义较大。
本研究发现,年龄、种族、病理学类型、组织分级、T 分期、M 分期、CA125 水平、是否行手术及化疗是老年卵巢癌患者生存预后的独立影响因素。年龄作为独立危险因素,随卵巢癌患者年龄的增加,患者预后越差。MICHALIS 等[4]研究发现年龄超过70 岁的卵巢癌患者的总生存率以及无进展生存期(PFS)较年轻患者相比更差。研究[13]也报道超过75岁的卵巢癌患者,中位生存期明显降低。这一结果可能与随年龄增长,癌症的侵袭性增强相关[14]。Nomogram图显示,T 分期对生存率的影响最大,分化程度及病理类型次之。T 分期是肿瘤进展的重要指标,其与患者预后密切相关,有研究表明,肿瘤的大小可作为卵巢癌的独立危险因素[15]。组织分化程度与预后密切相关,这可能与肿瘤分化程度越差,肿瘤组织侵袭性越高相关。CA125是老年卵巢癌预后独立危险因素,有研究表明CA125 的高低水平与临床分级、患者生存率密切相关[16]。CA125 越高,患者临床期别越晚、预后越差,本研究也得到相同结果。CA125是临床上用于筛查及预测卵巢癌预后的重要指标,可预测术后病情缓解及复发情况。对于化疗患者,CA125变化情况则与化疗敏感度及无瘤生存期密切相关[17]。
老年卵巢癌患者的最佳初始治疗方案是初次肿瘤细胞减灭术+铂类药物为基础的标准化疗,本研究发现约96.1%的患者接受了手术治疗,手术是卵巢癌患者预后的独立保护因素。FANFANI 等[18]研究也认为,65岁以上患者甚至是75岁以上患者仍可接受手术治疗,并且手术可提高老年不良预后。SCHUURMAN 等[14]研究表明老年患者较年轻患者相比虽接受手术的比例明显下降,但手术可明显延长生存期。但也有研究[13]报道,在一项128 例卵巢癌患者的研究中,仅有约5%的老年患者(>75岁)接受了标准手术治疗。相比年轻患者,老年患者接受标准治疗的人数大大降低[19]。年龄的增长可增加分次手术治疗及新辅助化疗概率,这可能与患者失去最佳手术时机相关。老年患者往往存在评估后无法耐受手术或拒绝行手术治疗、手术难度高、术后更易发生并发症、手术获益存在争议等问题,都使得老年患者较年轻患者相比,手术治疗不规范[20]。所以临床上在手术治疗前有必要对老年女性卵巢癌患者进行充分评估,而对于无法接受手术的老年女性卵巢癌患者仍推荐新辅助化疗后择期行肿瘤细胞减灭术。本研究结果提示,约82.4%的患者接受了化疗,并是老年女性卵巢癌不良预后的独立保护因素。HEILMAN 等[21]研究报道,对于年龄>70 岁的老年女性卵巢癌患者,接受标准化疗(5~6 次)患者的中位生存时间显著升高,TEW 等[22]研究认为老年患者仍建议行化疗,化疗可明显改善不良预后,改为单药化疗模式或低剂量化疗后可一定程度增加老年患者的化疗依从性。因此对于可耐受化疗的老年女性卵巢癌患者,仍推荐标准化疗。在老年女性卵巢癌患者行化疗前也应综合评估患者的身体状况及化疗收益。
总之,年龄、种族、病理学类型、组织分级、T 分期、M 分期、CA125 水平、是否手术及化疗是老年女性卵巢癌预后的独立危险因素,建立的老年女性卵巢癌不良预后Nomogram 图具有较好临床指导作用。本研究也存在一定程度局限性,数据库中无法明确具体手术及化疗情况,缺乏前瞻性试验作为外部验证队列,其次SEER 数据库仅包含美国地区人口特征,可能不适用于所有人口。

