灵芝三萜提取工艺的优化
温舒然 马占山 詹冬玲
摘要: 以灵芝孢子粉为原料, 使用体积分数为70%的乙醇为提取剂, 采用酶解与超声辅助提取相结合的方法, 将不同液固比、 超声时间、 酶解时间和酶用量设定为4个因素, 进行单因素试验并设计响应面试验, 以确定最优提取方式及其影响因素. 利用大孔树脂层析法对灵芝三萜进行分离纯化, 通过优化分离纯化工艺, 确定最佳洗脱树脂、 洗脱液体积分数、 上样液流速以及上样液质量比. 采用高效液相色谱法分析灵芝总三萜的组分差异. 通过预实验分析, 与单一提取法相比, 酶+超声辅助提取更高效. 采用乙醇为提取剂提取灵芝中三萜类化合物可提高三萜的纯度. 最优条件下可实现对三萜含量的快速、 精确测定, 为灵芝三萜的分离纯化提供理论依据.
关键词: 灵芝三萜; 提取工艺; 工艺优化; 分离纯化
中图分类号: Q586
文献标志码: A文章编号: 1671-5489(2024)02-0452-12
Extraction Process Optimization of Ganoderma Triterpenes
WEN Shuran, MA Zhanshan, ZHAN Dongling
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract: Ganoderma lucidum spore powder was used as raw material, ethanol with a volume fraction of 70% as extractant. We adopted a combination of enzymatic hydrolysis and ultrasound assisted extraction method, set different liquid-solid ratios, ultrasound time, enzymatic hydrolysis time, and enzyme dosage as four factors for a one-way test and designed a response surface experiment to determine the optimal extraction method and its influencing factors. The Ganoderma triterpene were separated and purified by using macroporous resin chromatography. By optimizing the separation and purification process, the optimal elution resin, eluent volume fraction, flow rate of the upper sample solution and the mass ratio of the upper sample solution were determined. The compositional differences of the total Ganoderma triterpenes were analysed by high performance liquid chromatography (HPLC). Though the pre-experimental analysis, the results show that the enzyme + ultrasound assisted extraction is more efficient compared to the single extraction method. Ethanol is used as an extractant to extract triterpenoids from Ganoderma lucidum can enhance the purity of triterpenoids. Under optimal conditions, the rapid and accurate determination of the triterpene content can be achieved, providing a theoretical basis for the separation and purification of Ganoderma triterpenes.
Keywords: Ganoderma triterpene; extraction process; process optimization; separation and purification
0 引 言
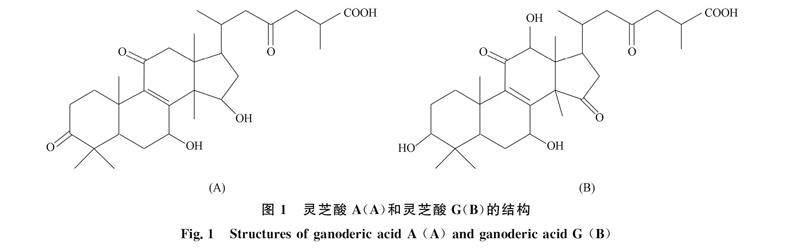
靈芝三萜类化合物(GT)是从灵芝中提取出的一种重要生物活性成分, 其中主要成分灵芝酸A和灵芝酸G的结构如图1所示. GT在制药和医疗保健中有巨大的应用潜力[1-3]. 药理研究表明, GT除调节血糖和血脂外, 还具有多种药理活性, 如抗肿瘤、 抗菌、 抗病毒、 抗氧化、 免疫调节和保肝作用[4-8], 已被用于治疗和预防各种疾病, 如肝炎和糖尿病等.
常见的灵芝三萜提取方法包括溶剂回流提取法[9]、 超声波提取法[10-11]、 超临界CO2萃取法[12]、 微波辅助提取法、 有机溶剂提取法和酶辅助提取法等[13-15]. 由于灵芝三萜是一种脂溶性物质, 因此可采用传统有机溶剂浸提法进行提取. 根据实验室环境条件, 采用多种提取方法相结合的方式, 对目标物料进行提取, 可有效提升提取效率.
灵芝粗提取液中含有多糖和色素等多种杂质, 需要分离其中杂质部分, 提升三萜的纯度. 目前, 分离纯化技术主要有薄层层析法、 柱层析法和制备高效液相色谱(HPLC)法等[16-17]. Cheng等[18]用石油醚洗涤除去脂肪酸, 用二氯甲烷提取灵芝三萜, 再用(400~600目)硅胶柱层析洗脱, 获得5个灵芝三萜组分.
本文以灵芝孢子粉为原料, 采用酶+超声辅助提取法提取灵芝三萜, 以体积分数为70%的乙醇为提取剂[19], 用不同液固比、 超声时间、 酶解时间、 酶用量为4个因素, 进行单因素试验, 并设计响应面试验, 以确定最优提取方式及影响因素. 利用大孔树脂层析法, 通过优化分离纯化工艺[20], 确定最佳洗脱树脂、 最佳洗脱液体积分数、 上样液流速以及上样液质量比. 通过HPLC分析灵芝总三萜的组分差异, 实现快速、 精确地对三萜含量进行测定[21], 为灵芝三萜的分离纯化以及HPLC分析提供理论依据.
1 材料与方法
1.1 材料、 试剂与仪器
灵芝子实体和灵芝孢子粉均为赤灵芝, 灵芝酸A和G的标准品购于长春特产所; 纤维素酶(质量分数≥99.9%)购于山东隆科特酶抑制剂有限公司; 无水亚硫酸钠购于天津市科密欧化学试剂公司; 齐墩果酸(质量分数≥98%)购于大连美仑生物技术有限公司; 无水乙醇、 NaOH、 HCl、 香草醛、 冰醋酸和高氯酸均为国产分析纯试剂, 甲醇和乙腈等为国产色谱纯试剂, 均购于北京化工厂; AB-8和D101型大孔树脂购于天津天泰化学品有限公司.
电子分析天平(CPA-125型, 德国Sartorius 公司); 电热恒温水浴锅(HH-4A型, 北京市光明医疗仪器厂); 制冰机(MCB-105型, 常熟市雪科电器有限公司); 离心机(KL04-A型, 美国Agilent 公司); 真空冷冻干燥机(FD-IB-50型, 北京博医康实验仪器有限公司); 电热鼓风干燥箱(101A-2ET型, 上海实验仪器厂有限公司); 旋转蒸发仪(RE-52AA型, 上海亚荣生化仪器厂); 紫外可见分光光度计(7230G型, 陕西凯利化玻仪器有限公司); 超声波清洗机(SG3300H型, 上海冠特超声仪器有限公司); 循环水式多用真空泵(SHB-IIIG型, 郑州长城科工贸有限公司); 智能恒流泵(BT1-100V-LCD型, 上海琪特分析仪器有限公司); Binary HPLC水泵(Waters1525型, 美国Waters公司); UV-Vis光谱仪(Waters2489型, 美国Waters公司).
1.2 方 法
1.2.1 灵芝三萜制备及标准曲线绘制
将灵芝孢子粉于50 ℃烘干, 过100目筛, 精確称取一定量样品加入锥形瓶中, 先加入纤维素酶, 再加入酶解缓冲液, 待酶解完成, 在无水乙醇中于59 kHz下进行超声处理, 并在3 500 r/min下高速离心20 min, 取上清液, 过滤、 定容后按香草醛-冰醋酸-高氯酸法测定三萜得率. 参考文献[22]方法, 将齐墩果酸配成100 μg/mL的对照溶液, 在546 nm处测吸光度值, 并绘制标准曲线, 用公式灵芝三萜得率=提取液中灵芝三萜的质量(mg)/灵芝粉的干质量(g)(1)计算得率.
1.2.2 单因素试验
以灵芝孢子粉为原料, 通过酶+超声辅助提取法提取灵芝三萜, 在乙醇体积分数为70%、 温度为50 ℃且pH=4的条件下, 在59 kHz下进行超声处理, 通过改变液固比(V(液)∶m(固)=30∶1,40∶1,50∶1,60∶1,70∶1 mL/g)、 超声时间(15,25,35,45,55 min)、 酶解时间(15,25,35,45,55 min)和酶量(1%,2%,3%,4%,5%)进行单因素试验.
1.2.3 响应面试验
利用Design-Expert V8.0.6软件, 参考单因素试验结果, 对三因素三水平进行设计, 分别以超声时间、 酶解时间和酶用量为主要指标, 采用单因素试验结果中对灵芝孢子粉中三萜化合物提取得率影响较大的3个因素进行响应面试验, 优化工艺.
1.2.4 大孔树脂吸附及洗脱工艺研究
使用内径和长度分别为1.08,50 cm的玻璃柱, 装入经处理的D101和AB-8型大孔树脂, 湿法装柱. 通过智能恒流泵以1 mL/min的流速吸取灵芝三萜提取液, 泵送通过玻璃柱, 静态吸附3 h, 用水冲洗玻璃柱1 管(1 管约为4.5 mL), 通过自动收集装置分段(5 mL/份)收集流出液, 并测定灵芝三萜的质量浓度, 绘制动态吸附曲线.
由于灵芝三萜酸易溶于有机溶剂, 因此用乙醇-水体系作为洗脱液. 吸取灵芝三萜提取液的上样液1 管, 控制流速为1 mL/min通过树脂柱. 为确定最佳的洗脱液浓度, 分别用体积分数为40%,60%,80%和95%浓度的乙醇对其进行洗脱, 用自动收集装置收集洗脱剂用量后测定灵芝三萜的质量浓度.
1.2.5 大孔树脂吸附率和解吸率计算
在500 mL三角形烧瓶中, 分别将5 g两种树脂与200 mL灵芝三萜提取物(1.0 mg/mL)混合. 振荡3 h后, 测定两种树脂的吸附容量. 使用循环水多用途真空泵在真空下进行抽吸过滤, 得到含有吸附物的树脂. 在烧瓶中称取0.5 g含吸附物大孔树脂的等分试样, 加入10 mL体积分数为95%的乙醇作为解吸溶剂. 振荡后, 测定溶剂中的灵芝三萜含量, 计算吸附率和解吸率: 吸附率=上样液质量浓度×上样液体积-洗脱液质量浓度/树脂质量×100%,(2)
解吸率=洗脱液质量浓度×洗脱液体积/(上样液质量浓度-吸附平衡质量浓度)×上样液体积×100%.(3)1.2.6 大孔树脂吸附泄露曲线
采用湿法装柱, 待树脂柱平衡稳定后, 采用恒流泵将三萜粗提取液引入树脂柱, 对其进行动态吸附, 并检测分离后的三萜浓度. 通常情况下, 在流出液中灵芝三萜的浓度达到上样液1/10时达到泄露点[23], 可停止上样, 此时为最大上样量. 以收集管数为横坐标, 流出液灵芝三萜浓度为纵坐标, 绘制泄露曲线.
1.2.7 灵芝三萜的纯化及纯度计算
在上样过程中, 将灵芝三萜样品溶液的上柱流速分别控制为1.0,2.0,3.0 mL/min, 测定每份流出液(5 mL/份)的质量浓度, 利用式(2)计算其吸附率. 同时, 分别配制质量浓度为10,15,20,25,30 mg/g的灵芝三萜样品溶液, 以泵速为1.0 mL/min的流速加载到树脂柱上, 测定每份流出液(5 mL/份)的质量浓度, 利用式(2)计算其吸附率.
使用AB-8型大孔树脂实现对灵芝粗三萜溶液的动态吸附解吸, 并旋蒸浓缩洗脱液. 将浓缩液进行冷冻干燥并称其质量. 测定样品溶液浓度, 并按纯度=灵芝三萜类化合物质量(g)/干燥后样品质量(g)×100%(4)计算产物的灵芝三萜纯度.
1.2.8 高效液相色谱分析
高效液相色谱待测样品预处理: 取1 mg经纯化、 浓缩冻干的灵芝三萜, 溶于10 mL甲醇中, 经0.22 μm微孔滤膜过滤后, 装入色谱瓶中. 标准品溶液配制: 分别称取灵芝酸A和G标准品, 用甲醇溶解, 过滤膜, 即得到标准品溶液. 参考文献[24]方法, 以乙腈(A)-醋酸(φ=0.01%)水溶液(B)为流动相, 使用色谱柱(4.6 mm×250 mm, 5 μm)对样品进行梯度洗脱. 将柱温控制在30 ℃, 分析波长设为254 nm, 以1.0 mL/min流速进样, 将进样量控制在20 μL. 高效液相色谱洗脱条件列于表1, 分别分析三萜类成分的单一标准品溶液与混合标准品溶液, 通过三萜类成分的保留时间定性分析.
2 结果与讨论
2.1 標准曲线的绘制
测量546 nm处吸光度得到的标准曲线如图2(A)所示. 以吸光度为纵坐标, 齐墩果酸质量浓度为横坐标, 得到标准曲线线性回归方程为 y=9.152 9x+0.042 1, R2=0.999 2, 表明线性关系良好, 可用该公式计算灵芝三萜含量.
2.2 单因素试验
2.2.1 液固比对灵芝三萜得率的影响
以30∶1,40∶1,50∶1,60∶1,70∶1的液固比为对照, 研究不同液固比对灵芝三萜最终得率的影响, 结果如图2(B)所示. 该方法的其他工艺参数为: 酶解时间40 min、 超声波作用时间40 min、 酶用量3%、 酶解温度50 ℃. 由图2(B)可见: 随着液固比的增加, 灵芝三萜得率不断提高, 可能是因为提取液与物料接触面积接触更充分, 导致灵芝三萜溶出效果更好; 当液固比为50∶1时, 灵芝三萜酶得率的最大值为0.86 mg/g; 当液固比继续增加时, 灵芝三萜得率下降, 这是由于提取液过多, 可能析出其他杂质影响了灵芝三萜析出, 导致灵芝三萜提取量下降. 本文选定最佳液固比为50∶1, 与文献[25-26]结果相同.
2.2.2 酶量对灵芝三萜得率的影响
以1%,2%,3%,4%,5%酶用量为对照, 研究不同酶用量对灵芝三萜最终得率的影响, 结果如图2(C)所示. 该方法的其他工艺参数为: 酶解时间40 min、 超声波作用时间40 min、 酶解温度50 ℃、 液固比50∶1. 由图2(C)可见: 随着酶用量的增加, 灵芝三萜得率增大; 当酶用量为4%时, 灵芝三萜得率的最大值为0.92 mg/g; 之后灵芝三萜的得率降低, 这是由于酶解灵芝中三萜类化合物时, 溶出了其他物质, 析出了其他杂质, 从而影响了灵芝中三萜类化合物析出, 导致灵芝三萜含量降低[27]. 因此, 本文选定最佳酶用量为4%.
2.2.3 酶解时间对灵芝三萜得率的影响
以15,25,35,45,55 min酶解时间为对照, 研究酶解时间对灵芝三萜得率的影响, 结果如图2(D)所示. 该方法的其他工艺参数为: 超声时间40 min、 酶用量为3%、 控制酶解温度为50 ℃、 液固比50∶1. 由图2(D)可见: 随着酶解反应时间的增加, 灵芝三萜的提取得率增大; 当反应时间为35 min时, 灵芝三萜得率的最大值为0.96 mg/g; 之后灵芝三萜的得率降低. 导致这种趋势的原因可能是纤维素酶在一定时间内酶解效率达到最大, 若时间过长, 由于纤维素酶对温度耐受范围有限, 酶内分子结构被破坏, 酶发生降解, 导致灵芝三萜得率降低[28]. 因此, 本文选定最佳酶解时间为35 min.
2.2.4 超声时间对灵芝三萜得率的影响
以超声时间15,25,35,45,55 min为对照, 研究超声时间对灵芝三萜得率的影响, 结果如图2(E)所示. 该方法的其他工艺参数为: 酶解时间40 min、 酶用量3%、 纤维素酶酶解温度50 ℃、 液固比50∶1. 由图2(E)可见: 随着超声时间的增加, 灵芝三萜得率增大; 当超声时间为45 min时, 灵芝三萜得率的最大值为0.84 mg/g; 之后灵芝三萜得率降低. 由于提取灵芝三萜时利用了超声波的机械效应和热效应达到传质平衡, 但需要一定时间[29], 导致得率逐渐增大, 之后溶出无效成分和杂质增多, 影响三萜类化合物质溶出, 得率下降. 因此, 本文选定最佳超声时间为45 min.
2.3 响应面试验分析
2.3.1 响应面工艺试验设计
以单因素试验结果为基础[30-32], 以灵芝三萜得率为响应面指标, 从中选取对其影响最大的3个因素, 分别是超声时间(A)、 酶解时间(B)和酶用量(C), 对其进行响应面分析试验, 选出最佳提取工艺. 利用Design-Expert V8.0.6软件, 建立三因素三水平二次回归方程, 设计因素水平列于表 2.
通过检验分析和二次多项式模型回归分析, 得到对灵芝三萜提取率进行预测的回归模型为y=0.888 6-0.009 6×A-0.021 4×B+0.044 1×C+0.029 1×AB-0.020 7×AC+0.044 1×BC-0.063 5×A2-0.086 8×B2-0.066 9×C2,式中: y为响应值灵芝三萜的提取率; A,B,C分别为超声时间、 酶解时间和酶用量的编码值. 方差分析(ANOVA)结果列于表4.
由表4可见: 该模型的P(Pr>F)<0.000 1, 达到极显著水平, 存在明显差异; 因变量与考察自变量间的线性关系显著, R2=0.982 7; 失拟项P=0.211 8>0.05不显著, 说明响应值在本文所得数据下可精准全面预测; 模型调整确定系数(Adj.R2)=96.05%, 预测相关系数(Pred.R2)=81.35%, 表明该模型具有较高的可信性和较好拟合度; 模型的变异系数(CV)为2.09%. 由方差分析结果可知, 超声时间(A)、 酶解时间(B)和酶用量(C)之间存在明显的交互作用, 不同因素对灵芝三萜得率影响不同, 由大到小依次为C>B>A.
2.3.2 响应面模型拟合及分析
根据二次模拟回归方程绘出响应面及等高线如图3所示. 酶用量、 酶解时间和超声时间两两之间分别存在交互作用, 且两因素交互作用显著, 同时影响灵芝三萜最终得率. 由图3(A)可见, 超声时间(A)和酶解时间(B)二者相互作用对灵芝三萜得率的影响显著性较强, 同时灵芝三萜得率随酶用量的增加呈先增加后减少的趋势, 在A方向曲面变化不明显, 方差分析中酶解时间对结果影响显著(P<0.01), 且A与B交互作用等高线椭圆程度明显, 所以二者交互作用显著(P<0.05). 由图3(B)可见: 超声时间(A)和酶用量(C)相互作用对灵芝三萜得率的影响显著性较强, 随着超声时间的增加, 灵芝三萜得率先增加后减少, 由方差分析可知, 在A方向曲面变化不大, 但C方向曲面变化极显著(P<0.01);
A与C交互作用等高线的椭圆程度明显, 因此二者交互作用显著(P<0.05). 由图3(C)可见: 酶解时间(B)和酶用量(C)相互作用对灵芝三萜得率的影响显著性较强, 随着超声持续时间的增加, 灵芝三萜得率先增加后减少; 由方差分析可知, 在B与C方向曲面变化极显著(P<0.01), 且B与C交互作用等高线椭圆程度明显, 所以二者交互作用极显著(P<0.01).
2.3.3 最佳提取条件确定
将所得数据利用 Design-Expert软件分析, 最终可确定灵芝三萜提取工艺的最佳条件为: 以φ(乙醇)=70%为提取剂, 控制液固比为50∶1, 并进行超声洗涤, 超声时间(A)为46 min, 再进行酶解, 将其温度控制在50 ℃, 并控制酶用量(C)为4.8%, 持续酶解时间(B)为35 min. 在该条件下, 灵芝孢子粉总三萜的得率为0.98 mg/g.
2.4 大孔树脂吸附灵芝三萜
2.4.1 上样液量的选择
图4为大孔树脂最佳吸附曲线. 由图4可见, 对每份流出液灵芝三萜质量浓度进行测定, 确定在第7~13管时, 大孔树脂吸附灵芝三萜得率最高, 吸附效果最好. 所以每次收集7~13管中灵芝三萜的流出液, 并绘制动态吸附最佳曲线.
图5为D101和AB-8两种大孔树脂动态吸附曲线对灵芝三萜纯化程度的影响. 由图5可见, 通过对比两种大孔树脂D101和AB-8吸附灵芝三萜粗体液, 可测定流出液灵芝三萜的质量浓度. 通过对解吸率的计算得到AB-8型大孔树脂和D101型大孔树脂的解吸率分别为94.39%和83.51%, 可見AB-8型大孔树脂具有更好的吸附性, 在动态洗脱试验中纯化效果更好. AB-8型大孔树脂在纯化分析中的方法简单, 适用于灵芝三萜类化合物的富集纯化.
2.4.2 大孔树脂吸附泄露曲线
图6为大孔树脂动态吸附泄露曲线. 由图6可见, 灵芝三萜得率随上样量增大而增大. 当上样量16管(约70 mL)时, 灵芝三萜得率为12.33 mg/g. 因此选择70 mL为最佳上样量.
2.4.3 洗脱剂体积分数的确定
图7为不同洗脱剂体积分数对灵芝三萜得率的影响.
由图7可见, 随着洗脱液体积分数的增加, 灵芝三萜得率呈先升高后降低的趋势. 当φ(乙醇)=40%时, 灵芝三萜得率最小, 为8.49 mg/g; 当φ(乙醇)=95%时, 灵芝三萜的得率最大, 为9.97 mg/g. 原因为灵芝三萜类物质为脂溶性物质, 易溶于乙醇等有机溶剂, 当乙醇体积分数增大时, 三萜类物质溶解度也不断增大, 且在φ(乙醇)=95%时具有较高的溶解性, 更容易被洗脱[33]. 因此, 选择灵芝三萜的洗脱溶剂为φ=95%的乙醇.
2.4.4 上样液流速的确定
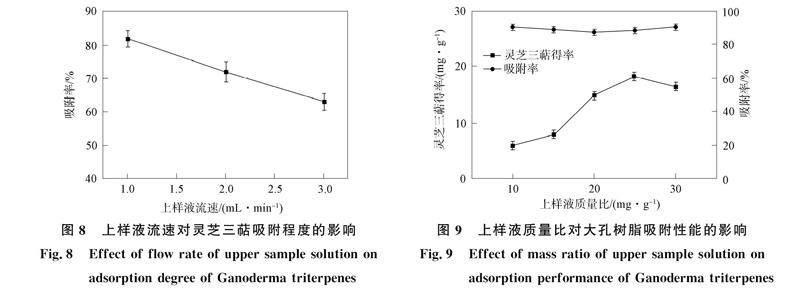
图8为上样液流速对灵芝三萜吸附程度的影响. 由图8可见, 随着上样液流速的增大, 大孔树脂对灵芝三萜的吸附能力逐渐降低. 刘洋璇[34]研究表明, 随着流速的增加, 树脂对样液的吸附能力不断降低, 使大孔树脂不能充分吸附, 吸附过程未完成便随样液流出树脂柱. 所以上样液流速选择1.0 mL/min, 此时吸附率最高.
2.4.5 上样液质量比的确定
图9为上样液质量比对大孔树脂吸附性能的影响. 由图9可见, 随着样品质量比的增大, 大孔树脂对灵芝三萜的吸附率呈先减小后增大的趋势, 在上样液质量比20~30 mg/g内, AB-8型大孔树脂对样品的吸附率波动较小. 灵芝三萜得率随上样液质量比的增加也呈升高的趋势, 当质量比为25 mg/g时, 灵芝三萜得率达到最大值18.34 mg/g. 但当样品质量比過高时, 所含杂质增多, 树脂因吸附其他物质而使吸附率下降. 因此, 上样液质量比选择25 mg/g, 以充分吸收灵芝三萜.
2.4.6 灵芝三萜纯度分析
用式(4)计算灵芝三萜纯度, 其纯度由原来的42.57%提高至87.09%, 约为纯化前2.05倍, 表明该方法简单高效, 可用于灵芝三萜的纯化分析.
2.5 高效液相色谱法鉴定分析
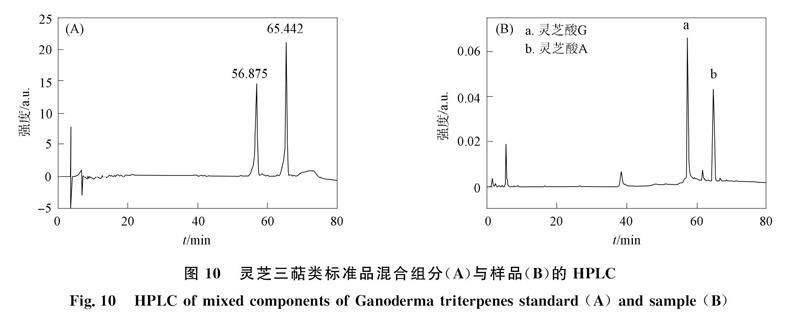
图10为灵芝三萜类标准品混合组分与样品的HPLC. 由图10可见, 在1.2.8条件下进行高效液相色谱分析, 得到的各色谱峰分离度良好, 其中三萜类标准样品的保留时间分别为灵芝酸G: 56.875 min, 灵芝酸A: 65.442 min. 由灵芝三萜标准品谱与样品谱可见, 通过大孔树脂纯化后得到灵芝三萜提取液, 纯化后得到以灵芝酸A和灵芝酸G为主要成分的灵芝三萜类化合物, 满足实验要求. 通过HPLC检测分析, 绘制标准曲线, 得到线性回归方程为
灵芝酸A: y=2.039 3×106x-62 245.530 3,R2=0.999 2;
灵芝酸G: y=3.894 1×106x-61 808.139 3,R2=0.999 4.
结果表明, 灵芝三萜在0.01~0.1 mg/L内具有良好的线性关系.
对两种灵芝三萜类化合物进行相对标准偏差(RSD)计算, 结果分别为0.51%,0.41%, 表明仪器精密度良好. 计算两种灵芝三萜酸峰面积, 结果表明, 二者无明显变化, RSD结果分别为1.17%,1.25%, 表明该方法具有良好的可重复性. 对两种灵芝三萜酸的 RSD结果进行计算, 结果分别为1.38%,1.28%, 表明受试品溶液在48 h内较稳定. 通过对三萜成分含量测定发现, 灵芝中三萜的组成及含量存在明显差异, 灵芝酸A和灵芝酸G分别占灵芝酸总量的26.17%,38.35%.
综上所述, 本文采用酶+超声波辅助提取法快速、 高效地提取灵芝中三萜类物质. 通过单因素试验和响应面试验确定灵芝三萜的最佳提取参数: 提取剂为φ=70%的乙醇, 液固比50∶1, 酶解最适温度50 ℃, 超声时间46 min, 酶解时间35 min, 酶量为4.8%. 在该条件下对灵芝孢子粉总灵芝三萜得率为0.98 mg/g. 选择AB-8型大孔树脂分离纯化灵芝三萜类物质, 通过考察动态吸附解吸条件确定最佳纯化工艺为: 上样液灵芝三萜类物质浓度为25 mg/g, 上样液流速为1.0 mL/min, 先静态吸附3 h后用1管(4.5 mL)蒸馏水洗去杂质, 再用φ=95%的乙醇作为洗脱剂并以1.0 mL/min流速洗脱. 在该条件下灵芝三萜类物质纯度由42.57%提高至87.09%. 通过HPLC分析洗脱液成分, 结果表明, 保留时间为56.875,65.442 min时出现峰值, 分别为灵芝酸G和灵芝酸A, 因此纯化后的灵芝三萜类化合物以灵芝酸A和灵芝酸G为主要成分析出.
参考文献
[1]CHEN H Y, LEI J Y, LI S L, et al. Progress in Biological Activities and Biosynthesis of Edible Fungi Terpenoids [J]. Critical Reviews in Food Science and Nutrition, 2022, 63(25): 7288-7310.
[2]GUO W L, CAO Y J, YOU S Z, et al. Ganoderic Acids-Rich Ethanol Extract from Ganoderma lucidum Protects against Alcoholic Liver Injury and Modulates Intestinal Microbiota in Mice with Excessive Alcohol Intake [J]. Current Research in Food Science, 2022, 5: 515-530.
[3]ZHAO C, FAN J L, LIU Y Y, et al. Hepatoprotective Activity of Ganoderma lucidum Triterpenoids in Alcohol-Induced Liver Injury in Mice, an iTRAQ-Based Proteomic Analysis [J]. Food Chemistry, 2019, 271: 148-156.
[4]LIN Z B, ZHANG H N. Anti-tumor and Immunoregulatory Activities of Ganoderma lucidum and Its Possible Mechanisms [J]. Acta Pharmacologica Sinica, 2004, 25(11): 1387-1395.
[5]罗云, 陈霖, 张雪涟, 等. 灵芝三萜类成分药理活性研究进展 [J]. 中国药理学通报, 2021, 37(9): 1185-1188. (LUO Y, CHEN L, ZHANG X L, et al. Research Progress on Pharmacological Activities of Triterpenes from Ganoderma lucidum [J]. Chinese Pharmacological Bulletin, 2021, 37(9): 1185-1188.)
[6]LI Y H, TANG J, GAO H L, et al. Ganoderma lucidum Triterpenoids and Polysaccharides Attenuate Atherosclerotic Plaque in High-Fat Diet Rabbits [J]. Nutrition Metabolism and Cardiovascular Diseases, 2021, 31(6): 1929-1938.
[7]LIU W, YUAN R Y, HOU A H, et al. Ganoderma triterpenoids Attenuate Tumour Angiogenesis in Lung Cancer Tumour-Bearing Nude Mice [J]. Pharmaceutical Biology, 2020, 58(1): 1061-1068.
[8]敖艷霞, 冯彩玲, 吴岩斌, 等. 灵芝总三萜对对乙酰氨基酚肝损伤的保护作用 [J]. 海峡药学, 2022, 34(4): 8-12. (AO Y X, FENG C L, WU Y B, et al. Protective Effect of Total Triterpenoids from Ganoderma lucidum on Acetaminophen Induced Liver Injury in Rats [J]. Strait Pharmaceutical Journal, 2022, 34(4): 8-12.)
[9]郑士彬, 韩阳, 韩静, 等. 响应面法优化灵芝三萜回流提取工艺 [J]. 中南药学, 2015, 13(4): 378-382. (ZHENG S B, HAN Y, HAN J, et al. Optimization of Refluxing Extraction Technology of Triterpenoids from Ganoderma lucidum by Response Surface Method [J]. Central South Pharmacy, 2015, 13(4): 378-382.)
[10]胡琼方, 董建生, 高文庚. 灵芝发酵粉中三萜化合物提取与测定 [J]. 食品研究与开发, 2018, 39(10): 104-109. (HU Q F, DONG J S, GAO W G. Extraction and Determination of Triterpene Compounds in Ganoderma lucidum Fermented Powder [J]. Food Research and Development, 2018, 39(10): 104-109.)
[11]OLUDEMI T, BARROS L, PRIETO M A, et al. Extraction of Triterpenoids and Phenolic Compounds from Ganoderma lucidum: Optimization Study Using the Response Surface Methodology [J]. Food & Function, 2018, 9(1): 209-226.
[12]LI L, GUO H J, ZHU L Y, et al. A Supercritical-CO2 Extract of Ganoderma lucidum Spores Inhibits Cholangiocarcinoma Cell Migration by Reversing the Epithelial-Mesenchymal Transition [J]. Phytomedicine, 2016, 23(5): 491-497.
[13]卢彦芳, 安静, 蒋晔. 微波连续抽提用于灵芝三萜类成分的分析 [J]. 中国中药杂志, 2015, 40(7): 1296-1299. (LU Y F, AN J, JIANG Y. Analysis of Triterpenoids in Ganoderma lucidum by Microwave Assisted Continuous Extraction [J]. China Journal of Chinese Materia Medica, 2015, 40(7): 1296-1299.)
[14]CHEN Y, XIE M Y, GONG X F. Microwave-Assisted Extraction Used for the Isolation of Total Triterpenoid Saponins from Ganoderma atrum [J]. Journal of Food Engineering, 2007, 81(1): 162-170.
[15]劉晓艳, 陈艺煊, 吴林秀, 等. 响应面法优化灵芝总三萜酶辅助提取工艺及其抗氧化活性研究 [J]. 食品科技, 2017, 42(8): 225-230. (LIU X Y, CHEN Y X, WU L X, et al. Response Surface Optimization of Enzyme-Assisted Extraction Triterpene from Juncao Ganoderma lucidum and Its Antioxidant Activity [J]. Food Science and Technology, 2017, 42(8): 225-230.)
[16]王涛. 灵芝三萜的提纯及其对前列腺癌细胞生长的影响 [D]. 广州: 南方医科大学, 2016. (WANG T. The Extraction, Purification of Ganoderma lucidum Triterpenoids and Its Effect on Cell Proliferation and Apoptosis in Prostate Cancer [D]. Guangzhou: Southern Medical University, 2016.)
[17]王英, 李云飞, 陈庚超, 等. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速检测三七农药残留 [J]. 西华大学学报(自然科学版), 2023, 42(5): 75-86. (WAGN Y, LI Y F, CHEN G C, et al. High Resolution Mass Spectrometry Method for Screening Pesticide Residues in Panax Notoginseng [J]. Journal of Xihua University (Natural Science Edition), 2023, 42(5): 75-86.)
[18]CHENG C R, YUE Q X, WU Z Y, et al. Cytotoxic Triterpenoids from Ganoderma lucidum [J]. Phytochemistry, 2010, 71(13): 1579-1585.
[19]HE B, ZHANG L L, YUE X Y, et al. Optimization of Ultrasound-Assisted Extraction of Phenolic Compounds and Anthocyanins from Blueberry (Vaccinium ashei) Wine Pomace [J]. Food Chemistry, 2016, 204: 70-76.
[20]田振, 唐庆九, 冯娜, 等. 利用大孔树脂制备灵芝活性三萜的研究 [J]. 食用菌学报, 2016, 23(4): 29-33. (TIAN Z, TANG Q J, FENG N, et al. Preparation of Triterpenoids from Fruiting Body of Ganoderma lucidum with Macroporous Resin [J]. Acta Edulis Fungi, 2016, 23(4): 29-33.)
[21]吕梦. 葛根素药理学活性及分离纯化的研究进展 [J]. 广东化工, 2016, 43(12): 108-109. (L M. Puerarin Pharmacology Activity and the Research Progress of Separation and Purification [J]. Guangdong Chemical Industry, 2016, 43(12): 108-109.)
[22]李维嘉, 王志强, 许泽群, 等. 分光光度法测定灵芝孢子油中总三萜的含量 [J]. 食品研究与开发, 2019, 49(17): 165-170. (LI W J, WANG Z Q, XU Z Q, et al. Determination of Total Triterpenoids in Ganoderma lucidum Spore Oil by Spectrophotometry [J]. Food Research and Development, 2019, 49(17): 165-170.)
[23]WU S H, WANG Y Y, GONG G L, et al. Adsorption and Desorption Properties of Macroporous Resins for Flavonoids from the Extract of Chinese Wolfberry (Lycium barbarum L.) [J]. Food and Bioproducts Processing, 2015, 93: 148-155.
[24]賈红岩, 王亚涛, 张芝华, 等. 高效液相色谱法测定不同产地及品种灵芝三萜类成分的含量 [J]. 微生物学通报, 2017, 44(1): 238-244. (JIA H Y, WANG Y T, ZHANG Z H, et al. Determination of Triterpenoids in Ganodema lingzhi from Different Areas and Species by HPLC [J]. Microbiology China, 2017, 44(1): 238-244.)
[25]付亚玲, 姚俊修, 张仁堂. 响应面法优化黑化红枣三萜酸提取工艺及抗氧化活性研究 [J]. 食品工业科技, 2021, 42(12): 176-183. (FU Y L, YAO J X, ZHANG R T. Optimization of Extraction and Antioxidant Activities of Triterpenic Acids from Blacked Jujube by Response Surface Methodology [J]. Science and Technology of Food Industry, 2021, 42(12): 176-183.)
[26]凡芸, 宋雅, 孙月, 等. 超声辅助乙醇提取杏鲍菇总三萜化合物工艺研究 [J]. 食品工业, 2016, 37(8): 124-126. (FAN Y, SONG Y, SUN Y, et al. Research on the Extraction Technology of Total Triterpenes from Pleurotus eryngii by Ethanol Association with Ultrasonic [J]. The Food Industry, 2016, 37(8): 124-126.)
[27]丁霄霄, 李凤伟, 余晓红. 响应面法优化复合酶提取灵芝总三萜工艺 [J]. 食品工业, 2018, 39(8): 40-44. (DING X X, LI F W, YU X H. Optimization of Complex Enzyme Extraction Technology of Total Triterpenoids from Ganoderma lucidum by Response Surface Methodology [J]. The Food Industry, 2018, 39(8): 40-44.)
[28]史美荣, 李元慈. 响应面法优化酶辅助提取沙苑子三萜的工艺及抗氧化活性研究 [J]. 中国农学通报, 2017, 33(26): 25-32. (SHI M R, LI Y C. Triterpenes from Astragali complanati Semen: Enzyme-Assisted Extraction Technology Optimized by Response Surface Methodology and Its Antioxidant Activity [J]. Chinese Agricultural Science Bulletin, 2017, 33(26): 25-32.)
[29]LUO B Y, LU Y G. The Ultrasonic-Enhanced Factor of Mass-Transfer Coefficient in the Supercritical Carbon Dioxide Extraction [J]. Science in China Series G: Physics Mechanics & Astronomy, 2008, 51(10): 1496-1504.
[30]黄玉坤, 宋亚宁, 陈芳, 等. 基于响应面法优化柱前衍生-高效液相色谱法分析传统郫县豆瓣中8种生物胺 [J]. 西华大学学报(自然科学版), 2020, 39(6): 61-71. (HUANG Y K, SONG Y N, CHEN F, et al. Analysis for Eight Biogenic Amines in Traditional Pixian Broadbean by a Pre-column Derivatization-HPLC Method Based on Response Surface Optimization [J]. Journal of Xihua University (Natural Science Edition), 2020, 39(6): 61-71.)
[31]李子元, 李长俊, 贾文龙, 等. 基于响应面法的SCORE 丙烷回收工艺参数优化 [J]. 天然气化工—C1化学与化工, 2022, 47(6): 155-161. (LI Z Y, LI C J, JIA W L, et al. Optimization of SCORE Process Parameters for Propane Recovery Based on Response Surface Methodology [J]. Natural Gas Chemical Industry, 2022, 47(6): 155-161.)
[32]王晓磊, 吕小明, 廖明旺, 等. 基于响应面分析法的天然气乙烷回收工艺参数优化 [J]. 天然气化工—C1化学与化工, 2022, 47(2): 122-128. (WANG X L, L X M, LIAO M W, et al. Parameters Optimization for Natural Gas Ethane Recovery Process Based on Response Surface Methodology [J]. Natural Gas Chemical Industry, 2022, 47(2): 122-128.)
[33]AALIM H, BELWAL T, WANG Y Y, et al. Purification and Identification of Rice Bran (Oryza sativa L.) Phenolic Compounds with in-vitro Antioxidant and Antidiabetic Activity Using Macroporous Resins [J]. International Journal of Food Science and Technology, 2019, 54(3): 715-722.
[34]劉洋旋. 葛根总黄酮的低共熔溶剂法提取、 分离纯化及其抗氧化活性研究 [D]. 武汉: 武汉轻工大学, 2020. (LIU Y X. Study on Extraction, Purification and Antioxidant Activity of Total Flavonoids from Pueraria by Deep Eutectic Solvents Method [D]. Wuhan: Wuhan Polytechnic University, 2020.)
(责任编辑: 单 凝)
收稿日期: 2023-07-26.
第一作者简介: 温舒然(2000—), 女, 汉族, 硕士研究生, 从事生物大分子空间结构改造的研究, E-mail: wenshuran2023@163.com.
通信作者简介: 詹冬玲(1977—), 女, 汉族, 博士, 副教授, 从事食品生物化学的研究, E-mail: zdlgale@126.com.
基金项目: 吉林省科技发展计划重点研发项目(批准号: 20210202109NC).

