纳米塑料-重金属-塑化剂联合暴露对儿童肠道微生物菌群及代谢的影响
豆晴楠 赵丽丽 姬汉轩 王怡斌 陈婉蓉 孙晓涵 姚国琴 马腾云
摘 要:[目的]探究纳米塑料(NPs)、镉(Cd)和邻苯二甲酸二丁酯(DBP)污染对儿童肠道菌群多样性、氨基酸代谢及短链脂肪酸(SCFAs)含量的影响.[方法]利用16S rRNA高通量测序技术和高效液相色谱-质谱法LC-MS/MS分析NPs、Cd、DBP单一污染及纳米塑料聚丙烯(PP)、Cd、DBP复合污染对儿童肠道细菌群落及肠道微生物代谢产物中短链脂肪酸及氨基酸含量的变化.[结果]高通量检测结果显示,与对照相比,在门属水平上,单一污染的优势菌门属无明显变化,PP+Cd、PP+DBP+Cd复合污染优势菌门属水平丰富度与多样性显著下降;LC-MS/MS检测结果显示,在肠道微生物代谢产物中,经NPs与DBP暴露后,氨基酸含量呈现不同程度的下降,而 Cd、PP+Cd、PP+Cd+DBP处理后,大多数氨基酸的含量显著增加;同时检测到丁酸、戊酸的含量也发生变化.[结论]与单一污染物处理相比NPs相关复合污染物暴露處理后其肠道微生物紊乱程度更强,且不同污染物处理均会影响肠道微生物的氨基酸代谢和SCFAs产量.肠道菌群与人体健康密切相关,探究肠道菌群及代谢功能在NPs、Cd、DBP影响下的变化,从肠道菌群层面评价NPs、Cd、DBP单一暴露和复合暴露污染下的危害和风险具有重要意义.
关键词:纳米塑料;镉;邻苯二甲酸二丁酯;肠道菌群;短链脂肪酸;氨基酸
中图分类号:Q939.9 文献标志码:A文章编号:1000-2367(2024)01-0033-10
微/纳米塑料(micronanoscale plastics,MNPs)是指尺寸小于5 mm的塑料颗粒,主要受到水流、风吹、阳光照射等外部环境的影响被破碎或降解所形成[1],广泛分布在淡水、海洋、土壤甚至空气中.人体内MNPs的摄入途径主要是食物、水和空气,如食用鱼类、双壳类、盐、饮用水、饮料、蜂蜜、蔬菜等.另外,塑料是常用的食品包装材料,其在食品生产、运输和包装过程中与食品接触会释放出塑料颗粒,对人类健康产生严重威胁.最近,在人类血液、肺、肝脏、母乳、胎盘、胎粪和婴儿粪便中均发现了微塑料[2].GREEN等[3]构建了人肠道细胞模型,并使用纳米聚苯乙烯颗粒暴露处理,结果发现纳米塑料会影响细胞活力和诱导细胞凋亡.BROWN等[4]发现纳米聚苯乙烯颗粒还会对人肺细胞产生炎症作用.其他研究表明,微塑料口服暴露会导致受体肝脏炎症、神经毒性反应,改变氨基酸和胆汁酸代谢,并改变微生物群组成[5].
此外,由于MNPs比表面积相对较大,经过磨损、风化和氧化后MNPs带负电荷,重金属和持久性有机污
收稿日期:2023-06-20;修回日期:2023-09-18.
基金项目:国家重点研发计划专项(2018YFD0200200);新乡市科技攻关项目(GG2020006);新乡市重大科技专项(22ZD001).
作者简介(通信作者):赵丽丽(1984-),女,河南新乡人,河南师范大学讲师,博士,研究方向为食品微生物学,E-mail:zhaolili@htu.edu.cn.
引用本文:豆晴楠,赵丽丽,姬汉轩,等.纳米塑料-重金属-塑化剂联合暴露对儿童肠道微生物菌群及代谢的影响[J].河南师范大学学报(自然科学版),2024,52(3):33-42.(Dou Qingnan,Zhao Lili,Ji Hanxuan,et al.Effect of combined exposure of nanoplastics-heavy metal-plasticizer on gut microbiota and metabolism in children[J].Journal of Henan Normal University(Natural Science Edition),2024,52(3):33-42.DOI:10.16366/j.cnki.1000-2367.2023.06.20.0003.)
染物容易在MNPs表面黏附和积累,然后在环境中迁移并进入人体内[5-6].镉(cadmium,Cd)是环境中最常见的有毒金属污染物之一,广泛存在于土壤、水生生态系统中,具有环境毒性大、易积累、降解性差等特点.有研究报道,长期低剂量Cd2+暴露会导致小鼠脂质沉积和肝功能障碍[7].此外,LIU等[8]发现小鼠暴露于Cd2+污染物下会降低小鼠肠道总细菌的丰度及结肠中短链脂肪酸的水平.而MNPs对Cd的吸附可能会进一步改变其环境行为、归宿、生物利用度和毒性,从环境转移到食物链甚至人体,这可能对生态系统及人类健康造成更严重的破坏.将草鱼暴露在聚苯乙烯纳米塑料和Cd2+的复合环境中96 h后,相较于单一Cd2+处理组来说,纳米微塑料的添加急剧增加了Cd2+的毒性,且随着浓度的增加,协同作用随之增强[9].环境中的微塑料在制造过程中不与聚合物碳链聚合,降解时可能会发生一系列变化,导致一些具有生物毒性的塑料添加剂释放到环境中,形成二次污染物,如邻苯二甲酸二丁酯(dibutyl phthalate,DBP).在生殖能力毒性风险测评中,DBP被分类为生殖毒性第3类有毒化合物[10].作为增塑剂,DBP被广泛应用于儿童玩具、医疗器械、营养补充剂和各种包装.最近的一项研究在母体和脐带血清样本中发现了12种邻苯二甲酸酯代谢物[11].研究发现,当小鼠暴露于DBP时,盲肠内容物中肠道微生物群的组成和结构在门和属水平上均发生了变化.DBP暴露可导致肠道菌群失调并扰乱肝脏脂质代谢,导致脂质积累,从而造成肝脏炎症[12].
越来越多的证据证明,环境污染物可以改变生物体内肠道微生物的生物组成和多样性,肠道菌群参与宿主生理功能的调节,在维持宿主健康、免疫系统的正常发育和活动中有重要作用.由于肠道微生物群失调会引起各种与年龄相关的疾病,生态失调已被视为全球死亡的重要原因之一[13].我们前期的研究发现,纳米塑料(nanoplastics,NPs)、Cd,DBP均可影响植物乳杆菌的生长,且质量浓度分别为100.0、2.5、600.0 μg/mL时对菌株生长的影响最大;聚丙烯(polypropylene,PP)与聚乙烯(polyethylene,PE)、聚氯乙烯(polyvinyl chloride,PVC)相比,本文所采用的纳米塑料类型中PP对植物乳杆菌的影响更大[14],因此,本实验选用PP为Cd和DBP的复合污染物.然而,目前的研究大多集中在MNPs及其他污染物单一污染的危害,而MNPs的复合污染可能会造成更严重的健康影响,并且动物与人体肠道菌群存在差异,国内外大多数研究为复合污染对动物和水生生物的毒性影响,很少有人考虑其对人类健康的影响,因此,有必要研究MNPs、MNPs添加剂和重金属复合污染对人体健康造成的共同危害.本文建立了肠道微生物体外培养体系,研究100.0 μg/mL的NPs、2.5 μg/mL的重金属Cd和600.0 μg/mL的塑化剂DBP共同暴露时儿童肠道菌群及代谢的变化.微塑料类型主要采用PP、PE、PVC等3种常见的NPs类型.考察在Cd、DBP单一暴露污染及PP、Cd、DBP复合污染下,儿童肠道细菌群落多样性及氨基酸代谢、短链脂肪酸含量的变化.本研究旨在为NPs、Cd和DBP对儿童肠道的共同作用提供理论依据,并警示人们NPs污染的风险.
1 材料与方法
1.1 材料
1.1.1 试剂与药品
无菌脱纤维绵羊血(南京亚松生物科技有限公司);澄清瘤胃液(艾礼生物科技上海有限公司);树脂厌氧培养瓶(河南美凯生物科技有限公司);100 nm NPs颗粒(聚丙烯PP、聚乙烯PE、聚氯乙烯PVC)(新乡智宝生物科技有限公司);邻苯二甲酸二丁酯(DBP)标准溶液、Cd镉标准溶液(北京索莱宝科技有限公司);正丁酸、正戊酸标准溶液、乙腈、甲酸(上海麦克林生化科技有限公司).
1.1.2 仪器
安捷伦1260液相色谱仪(美国,安捷伦)与三重四极杆飞行时间质谱仪(德国,布鲁克);低温高速离心机Heraeus Fresco 21(赛默飞世尔科技中国有限公司);全自动氮吹仪(宁波新艺超声设备有限公司);涡旋仪MI01002(美国FOUR E′S-广西王河科技有限公司).
1.2 实验方法
1.2.1 样品采集及处理
样品来源于15名(8男7女)10岁以下健康供体的新鲜粪便,均无任何消化性疾病,在样品采集前一周之内未服用过任何药物.排便后立即用无菌袋收集,置于冰袋上30 min内送至实验室并充氮气后在4 ℃下短暂保存.参考向情儒等[15]的方法处理样品,并略加修改.从15份样品中分别取0.5 g混合均匀,按照1∶10的体积比重悬于PBS缓冲液中,用涡旋仪充分混合5 min后使用3层无菌医用纱布过滤,得到10%的粪便接种物,置于4 ℃冰箱备用.
1.2.2 体外培养
体外培养使用树脂厌氧培养瓶,实验共分为8种不同处理,分别为PP、PE、PVC纳米塑料,Cd、DBP单一污染,PP+Cd、PP+DBP、PP+Cd+DBP复合污染,在培养瓶中加入5 mL无菌脱纤维绵羊血,5 mL澄清瘤胃液,0.5 mL粪便接种物以及不同处理的污染物,其中NPs、Cd、DBP的终质量浓度分别为100.0、2.5、600.0 μg/mL.相同条件下,不加任何污染物的处理为空白对照,每组3个重复.将处理后的培养瓶置于37 ℃下培养48 h后收集样品,以供下一步分析.
1.2.3 16S rRNA高通量测序
样品总DNA提取和高通量测序委托上海美吉生物医药科技有限公司进行.取1 mL培养好的样品离心10 min(4 ℃,6 000 r/min)取上清于离心管中并使用液氮速冻,将处理合格的样品保存于干冰中至公司进行总DNA提取,使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)细菌通用引物对16S rRNA基因V3-V4可变区进行PCR扩增.使用质量分数2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%(质量分数)瓊脂糖凝胶电泳检测,并用Quantus Fluorometer(Promega,USA)对回收产物进行检测定量.使用NEXTFLEX Rapid DNA-Seq Kit对纯化后的PCR产物进行建库,利用Illumina公司平台进行测序(上海美吉生物医药科技有限公司).
1.2.4 短链脂肪酸的测定
取1 mL培养好的样品离心10 min(4 ℃,13 000 r/min)取上清于离心管中并用0.22 μm滤膜过滤至进样瓶待测.设定丙酸、丁酸、戊酸质量浓度为0、5、10、25、50、100、200 μg/L,使用高效液相色谱-质谱联用技术制作出标准曲线,通过DataAnalysis软件分析数据并记录峰面积,采用线性回归分析法计算不同处理对肠道细菌产物短链脂肪酸含量的影响.色谱条件:色谱柱为XDB-C18液相色谱柱,使用梯度洗脱的方法.流动相:A(含体积分数0.1%甲酸的水);B(含体积分数0.1%甲酸的乙腈),其中进样量为10 μL,柱温为30 ℃.流动相洗脱梯度见表S1.质谱条件:采用电喷雾离子源,MRM的正离子模式,氮气作为雾化、锥孔气[16];主要参数设置包括:毛细管电压4.5 kV;端板偏移电压0.5 kV;离子源温度220 ℃;喷雾器电压5.0 kV;干燥气体条件9.0 L/min;质荷比范围50~1 300 m/z.
1.2.5 氨基酸代谢产物的测定
按照1.2.4中的方法进行样品处理及检测,根据不同种类氨基酸的分子式与相对分子质量与样品特征峰比对,以确定氨基酸种类并利用特征峰面积计算氨基酸含量(附录图S1).
1.2.6 方法验证与数据分析
从线性、检出限(LOD)两方面评估液相色谱质谱法测定氨基酸代谢产物、短链脂肪酸含量的准确性.分别绘制不同氨基酸和短链脂肪酸浓度下的峰面积(Y)与浓度(X)之间的关系,氨基酸和短链脂肪酸在各自的质量浓度范围内均有良好的线性关系,最低检测限(LOD)以3倍信噪比计算.不同氨基酸的线性相关系数为0.997 0~0.999 1,检出限为3.12~11.40 ng/L;短链脂肪酸的线性相关系数为0.999 0~0.999 3,检出限为0.8~1.0 ng/L,表明该方法具有较高的灵敏度.使用Quantitative Insights Into Microbial Ecology 2(QIIME 2)分析得到的序列数据,DADA 2对序列进行质量过滤、修剪、去噪和合并,并用GreenGenes(版本13.8)参考数据库进行分类分析,R语言进行数据清洗和检验;利用Excel进行实验数据整理,数据结果以平均值±标准差表示(n=3),利用SPSS 21.0软件,单因素分析方法(ANOVA)进行显著性分析,P<0.05表示有统计学意义;氨基酸代谢产物、短链脂肪酸含量数据处理及作图采用Origin 2018;冗余分析利用Canoco进行,使用Canoco for Windows指定分析的数据和排序模型,CanoDraw绘制排序图;利用R语言生成物种相关性矩阵,相关性|r|>0.6、p<0.05挑选物种进行相关性网络图分析[17],网络图绘制使用Gephi软件.
2 结 果
2.1 不同污染对儿童肠道菌群门属水平的影响
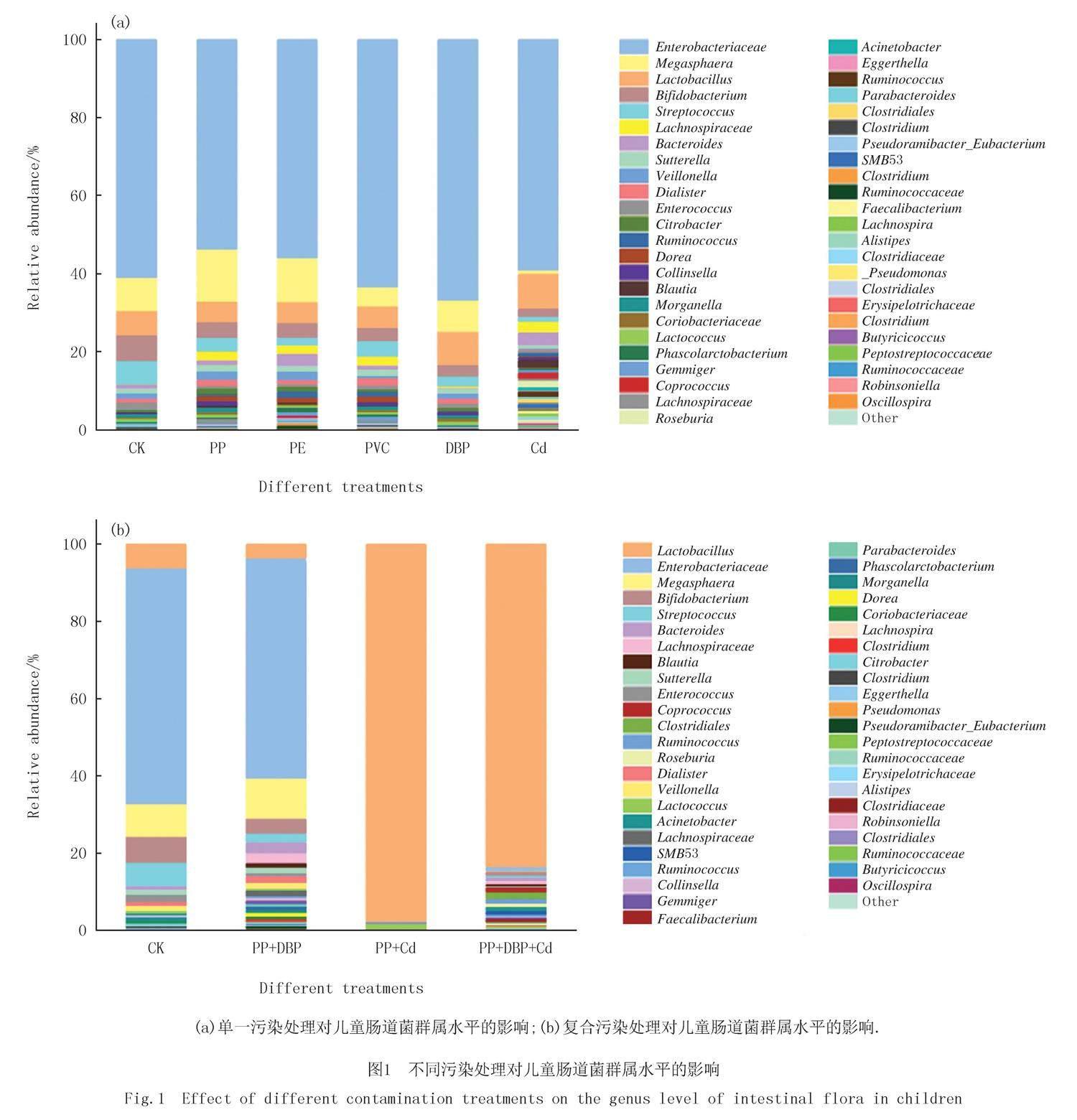
不同污染物暴露下儿童肠道菌群门水平变化情况见附录图S1,每个处理组3个重复.儿童肠道微生物菌群在门分类水平上共鉴定出9个门,其中优势菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes),占总比例的99%~100%.与对照相比经不同类型的NPs、DBP、Cd单一污染及PP+DBP复合污染后,Proteobacteria、Firmicutes、Actinobacteria丰度无明显变化,门水平细菌群落组成无显著性差异;经PP+Cd、PP+DBP+Cd联合暴露后厚壁菌门的相对丰度分别升高至99.83%和94.96%,门水平多样性明显降低.不同污染物暴露下儿童肠道菌群属水平变化情况如图1所示.
图1(a)和图1(b)均选择样本中相对丰度大于0.05%的前47和46个属,与对照相比,单一污染及PP+DBP复合污染的优势菌属无明显变化,主要为肠杆菌科(Enterobacteriaceae)、乳杆菌属(Lactobacillus)、巨型球菌属(Megasphaera)、双歧杆菌属(Bifidobacterium)、链球菌属(Streptococcus),其中Bifidobacterium,Streptococcus丰度下降.菌属多样性增加,新增多尔氏菌属(Dorea)、布劳特氏菌属(Blautia)、瘤胃球菌属(Ruminococcus)等.与单一污染相比,在PP+Cd和PP+DBP+Cd复合污染组中优势菌属有显著差异,其中乳杆菌属的相对丰度分别升高至97.50%和83.45%,PP+Cd样品属水平多样性显著下降.以上结果表明,在不同污染物暴露下均会使肠道菌群发生一定程度的紊乱,其中PP+Cd和PP+DBP+Cd复合污染暴露下的菌群紊乱程度最强,且乳杆菌属对这2组样品污染物耐受性最强.
2.2 不同污染与儿童肠道菌群相关性分析
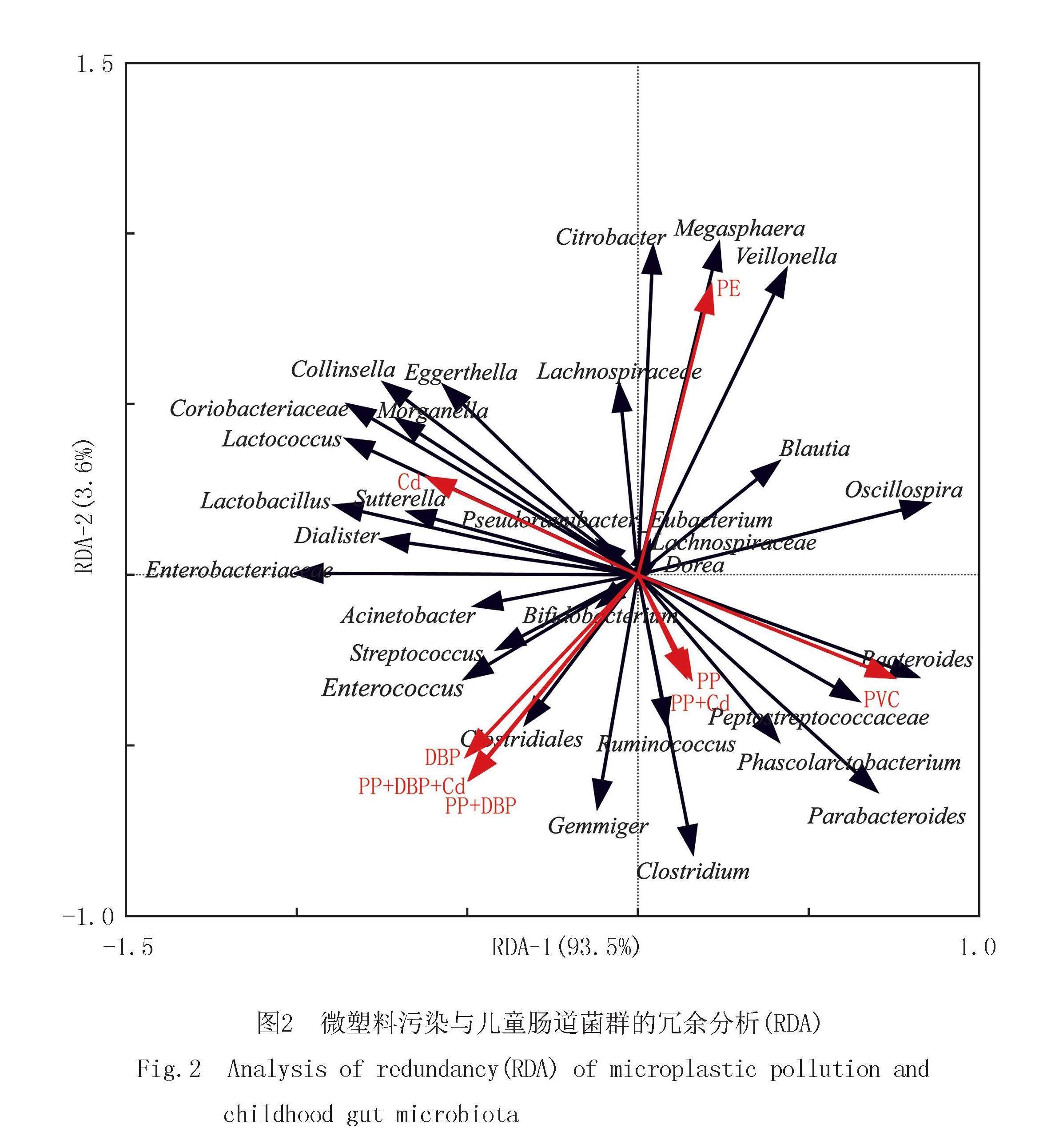
为了了解环境变量NPs,Cd和DBP不同污染方式与儿童肠道菌群物种分类水平间的变化(每个处理3个重复),运用Canoco进行相关性分析(图2),数据分析的4个轴的最大梯度为2.369,因此进一步分析采用基于线性模型的RDA直接排序法.
选取了相对丰度大于0.005%的前44个菌属,Cd与乳球菌属(Lactococcus)、Lactobacillus、萨特氏菌属(Sutterella)、小杆菌属(Dialister)、Enterobacteriaceae、摩根氏菌属(Morganella)、柯林斯菌属(Collinsella)呈正相关,与拟杆菌属(Bacteroides)、消化链球菌科(Peptostreptococcaceae)、副拟杆菌属(Parabacteroides)等呈负相关;PVC与Cd呈现相反的趋势;PP、PP+Cd与梭菌属(Clostridium)、Ruminococcus、考拉杆菌属(Phascolarctobacterium)、Parabacteroides等呈正相关;DBP、PP+DBP、PP+DBP+Cd与梭菌目(Clostridiales)、肠球菌属(Enterococcus)、Streptococcus、不动菌属(Acinetobacter)、芽殖菌属(Gemmiger)等呈正相关,与布劳特氏菌属(Blautia)、韦荣氏球菌属(Veillonella)、巨型球菌属(Megasphaera)、毛螺菌科(Lachnospiraceae)等呈负相关;PE与DBP、PP+DBP、PP+DBP+Cd呈相反的趋势.
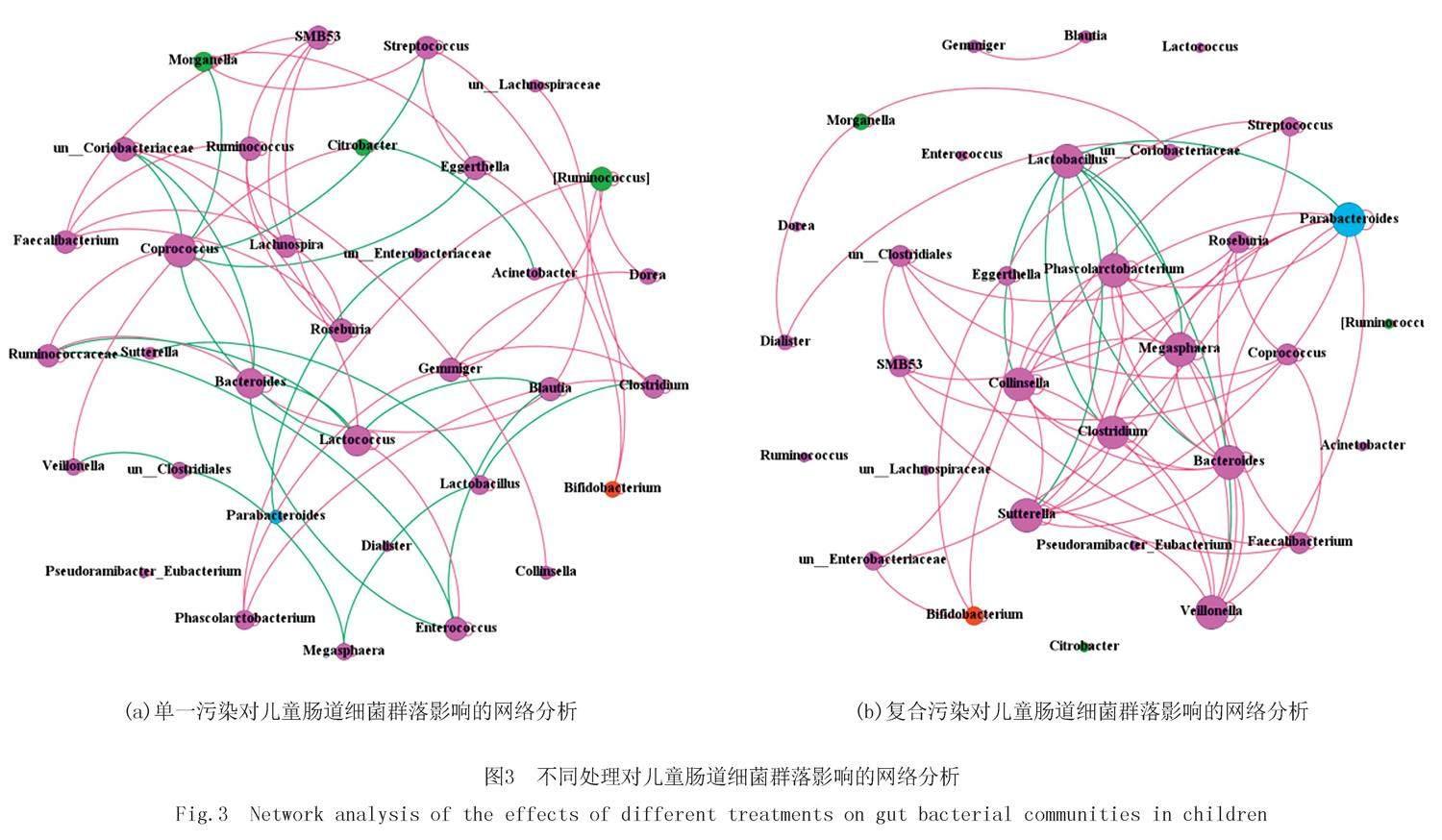
2.3 不同污染对儿童肠道细菌群落影响的网络分析
探索纳米塑料、重金属、塑化剂与儿童肠道细菌类群之间的关联,图3(a)和图3(b)分别显示了单一污染(PP、PE、PVC、Cd、DBP处理组)和复合污染(PP+Cd、PP+DBP、PP+Cd+DBP處理组)下微生物之间的相互关系,每个处理组3个重复.由图3可以看出,单一污染和复合污染中细菌网络第一优势菌门均是厚壁菌门,分别为85.29%和84.38%;图3(a,b)均以正相关关系为主,正相关比例分别为77.65%和90.91%.通过计算分子生态网络拓扑学特征参数描述菌群之间复杂的相互关系,图3(a)中节点数为34,连接数为85,其中粪球菌属连通数最高(7),与其他节点多为负相关关系;图3(b)中节点数为32,连接数为88,Lactobacillus,Parabacteroides,Phascolarctobacterium,Megasphaera,Veillonella,Collinsella,Bacteroides,Sutterella,Clostridium的连接数最高(均为8),除Lactobacillus外与周围节点均为正相关关系;并且这9个节点之间相互作用,Lactobacillus与其他8个节点以竞争关系互作;与图3(a)相比,图3(b)的边数、平均度、平均聚类系数、连接部件和图密度均较高,模块化指数和网络直径较低,但两者模块化指数大于0.4,说明网络均具有模块化结构.
两组细菌网络第一优势菌门均是Firmicutes,分别为85.29%和84.38%,由此说明,单一污染物细菌分子生态网络中物种更丰富、互作关系更复杂;复合污染中Collinsella,Clostridium,Megasphaera,Collinsella等致病菌在复合污染中以共生关系与周围细菌互作;Lactobacillus与周围节点均为负相关关系(100%),说明Lactobacillus多以竞争关系与周围细菌互作.本研究构建的两个分子生态网络中均为正相关关系占优势(77.65%、90.91%),表明合作关系大于竞争关系.
2.4 不同污染处理对儿童肠道代谢的影响
2.4.1 对肠道微生物氨基酸代谢的影响
使用LC-MS/MS测定肠道微生物培养系统中19种氨基酸的含量,并将测定结果导入Origin,数据经Z评分进行归一化处理后绘制热图,用来表达不同污染物单一处理及复合污染等8种不同处理方式对肠道微生物氨基酸代谢的影响,每个处理组3个重复.如图4(a)所示,与对照组相比,经NPs与DBP单一暴露后,除甘氨酸、缬氨酸和苏氨酸外,其他氨基酸含量均有不同程度的下降,其中亮氨酸、异亮氨酸、脯氨酸和丙氨酸下降最明显;Cd单一暴露、PP+Cd、PP+Cd+DBP复合暴露后,大多数氨基酸的含量显著增加.由此说明,不同污染物处理均会影响氨基酸代谢.
2.4.2 对儿童肠道菌群代谢产物短链脂肪酸的影响
如图4(b)所示,研究了不同污染对儿童肠道菌群代谢产物SCFAs的影响,鉴定了肠道微生物培养体系中丁酸和戊酸的含量(每个处理组3个重复).与对照组相比,肠道微生物产生丁酸的量在PP、PVC、DBP暴露下有所升高,而在PE处理下含量基本不变.在Cd、PP+DBP、PP+Cd、PP+DBP+Cd等4个处理组中,丁酸含量均为0.在PP、PE、PVC、DBP和PP+Cd组中,戊酸的含量大幅度增加,与对照相比有极显著性差异;而Cd、PP+DBP、PP+DBP+Cd组的戊酸含量降低.以上述结果可知,添加纳米塑料、重金属、塑化剂后对肠道微生物代谢产物SCFAs的含量均有一定程度的影响.
3 讨 论
肠道菌群是生物体内一个非常重要的微生态系统,主要依靠宿主生物的肠道生存并发挥相应的功能.人体微生物群落组成和多样性与人体健康密切相关.本项研究中利用高通量测序和液相质谱联用分析了纳米塑料、重金属和塑化剂在单一污染和复合污染时对儿童肠道细菌群落组成、分子生态网络的拓扑学特征、氨基酸和短链脂肪酸产物的影响,是研究儿童微生物群落结构及其代谢功能响应的关键.研究结果表明,经不同污染物暴露后,儿童肠道菌群发生紊乱的程度也具有差异性.与PP+Cd、PP+Cd+DBP复合污染相比,单一污染的门属水平变化较小,可能是因为复合污染时微塑料会将Cd2+吸附在表面,共同作用于人体,对肠道菌群造成更严重的危害,其中NPs-PP与Cd联合暴露后,肠道菌群门水平数量显著减少,Firmicutes相对丰度增加,这与JIN等[18]在NPs对斑马鱼肠道菌群影响的研究结果一致.Firmicutes和Bacteroidetes是肠道微生物群中的2種主要细菌,病理学上,Firmicutes可诱导肥胖和肝脂肪变性,并促进TNF-α mRNA水平的升高,Firmicutes可能参与了非酒精性脂肪性肝病的发病机制,并且胆石病患者、多发性硬化症患者[19]Firmicutes的数量均显著增加.Firmicutes与Bacteroidetes的比值(F/B)与炎症状况密切相关,如炎症性肠病(IBD)和肥胖个体都存在较高的比值.本实验中,与对照相比PP、PVC、DBP、PP+Cd、PP+Cd+DBP实验组的F/B增加,从20.8分别增加至25.5、21.0、82.6、1 836.3、91.6;LOUIS等[20]为16名肥胖患者实施了一项减肥计划,结果显示肥胖患者的F/B比率高于健康组.然而与PP+Cd相比,PP+Cd+DBP复合污染时Firmicutes丰度相对略有降低,Bacteroidetes丰度及门水平数有所回升,可能是因为DBP与Cd共同存在下呈现出拮抗作用.
在属水平上,经污染物暴露后Bifidobacterium、链球菌属(Streptococcus)相对丰度降低.Bifidobacterium丰度降低会使小鼠体重增加、脂肪堆积并降低葡萄糖耐量,引起代谢紊乱[21],这些益生菌丰度的下降会破坏肠道微生态平衡,降低肠道免疫能力及健康程度.另外,不同污染物暴露后新增多尔氏菌属(Dorea)、Blautia,Ruminococcus、粪杆菌属(Faecalibacterium)、罗氏菌属(Roseburia),其丰度均与慢性疾病包括炎症性肠病、结肠癌、肥胖等密切相关[22].有实验研究了不同胃肠道疾病患者肠道菌群的变化,其中肠易激综合征会导致Faecalibacterium丰度升高,溃疡性结肠炎会使Blautia,Roseburia丰度升高,克罗恩病会使Ruminococcus丰度升高[23].PP+Cd、PP+DBP+Cd复合污染时,菌群多样性降低,优势菌群由Enterobacteriaceae变为Lactobacillus,Lactobacillus相对丰度增高至97.50%和83.45%.ZHAI等[24]研究表明乳酸菌对重金属镉具有强的耐受能力,且在二价金属Cd离子存在下,会促使细胞表面分泌物增多,细胞发生聚集形成生物膜.段莉阳等[25]的研究表明,在重金属和微塑料等胁迫条件下,具有相应耐受能力的微生物会与微塑料黏附,并得以富集生长.所以本实验中,Lactobacillus丰度升高可能是由于PP+Cd、PP+Cd+DBP共同污染时,Lactobacillus为抵御不良环境,与PP发生黏附,使细胞聚集形成生物膜,造成丰度升高,说明乳酸菌有较强的耐受性.总之,不同的污染物暴露下都会导致细菌群落在门属水平上的多样性和丰富度呈现明显差异,并且与单一污染相比复合污染的差异性更强,因此,肠道菌群对于维持宿主的健康非常重要.
网络分析与肠道菌群的多样性分析相比,网络分析更便于体现微生物之间的相互作用以及结构变化.在分子生态网络图中,正相关通常代表生态位一致性或共生关系,负相关代表竞争关系.在整个网络中,复合污染时Lactobacillus以竞争关系与周围细菌互作,Lactobacillus丰度的增加使肠道菌群多样性降低.本研究构建的两个分子生态网络中均为正相关关系占优势,表明整体上合作关系大于竞争关系,但复合污染更能促进微生物之间的共生关系.同时,与单一污染相比,复合污染具有较短的平均路径长度(1)和较高的平均聚类系数(0.928).平均路径长度表示物质、信息、能量在微生物之间的传递效率,平均聚类系数表示节点与其他节点的连接程度[26].由此说明,复合污染下微生物之间的关系更密切,网络图中节点之间的响应速度和传递效率更高,群落结构更易发生变化.复合污染的连接数和平均度均较高,说明复合污染下细菌分子生态网络中物种互作关系更复杂;单一污染的节点数较高,说明单一污染下物种更丰富.
腸道微生物群在氨基酸消化和吸收过程中起着至关重要的作用,氨基酸代谢的多样性可能会对宿主产生有益或不利的影响.Clostridium、Bacteroides、Bifidobacterium丰度与氨基酸代谢能力密切相关,而复合污染时它们的丰度降低,使氨基酸的分解与利用率下降,在人体肠道大量积累.研究表明,克罗恩病患者粪便中高水平的氨基酸,如丙氨酸、β-丙氨酸和苯丙氨酸,部分原因可能是这些患者的炎症引起的吸收不良,或反映了产生细菌的增加[27].微生物群衍生分子(如SCFAs)作为微生物群和宿主之间的重要分子信号或调节宿主代谢的代谢底物[28].复合污染时,氨基酸代谢产物丙酸、丁酸含量为0,丁酸作为肠道上皮细胞线粒体呼吸的主要能量来源,在组蛋白去乙酰化过程中起到重要作用,广泛影响肠道上皮细胞和免疫细胞的繁殖和代谢[29].戊酸含量大幅上升,可能是因为Lactobacillus,Ruminococcus丰度的升高.丁酸对糖尿病有较大的有益作用,并在构建肠道粘膜结构和肠道免疫屏障中起重要作用[30].NPs暴露会降低肠道中双歧杆菌的丰度,并显著降低肠道菌群中双歧杆菌/大肠杆菌(B/E)值,其中PP+Cd的B/E值为0,肠道定植能力明显减弱,影响肠道微生物的代谢功能,降低短链脂肪酸的含量.另外,由于本实验是将人体粪便细菌进行体外培养和暴露,缺少了肠道内环境的相互作用.所以,目前的结果对污染物人体健康效应的意义有限,没有办法直接外推至人体.关于NPs、Cd、DBP单一污染和复合污染对儿童肠道微生物群落结构的改变还需要更多的毒理学实验进一步研究.
4 结 论
本实验研究了NPs(PP、PE、PVC)、Cd、DBP单一污染和复合污染对儿童肠道细菌群落、短链脂肪酸含量和氨基酸代谢能力的影响.实验结果显示,一方面,在肠道菌群多样性分析上,不同处理均会使肠道菌群发生不同程度的紊乱,细菌群落的多样性和丰富度都呈现明显差异,且复合污染时差异更明显.单一污染时优势菌门为Proteobacteria、Firmicutes、Actinobacteria、Bacteroidetes,优势菌属主要为Enterobacteriaceae、Lactobacillus、Megasphaera、Bifidobacterium.而PP+Cd、PP+DBP+Cd复合污染时Firmicutes占比较大,乳杆菌显示出对污染物更强的耐受性.同时,在肠道菌群相互关系上,复合污染时也比单一污染时微生物互作关系更复杂.另一方面,在肠道微生物代谢分析上,纳米塑料与重金属、塑化剂复合污染时会影响氨基酸的代谢及短链脂肪酸的合成,氨基酸比例失衡使肠道黏膜受损,短链脂肪酸合成能力下降会影响营养物质的吸收及免疫防御能力,危害人体健康.
附录见电子版(DOI:10.16366/j.cnki.1000-2367.2023.06.20.0003).
参 考 文 献
[1] GALGANI F,HANKE G,WERNER S,et al.Marine litter within the European marine strategy framework directive[J].ICES Journal of Marine Science,2013,70(6):1055-1064.
[2]DAMIA B,YOLANDA P,AHMED H.Alfarhan,Microplastics:Detection in human samples,cell line studies,and health impacts[J].Environmental Toxicology and Pharmacology,2023,101:104204.
[3]GREEN T R,FISHER J,STONE M,et al.Polyethylene particles of a 'critical size' are necessary for the induction of cytokines by macrophages in vitro[J].Biomaterials,1998,19(24):2297-2302.
[4]BROWN D M,WILSON M R,MACNEE W,et al.Size-dependent proinflammatory effects of ultrafine polystyrene particles:a role for surface area and oxidative stress in the enhanced activity of ultrafines[J].Toxicology and Applied Pharmacology,2001,175(3):191-199.
[5]JIN Y X,LU L,TU W Q,et al.Impacts of polystyrene microplastic on the gut barrier,microbiota and metabolism of mice[J].The Science of the Total Environment,2019,649:308-317.
[6]WANG F Y,YANG W W,CHENG P,et al.Adsorption characteristics of cadmium onto microplastics from aqueous solutions[J].Chemosphere,2019,235:1073-1080.
[7]ZHANG S B,JIN Y X,ZENG Z Y,et al.Subchronic exposure of mice to cadmium perturbs their hepatic energy metabolism and gut microbiome[J].Chemical Research in Toxicology,2015,28(10):2000-2009.
[8]LIU Y H,LI Y H,LIU K Y,et al.Exposing to cadmium stress cause profound toxic effect on microbiota of the mice intestinal tract[J].PLoS One,2014,9(2):e85323.
[9]CHEN X,WANG J,XIE Y J,et al.Physiological response and oxidative stress of grass carp(Ctenopharyngodon idellus)under single and combined toxicity of polystyrene microplastics and cadmium[J].Ecotoxicology and Environmental Safety,2022,245:114080.
[10]CAMPANALE C,MASSARELLI C,SAVINO I,et al.A Detailed Review Study on Potential Effects of Microplastics and Additives of Concern on Human Health[J].International Journal of Environmental Research and Public Health,2020,17(4):1212.
[11]HWA H L,PENG F S,TING T T,et al.Monitoring phthalates in maternal and cord blood:implications for prenatal exposure and birth outcomes[J].Environmental Toxicology and Chemistry,2022,41(3):715-725.
[12]XIONG Z,ZENG Y Y,ZHOU J F,et al.Exposure to dibutyl phthalate impairs lipid metabolism and causes inflammation via disturbing microbiota-related gut-liver axis[J].Acta Biochimica et Biophysica Sinica,2020,52(12):1382-1393.
[13]ROTH G A,ABATE D,ABATE K H,et al.Global,regional,and national age-sex-specific mortality for 282 causes of death in 195 countries and territories,1980-2017:a systematic analysis for the Global Burden of Disease Study 2017[J].Lancet,2018,392(10159):1736-1788.
[14]ZHAO L L,DOU Q N,CHEN S Y,et al.Adsorption abilities and mechanisms of Lactobacillus on various microplactics[J].Chemosphere,2023,320:138038.
[15]向情儒,李文遠,冯涛.基于体外发酵的双孢菇膳食纤维及双孢菇粉对人体肠道菌群的调节作用[J].食品工业科技,2023,44(10):130-137.
XIANG Q R,LI W Y,FENG T.Regulating effects of dietary fiber and powder of Agaricus bisporus based on in vitro fermentation on human gut microbiota[J].Science and Technology of Food Industry,2023,44(10):130-137.
[16]符欢.人粪便中短链脂肪酸的快速分析方法建立和验证及其临床应用[D].长春:长春工业大学,2020.
FU H.Establishment and validation of rapid analysis methods of short-chain fatty acids in human feces and their clinical application[D].Changchun:Changchun University of Technology,2020.
[17]BARBERN A,BATES S T,CASAMAYOR E O,et al.Using network analysis to explore co-occurrence patterns in soil microbial communities[J].The ISME Journal,2012,6(2):343-351.
[18]JIN Y X,XIA J Z,PAN Z H,et al.Polystyrene microplastics induce microbiota dysbiosis and inflammation in the gut of adult zebrafish[J].Environmental Pollution,2018,235:322-329.
[19]COSORICH I,DALLA-COSTA G,SORINI C,et al.High frequency of intestinal TH17 cells correlates with microbiota alterations and disease activity in multiple sclerosis[J].Science Advances,2017,3(7):e1700492.
[20]LOUIS S,TAPPU R M,DAMMS-MACHADO A,et al.Characterization of the gut microbial community of obese patients following a weight-loss intervention using whole metagenome shotgun sequencing[J].PLoS One,2016,11(2):e0149564.
[21]WOTING A N,PFEIFFER N,HANSKE L,et al.Alleviation of high fat diet-induced obesity by oligofructose in gnotobiotic mice is independent of presence of Bifidobacterium longum[J].Molecular Nutrition & Food Research,2015,59(11):2267-2278.
[22]WANG X Q,ZHANG A H,MIAO J H,et al.Gut microbiota as important modulator of metabolism in health and disease[J].RSC Advances,2018,8(74):42380-42389.
[23]NISHINO K,NISHIDA A,INOUE R,et al.Analysis of endoscopic brush samples identified mucosa-associated dysbiosis in inflammatory bowel disease[J].Journal of Gastroenterology,2018,53(1):95-106.
[24]ZHAI Q X,YIN R J,YU L L,et al.Screening of lactic acid bacteria with potential protective effects against cadmium toxicity[J].Food Control,2015,54:23-30.
[25]段莉陽,张玉,任学敏,等.微塑料和镉复合污染对狼尾草根际土壤微生物群落结构和功能的影响[J].环境科学,2023,44(12):6973-6981.
DUAN L Y,ZHANG Y,REN X M,et al.Effect of microplastic and cadmium compound contamination on microbial community structure and function in the rhizosphere of plants[J].Environmental Science,2023,44(12):6973-6981.
[26]DENG Y,ZHANG P,QIN Y,et al.Network succession reveals the importance of competition in response to emulsified vegetable oil amendment for uranium bioremediation[J].Environ Microbiol,2016,18(1):205-218.
[27]SANTORU M L,PIRAS C,MURGIA A,et al.Cross sectional evaluation of the gut-microbiome metabolome axis in an Italian cohort of IBD patients[J].Scientific Reports,2017,7(1):9523.
[28]张小芳.利用体外发酵模型研究人体肠道中氨基酸代谢[D].金华:浙江师范大学,2020.
[29]庞博.发芽糙米对T2DM患者支链氨基酸和短链脂肪酸的影响研究[D].哈尔滨:哈尔滨工业大学,2019.
PANG B.Effect of germinated brown rice on branched chain amino acids and short chain fatty acids in T2DM patients[D].Harbin:Harbin Institute of Technology,2019.
[30]MORRISON D J,PRESTON T.Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J].Gut Microbes,2016,7(3):189-200.
Effect of combined exposure of nanoplastics-heavy metal-plasticizer on gut microbiota and metabolism in children
Dou Qingnan1, Zhao Lili1, Ji Hanxuan2, Wang Yibin1, Chen Wanrong1, Sun Xiaohan1, Yao Guoqin1, Ma Tengyun1
(1. College of Life Science, Henan Normal University, Xinxiang 453007, China; 2. Whole-process Teaching Base, Xinxiang Medical College, Xinxiang 453003, China)
Abstract: [Objective] To explore the effects of nano-plastics(NPs), cadmium(Cd) and dibutyl phthalate(DBP) on intestinal flora diversity, amino acid metabolism and short-chain fatty acid content in children. [Methods] The effects of single and combined pollution of nano-plastics(polypropylene,PP), Cd and DBP on the contents of short-chain fatty acids and amino acids in intestinal bacterial communities and intestinal microbial metabolites in children were analyzed by high throughput sequencing technology of 16S rRNA and high performance liquid chromatogen-mass spectrometry(LC-MS/MS). [Results] The high-throughput test results showed that, compared with the control, at the phylum genus level, the dominant bacteria with single pollution had no significant change, and the diversity of the dominant bacteria with PP+Cd, PP+DBP+Cd combined pollution significantly decreased. The results of LC-MS/MS test showed that the amino acid content of intestinal microbial metabolites decreased to varying degrees after exposure to NPs and DBP, while the content of most amino acids increased significantly after Cd, PP+Cd, PP+Cd+DBP treatment. The content of butyric acid and valerate also changed. [Conclusion] Compared with the single pollutant treatment, the intestinal microbial disorder is stronger after exposure to nano-plastics-related complex pollutants, and different pollutant treatments could affect the amino acid metabolism and SCFAs production of intestinal microorganisms. Intestinal flora is closely related to human health. It is of great significance to explore the changes of intestinal flora and metabolic function under the influence of NPs, Cd and DBP, and to evaluate the hazards and risks of single exposure and combined exposure to NPs, Cd and DBP from the level of intestinal flora.
Keywords: nano-plastics; cadmium; dibutyl phthalate; gut microbiota; short-chain fatty acids; amino acid
[責任编校 刘洋 杨浦]
附 录

