银丹心脑通软胶囊联合双联抗血小板方案治疗急性脑梗死的临床研究
陈红霞,高晓红,张玉秋
1.北京大学首钢医院 药剂科,北京 100041
2.北京大学首钢医院 神经内科,北京 100041
3.清华大学玉泉医院(清华大学中西医结合医院)药剂科,北京 100049
急性脑梗死是指因脑血管血流不畅或受阻,引起脑组织缺血缺氧,进而造成神经功能受损,并表现出意识障碍、吞咽障碍、智力障碍及偏瘫等,该病现已成为导致中老年人群致残及致死的主要心脑血管疾病之一[1]。临床治疗急性脑梗死的关键在于即刻开通闭塞血管,使脑血管梗死区域内的血流恢复供应,从而减轻或改善脑组织损伤[2]。抗血小板是预防或治疗急性脑梗死的基石,阿司匹林联合氯吡格雷能从不同途径发挥抗血小板作用。血管内介入是目前临床治疗急性脑梗死的一项重要措施,其借助动脉溶栓、拉栓及支架置入等方式去除血栓,恢复脑血管灌注,进而改善患者神经功能情况。然而,上述措施在临床治疗实践中依然有各种原因致使复流缓慢或无复流,导致临床疗效不理想[3]。中药近几年来被广泛用于治疗急性脑梗死,诸多研究报道,中药通过行气止痛、活血化瘀等功效来改善脑循环、减少神经元受损,从而加速脑神经功能恢复[4-5]。银丹心脑通软胶囊是一种治疗脑血管疾病的常用中药制剂,具有抗血小板聚集、改善血流流变学、提高组织缺氧耐受度及减缓动脉粥样硬化等作用[6]。基于此,本研究针对银丹心脑通软胶囊联合双抗血小板药治疗急性脑梗死的疗效进行分析,为临床治疗提供参考依据。
1 资料与方法
1.1 一般临床资料
采用样本量粗略估算法对样本数量进行估算,按照变量数的1~5 倍取样本量,本研究共纳入5 个变量,每个变量取20~25 个样本量,考虑20%脱落率,共取样约100 例。以2020 年1 月—2022 年1月在北京大学首钢医院行血管内介入治疗的100 例急性脑梗死患者作为研究对象,其中男53 例,女47例;年龄46~70 岁,平均年龄(59.30±3.06)岁;身体质量指数21~26 kg/m2,平均身体质量指数(23.20±0.36)kg/m2;梗死部位前循环及后循环分别有55、45 例。本研究经北京大学首钢医院伦理委员会审批(审批号YC20201063)。
1.2 纳入及排除标准
纳入标准:脑梗死诊断符合《缺血性卒中基层诊疗指南(2021 年)》[7]中的诊断标准,既往未有神经系统疾病,首次发病,拟采取血管介入术治疗。
排除标准:伴有凝血功能异常者,合并脑血管畸形、脑出血、脑外伤及脑内肿瘤者,既往与认知功能异常及精神障碍性疾病者,并发心肝肾严重脏器功能不全者,有介入治疗及对本研究药物有禁忌者。
1.3 药物
阿司匹林肠溶片由拜耳医药保健有限公司生产,规格100 mg/片,产品批号20191014、20 200620;硫酸氢氯吡格雷片由赛诺菲(杭州)制药有限公司生产,规格75 mg/片,产品批号20191201、20 200511;银丹心脑通软胶囊由贵州百灵企业集团制药股份有限公司生产,规格0.4 g/粒,产品批号20191105、20200415。
1.4 分组及治疗方法
按随机数字表法将患者分为对照组和治疗组,每组各50 例。对照组患者男性24 例,女性26 例;年龄46~70,平均年龄(59.23±3.12)岁;身体质量指数21~26 kg/m2,平均身体质量指数(23.11±0.42)kg/m2;梗死部位前循环及后循环分别有30、20 例。对照组患者男性29 例,女性21 例;年龄46~70 岁,平均年龄(59.46±3.00)岁;身体质量指数21~26 kg/m2,平均身体质量指数(23.31±0.22)kg/m2;梗死部位前循环及后循环分别有25、25 例。两组患者一般资料间比较差异无统计学意义,具有可比性。
两组患者均采取血管介入治疗以及同时进行降脂、控制血糖血压、营养神经、预防并发症等常规治疗。对照组患者口服阿司匹林肠溶片,100 mg/次,1 次/d,同时口服硫酸氢氯吡格雷片,75 mg/次,1 次/d。治疗组患者在对照组基础上口服银丹心脑通软胶囊,3 粒/次,3 次/d。两组患者均持续治疗2 周。
1.5 疗效评价标准[8]
治愈:治疗后患者病残程度为0 级,NIHSS 评分降低程度≥90%;显效:治疗后患者病残程度为1~3 级,45%≤NIHSS 评分降低程度<90%;好转:治疗后患者神经功能改善,18%≤NIHSS 评分降低程度<45%;无效:治疗后神经功能恶化,NIHSS 评分降低程度<18%。
1.6 观察指标
1.6.1 NIHSS 和Barthel 指数评分 比较两组治疗前后NIHSS 和Barthel 指数评分,NIHSS 量表评分共42 分,评分越高提示神经功能受损越严重。Barthel 指数评分满分100 分,评分越高提示患者日常生化能量越强[9]。
1.6.2 氧化应激水平 比较两组治疗前后过氧化脂质(LPO)、丙二醛(MDA)。分别抽取患者治疗前后晨起空腹肘静脉血4 mL,离心(离心半径10 cm,3 000 r/min)10 min 后吸取上清液备存待检。采用酶联免疫吸附法测定LPO、MDA 水平,检测试剂盒购于上海江莱生物技术有限公司。
1.6.3 miR-449a 和miR-19b-3p 水平 采用实时荧光定量聚合酶链反应法(qT-PCR)对miR-449a、miR-19b-3p 进行测定,首先使用Trizo 试剂盒对总RNA进行提取,经紫外分光光度计对RNA 浓度检测合格情况进行确认,随后利用反转录试剂盒合成cDNA,然后通过qT-PCR 扩增,选用U6 作为内参,引物序列:miR-449a 下游引物5’-TTTCATAGGCAC CATCACTTTAC-3’;上游引物5’-CACCTTTCTCC CTTTCCCTTACTCTCC-3’;miR-19b-3p 下游引物5’-TATGGTTGTTCAGCTCTGTCTC-3’,上游引物5’-TGTCATAATCACTGTGCAAATCC-3’内参U6下游引物5’-AACGCTTCACGAATTTGCGTF’,上游引物5’-CTCGCTTCGGCAGCACA-3’;反应程序:94 ℃预变性3 min,95 ℃变性15 s,72 ℃延伸30 s,共40 个循环,通过2-ΔΔCt计算miR-19b-3p和miR-449a 相对表达量。
1.7 不良反应观察
统计两组不良反应发生率,包括胃肠道不适、皮疹、腹痛、腹胀等。
1.8 统计学方法
通过SPSS 20.0 软件分析处理数据,计数资料以百分比表示,采用χ2检验,计量资料均符合正态分布,以表示,采用t检验。
2 结果
2.1 两组临床疗效比较
治疗后,与对照组比较,在总有效率方面,治疗组患者明显升高(96.00%vs84.00%,P<0.05),见表1。

表1 两组临床疗效比较Table 1 Comparison on clinical efficacy between two groups
2.2 两组NIHSS 和Barthel 指数评分比较
治疗后,两组患者NIHSS 评分明显低于治疗前,而Barthel 指数评分明显高于治疗前(P<0.05);且治疗组患者NIHSS 和Barthel 指数评分明显好于对照组(P<0.05),见表2。
表2 两组NIHSS 评分和Barthel 指数评分比较( )Table 2 Comparison on scores of NIHSS and Barthel index between two groups ()
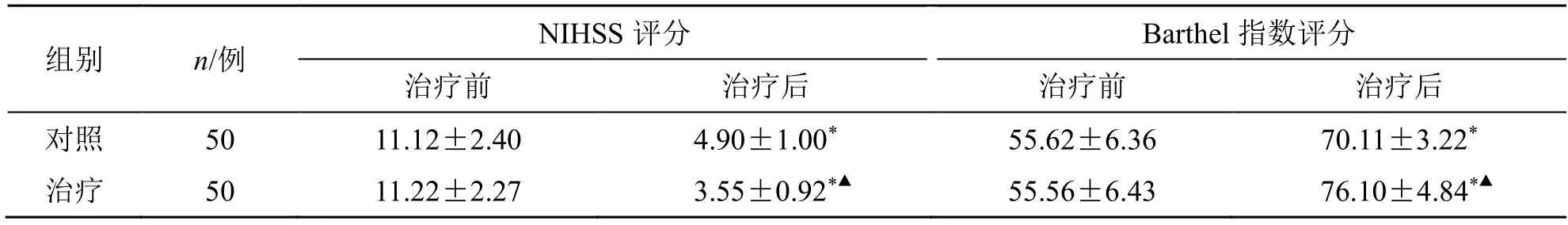
表2 两组NIHSS 评分和Barthel 指数评分比较( )Table 2 Comparison on scores of NIHSS and Barthel index between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.3 两组氧化应激水平比较
治疗后,两组患者LPO 和MDA 水平明显低于治疗前(P<0.05),且治疗组患者LPO 和MDA 水平均明显低于对照组(P<0.05),见表3。
表3 两组氧化应激水平比较( )Table 3 Comparison on oxidative stress levels between two groups ()

表3 两组氧化应激水平比较( )Table 3 Comparison on oxidative stress levels between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.4 两组miR-449a 和miR-19b-3p 水平比较
治疗后,两组miR-19b-3p 表达水平明显低于治疗前,而miR-449a 表达水平明显高于治疗前(P<0.05),且治疗组患者miR-19b-3p 和miR-449a 表达水平明显好于对照组(P<0.05),见表4。
表4 两组miR-449a 和miR-19b-3p 表达水平比较( )Table 4 Comparison on the expression levels of miR-449a and miR-19b-3p between two groups ()

表4 两组miR-449a 和miR-19b-3p 表达水平比较( )Table 4 Comparison on the expression levels of miR-449a and miR-19b-3p between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.5 不良反应
两组患者治疗期间未发生胃肠道不适、皮疹、腹痛、腹胀等药品不良反应。
3 讨论
急性脑梗死是临床常见的一种心脑血管疾病,当脑血管狭窄或闭塞后,缺血半暗带会发生一系列级联反应,导致神经功能受损,所以临床治疗应以恢复脑血管血流,改善神经细胞缺血缺氧,及减轻神经功能损伤为原则[10]。现今血管介入是针对急性脑梗死的一种主要治疗措施,通过机械取栓或支架置入等方式去除血栓,恢复闭塞血管再通[11]。大量研究发现,尽管血管介入取栓率及血管再通率均较高,然而容易受到各种因素影响,其中40%患者介入后存在预后不理想情况,甚至威胁患者生命安全,所以在急性脑梗死介入后需采取有效治疗,以改善患者血流供应,是目前临床研究焦点[12-13]。
随着医学技术快速发展,临床学者意识到中医中药具有不良反应轻、安全性高及疗效佳等优点。中医认为,急性脑梗死属于“卒中”“中风”范畴,常因饮食不节、过劳、气血亏虚等引起血瘀、脉络阻塞,而痰浊内生、经行不畅,则上扰清窍,最终引发中风,故治疗以行气通络、活血化瘀为主要原则[14]。银丹心脑通软胶囊主要组分为山楂、三七、大蒜素、银杏叶、灯盏细辛、绞股蓝、丹参、艾片。其中银杏叶能止痛活血,三七可定痛活血,丹参能行气活血化瘀,灯盏细辛能清热凉血,大蒜能导滞行气,艾叶能醒神开窍,全方配伍可起到止痛行气、活血化瘀的功效[15]。有文献报道,银丹心脑通胶囊具有抗动脉粥样硬化、调节微循环、抗缺血再灌注及抗氧化等作用,被广泛用于心脑血管类疾病[16]。
有研究报道,卫生研究院卒中量表(NIHSS)及Barthel 指数是临床评估急性脑梗死患者神经功能的主要量表[17],过氧化脂质(LPO)、丙二醛(MDA)、miR-19b-3p 及miR-449a 可能参与急性脑梗死的发生与发展[18-19]。LPO 是机体内有较强活性的脂类自由基,可引起物质代谢、细胞能量代谢异常,其含量多少可有效反映脑组织细胞氧化损伤程度。MDA 是一种清除氧自由基的金属蛋白酶,能有效清除氧自由基,并抑制LPO 对脑组织细胞带来的损伤,进而起到保护脑细胞的作用[20]。本研究结果显示,治疗组患者治疗总有效率、神经功能及日常生活能力好转程度,氧化应激水平减轻程度均较对照组明显改善,两组均未见不良反应,其提示银丹心脑通软胶囊有助于提高改善患者神经功能及日常生活能力,提升临床疗效,且未额外增加患者不良反应。
研究发现,miRNA 表达谱在急性脑梗死患者中改变较为明显,其与神经系统损伤、发育及修复具有显著相关性[21-22]。miR-19b-3p 是一种可调控基因表达的非编码RNA,其可促进急性脑梗死的发生与发展,当局部脑组织缺血缺氧时,缺氧诱导因子1-α 水平会显著增加,并靶向上调miR-19b-3p 表达,随着缺血缺氧程度加剧,后者表达水平也明显上调[23]。miR-449a 位于Cdc20b基因,是目前研究心脑血管疾病的热点,当该基因低表达或缺失时,引起神经细胞增殖或凋亡加速,诱导脑组织炎性反应,最终导致脑组织受损[24]。文献报道,急性脑梗死患者miR-19b-3p 及miR-449a 存在异常表达,两者联合能有效预测介入取栓患者预后不良[25]。本研究还发现,治疗后两组患者miR-19b-3p 下调及miR-449a 上调水平均明显高于对照组,提示银丹心脑通软胶囊通过调节miR-449a、miR-19b-3p 表达来发挥治疗急性脑梗死的作用。这可能与银丹心脑通软胶囊的剂型有关,其具有比颗粒剂、胶囊、片剂起效快,稳定性高及生物利用度佳等特点[26]。此外,银丹心脑通有较强的抗炎性作用,其中绞股蓝、大蒜能促进受损细胞修复,进而调节机体miR-449a、miR-19b-3p表达[27]。
综上所述,银丹心脑通软胶囊联合双联抗血小板在急性脑梗死介入术后中具有较高疗效和安全性,有助于调节miR-449a、miR-19b-3p 表达,减轻患者氧化应激水平,改善神经功能受损及提高日常生活能力。
利益冲突所有作者均声明不存在利益冲突

