基于蛋白质组学技术对植物乳杆菌YP36细菌素的抑菌机制研究
王 婷,来欢欢,赵 微,3,崔美林,3,张秀红,3*
(1.山西师范大学 食品科学学院,山西 太原 030032;2.山西师范大学 生命科学学院,山西 太原 030032;3.山西省微生物应用技术工程研究中心,山西 太原 030032)
细菌素是细菌核糖体产生的一类具有抑菌活性的蛋白类或多肽类物质,细菌素能赋予产生菌生存优势[1-2]。大多数乳酸菌都能产生细菌素[3],细菌素也是益生菌筛选常用的标准之一,在食品工业中作为生物防腐剂用于食物保鲜[4]。由于大多数乳酸菌产生的细菌素成分及性质不完全相同,其抑菌机制也不尽相同,如有的细菌素与细胞膜结合,在细胞膜上聚集,形成孔洞,破坏细胞膜的完整性,导致胞内物质泄露[5];有的细菌素的作用位点是细胞壁(它能抑制细胞壁中肽聚糖的生物合成[6])、革兰氏阴性细菌外膜,有的细菌素干扰脱氧核糖核酸(deoxyribonucleic acid,DNA)、核糖核酸(ribonucleic acid,RNA)和蛋白质代谢[7];有的细菌素对敏感菌的抑菌作用还与其细胞内能量代谢及糖类转运系统等部分相关蛋白表达有关[8]。植物乳杆菌(Lactobacillus plantarum)YP36是从清香型白酒酒醅中分离的乳酸菌,其细菌素对指示菌金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)具有明显抑制效果,对清香酒醅中酵母菌无抑制作用,在4~121 ℃范围内表现出热稳定性,pH稳定性范围在2.0~4.0之间,对酒醅正常发酵有重要的作用[9]。
蛋白质组学是以蛋白质为研究对象,高通量系统化解析蛋白质组成、功能及相互作用的科学。蛋白质是生命活动的承担者,蛋白质组学能够从蛋白水平上揭示研究对象的生理状态、病理状态等过程的作用机制[10]。目前蛋白质组学技术主要应用于细胞、组织和体液中蛋白质表达差异的分析[11],但是利用该技术研究酒醅来源乳酸菌细菌素作用机制尚未报道。
本研究中采用高效液相色谱-串联质谱(highperformance liquid chromatography-mass spectrometry/mass spectrometry,HPLC-MS/MS)联用非标记定量蛋白质组学技术[12]对细菌素处理前后植物乳杆菌SL32-2表达的差异表达蛋白进行鉴定,并采用基因本体论(Gene Ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析对差异蛋白进行代谢功能分析,旨在为乳酸菌在白酒酿造过程中作用机制提供新的认识。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌(Lactobacillus plantarum)SL32-2、YP36(产细菌素):本实验室保存。
1.1.2 试剂
K2HPO3、KH2PO3:天津科密欧化学试剂有限公司;甘油、溴酚蓝、牛血清白蛋白(bovine serum albumin,BSA):生物工程(上海)股份有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、尿素(Urea)、Tris、二硫苏糖醇:伯乐生命医学产品(上海)有限公司;NH4HCO3、三氟乙酸、EmporeTM固相萃取柱(C18,7 mm/3 mL):西格玛奥德里奇(上海)贸易有限公司;二辛可宁酸测定(bicinchoninic acid assay,BCA)定量试剂盒:上海碧云天生物技术有限公司;KH2PO4、KCl、HCl:国药集团化学试剂有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS培养基[13]:葡萄糖20 g,蛋白胨10 g,牛肉浸粉5 g,酵母粉4 g,MgSO4·7H2O 0.5 g,MnSO4·4H2O 0.25 g,柠檬酸二铵2 g,CH3COONa·3H2O 5 g,K2HPO4·7H2O 2 g,吐温-80 1 mL,1 000 mL。121 ℃条件下灭菌20 min。
1.2 仪器与设备
GI80DS型高压灭菌锅:致微(厦门)仪器有限公司;ZHJH-C1112B型双人超净工作台、ZXMP-R1230型恒温恒湿培养箱:上海智城分析仪器制造有限公司;D-37520型低速冷冻离心机、Q Exactive型质谱、Easy nLC型色谱仪、MP Fastprep-24型匀浆仪:赛默飞世尔科技(中国)有限公司;AKTA Purifier 100型纯化仪、EPS601型电泳仪:通用电气医疗生物科学有限公司;JY92-II型超声破碎仪:宁波新芝生物科技股份有限公司;QT-1型Votex振荡器:上海琪特分析仪器有限公司。
1.3 方法
1.3.1 菌种活化与细菌素制备
菌株活化:将甘油保藏的乳酸菌菌株YP36接种于MRS培养基中,于37 ℃静置培养24 h,待乳酸菌菌株YP36活化3代以后,储存于4 ℃冰箱内备用。
细菌素的制备:将菌株YP36活化后,以3%(V/V)的接种量接种到MRS液体培养基中,37 ℃培养24 h后,12 000 r/min离心10 min,将上清液通过0.22 μm的微孔滤膜过滤,所得滤液为细菌素粗品,保存在4 ℃下备用[14]。
1.3.2 细菌素处理前后发酵液样品的制备
将活化后的植物乳杆菌SL32-2以2%(V/V)接种量接种于MRS培养基中,37 ℃静置培养4 h,以该发酵液为对照(CK)。活化后的植物乳杆菌SL32-2以2%(V/V)接种量接种于含有10%细菌素粗品的MRS培养基,37 ℃培养4 h的发酵液为处理组样品(B)。将对照和处理样品分别用缓冲液清洗3次后,液氮中处理30 min,于-80 ℃冰箱备用。
1.3.3 蛋白质提取和肽段酶解
样品采用SDT裂解液(4% SDS、100 mmol/L Tris/HCl pH 7.6、0.1 mol/L二硫苏糖醇(dithiothreitol,DTT))提取蛋白质[15],然后用二辛可宁酸测定(bicinchoninic acid,BCA)法[16]进行蛋白质定量。每个样品取适量蛋白质采用过滤器辅助蛋白质组制备(filter aided and proteome preparation,FASP)方法[17]进行胰蛋白酶酶解,采用C18 Cartridge对肽段进行脱盐,肽段冻干后加入40 μL 0.1%甲酸溶液复溶,肽段定量[18]。
1.3.4 HPLC-MS/MS数据采集及蛋白质定量
采用高效液相色谱(HPLC)法液相系统进行样品分离。样品由自动进样器上样到上样柱,经过分析柱分离,流速为300 μL/min。流动相为含0.1%甲酸的水溶液(A液)和含0.1%甲酸的84%乙腈(B液)。用95%A液平衡[19],上样柱为nanoViper C18色谱柱(100 μm×2 cm),分析柱为C18-A2 Thermo sclentific EASY柱(75 μm×3 cm)。样品分离后用Q-Exactive质谱仪进行一级、二级质谱数据采集[20]。检测方式为正离子,母离子扫描范围为300~1 800 m/z,在200 m/z时,一级质谱分辨率为70 000,二级质谱分辨率为175 000[21]。
用MaxQuant 1.6.14软件通过MS和MS/MS搜索肽段母离子及其理论碎片离子的信号来确认该肽段及相关蛋白是否存在于样本中,并获得未知肽段、蛋白及翻译后修饰信息。采用非标记定量(label free quantification,LFQ)对鉴定蛋白进行相对定量[22]。
1.3.5 生物信息学分析方法
用Pfam数据库进行蛋白质结构域分析。对目标蛋白质利用基本局部比对搜索工具(basic localalignmentsearchtool,BLAST)2GO进行GO(Gene ontology,http://geneontology.org/)注释,包括序列比对、GO条目提取、GO注释和Inter-ProScan补充注释等4个步骤;利用KAAS(KEGG automatic annotation server)软件进行KEGG(https://www.genome.jp/kegg/)通路注释;采用Fisher精确检验,比较目标蛋白质集合和总体蛋白质集合中各个GO分类(或KEGG通路或Domain)的分布情况,以进行富集分析[23]。
2 结果与分析
2.1 细菌素处理前后植物乳杆菌SL32-2鉴定蛋白的分布
采用韦恩图分析细菌素处理前后植物乳杆菌SL32-2鉴定蛋白分布情况,结果见图1。由图1可知,处理前鉴定的蛋白质共有1 999个,处理后鉴定的蛋白质共有2 005个,其中处理前后共有蛋白质为1 905个。
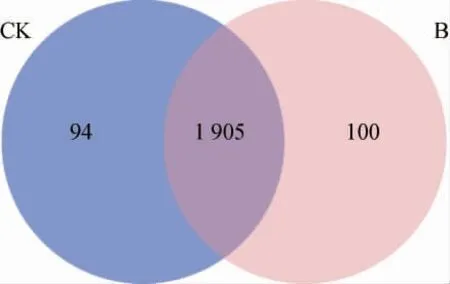
图1 细菌素处理前后植物乳杆菌SL32-2中鉴定蛋白韦恩图Fig. 1 Venn diagram of identified protein from Lactobacillus plantarum SL32-2 before and after bacteriocin treatment
2.2 细菌素处理前后植物乳杆菌SL32-2差异表达蛋白分析
对细菌素处理后植物乳杆菌SL32-2差异表达蛋白分析时,以表达倍数(fold change,FC)>2.0(上调>2.0倍或下调<0.5倍)且P值<0.05为标准,得到细菌素处理后上调、下调蛋白质数目,同时还做了“有无”差异比较,即分析只在细菌素处理前或处理后出现的蛋白质,结果见图2。
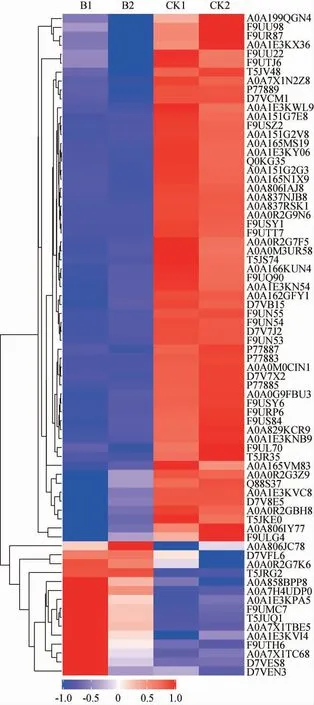
图2 细菌素处理前后植物乳杆菌SL32-2差异表达蛋白热图Fig. 2 Heat map of differentially expressed protein of Lactobacillus plantarum SL32-2 before and after bacteriocin treatment
由图2可知,与细菌素处理前相比,细菌素处理后显著下调的蛋白质有59个,在细菌素处理后消失的蛋白质有26个;有33个蛋白在细菌素处理后开始表达,显著上调的蛋白质只有15个,这一结果表明细菌素处理后植物乳杆菌SL32-2下调和消失的蛋白数目较多,菌体整体代谢减弱。
进一步对细菌素处理前后差异表达蛋白种类分析,结果见表1。由表1可知,在细菌素处理前CK中鉴定到的蛋白、细菌素处理后鉴定到的表达上调、下调的蛋白中以及细菌素处理后才鉴定到的蛋白中,占比最大的是酶类,分别占65.38%、40%、72.88%、33.33%,由此可知,细菌素处理后会影响到细菌整体的代谢网络,而不只是简单的细菌素成分的作用。其次是转运蛋白,如能够利用腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)水解产生的能量将结合的氨基酸跨膜转运的寡肽ABC转运蛋白[24]等,以及将各种糖及其衍生物进行磷酸化然后运输到胞内的磷酸转移酶系统(phosphotransferase system,PTS)中的糖转运蛋白[25],表明细菌素处理后不仅影响细胞内的物质流,还能影响胞外营养物质到胞内,以及胞内各种功能蛋白的运输。除此之外还有转录调节因子、独有蛋白和未知蛋白。

表1 细菌素处理前后植物乳杆菌SL32-2差异表达蛋白分类Table 1 Classification of differentially expressed proteins from Lactobacillus plantarum SL32-2 before and after bacteriocin treatment
2.3 细菌素处理前后植物乳杆菌SL32-2差异表达蛋白的GO功能分析
为了全面深入了解细菌素处理后差异蛋白在生物体中的功能、定位及参与的生物学途径,通过GO富集分析对蛋白质的功能分类进行注释。GO功能注释主要分为3类:生物过程(biological process,BP),分子功能(molecular function,MF)和细胞组分(cellular component,CC)。以P值<0.05为筛选标准,对用细菌素处理前后菌株SL32-2差异表达蛋白的GO功能富集分析表明,显著性差异表达蛋白所涉及的功能条目共有99条,其中属于生物过程的有78条,属于分子功能的有21条,其中BP的前20条和MF的前10条功能条目见图3。由图3可知,BP的前20条涉及的功能有核苷、核苷酸生物合成及代谢;糖基化合物合成、酒精、有机羟基化合物、多元醇代谢相关过程,且大多与嘧啶核苷及核苷酸生物合成和代谢相关;MF的前10条涉及的功能大多与糖类利用相关。

图3 细菌素处理前后植物乳杆菌SL32-2差异表达蛋白基因本体富集分析Fig. 3 Gene Ontology enrichment analysis of differentially expressed protein of Lactobacillus plantarum SL32-2 before and after bacteriocin treatment
富集因子为该代谢路径下差异蛋白数目与所有注释到该路径蛋白数目的比值,代表富集到目标路径的蛋白数占比,值越大表示富集的程度越大。在对植物乳杆菌SL32-2细菌素处理后差异表达蛋白GO分析时发现,5条与细胞壁代谢相关的BP条目:(GO:0016998)细胞壁大分子分解代谢过程、(GO:0006027)糖胺聚糖分解代谢过程、(GO:0009253)肽聚糖分解代谢过程、(GO:0006026)氨基聚糖分解代谢过程及(GO:0008152)代谢过程都显著性富集到两个相同的蛋白A0A2S3U5Q5、A0A7X1TC68。这两个蛋白涉及的MF条目有GO:0004553水解酶活(水解O-糖基化合物)、GO:0016798水解酶活性(作用于糖苷键)、GO:0003824催化活性,具体见表2。

表2 细菌素处理前后植物乳杆菌SL32-2细胞壁代谢相关蛋白基因本体富集分析Table 2 Gene Ontology enrichment analysis of cell wall metabolism related proteins from Lactobacillus plantarum SL32-2 before and after bacteriocin treatment
A0A2S3U5Q5被鉴定为溶菌酶(putative autolytic lysozyme),是细菌素处理新诱导表达的,可以裂解细胞壁肽聚糖N-乙酰胞壁酸和N-乙酰葡糖胺之间的β-1,4-糖苷键[26],破坏细胞壁的完整性,达到抑菌目的。A0A7X1TC68糖苷水解酶(glycosyl hydrolase family 25,GH25)则是在细菌素处理后表达上调,它属于GH25家族蛋白,具有溶菌酶活性。溶菌酶是一种抗菌酶,其本质是一种糖苷水解酶,基于序列相似性的糖基水解酶分类系统已经定义了85个不同的家族[27],GH25仅包含一种具有已知活性的酶,该酶主要水解肽聚糖中N-乙酰胞壁酸和N-乙酰-D-氨基葡萄糖残基间的β-1,4-糖苷键。说明细菌素处理使乳酸菌表达更多具有溶菌酶活性的蛋白,降解原有细胞壁,使细胞壁不完整,不能维持正常生长,达到抑菌的目的。
2.4 细菌素处理前后差异表达蛋白质的KEGG代谢通路分析结果
将细菌素处理后,植物乳杆菌SL32-2差异表达蛋白进行KEGG富集分析,结果共涉及到53段代谢通路,其中显著性富集到KEGG途径的有14条(P<0.05),其富集分析结果见图4。
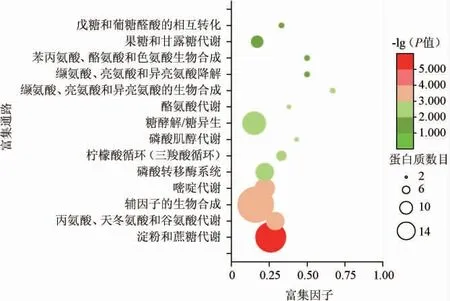
图4 细菌素处理前后植物乳杆菌SL32-2差异表达蛋白京都基因与基因组百科全书富集分析Fig. 4 Kyoto Encyclopedia of Genes and Genomes enrichment analysis of differentially expressed protein of Lactobacillus plantarum SL32-2 before and after bacteriocin treatment
由图4可知,图中横坐标为富集因子,纵坐标表示富集程度排名靠前的代谢路径。每个点的大小表示富集到该GO条目的蛋白的个数,点越大表示富集到该GO条目的蛋白越多,反之则越少[28]。颜色梯度代表lg(P值)的大小,颜色越接近红色代表P值越小,对应代谢通路富集度的显著性水平越高。在富集到的14条途径中,属于碳代谢的有6条,即淀粉和蔗糖代谢、糖酵解/糖异生、柠檬酸(三羧酸)循环、磷酸肌醇代谢、果糖和甘露糖代谢,以及戊糖和葡糖醛酸的相互转化;氨基酸代谢有5条,即丙氨酸、天冬氨酸和谷氨酸代谢、色氨酸代谢、缬氨酸、亮氨酸和异亮氨酸的合成与降解;苯丙氨酸、酪氨酸和色氨酸的生物合成;核苷酸代谢1条,核酸代谢1条,跨膜途径1条。
细菌素处理后植物乳杆菌SL32-2差异表达蛋白质的6段代谢途径相关酶表达受到影响,其受影响的碳代谢及嘧啶代谢途径结果见图5。
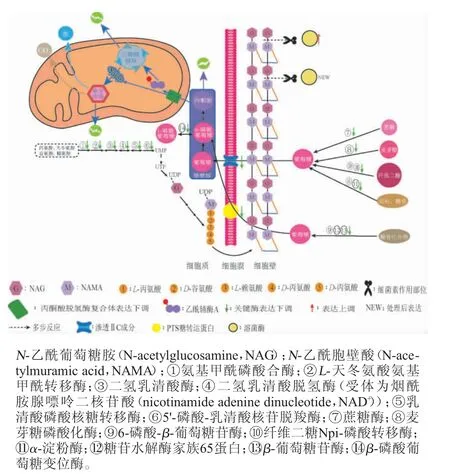
图5 细菌素处理后植物乳杆菌Sl32-2差异表达蛋白受影响的碳代谢及嘧啶代谢途径Fig. 5 Carbon metabolism and pyrimidine metabolism pathway affected by differentially expressed protein of Lactobacillus plantarum SL32-2 after bacteriocin treatment
由图5可知,影响最显著的是碳源吸收阶段的淀粉和蔗糖代谢,如淀粉降解需要的α-淀粉酶[EC 3.2.1.1]、麦芽糖磷酸化酶[EC 2.4.1.8];蔗糖降解需要的蔗糖酶[EC 3.2.1.20];以及胞外纤维二糖降解需要的纤维二糖Npi-磷酸转移酶[EC 2.7.1.205]和6-磷酸-β-葡萄糖苷酶[EC 3.2.1.86],另外还有一些糖苷酶,如糖苷水解酶家族65蛋白(A0A166KUN4,A0A0G9FBU3)、6-磷酸-β-葡萄糖苷酶(F9URP6,A0A0 R2GBH8、A0A151G2V8),β-葡萄糖苷酶(A0A162GFY1)细菌素处理后这些酶表达全部下调,最终导致D-葡萄糖的生成减少。碳源吸收阶段渗透IIC成分(F9UU22);磷酸转移酶系统(phosphotransferase system,PTS)糖转运蛋白(T5JR35)显著性下调,导致进入细胞的葡萄糖减少。还有β-磷酸葡萄糖变位酶(F9US84)下调,β-磷酸葡萄糖变位酶可将葡萄糖-6-磷酸转化成葡萄糖-1-磷酸,葡萄糖-1-磷酸是二磷酸尿苷(uridine diphosphate,UDP)-葡萄糖的前体,而UDP-葡萄糖是多种代谢途径的糖基供体,如细胞壁等。β-磷酸葡萄糖变位酶的下调可能影响细胞形态,抑制细菌生长[29]。
糖酵解/糖异生是糖的分解代谢/合成代谢重要阶段,共检测到9个显著差异蛋白,其中8个均显著下调,只有1个显著上调。8个下调蛋白中,有1个是从纤维二糖得到葡萄糖的β-葡萄糖苷酶,3个是将磷酸二糖释放葡萄糖的6-磷酸-β-葡萄糖苷酶(F9URP6,A0A0R2GBH8、A0A151G2V8);还有4个是不同底物脱氢酶或脱氢酶的组分。糖酵解是产能较少的生物氧化过程,脱氢酶或组分表达下调使糖酵解产生更少的能量,能显著降低碳源代谢,反过来也会影响糖的异生。该阶段唯一上调的是醛醇脱氢酶。细菌中有醇醛脱氢酶能使乙醇和乙醛脱氢,是一种双功能酶,而且是乙醇厌氧发酵中的关键酶[30]。
三羧酸阶段,糖酵解产物丙酮酸继续代谢的关键酶,如丙酮酸脱氢酶E1成分[EC 1.2.4.1]、丙酮酸脱氢酶E2成分(二氢硫辛酰胺乙酰转移酶)[EC 2.3.1.12]和二氢硫辛酰胺脱氢酶[EC 1.8.1.4]表达也下调,导致进入三羧酸循环的乙酰辅酶A的量减少,最终减少能量供应。α-酮戊二酸脱氢酶-α-亚基的下调削弱了三羧酸循环中的不可逆的限速反应,使整个三羧酸循环代谢下调。关于其他单糖,如果糖和甘露糖代谢也受到影响,如甘露糖-6-磷酸异构酶[EC 5.3.1.8]在细菌素处理后不再表达,导致β-D-果糖-6磷酸的生成量减少;L-艾杜糖醇脱氢酶可将L-山梨糖醇氧化为L-果糖,该酶的下调也可导致L-果糖的减少;甘露醇也是细菌生长的碳源,转移因子亚基、甘露醇-1-磷酸5-脱氢酶也都下调,导致甘露醇浓度下降。
差异蛋白中数量最多的是辅因子,辅因子是能与酶蛋白结合并能影响其活力的非蛋白成分,因而可影响细菌细胞中很多酶反应(见表3)。

表3 细菌素处理前后植物乳杆菌SL32-2表达的参与辅因子生物合成途径的显著差异蛋白Table 3 Significantly difference proteins involved in cofactor biosynthesis pathway expressed by Lactobacillus plantarum SL32-2 before and after bacteriocin treatment
由表3可知,细菌素处理后,植物乳杆菌SL32-2高达14个辅因子受到影响,11个显著下调,1个不再表达,有2个表达上调。11个显著下调辅因子中有9个参与嘧啶代谢,嘧啶是合成细胞壁肽聚糖重要的载体,嘧啶下调直接影响细胞壁的合成,结合GO富集分析中细菌素处理后有溶菌酶上调,还有新的溶菌酶分子合成,共同有效抑制了细胞的生长。下调的辅因子中有5个参与氨基酸代谢,且全部是丙氨酸、天冬氨酸和谷氨酸的代谢,有效减弱了氨基酸之间的转换以及通过氨基酸途径再次抑制嘧啶代谢。二氢脂酰脱氢酶[EC 1.8.1.4]的下调则影响了细胞内非常广泛的代谢反应,如丙酮酸代谢,多种(赖氨酸、甘氨酸、丝氨酸、苏氨酸、色氨酸)氨基酸代谢、乙醛酸和二羧酸的代谢、糖酵解/糖异生、三羧酸循环、部分氨基酸(缬氨酸、亮氨酸和异亮氨酸)降解等。
细菌素处理后,植物乳杆菌SL32-2虽然只有一条核酸代谢受影响,但是受影响蛋白数量较多,主要分布在嘧啶代谢的单磷酸尿苷(uridine monophosphate,UMP)合成途径中,如以丙氨酸、天冬氨酸、谷氨酸和精氨酸为原料合成N-氨基甲酰-L-天冬氨酸途径中的EC 6.3.5.5(氨甲酰磷酸合酶)和EC 2.1.3.2(天冬氨酸氨甲酰转移酶),以及以L-天冬氨酸为原料合成UMP途径中的EC 2.1.3.2(天冬氨酸氨甲酰转移酶)、EC 3.5.2.3(二氢乳清酸酶)、EC 1.3.1.14(二氢乳清酸脱氢酶(NAD+)、EC 2.4.2.10(乳清酸磷酸核糖转移酶)和EC 4.1.1.23(5'-磷酸-乳清酸核苷脱羧酶)全部表达下调,使UMP的生成减少,进而能有效影响UDP和细胞壁的合成。
3 结论
本研究利用蛋白质组学技术分析细菌素作用植物乳杆菌SL32-2后抑菌生长的机制表明,细菌素处理后植物乳杆菌SL32-2发酵液显著上调和下调的蛋白质分别有15个和59个,另外有26个蛋白消失,33个蛋白诱导表达;在上调、下调以及消失和诱导表达蛋白中,数量最多的都是酶类,其次是转运蛋白。GO功能富集分析表明,显著性差异表达蛋白的功能条目共99条,主要集中在肽聚糖分解代谢和细胞壁大分子分解代谢、碳水化合物代谢以及嘧啶核苷酸代谢和生物合成等方面。其中,细菌素处理后上调表达的溶菌酶A0A7X1TC68和诱导表达的溶菌酶A0A2S3U5Q5参与了5个BP和3个BF条目,可协同作用降解细菌细胞壁中的肽聚糖,使细胞失去完整性而裂解;KEGG富集分析表明,差异蛋白共涉及淀粉和蔗糖代谢途径、丙氨酸、天冬氨酸和谷氨酸代谢途径、辅因子生物合成途径和嘧啶代谢途径等53条通路,使细胞最主要的营养要素碳源的吸收降解及代谢途径中的关键酶表达下调,降低细胞的能量供应等,细胞壁主要成分肽聚糖生物合成中的重要载体UDP前体物质UMP合成途径中的关键酶表达下调,抑制细胞壁的合成。

