附子理中丸大蜜丸、水蜜丸和浓缩丸3种剂型的化学特征关键质量属性辨识研究
杨莎莎,林 夏,郝怡雯,周 航,张 月,高子希,谢福玉,张 星,傅超美,张 臻
附子理中丸大蜜丸、水蜜丸和浓缩丸3种剂型的化学特征关键质量属性辨识研究
杨莎莎,林 夏#,郝怡雯,周 航,张 月,高子希,谢福玉,张 星,傅超美*,张 臻*
成都中医药大学药学院西南特色中药资源国家重点实验室,四川 成都 611137
建立附子理中丸(Fuzi Lizhong Pills,FLP)处方的大蜜丸(Dami Pills,FLP-D)、水蜜丸(Shuimi Pills,FLP-S)及浓缩丸(Nongsuo Pills,FLP-N)的HPLC指纹图谱,同时测定7种药效成分含量,寻找FLP处方与剂型关联的化学特征关键质量属性。采用分层抽样法结合研究实际,随机抽取市售FLP-D 30批,FLP-S 12批,FLP-N 12批,建立以上54批FLP的HPLC指纹图谱,并同时测定甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚7种有效成分含量;利用主成分分析(principal component analysis,PCA)和偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA)方法对FLP-D、FLP-S和FLP-N各自的HPLC指纹图谱特征峰及7种有效成分进行分析。FLP-D、FLP-S和FLP-N的HPLC指纹图谱分别标定出20、25、20个特征峰,通过PCA和PLS-DA,筛选出14个差异性标志物,其中8、9、12、17、18、25号峰来自甘草,29、32号峰来自干姜,22号峰来自白术。含量测定结果表明,甘草苷、苯甲酰新乌头原碱、6-姜酚、白术内酯III、白术内酯I在FLP-D、FLP-S和FLP-N中的含量差异显著,其中6-姜酚为变量重要性投影(variable importance in projection,VIP)值>1.0的差异性标志物。建立的HPLC指纹图谱与多成分同时测定方法能有效评价FLP-D、FLP-S和FLP-N的化学成分差异;识别出的14个差异性标志物可作为区分FLP-D、FLP-S和FLP-N的潜在化学特征关键质量属性;甘草苷、苯甲酰新乌头原碱、白术内酯III、白术内酯I可作为区分FLP-D与FLP-N或区分FLP-S与FLP-N的化学特征关键质量属性,6-姜酚可作为同时区分FLP-D、FLP-S和FLP-N 3种不同剂型的化学特征关键质量属性。为进一步完善FLP系列制剂的质量标准提供了参考,同时为解决同方异剂中药的质控指标同质化问题提供了新思路。
附子理中丸;HPLC;指纹图谱;甘草苷;苯甲酰新乌头原碱;党参炔苷;6-姜酚;白术内酯III;白术内酯I;10-姜酚;剂型差异;化学特征关键质量属性;主成分分析;偏最小二乘法-判别分析;差异性标志物
中医药是中华民族几千年的临床经验与智慧的结晶,是中华文明的瑰宝。随着制剂技术的快速发展,中药方剂被不断开发成丸剂、片剂、口服液等多种剂型,相同方剂具备多样剂型(同方异剂)的现象越来越常见,《中国药典》2020年版一部中有245首方剂形成了623个同方异剂中成药品种[1]。但由于中药的化学成分众多,药效物质基础复杂,使得同方异剂中药的质控指标趋于同质化,同一方剂中药的剂型不同但质量标准类似,这种忽略不同剂型的制剂工艺特征背景下的质控标准不能全面反映药品的质量特征,不利于中药的现代开发与临床应用。
不同剂型中药的制备工艺不同,现代研究表明,制剂工艺影响化学成分的属性、有无、多寡与相对比例等,从而影响中药的质量与疗效[2]。关键质量属性(critical quality attributes,CQAs)是反映产品质量的特征参数,化学特征CQAs主要关注与制剂质量密切相关的化学成分,是反映药物安全性与有效性的重要标准[3]。白钢等[4]提出应以中医药理论为指导,选取能体现中药临床优势和产品特色的CQAs特征参数,为中药复方的高质量发展提供科学依据与方法借鉴。因此,辨识能够充分体现同方异剂中药剂型特色的化学特征CQAs,有利于解决同方异剂中药存在的质控指标同质化问题,从而推动中药的高质量发展。
附子理中丸(Fuzi Lizhong Pills,FLP)出自第一部官方制剂规范《太平惠民和剂局方》,由附子、党参、干姜、白术、甘草5味中药组成,全方配伍得宜,堪称温中健脾、温肾助阳之经典名方[5]。目前全国共有176个厂家生产的约262种FLP,主要有FLP大蜜丸(Dami Pills,FLP-D)、FLP水蜜丸(Shuimi Pills,FLP-S)和FLP浓缩丸(Nongsuo pill,FLP-N)3种上市剂型。FLP-D与FLP-S收载于《中国药典》2020年版一部,FLP-N收载于《卫生部药品标准中成药成方制剂第七册》,3者制剂工艺不同,质控指标却同质化且单一,其临床定位也完全一致,FLP-D与FLP-S仅选择甘草苷作为含量测定指标成分,FLP-N无任何含量测定指标。中药复方通过多种成分相互作用发挥药效[6],仅用单一成分同时作为3种剂型的含量测定指标,既不符合中药复方疗效发挥的特点,也不能体现3种丸剂不同的剂型特征。且有研究表明[7],附子理中蜜丸与浓缩丸含有的6-姜酚、白术内酯I等9种体外药效成分含量存在明显差异。可见,FLP作为“同方异剂”中药的代表之一,其临床定位与质控指标同质化问题亟待解决。
基于此,本研究根据目前FLP-D、FLP-S和FLP-N市售品种生产厂家的不同占比(10∶3∶2)同时结合指纹图谱研究中样本的谱图数量需10批及以上的实际需要,采用分层抽样法随机抽取来自10、4、4个厂家,每个厂家各3批次的市售FLP-D样品30批,FLP-S样品12批,FLP-N样品12批;采用HPLC方法,建立FLP-D、FLP-S和FLP-N 3种不同剂型的指纹图谱,并同时测定甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚7种有效成分含量;结合主成分分析(principal component analysis,PCA)、偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA)等分析方法,对比研究3种不同剂型FLP所含化学成分的差异,辨识其与剂型相关的化学特征CQAs,为进一步完善FLP的质量标准、保证其临床合理应用提供参考,为解决同方异剂中药质控指标同质化问题提供新思路。
1 仪器与材料
UltiMate 3000型高效液相色谱仪,美国Thermo Fisher公司;XM-P221H型超声波处理器,小美超声仪器(昆山)有限公司;ARSS4CN型十万分之一分析天平,奥豪斯仪器(上海)有限公司。
对照品甘草苷(批号AF21030904)购自成都埃法科技有限公司;对照品苯甲酰新乌头原碱(批号MUST-22102410)、10-姜酚(批号MUST-22073004),均购自成都曼斯特生物科技有限公司;对照品白术内酯I(批号RFS-B03302201010)、白术内酯III(批号RFS-B03502201004)、党参炔苷(批号RFS-D02602204021)和6-姜酚(批号RFS-J01902111009)均购自成都瑞芬思德丹生物科技有限公司;各对照品质量分数均≥98.00%。水为纯化水;乙腈、磷酸为色谱纯,其他试剂均为分析纯。附子、干姜、白术、甘草、党参饮片均购自四川国强中药饮片有限公司,经成都中医药大学裴瑾教授鉴定,分别为毛茛科乌头属植物乌头Debx.的子根炮制加工品,姜科姜属植物姜Rosc.的干燥根茎,菊科苍术属植物白术Koidz.的干燥根茎的炮制加工品,豆科甘草属植物甘草Fisch.的干燥根和根茎,桔梗科党参属植物党参(Franch.) Nannf.的干燥根。
为保证抽取样本具有良好的代表性与尽可能小的抽样误差,本研究采用分层抽样法中的比例分配法,根据3种剂型FLP的生产厂家占比(FLP-D∶FLP-S∶FLP-N=10∶3∶2),同时结合指纹图谱研究中样本的HPLC谱图数量需10批及以上的实际需要,随机抽取来自10、4、4个厂家,每个厂家各3批次的FLP-D、FLP-S和FLP-N的30、12、12批次的市售FLP样品。样品信息见表1。
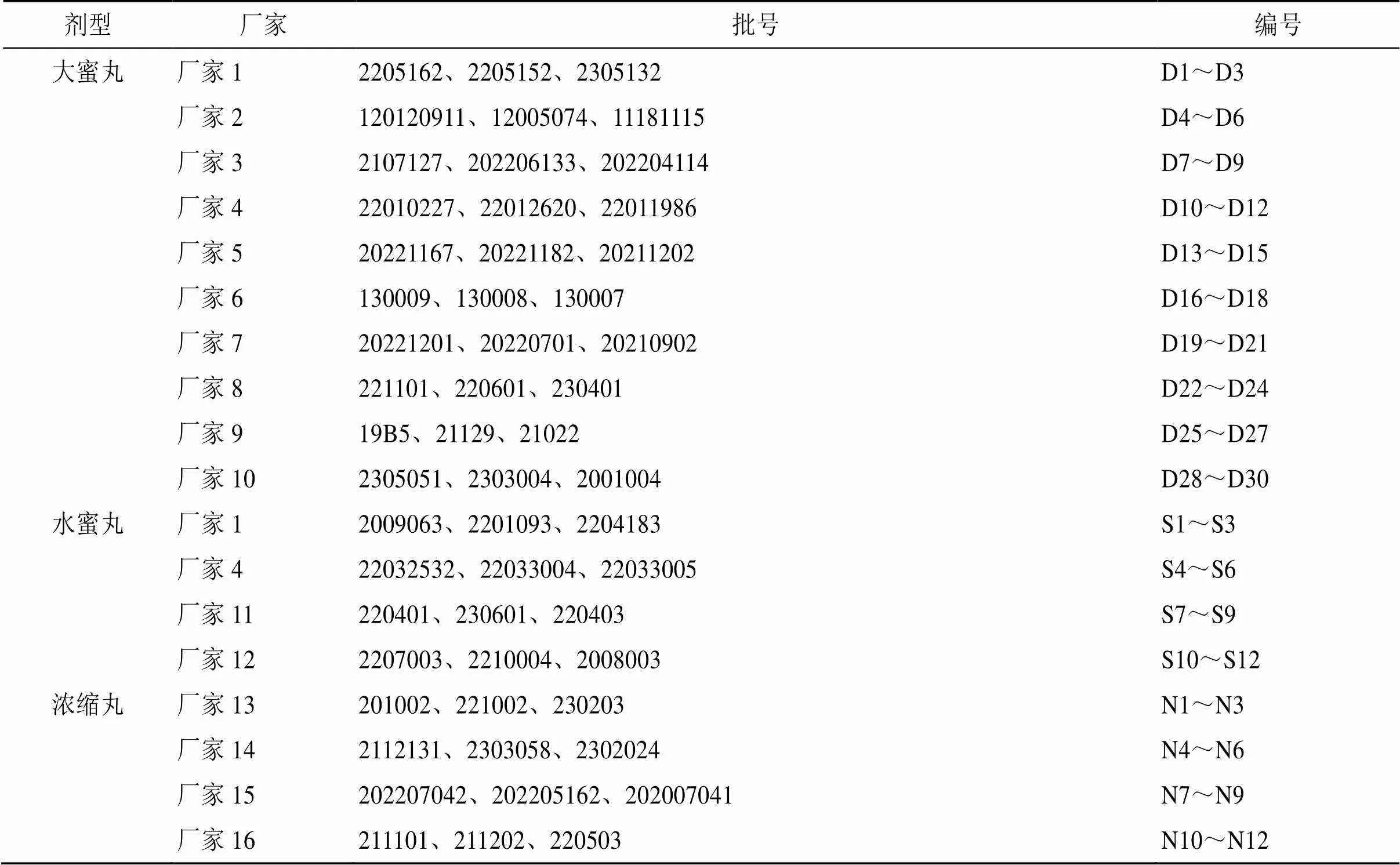
表1 54批FLP的样品信息
2 方法与结果
2.1 色谱条件
色谱柱为Hypersil Gold C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.01%磷酸水溶液,梯度洗脱:0~2 min,0~15%乙腈;2~10 min,15%~20%乙腈;10~17 min,20%~35%乙腈;17~22 min,35%~40%乙腈;22~32 min,40%~50%乙腈;32~42 min,50%乙腈;42~52 min,50%~70%乙腈;52~70 min,70%乙腈;体积流量为1 mL/min;柱温为25 ℃;检测波长235 nm;进样体积10 μL。
2.2 样品的制备
2.2.1 对照品溶液的制备 取甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚对照品,精密称定,加入适量含0.05%盐酸的甲醇溶液,制成含甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚各成分质量浓度分别为1.37、0.25、0.24、0.78、0.24、0.16、0.20 mg/mL的混合对照品溶液。
2.2.2 供试品溶液的制备 结合文献方法[8-9]与本研究前期对提取方法的考察结果,分别取3种不同剂型的市售FLP(大蜜丸6 g,水蜜丸4 g,浓缩丸8丸,3种丸剂的生药量相等),置于具塞锥形瓶中,精密加入70%乙醇20 mL,密塞,25 ℃下超声(250 W)提取45 min,放冷,取上清液,用0.22 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.2.3 单味药材样品溶液的制备 分别取附子、党参、白术、干姜、甘草药材适量,粉碎,过6号筛,按照“2.2.2”项下方法,制备单味药材样品溶液。
2.2.4 阴性样品溶液的制备 参照《中国药典》2020年版一部项下FLP制法,分别制备缺附子、党参、白术、干姜、甘草的大蜜丸与水蜜丸,参照《卫生部药品标准中药成方制剂第七册》FLP制法,制备缺附子、党参、白术、干姜、甘草的浓缩丸。按照“2.2.2”项下方法,制备各阴性样品溶液。
2.3 HPLC指纹图谱建立
2.3.1 精密度试验 取同一批市售FLP(D30)供试品溶液,按“2.1”项下色谱条件连续测定6次,以13号峰6-姜酚为参照峰,计算得各峰相对保留时间和相对峰面积的RSD均小于3%,结果表明仪器精密度良好。
2.3.2 重复性试验 取同一批市售FLP(D30),按“2.2.2”项下方法平行制备供试品溶液6份,按照“2.1”项下色谱条件进行分析,以13号峰6-姜酚为参照峰,计算得各峰相对保留时间和相对峰面积的RSD均小于3%,结果表明该方法重复性良好。
2.3.3 稳定性试验 取同一批市售FLP(D30)供试品溶液,按“2.1”项下色谱条件在制备后0、4、8、12、6、20、24 h进样分析,以13号峰6-姜酚为参照峰,计算得各峰相对保留时间和相对峰面积的RSD均小于3%,表明供试品溶液在24 h内稳定。
2.3.4 3种剂型FLP的HPLC指纹图谱建立 将54批FLP样品按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录各色谱图。采用“中药色谱指纹图谱相似度评价系统”2012版,分别设定D30、S8、N7为参照图谱,采用中位数法,时间窗宽度设为0.1 min,进行多点校正和Mark峰匹配,分别得到FLP-D、FLP-S与FLP-N的叠加指纹图谱和对照指纹图谱(图1)。FLP-D共标定了20个特征峰(图1-A),经与混合对照品的色谱结果进行比较分析,鉴定出其中6个色谱峰,分别为4号峰甘草苷、5号峰党参炔苷、13号峰6-姜酚、15号峰白术内酯III、26号峰白术内酯I、28号峰10-姜酚;FLP-S共标定了25个特征峰(图1-B),经与混合对照品的色谱结果进行比较分析,鉴定出其中5个色谱峰,分别为4号峰甘草苷、5号峰党参炔苷、13号峰6-姜酚、15号峰白术内酯III、28号峰10-姜酚;FLP-N共标定了20个特征峰(图1-C),经与混合对照品的色谱结果进行比较分析,鉴定出其中4个色谱峰,分别为4号峰甘草苷、5号峰党参炔苷、13号峰6-姜酚、15号峰白术内酯III。
2.4 不同剂型FLP的HPLC指纹图谱差异性分析
2.4.1 聚类分析 将FLP-D、FLP-S与FLP-N 3种剂型各自的指纹图谱中的特征峰峰面积作为变量,导入SIMCA 14.1分析软件,进行聚类分析。结果如图2所示,当组间距离为4时,54批样品聚为4类,S1~S7、S9~S12聚为一类,D1~30聚为一类,N1~N12聚为一类,S8聚为一类,以上结果说明FLP-D、FLP-S与FLP-N各自聚为一类,不同类别之间的化学成分的相对含量有较大差异。
2.4.2 PCA 采用SIMCA 14.1分析软件对FLP-D、FLP-S以及FLP-N 3种剂型的特征峰进行PCA,结果见图3。由PCA得分图可知,FLP-D、FLP-S和FLP-N能够较好地分开,说明不同剂型FLP的化学成分存在较大差异。
2.4.3 PLS-DA 为进一步分析FLP-D、FLP-S以及FLP-N所含化学成分的差异,采用有监督的PLS-DA模型进行分析。以FLP-D、FLP-S以及FLP-N 3种剂型的特征峰数据为变量,利用SIMCA14.1软件对FLP-D、FLP-S与FLP-N进行PLS-DA。结果如图4-a~c所示,可知FLP-D、FLP-S与FLP-N存在一定差异,能够分为3类。由变量重要性投影(variable importance in projection,VIP)图(图4-c)可知,VIP>1.0的差异化合物有14个,说明3种不同剂型FLP所含的化学成分相差较大。
2.4.4 3种剂型FLP的差异峰归属 制备缺附子、缺干姜、缺党参、缺白术以及缺甘草阴性样品溶液及单味药材样品溶液,按“2.1”项下色谱条件进样测定,记录色谱图。结合各色谱峰的保留时间,通过对比分析,对PLS-DA中识别出的14个差异成分进行峰归属,色谱图对比结果如图5所示。差异峰中的第8、9、12、17、18、25号峰来自甘草,第29、32号峰来自干姜,第22号峰来自白术,第2、20、26、27、31号峰未识别出药材来源。
2.5 多成分含量测定
2.5.1 系统适应性考察 按照“2.1”项下色谱条件对混合对照品溶液、FLP供试品溶液和阴性样品溶液进样分析,结果表明样品中各成分的分离度较好,阴性无干扰,HPLC色谱图见图6。

图1 FLP-D (D1~D30, A)、FLP-S (S1~S12, B) 和FLP-N (N1~N12, C) 样品的HPLC指纹图谱及其对照指纹图谱(DR,SR,NR)
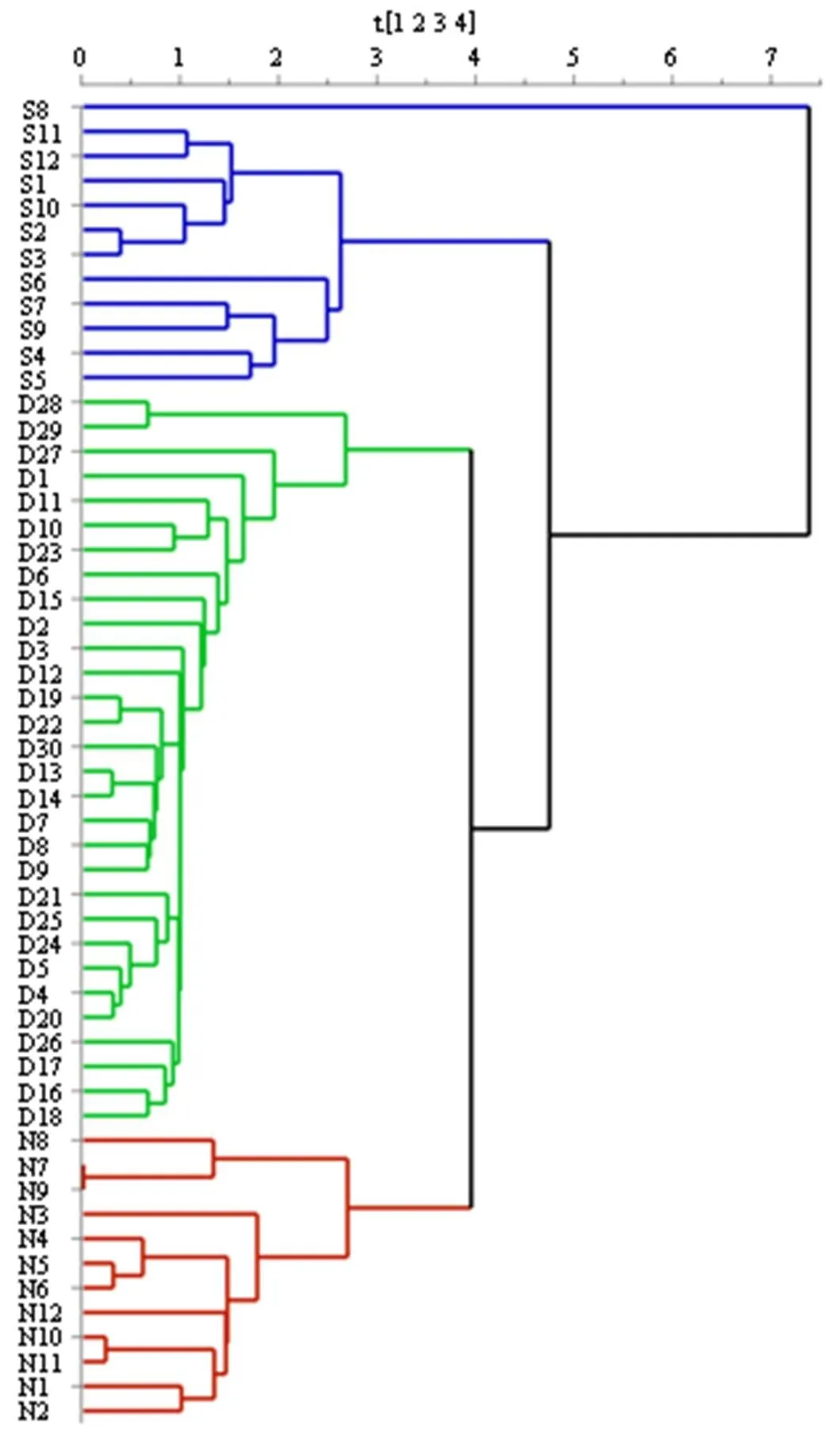
图2 FLP-D (D1~D30)、FLP-S (S1~S12) 和FLP-N (N1~N12) 样品聚类分析图

图3 FLP-D (D1~D30)、FLP-S (S1~S12) 和FLP-N (N1~N12) 样品的PCA统计分析图
2.5.2 线性关系考察 取“2.1.1”项下混合对照品溶液适量,采用二倍稀释法,分别稀释0、2、4、8、16、32、64、128倍,按照“2.1”项下色谱条件进行测定。以各成分质量浓度为横坐标(),峰面积为纵坐标()建立标准曲线,进行线性回归,得7个成分的回归方程与线性范围,结果分别为甘草苷=366.9+1.993 7,2=0.999 4,线性范围4.68~600.00 μg/mL;苯甲酰新乌头原碱=206.1+0.258 6,2=0.999 7,线性范围0.78~100.00 μg/mL;党参炔苷=58.518+0.045 6,2=0.999 8,线性范围0.86~110.00 μg/mL;6-姜酚=140.8+0.468 8,2=0.999 4,线性范围2.66~340.00 μg/mL;白术内酯III=262.6+0.236 3,2=0.999 5,线性范围0.86~110.00 μg/mL;白术内酯I=134.93+0.070 7,2=0.999 5,线性范围0.55~70.00 μg/mL;10-姜酚=125.02+0.086 9,2=0.999 6,线性范围0.70~90.00 μg/mL。
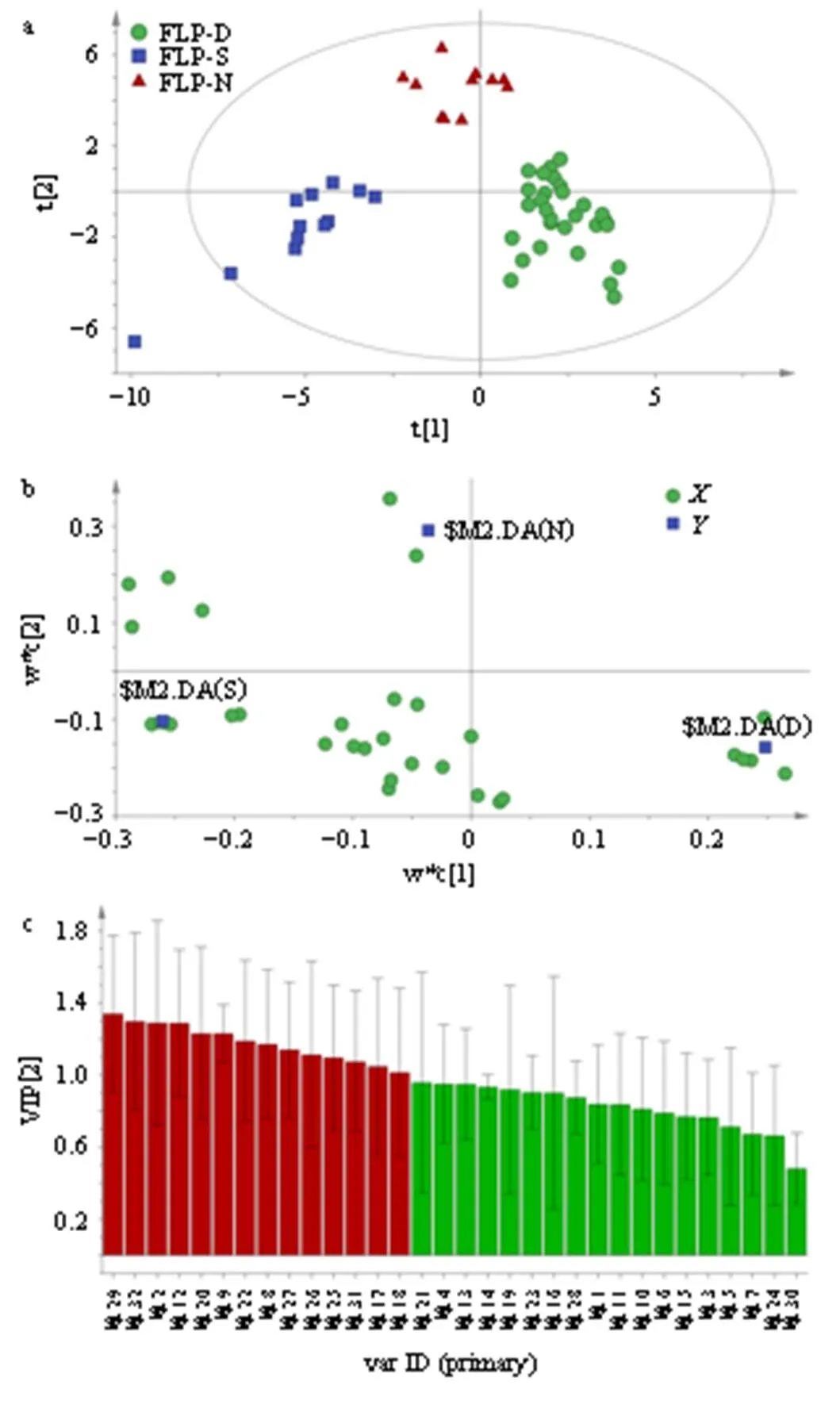
a-PLS-DA得分矩阵;b-PLS-DA载荷散点图;c-PLS-DA的VIP值。
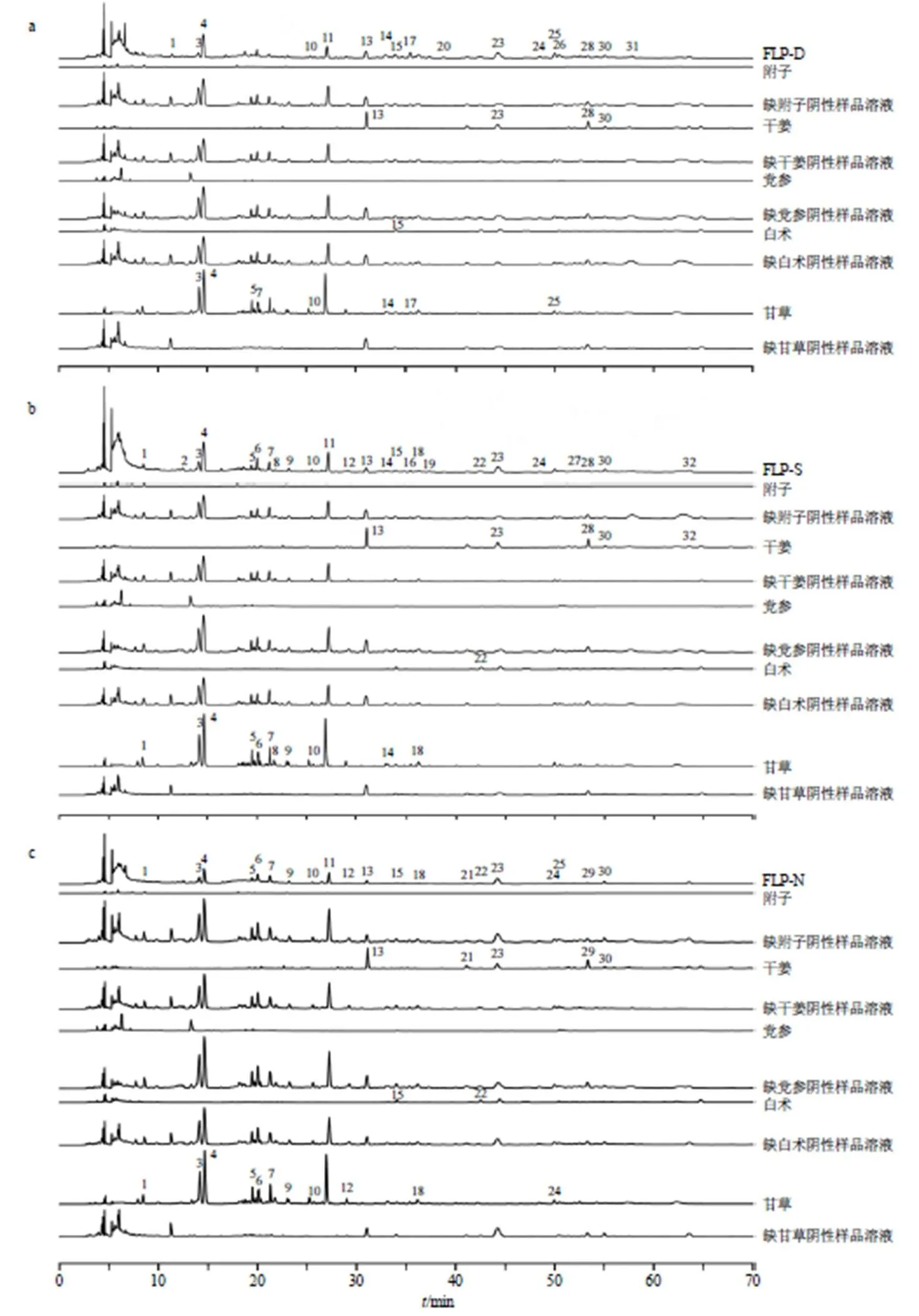
图5 FLP-D (a)、FLP-S (b) 和FLP-N (c) 样品指纹图谱的差异峰归属色谱图
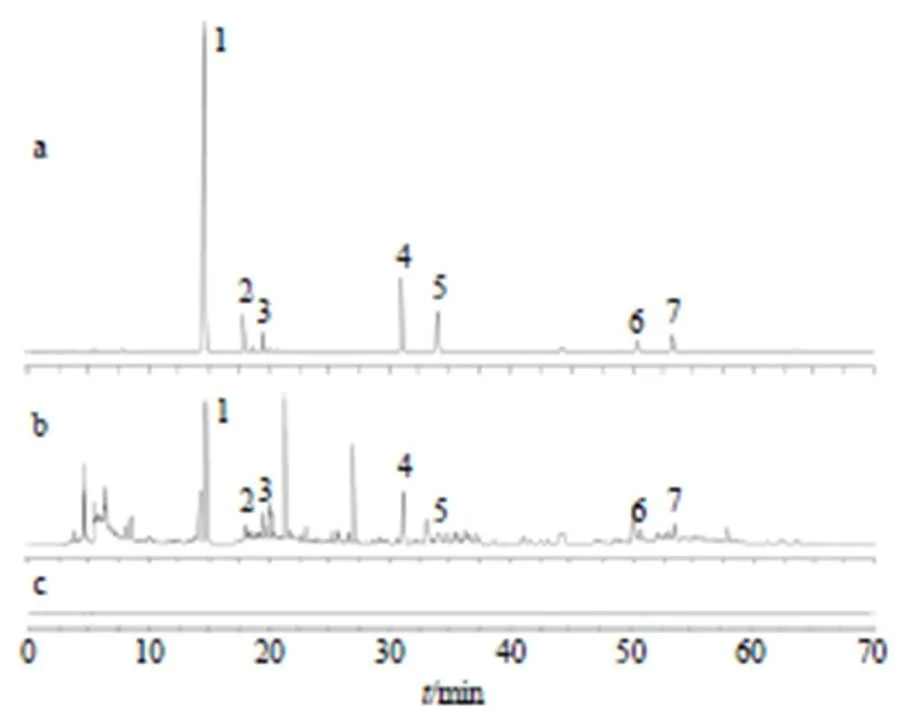
1-甘草苷;2-苯甲酰新乌头原碱;3-党参炔苷;4-6-姜酚;5-白术内酯III;6-白术内酯I;7-10姜酚。
2.5.3 精密度试验 取同一批市售FLP(D30)供试品溶液,按“2.1”项下色谱条件连续测定6次,记录峰面积。计算得甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚峰面积的RSD分别为0.07%、0.44%、2.41%、0.28%、0.55%、0.10%、0.36%,结果表明仪器精密度良好。
2.5.4 重复性试验 取同一批市售FLP(D30),按“2.2.2”项下方法平行制备供试品溶液6份,按照“2.1”项下色谱条件进行分析,记录峰面积。计算得甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚质量分数的RSD分别为2.20%、0.51%、1.39%、0.52%、2.10%、0.70%、0.33%,结果表明该方法重复性良好。
2.5.5 稳定性试验 取同一批市售FLP(D30)供试品溶液,按“2.1”项下色谱条件在制备后0、4、8、12、16、20、24 h进样分析,记录峰面积。计算得甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚峰面积的RSD分别为0.78%、0.50%、0.88%、1.17%、0.72%、1.06%、1.13%,说明供试品溶液在24 h内稳定。
2.5.6 加样回收率试验 精密称取已测定指标成分含量的同一批市售FLP(D30)6份,每份3.0 g,分别按样品中各成分含量的100%水平,每份加入各对照品溶液,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析。计算得甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚的平均加样回收率分别为95.60%、99.47%、104.08%、101.64%、98.63%、103.40%、103.78%,RSD分别为2.94%、1.31%、1.26%、1.25%、0.64%、2.84%、0.17%,结果表明该方法的回收率符合要求。
2.5.7 样品含量测定 54批FLP样品,按照“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,通过标准曲线计算各批次样品中甘草苷、苯甲酰新乌头原碱、党参炔苷、6-姜酚、白术内酯III、白术内酯I、10-姜酚的质量分数,结果见表3。甘草苷、苯甲酰新乌头原碱、党参炔苷、白术内酯III、白术内酯I的质量分数为FLP-S>FLP-D>FLP-N,6-姜酚和10-姜酚的质量分数为FLP-S>FLP-N>FLP-D。采用SPSS 26.0对FLP-D、FLP-S和FLP-N中的指标成分含量进行单因素方差分析(one-way analysis of variance,ANOVA),<0.05即为差异具有统计学意义,结果如表4所示,FLP-S中的6-姜酚的含量显著高于FLP-D;FLP-S中的甘草苷、苯甲酰新乌头原碱、6-姜酚、白术内酯III及白术内酯I的含量均显著高于FLP-N;FLP-D中的甘草苷、苯甲酰新乌头原碱、白术内酯III与白术内酯I的含量均显著高于FLP-N;党参炔苷、10-姜酚在FLP-D、FLP-S及FLP-N中的含量无显著差异。进一步将以上数据导入SIMCA 14.1软件进行PLS-DA,结果如表5所示,VIP>1.0的差异化合物有1个,为6-姜酚。
3 讨论
3.1 FLP-D、FLP-S和FLP-N的成分差异性分析
3.1.1 HPLC指纹图谱差异性分析 在FLP-D、FLP-S和FLP-N的指纹图谱差异性研究中发现:(1)3种剂型特征峰数量为FLP-S>FLP-D>FLP-N;(2)除各自特有成分外,大部分成分的相对含量为FLP-S>FLP-D>FLP-N。以上结果初步表明,FLP-S所含成分的种类与相对含量在3种剂型中最多,FLP-N最少。其原因可能是:一方面,大蜜丸与水蜜丸均为药材原粉入药,而浓缩丸中的部分药材经过渗滤煎煮,提取总量相较于原粉入药时相对含量较低;另一方面,蜂蜜黏合性较强,会延缓蜜丸的释药速度[10]。蜂蜜中含有3/4的糖类[11],这些糖类化合物含有大量的羧基、羟基等亲水基团,具有很强的吸湿性[12-13],使得蜜丸在溶解时存在“吸水-浸润-溶解”的反复过程,形成亲水性屏障作用的浸膏层,会限制水分子向内渗透与药物向外扩散,导致蜜丸释药缓慢[14]。FLP-D的炼蜜添加量是水蜜丸的近3倍,因此,在相同的提取方法下,本研究在相同时间点取样,检测到的FLP-D的成分溶出少于FLP-S。
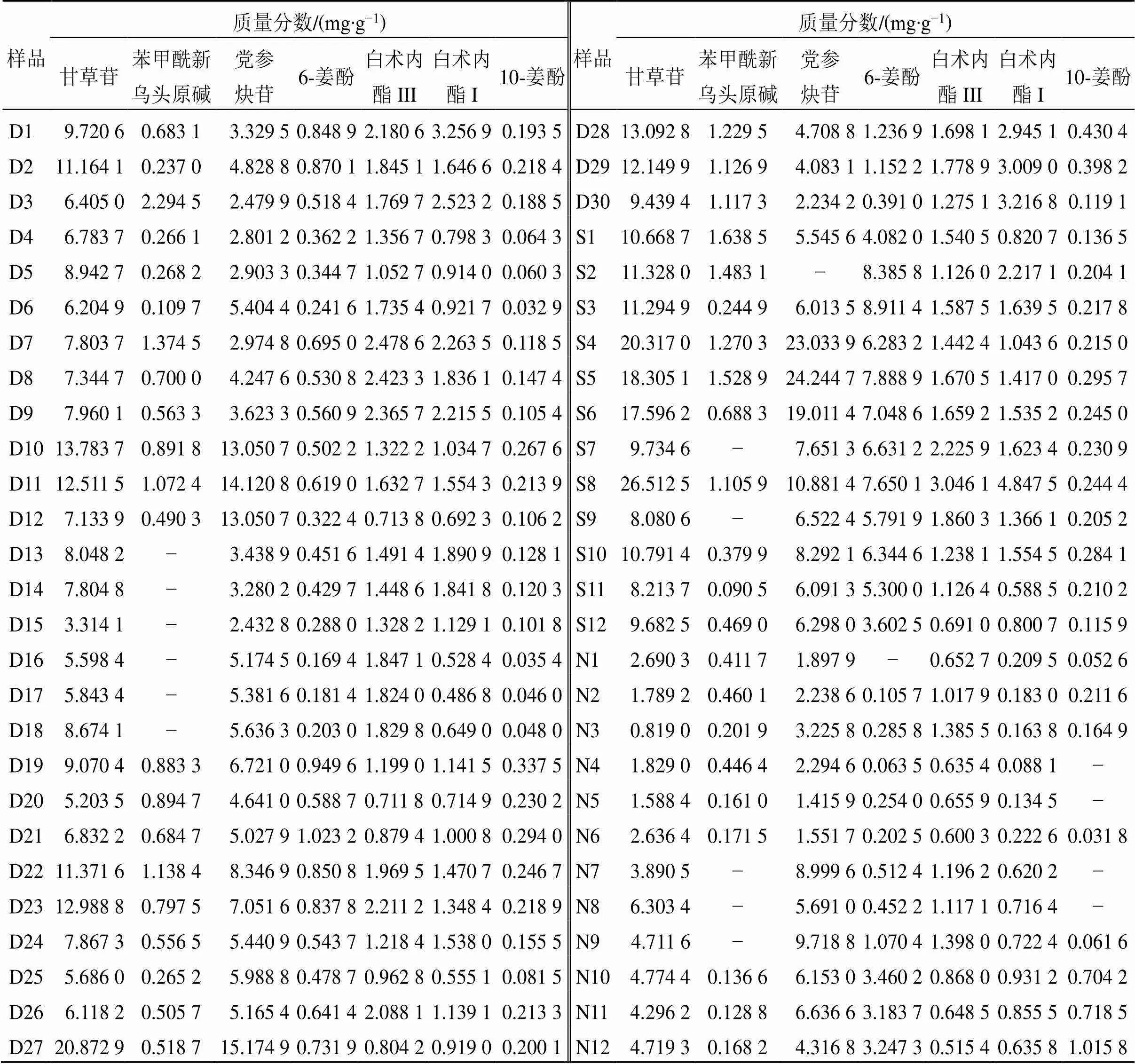
表3 54批FLP样品含量测定结果
“−”表示该成分未在样品中检出。
“−” means this component is not detected in samples.
表4 FLP-D、FLP-S和FLP-N样品中的指标成分含量比较()
与FLP-D比较:*<0.05**<0.01;与FLP-S比较:##<0.01。
*< 0.05**< 0.01FLP-D;##< 0.01FLP-S.

表5 FLP-D、FLP-S和FLP-N样品中各指标成分含量VIP值
PLS-DA共识别出14个差异化合物(VIP>1.0),第2、8、27、32号峰为FLP-S特有,第17、20、26、31号峰为FLP-D特有,第29号峰为FLP-N特有。以上结果说明,不同剂型FLP所含化学成分存在明显不同,以上成分可作为区分FLP-D、FLP-S和FLP-N的剂型关联的潜在化学特征CQAs。14个差异化合物的峰归属结果发现,第29、32号峰来自干姜,第22号峰来自白术,第8、9、12、17、18、25号峰来自甘草。FLP以温阳祛寒、益气健脾之功效见长,方中干姜、白术为臣药,发挥温运中阳、健脾燥湿的功效,甘草起到补中扶正、调和诸药的作用[15-16]。化学成分是复方发挥疗效的物质基础,3种剂型FLP存在的明显化学成分差异说明FLP-S、FLP-D与FLP-N在温运中阳、健脾燥湿、益气补中等方面的功效发挥可能存在差异,虽然有研究[7,17]表明不同剂型FLP的体内外药效成分确有不同,但目前并未见相关的药理药效实验研究报道。此外,本研究主要通过比对标准品化合物与样品中化合物的保留时间确定样品中的化学成分,仍需进一步通过LC-MS方法对以上化合物进行检测鉴定。
3.1.2 指标成分确定 本研究参照《中国药典》2020年版一部中,对FLP处方中单味药材的含量测定指标,同时结合相关文献报道,选择与复方功效密切相关的化学成分进行定量分析。附子中的单酯型生物碱是其发挥药效的主要成分之一,具有抗炎镇痛、免疫调节等作用[18-19];党参所含成分党参炔苷是其主要药效成分,具有健脾、免疫调节等药理作用,可作为党参的指标成分[20];白术中的白术内酯I、III等内酯类成分是其发挥抗炎、治疗泄泻的活性成分[21];6-姜酚、10-姜酚是干姜中的主要活性成分,具有抗氧化、抗炎等药理作用,与其回阳通脉功效的发挥密切相关[22-23];甘草所含黄酮类成分甘草苷等是其发挥药效的主要成分[24]。在本研究中,附子所含乌头碱、新乌头碱未被HPLC检出,苯甲酰乌头原碱、苯甲酰次乌头原碱在样品中难以分离。因此,综合选择苯甲酰新乌头原碱、党参炔苷、白术内酯I、白术内酯III、6-姜酚、10-姜酚、甘草苷7种药效相关成分进行定量分析。
3.1.3 多成分含量测定差异性分析 多成分含量测定差异研究分别对FLP-D、FLP-S和FLP-N中的7个药效相关指标成分同时进行了含量测定。结果发现(表4),甘草苷、苯甲酰新乌头原碱、党参炔苷、白术内酯III和白术内酯I的质量分数为FLP-S>FLP-D>FLP-N,6-姜酚和10-姜酚的质量分数为FLP-S>FLP-N>FLP-D。由此可见,水蜜丸中7个指标成分的质量分数均高于大蜜丸,这进一步说明了炼蜜的添加量对蜜丸药效成分的质量分数具有重要影响。且有学者研究表明[25],炼蜜用量对附子理中丸蜜丸中生物碱、甘草酸、白术内酯III等21个活性成分的药代动力学有重要影响。因此,炼蜜用量及炼蜜所含化学成分或可成为区分不同蜜丸的潜在CQAs。
单因素方差分析发现5种药效成分在不同剂型中的含量差异显著,其中甘草苷、苯甲酰新乌头原碱、白术内酯III、白术内酯I在2种附子理中蜜丸和浓缩丸中的含量具有显著差异(<0.05),可作为区分FLP-D与FLP-N或区分FLP-S与FLP-N的化学特征CQAs;6-姜酚为3种剂型的差异化合物(VIP>1.0),可作为同时区分FLP-D、FLP-S和FLP-N 3种剂型的化学特征CQAs。党参炔苷、10-姜酚2种药效成分在不同剂型中的含量无显著差异。党参炔苷作为臣药党参的主要活性成分之一,与其健脾的传统功效密切相关[20];10-姜酚是代表方中臣药干姜的传统药性的主要成分之一,具有保护脾胃、回阳通脉等作用[23]。党参炔苷与10-姜酚2种药效成分作为FLP-D、FLP-S及FLP-N的共性成分,在一定程度上说明了3种FLP在临床功效与适应症等方面具有共性,但其用于治疗具体疾病的药效是否有异同仍需进一步研究。
此外,本实验也对君药附子中的乌头碱、新乌头碱、苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱5种生物碱进行了测定,乌头碱与新乌头碱未在样品中检出,苯甲酰乌头原碱与苯甲酰次乌头原碱在样品中与其他杂峰混合,难以分离,因此最终选择分离度较好的苯甲酰新乌头原碱进行含量测定。结合本课题组的前期研究与参考文献[17,26-27],发现乌头碱与新乌头碱能被质谱检测,但含量很低,约为0.1~4.0 μg/g,因此,推测在本研究中未检出原因可能是其在样品中含量过低,无法达到最低检测限度。值得注意的是,目前该方的含量测定指标并没有对君药附子相关成分进行规定,仅有乌头碱限量作为检查项之一,这既不能很好地体现本方疗效,也不利于FLP的临床有效运用。本研究发现苯甲酰新乌头原碱在FLP-D与FLP-N,FLP-S与FLP-N中含量差异显著,因此可考虑将苯甲酰新乌头原碱等双酯型生物碱列入含量测定指标,作为区分不同剂型FLP的化学特征CQAs。
3.2 同方异剂中药含量测定指标存在的问题
目前大多数同方异剂的中药成方制剂的含量测定规定主要为:(1)大部分制剂含量测定指标同质化,表现为大部分同方异剂制剂使用相同指标,且指标成分仅针对中药材,与剂型关联度不大,无法体现剂型特征,如附子理中制剂(FLP-D、FLP-S)、祛风止痛制剂(祛风止痛浓缩丸、祛风止痛片、祛风止痛胶囊)等;(2)部分制剂含量测定指标单一,该类中药制剂仅使用非君药的单一成分作为含测指标,不符合中药复方药效发挥的特点,如:附子理中丸(大蜜丸、水蜜丸)含测指标为佐使药甘草的成分甘草苷,八珍丸(水蜜丸、大蜜丸、浓缩丸)含测指标为佐药白芍的成分芍药苷;(3)少部分制剂无任何含量测定指标:如龙胆泻肝丸(小蜜丸、大蜜丸)、香附丸(大蜜丸、水蜜丸)、FLP-N等。可见,同方异剂中药的质量控制普遍存在问题。
剂型因素通过影响药物本身所含成分的种类与含量进而影响药效发挥,大量研究表明[28-31],同方异剂制剂所含化学成分的种类、含量及其体外溶出、体内吸收等过程与最终药效均存在明显不同。有研究[32]发现止嗽散冲剂颗粒与汤剂治疗喘息型支气管炎的临床疗效不同,冲剂中有效成分含量更高可能是其疗效更好的原因之一。有学者对不同剂型六味地黄丸的物质组释放动力学进行可视化表征,发现浓缩丸释放最快且最完全,小蜜丸和水蜜丸次之,大蜜丸释放速度最慢、释药量小[33]。
银翘散源自《温病条辨》,是清热解毒的代表方剂,但将原方散剂改为丸剂、片剂、胶囊剂时,其释药速度变缓,且长时间加热使有效成分损失,无法达到原方疗效[34]。由此可见,同方异剂中药所含化学成分的种类、含量以及释药速度和程度存在差异,且最终影响方剂疗效,不使用指标成分、使用单一指标成分,或使用完全相同成分对同方异剂中成药进行质量控制,均无法体现不同剂型的制剂特征,缺乏合理性。
综上,本研究通过采用“中药指纹图谱结合多指标成分含量测定”的方法,对同方异剂中药所含化学成分进行对比研究,能够从定性与定量两方面分析不同剂型的主要化学成分,同时关注重要药效成分,辨识与剂型密切关联的化学特征CQAs,充分体现了同方异剂中药的剂型特色,为解决同方异剂中药的质控指标单一、无法体现剂型特征的同质化问题提供了一种参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020.
[2] 李学林, 张珊珊, 刘瑞新. 试论制剂因素对中药药性的影响 [J]. 中医研究, 2014, 27(12): 66-70.
[3] 杨莎莎, 林夏, 黄友, 等. 经典名方关键质量属性及影响因素分析 [J]. 中草药, 2023, 54(4): 1274-1284.
[4] 白钢, 张铁军, 刘昌孝. 基于监管科学的中药质量评价方法的整合研究思路和发展方向 [J]. 中草药, 2022, 53(20): 6313-6318.
[5] 林夏, 黄友, 杨莎莎, 等. 高通量测序技术研究附子理中丸对脾阳虚IBS-D大鼠肠道菌群的影响 [J]. 南京中医药大学学报, 2021, 37(3): 388-395.
[6] 陈修平, 寻克丽, 王一涛. 中药复方药效物质基础的系统药理学评价 [J]. 中草药, 2010, 41(1): 1-5.
[7] 甘嘉荷. 不同剂型附子理中丸化学成分与入血成分对比研究 [D]. 北京: 中国中医科学院, 2018.
[8] 陈雪芬, 徐鹏鹤, 欧晓阳. HPLC法同时测定附子理中丸中甘草苷、甘草酸铵白术内酯II和白术内酯III的含量 [J]. 中国中医药科技, 2022, 29(1): 41-44.
[9] 武红娜, 潘海霞, 赵庆林, 等. 附子理中丸质量标准的改进与提升研究 [J]. 中国现代应用药学, 2020, 37(17): 2098-2102.
[10] 谢余, 李奇娟, 王文俊, 等. 木香类药物“制剂过程-药效”综合分析与展望 [J]. 中药材, 2019, 42(5): 1198-1203.
[11] 吴国泰, 武玉鹏, 牛亭惠, 等. 蜂蜜的化学、药理及应用研究概况 [J]. 蜜蜂杂志, 2017, 37(1): 3-6.
[12] 肖琼, 沈平, 朱莲华. 中药固体制剂防潮技术与辅料应用的研究 [J]. 中成药, 2007, 29(2): 208-211.
[13] Mizrahy S, Peer D. Polysaccharides as building blocks for nanotherapeutics [J]., 2012, 41(7): 2623-2640.
[14] 刘立伟, 董毅智, 李玉坤, 等. 传统丸剂历史沿革、科学内涵及丸剂二次开发的发展构想 [J]. 北京中医药大学学报, 2022, 45(6): 571-577.
[15] 赵萱, 陈云慧, 郑明月, 等. 基于数据挖掘的含人参-附子药对方剂的组方规律分析 [J]. 中草药, 2021, 52(4): 1083-1091.
[16] 武红娜. 附子理中丸基本信息及临床应用进展 [J]. 临床合理用药杂志, 2020, 13(1): 179-180.
[17] 宋志前, 甘嘉荷, 董运茁, 等. 附子理中丸中制附子的6种生物碱成分含量测定 [J]. 中国实验方剂学杂志, 2017, 23(10): 55-60
[18] Zhou G H, Tang L Y, Zhou X D,. A review on phytochemistry and pharmacological activities of the processed lateral root ofDebeaux [J]., 2015, 160: 173-193.
[19] 唐梅, 赵立春, 徐敏, 等. 附子化学成分和药理作用研究进展 [J]. 广西植物, 2017, 37(12): 1614-1627.
[20] 边惠琴, 武晓玉, 夏鹏飞, 等. 党参的研究进展及质量标志物的预测分析 [J]. 华西药学杂志, 2022, 37(3): 337-344.
[21] 左军, 张金龙, 胡晓阳. 白术化学成分及现代药理作用研究进展 [J]. 辽宁中医药大学学报, 2021, 23(10): 6-9.
[22] Tian W N, Wang H N, Zhu Y,. Intervention effects of delivery vehicles on the therapeutic efficacy of 6-gingerol on colitis [J]., 2022, 349: 51-66.
[23] 徐桐, 丛竹凤, 贺梦媛, 等. 干姜的研究进展及质量标志物分析 [J]. 山东中医杂志, 2022, 41(5): 569-575.
[24] Jiang M Y, Zhao S J, Yang S S,. An “essential herbal medicine” -licorice: A review of phytochemicals and its effects in combination preparations [J]., 2020, 249: 112439.
[25] 甘嘉荷, 王淳, 宋志前, 等. 炼蜜用量对附子理中丸中9种生物碱类成分药代动力学的影响 [J]. 中国实验方剂学杂志, 2018, 24(3): 90-96.
[26] Zhang Z, Jiang M Y, Wei X Y,. Rapid discovery of chemical constituents and absorbed components in rat serum after oral administration of Fuzi-Lizhong pill based on high-throughput HPLC-Q-TOF/MS analysis [J]., 2019, 14: 6.
[27] 宋志前, 王淳, 甘嘉荷, 等. 附子理中丸3种剂型中16个活性成分日服用总量的比较 [J]. 中国实验方剂学杂志, 2019, 25(19): 17-24.
[28] 孙国祥, 杨婷婷. 用高效液相色谱指纹图谱定量评价4种不同剂型六味地黄丸质量和工艺差异 [J]. 中南药学, 2010, 8(2): 148-154.
[29] 令红艳. 不同板蓝根制剂腺苷含量测定及其抗炎作用比较 [J]. 中国实验方剂学杂志, 2012, 18(11): 143-145.
[30] 杨华杰, 魏惠珍, 吕尚, 等. 基于化学模式识别和网络药理学的六味地黄丸中标志物的预测 [J]. 中药新药与临床药理, 2021, 32(9): 1345-1352.
[31] 赵洪芝, 孟宪生, 叶挺祥, 等. 六味地黄丸的HPLC指纹图谱和模式识别研究 [J]. 中草药, 2010, 41(1): 48-51.
[32] 王镇. 不同剂型止嗽散治疗喘息型支气管炎疗效分析 [J]. 实用中医药杂志, 2017, 33(8): 876-877.
[33] 叶英响, 陈烨, 翁夏蒙, 等. 不同类型六味地黄丸的物质组释放动力学特征及其可视化表征 [J]. 中草药, 2017, 48(21): 4425-4431.
[34] 杨明, 张婧, 宋民宪, 等. 银翘散原方改剂问题的分析及建议 [J]. 中成药, 2012, 34(8): 1621-1624.
Identification of critical quality attributes with chemical characteristics of three dosage forms of Fuzi Lizhong Dami Pills, Shuimi Pills and Nongsuo Pills
YANG Shasha, LIN Xia, HAO Yiwen, ZHOU Hang, ZHANG Yue, GAO Zixi, XIE Fuyu, ZHANG Xing, FU Chaomei, ZHANG Zhen
State Key Laboratory of Southwestern Chinese Medicine Resources, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
To find the chemical critical quality attributes (CQAs) associated with the dosage form characteristics of Fuzi Lizhong Pills (FLP, 附子理中丸) by establishing HPLC fingerprints of Dami Pills (FLP-D), Shuimi Pills (FLP-S) and Nongsuo Pills (FLP-N) and determining contents of seven effective components.According to the stratified sampling method and research requirement, 30 batches of FLP-D, 12 batches of FLP-S and 12 batches of FLP-N were randomly selected from the market. The HPLC HPLC fingerprints of 54 batches of FLP were establishe. The contents of seven effective components, including liquiritin, benzoylmesaconine, lobetyolin, 6-gingerol, atractylenolide III, atractylenolide I, and 10-gingerol were simultaneously determined. Principal component analysis (PCA) and partial least squares-discriminant analysis (PLS-DA) were used to analyze the HPLC fingerprint characteristic peaks of FLP-D, FLP-S and FLP-N and seven active components.There were 20 characteristic peaks in the fingerprints of FLP-D, 25 characteristic peaks in FLP-S, and 20 characteristic peaks in FLP-N. A total of 14 differential markers were determined by PCA and PLS-DA. Among them, peaks 8, 9, 12, 17, 18 and 25 originated from Gancao (et), peaks 29 and 32 originated from Ganjiang (), and peak 22 originated from Baizhu (). The contents of liquiritin, benzoylmesaconine, 6-gingerol, atractylenolide III and atractylenolide I in FLP-D, FLP-S and FLP-N were significantly different. The compound 6-gingerol was a differential marker with variable importance in projection (VIP) value > 1.0.The established HPLC fingerprint and multi-component simultaneous determination method can effectively evaluate the chemical composition differences of FLP-D, FLP-S and FLP-N. The identified14 differential markers could be the potential CQAs of FLP-D, FLP-S and FLP-N. Liquiritin, benzoylmesaconine, atractylenolide III and atractylenolide I could be used as CQAs to distinguish FLP-D and FLP-N, or FLP-S and FLP-N. 6-gingerol could be used as CQAs for differentiating FLP-D, FLP-S and FLP-N simultaneously. Our research provides a reference for further enhancing the quality standards of FLP, and presents a novel idea to address the homogeneity issue in quality control for traditional Chinese medicine with the same prescription but different dosage forms.
Fuzi Lizhong Pills; HPLC; fingerprint; liquiritin; benzoylmesaconine; lobetyolin; 6-gingerol; atractylenolide III; atractylenolide I; 10-gingerol; dosage form differences; chemical critical quality attributes; PCA; PLS-DA; differential markers
R283.6
A
0253 - 2670(2024)09 - 2955 - 12
10.7501/j.issn.0253-2670.2024.09.010
2023-10-26
四川省科技计划重点研发项目(2020YFS0567);四川省科技厅四川省科技计划项目(2021YJ0251);四川省中医药管理局科学技术研究专项(2023MS600);成都中医药大学杏林学者青基人才专项(QJRC2022027)
杨莎莎,女,硕士研究生,研究方向为中药新制剂和新剂型研究。E-mail: 1973246652@qq.com
林 夏,女,博士研究生,研究方向为中药新制剂和新剂型研究。E-mail: 3328116305@qq.com
通信作者:张 臻,女,副教授,主要从事中药制剂新技术新剂型、中药复方功效与作用机制研究。E-mail: zhangzhendr@126.com
傅超美,男,教授,从事中药新制剂和新剂型研究。E-mail: chaomeifu@126.com
[责任编辑 郑礼胜]

