刺槐素通过核因子κB信号通路抑制脂多糖诱导的巨噬细胞损伤
补 娟 史 深 叶勒丹·马汉 王兆霞 周 玲
(1 新疆维吾尔自治区人民医院医学研究与转化中心,乌鲁木齐,830001; 2 新疆维吾尔自治区疾病预防控制中心消毒与感染控制中心,乌鲁木齐,830002)
炎症是一种机体适应性防御反应,但长期过度的炎症会对身体产生有害影响,引起一系列疾病如糖尿病、哮喘和类风湿性关节炎等,在严重情况下,甚至威胁人类生命[1-4]。因此,研究安全有效的抗炎药物具有重要的意义。
核因子κB是炎症反应中的重要信号通路,激活核因子κB可诱导如白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、诱导型一氧化氮合酶(Inducible Nitric Oxide Synthase,iNOS)、环氧合酶2(Cyclooxygenase-2,COX-2)等炎症介质的表达[5],阻断核因子κB的活化,可以抑制炎症介质的表达,发挥抗炎作用。因此,抑制核因子κB信号通路是开发抗炎药物的重要靶点。
刺槐素(Acacetin)是一种天然黄酮类药物,可从多种植物中提取获得,具有多种药理作用[6]。近年来研究发现,刺槐素可以抑制炎症介质TNF-α、IL-1β、IL-6等的表达,对炎症疾病如支气管炎、哮喘、肺损伤、肠炎等具有保护作用,但是刺槐素的抗炎作用机制还不明确[7-10]。因此我们用脂多糖(Lipopolysaccharide,LPS)刺激小鼠骨髓巨噬细胞,研究刺槐素是否通过抑制核因子κB信号通路发挥抗炎作用。
1 材料与方法
1.1 材料
1.1.1 动物与细胞 采用6~8周C57BL/6J小鼠原代骨髓巨噬细胞。小鼠由新疆医科大学提供(许可证号:SCXK(新)2018-0002;伦理批号:KY2020041050),饲养在通风良好、温度、湿度适宜的环境中,自由饮水及进食。分离骨髓巨噬细胞,加入含10%胎牛血清(Fatal Bovine Serum,FBS)及1%双抗的杜氏改良培养基(Dulbecco′s Modification of Eagle′s Medium,DMEM)(高糖)培养基培养7~8 d,细胞生长汇合至80%后进行实验。
1.1.2 药物 刺槐素(sigma公司,美国,货号:00017,批号:BCBT8459,二甲基亚砜(Dimethylsulfoxide,DMSO)配置为10 mmol/L的母液,用于稀释成不同浓度的工作液)。
1.1.3 试剂与仪器 粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage Colony-stimulating Factor,GM-CSF)(北京索莱宝科技有限公司,货号:P00184)、LPS(sigma公司,美国,L2630);DMEM(高糖)培养基、青霉素-链霉素双抗(10 000U)(GIBCO公司,美国,货号分别为:C11965500BT,15140-122);FBS(中国Excell Bio公司,货号:FND500);CCK-8试剂盒(APExBIO公司,美国,货号:K1018);核因子κB p65、磷酸化核因子κB p65(Phosphonated NF-κB p65,p-NF-κB p65,p-p65)、核因子κB抑制蛋白α(Inhibitor of Nuclear Factor kappa B Alpha,IκBα)抗体(Abcam公司,美国,货号分别为:ab32536,ab76302,ab32518);磷酸化-IκBα(Phosphonated IκBα,p-IκBα)抗体(CST公司,美国,货号:5209s);二喹啉甲酸(Bicinchoninic Acid,BCA)法蛋白定量试剂盒(北京全式金生物技术有限公司,货号:DQ111-01);山羊抗兔免疫球蛋白G(IgG)(Abcam公司,美国,货号:ab150077);台式离心机(上海力申科学仪器有限公司,型号:Neofuge),酶标仪(Bio-Rad公司,型号:xMarkTM),化学发光成像仪系统(上海勤翔科学仪器有限公司,型号:Chemiscope 3000),蛋白转膜仪(Bio-Rad公司,美国,型号:Mini-PROTEAN Tetra system),电泳仪(北京六一生物科技有限公司,型号:DYCZ-24DN),电子天平(Sartorius公司,德国,型号:CP324S),脱色摇床(江苏海门其林贝尔仪器制造有限公司,型号:TS-3D),共聚焦显微镜(卡尔蔡司光学有限公司,德国,型号:LSM700)。
1.2 方法
1.2.1 CCK-8法检测刺槐素对小鼠骨髓巨噬细胞的毒性作用 将细胞接种于96孔板,每孔4×103个细胞,置于培养箱(37 ℃、5%CO2)中孵育12 h。加入不同浓度(5 μmol/L,10 μmol/L,20 μmol/L,40 μmol/L)的刺槐素继续培养24 h。设定5个平行组,24 h后,每孔加入10 μL的CCK8试剂,放置培养箱孵育1 h,酶标仪(450 nm)测吸光度值(A)。根据公式:细胞活力(%)=(各浓度给药组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%,计算细胞增殖情况。结合课题组前期研究结果,选择10 μmol/L刺槐素作为后续研究剂量。
1.2.2 分组与模型制备 1)空白对照组:正常培养相应时间;2)LPS(10 min)组:LPS(50 ng/mL)预刺激10 min;3)LPS(10 min)+刺槐素(10 μmol/L)组:LPS(50 ng/mL)预刺激10 min,随后用刺槐素(10 μmol/L)处理0.5 h;4)LPS(30 min)组:LPS(50 ng/mL)预刺激30 min;5)LPS(30 min)+刺槐素(10 μmol/L)组:LPS(50 ng/mL)预刺激30 min,随后用刺槐素(10 μmol/L)处理0.5 h;6)LPS(60 min)组:LPS(50 ng/mL)预刺激60 min;7)LPS(60 min)+刺槐素(10 μmol/L)组:LPS(50 ng/mL)预刺激60 min,随后用刺槐素(10 μmol/L)处理0.5 h。
1.2.3 检测指标与方法 蛋白免疫印迹检测核因子κB p65、p-核因子κB p65、IκBα和p-IκBα:收集细胞,提取总蛋白,用BCA法蛋白定量。计算30 μg蛋白所用体积。电泳条件:浓缩胶80 V,分离胶100 V。电泳结束后,将胶上蛋白条带转移至聚偏二氟乙烯(Polyvinylidene Fluoride,PVDF)膜上。核因子κB p65、p-核因子κB p65、IκBα、p-IκBα及β-肌动蛋白(β-actin)使用0.45 μmol/LPVDF膜,转膜时间为60 min。转印后的膜用封闭剂(5%牛血清白蛋白(Bovine Serum Albumin,BSA),三羟甲基氨基甲烷缓冲液(Tris Buffered Saline Tween,TBST)配制)在室温下封闭2 h,将膜分别加核因子κB p65(1∶800)、p-核因子κB p65(1∶800)、IκBα(1∶1 000)及p-IκBα(1∶800)。4 ℃孵育过夜。TBST洗涤10 min×3次,加入相应的二抗抗体(1∶5 000),室温下孵育2 h。TBST洗涤10 min×3次,将化学发光试剂A液和B液按1∶1比例配制,均加2 mL至膜上,用化学发光仪检测、拍照。以目的基因条带吸光度与β-actin条带吸光度比值计算相对表达量。
激光共聚焦观察核因子κB核转位情况:调整细胞浓度为1×105个/mL,滴加200 μL于黏附性载玻片上,干预完成后取出载玻片,用磷酸缓冲盐溶液(Phosphate Buffered Saline,PBS)洗涤3次,2 min/次;4%多聚甲醛固定20 min,PBS洗涤3次,2 min/次;0.5%聚乙二醇辛基苯基醚(TritonX-100)处理5 min,PBS洗涤3次,2 min/次;1%BSA室温封闭30 min,甩干封闭液;滴加80 μL浓度为2 μg/mL的核因子κB p65抗体,每张片子滴加一种抗体;37 ℃孵育2 h,PBS洗涤3次,2 min/次;滴加80 μL浓度为2 μg/mL的山羊抗兔IgG二抗,37 ℃避光孵育1 h,PBS洗涤3次,2 min/次;滴加80 μL浓度为1 μg/mL的4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI),室温避光孵育5 min,PBS洗涤3次,2 min/次;50%甘油封片,激光共聚焦显微镜观察拍照。

2 结果
2.1 刺槐素对小鼠骨髓巨噬细胞增殖活性的影响 0 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L和40 μmol/L刺槐素处理后巨噬细胞存活率分别为(100.000±18.962)%、(104.074±6.691)%、(102.263±17.242)%、(93.210±12.655)%和(82.654±16.156)%,各组间细胞存活率比较无统计学意义(P>0.05)。
2.2 刺槐素对核因子κB信号通路的影响 各组细胞中的核因子κB p65、IκBα的蛋白表达水平没有差异。与空白对照组比较,LPS刺激10 min,30 min和60 min组的p-p65、p-IκBα表达水平均显著上调(均P<0.05);与LPS(10 min)组比较,LPS(10 min)+刺槐素组p-IκBα表达显著降低(P<0.01);与LPS(30 min)组比较,LPS(30 min)+刺槐素组p-p65(P<0.01)、p-IκBα均显著降低(P<0.05);与LPS(60 min)组比较,LPS(60 min)+刺槐素组p-p65(P<0.05)、p-IκBα均显著降低(P<0.001)。见图1,表1。
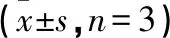
表1 小鼠骨髓巨噬细胞中p-p65,p65,p-IκBα和IκBα的表达

图1 小鼠骨髓巨噬细胞中p-p65,p65,p-IκBα和IκBα的表达(n=3)
2.3 刺槐素对核因子κB核转位的影响 激光共聚焦结果显示,空白对照组核因子κB p65(绿色)广泛分布在细胞质中,未见分布于细胞核(蓝色);当LPS刺激后,可观察到大量的核因子κB p65定位于细胞核上,表明LPS促进核因子κB p65激活转位入核;刺槐素处理后LPS介导的核因子κB p65定位于细胞核的蛋白水平显著降低。见图2。
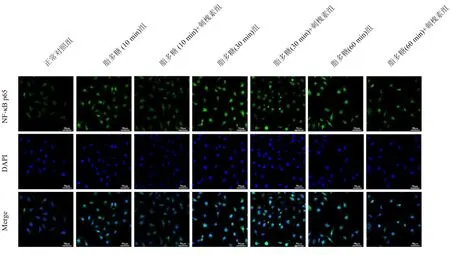
图2 刺槐素对核因子κB核转位的影响(免疫荧光染色,×200)
3 讨论
刺槐素具有抗氧化作用和抗炎作用,SUN等[11]研究发现刺槐素可调节iNOS,COX-2,超氧化物歧化酶(Superoxide Dismutase,SOD)和血红素加氧酶1(Heme Oxygenase-1,HO-1),降低炎症介质分泌对肺损伤发挥保护作用。HUANG和LIOU[7]发现刺槐素可明显减少支气管炎细胞中的IL-6、IL-8、细胞间黏附分子-1(Intercellular Cell Adhesion Molecule-1,ICAM-1)、嗜酸细胞活化趋化因子-1,对支气管炎具有保护作用。CHEN等[8]发现刺槐素可抑制p38和C-Jun氨基末端激酶(C-Jun N-terminal Kinase,JNK)的磷酸化,减少基质金属蛋白酶-1(Matrix Metalloproteinase-1,MMP-1)、基质金属蛋白酶-3(Matrix Metalloproteinase-3,MMP-3)、基质金属蛋白酶-13(Matrix Metalloproteinase-13,MMP-13)的表达,对关节炎具有保护作用。我们前期研究发现刺槐素可以抑制Toll样受体4(Toll-like Receptor 4,TLR4)/核因子κB/NOD样受体热蛋白3(NOD-like Receptor 3,NLRP3)信号通路,减少炎症介质IL-1β、IL-6、TNF-α的表达,对脑缺血再灌注损伤发挥保护作用[12];同时发现刺槐素可以通过抑制NLRP3信号通路减少老年斑的形成,改善阿尔茨海默病小鼠模型的记忆能力[13]。虽然较多研究表明刺槐素能发挥抗炎作用,在细胞实验或动物实验中对炎症疾病具有预防作用,但其抗炎作用还需要进一步阐明[14-16]。本研究中我们进一步在体外运用LPS介导的巨噬细胞炎症反应模型,探讨刺槐素的抗炎作用。我们用不同浓度的刺槐素处理小鼠骨髓巨噬细胞24 h,发现刺槐素对小鼠骨髓巨噬细胞具有低毒性,结合课题组前期研究结果,我们选定刺槐素浓度为10 μmol/L。
炎症是一种涉及多种化学介质和信号通路参与的关键反应,与多种疾病的发生发展有关。巨噬细胞是对抗外源性病原体的炎症反应的主要细胞,具有病原体相关分子模式(Pathogen Associated Molecular Pattern,PAMP)受体,如Toll样受体(Toll-like Receptors,TLRs)和晚期糖基化终产物受体(Receptor for Advanced Glycation Endproduct,RAGE),能够识别细胞外抗原,如LPS。与巨噬细胞PAMP受体结合后,LPS触发参与炎症爆发的不同细胞内信号通路,通过复杂的信号转导通路,参与了多种炎症疾病过程[17-19]。LPS的促炎作用可通过核因子κB依赖的转录激活介导[20],并且我们前期研究发现刺槐素可抑制NLRP3炎症小体的活化[21],而NLRP3炎症小体活化的启动阶段可由核因子κB介导,因此我们研究了刺槐素的抗炎作用是否与抑制核因子κB有关。结果发现随着LPS时间的推移,核因子κB p65的磷酸化水平显著增加,给予刺槐素治疗后,能显著降低p65的磷酸化;我们进一步通过激光共聚焦实验发现刺槐素可以抑制核因子κB的核转位。
核因子κB的活性受核因子κB抑制因子(Nuclear Factor κB Inhibitory Factor,IκB)调控,在细胞静息状态,它们以二聚体的形式与IκB蛋白结合,保持无活性的状态存在于细胞质[22]。LPS被巨噬细胞的TLR4识别,激活IκB磷酸化,促进IκB从核因子κB p50/p65二聚体上解离,解离的p50/p65转位入核后启动炎症介质转录调控[23-24]。本研究发现随着LPS时间的推移,IκB的磷酸化水平显著增加,给予刺槐素治疗后,能显著降低IκB的磷酸化。
综上所述,本研究证实刺槐素的抗炎作用与调控核因子κB信号通路,抑制核因子κB核转位有关,为进一步认识刺槐素的药理作用提供了理论依据。关于刺槐素如何调控核因子κB信号通路,发挥抗炎作用还需要进一步研究。
利益冲突声明:无。

