扶正安中汤联合索拉非尼在中晚期肝癌患者的临床观察
梁 菲 燕腾飞 王久利 徐海军 梁 海
(1 亳州市中医院肿瘤科,亳州,236800; 2 亳州市人民医院药学部,亳州,236800)
肝细胞癌(Hepatocellular Carcinoma,HCC)起病隐匿,早期无典型临床症状,大多数患者确诊时已是中晚期阶段,无法进行手术切除、微波消融及肝移植等治疗[1]。研究表明,全球HCC发病率居恶性肿瘤第6位,年新增约90万例,死亡率居第3位;中国HCC患者发病率居第5位,年新增约41万例,死亡率居第2位[2]。目前,肝动脉插管化疗栓塞术(Transcatheter Arterial Chemoembolization,TACE)成为无手术机会的HCC患者的最主要治疗方式之一,主要通过切断肿瘤的血供,以抑制肿瘤血管形成[3]。但其易导致肿瘤侧支循环形成、肿瘤血管再生等不良事件,术后需要给予阻断肿瘤新生血管形成的药物。索拉非尼(Sorafenib,SOR)同时作用于肿瘤细胞和血管,发挥双重抗肿瘤作用[4]。目前SOR应用于TACE后HCC复发广泛转移的治疗,但其近期疗效还有待进一步提高[5]。中医药治疗通过改善肿瘤患者的病理、生理过程,从而恢复机体的阴阳平衡。另外,中晚期HCC患者普遍具有腹部胀满、纳差等特点,西医治疗更加重这些症状的发生。研究表明,中西医结合治疗恶性肿瘤患者可增加疗效,减少不良反应,提高患者生命质量[6-7]。扶正安中汤能够扶正固本,改善患者机体情况,使患者进一步接受治疗[8],但尚未有关于联合分子靶向药物治疗TACE后中晚期HCC患者的报道。鉴于此,本研究应用扶正安中汤联合SOR治疗TACE后中晚期HCC患者,并探讨其疗效,现报道如下。
1 资料与方法
1.1 一般资料 选取2021年1至12月亳州市中医院肿瘤科收治的TACE术后中晚期HCC患者100例作为研究对象,按简单随机化分组方法分为对照组和观察组,每组50例。在计算本研究所需样本量时,根据既往研究结果,找出拟比较的疾病控制率差异有统计学意义的2组,在临床试验统计网(www.trialstats.com)中进行测算,检验水准α=0.05(双侧),检验效能(1-β)=0.80,观察组率值=0.60,对照组率值=0.30,样本量比值=1。计算得出各组所需样本量=42例,本研究实际入组病例数大于最小样本量。
对照组年龄50~75岁,平均年龄(56.83±10.27)岁;男29例,女21例;身高(163.57±6.56)cm;体质量(61.25±13.40)kg;卡诺夫斯凯计分(Karnofsky Performance Score,KPS)(79.50±12.45)分;巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer,BCLC)分期:B期和C期分别为32例、18例。Child-Pugh分级:A级24例、B级26例。观察组年龄51~75岁,平均年龄(56.73±10.15)岁;男30例,女20例;身高(165.67±7.13)cm;体质量(64.79±10.87)kg;KPS(84.33±7.76)分;BCLC分期:B期31例、C期19例。Child-Pugh分级:A级23例、B级27例。2组基线数据差异无统计学意义(P>0.05),具有可比性。患者均自愿签署知情同意书。本研究通过亳州市中医院医学伦理委员会批准实行(伦理审批号:2021KYY-KY18)。
1.2 诊断标准 参照《原发性肝癌诊疗规范(2019年版)》HCC的诊断和《中医证候鉴别诊断学》HCC的中医证名[1,9],肝郁脾虚证型:肝肾亏虚,脾虚痰阻。
1.3 纳入标准 1)符合HCC诊断标准;2)BCLC分期B~C期者;3)患者不适合手术切除,预计生存期超过3个月;4)KPS评分≥60分;5)病灶可测量者;6)无法再次手术切除者;7)首次服用本研究的药物;8)符合《中医证候鉴别诊断学》HCC的中医证名,肝郁脾虚证型:肝肾亏虚,脾虚痰阻。
1.4 排除标准 1)合并严重内科疾病;2)合并重要器官功能和免疫功能障碍者;3)合并全身或局部感染者;4)合并血液系统疾病者;5)合并认知功能不全者。
1.5 剔除与脱落标准 1)不能依从本研究方案治疗者;2)身体和病情变化符合排除标准者;3)出现严重不良反应经评估不适合继续参与研究者;4)自行退出治疗者;5)治疗期间死亡者。
1.6 治疗方法 对照组给予SOR(德国拜耳有限公司,德国,批号:20121123)治疗,口服400 mg,2次/d。观察组在此基础上加用扶正安中汤(生黄芪20 g、酸枣仁24 g、炒谷芽24 g、山药20 g、绿梅花10 g、橘络12 g、仙鹤草18 g、无花果10 g、石斛18 g、灵芝10 g、姜竹茹10 g)治疗,由本院中药房统一水煎,每日1剂,水煎2次取汁200 mL,分早晚餐后30 min服用,2个月为1个疗程,2组均持续用药3个疗程后进行疗效评估。
1.7 观察指标 1)比较2组中医证候积分[10]:症状包括两胁胀痛、腹胀、纳呆、嗳气纳差、乏力、苔薄及脉弦共7个方面,按照病情严重程度从无至重度,记为0~6分。2)比较2组肝、肾功能指标:术后3 d抽取空腹静脉血5 mL,离心后取上清液(离心半径9.5 cm,3 000 r/min,5 min)。采用双抗体夹心酶联免疫吸附试验检测谷草转氨酶(Glutamic-oxaloacetic Transaminase,GOT)、谷丙转氨酶(Glutamic-pyruvic Transaminase,GPT)、白蛋白(Albumin,ALB)、总胆红素(Total Bilirubin,TB)、肌酐(Creatinine,Cr)、血尿素氮(Blood Urea Nitrogen,BUN),时间均为治疗前及治疗3个疗程结束次日。3)统计1年的生存情况,自治疗开始起进行电话随访,每月1次,若随访期间因肿瘤患者死亡则终止随访。4)检测2组肿瘤标志物和炎症介质水平:术后1周抽取空腹静脉血5 mL,于1 h内离心取上清液(离心半径9.5 cm,3 000 r/min,5 min)。采用微粒子发光检测血清甲胎蛋白(Alpha-fetoprotein,AFP)(北京百奥莱博科技有限公司,批号:ZN2015),采用酶联免疫吸附试验检测恶性肿瘤特异性生长因子(Tumor-specific Growth Factor,TSGF)(本生健康科技有限公司,批号:BS-9828)、血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)(本生健康科技有限公司,批号:BS-0723)、肿瘤坏死因子-α(Tumor Necrosis Factor-alpha,TNF-α)(本生健康科技有限公司,批号:BS-0121)、白细胞介素-6(Interleukin-6,IL-6)(本生健康科技有限公司,批号:BS-2689),时间均为治疗前及治疗3个疗程结束次日。5)评估2组用药安全性,按照文献制定的标准进行评价[11],不良反应(Adverse Drug Reaction,ADR)包括消化道症状、高血压、手足综合征等,分为Ⅰ~Ⅳ级。
1.8 疗效判定标准 按照文献[12]制定的标准进行评价,1)病灶完全消失,且无新发病灶,维持时间>4周,为完全缓解(Complete Response,CR);2)病灶最大直径之和缩小30%~70%,并无新病灶,维持时间>4周,为部分缓解(Partial Response,PR);3)病灶最大直径之和缩小<30%,并无新病灶,维持时间>4周,为稳定病情(Stable Disease,SD);4)相对于治疗前,病灶最大直径增大,且有新病灶,为疾病进展(Progressive Disease,PD)。疾病控制率(Disease Control Rate,DCR)=(CR+PR+SD)例数/总例数×100%。

2 结果
2.1 2组患者近期疗效比较 观察组疾病控制率大于对照组(P<0.05)。见表1。

表1 2组患者近期疗效比较
2.2 2组患者治疗前后肿瘤标志物和炎症介质情况比较 治疗前,2组患者肿瘤标志物和炎症介质差异无统计学意义(P>0.05)。与治疗前比较,治疗后2组患者TSGF、AFP、VEGF、TNF-α和IL-6均下降(均P<0.05),对照组高于观察组(均P<0.05)。见表2。

表2 2组患者治疗前后肿瘤标志物和炎症介质比较
2.3 2组患者治疗前后中医证候积分比较 治疗前,2组患者中医证候积分差异无统计学意义(P>0.05)。与治疗前比较,治疗后2组患者中医证候积分均下降(均P<0.05),对照组高于观察组(均P<0.05)。见表3。

表3 2组患者治疗前后中医证候积分比较分)
2.4 2组患者治疗前后肝、肾功能情况比较 治疗前,2组患者肝、肾功能差异无统计学意义(P>0.05)。与治疗前比较,治疗后2组患者GOT、GPT、TB和ALB均下降(均P<0.05),对照组高于观察组(均P<0.05);而2组Cr和BUN均升高,对照组低于观察组,但差异无统计学意义(P>0.05)。见表4。

表4 2组患者治疗前后肝、肾功能比较
2.5 2组患者生存率比较 一年随访期间,2组均无患者失访。对照组生存12例,死亡38例,生存率为24.00%;观察组生存21例,死亡29例,生存率为42.00%。组间差异有统计学意义(χ2=8.72,P=0.018)。见图1。
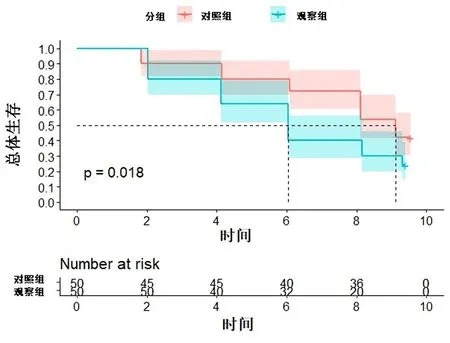
图1 2组患者生存率比较
2.6 2组患者ADR发生情况比较 比较观察组和对照组消化道反应、高血压及手足综合征的ADR发生率,差异无统计学意义(P>0.05)。见表5。
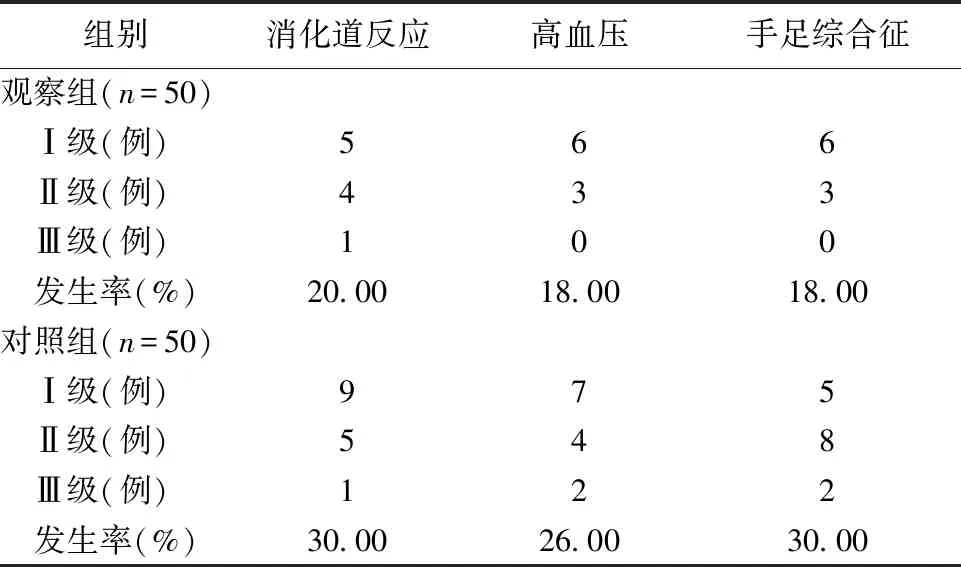
表5 2组患者ADR发生情况比较
3 讨论
TACE后转移是HCC患者的主要死因,中晚期HCC患者的5年生存期仅为30%左右,因此,亟需寻找新的治疗方案提升中晚期HCC治疗的有效率,改善患者的生命质量[13-14]。随着分子靶向药物治疗HCC的研究深入,通过针对已明确的致癌位点设计药物具有精准和高效的特点,可以更好地治疗术后肿瘤广泛转移,但其近期疗效不佳,且药物本身的不良反应在一定程度上限制其应用。
随着中医药研究发展,中西医联合治疗中晚期HCC有效地提高了临床疗效和降低了不良反应[15-17]。何若苹等[18]报道显示正气虚衰是促使HCC发生发展的根本原因,且贯穿整个疾病过程;周滢和周萍[19]报道显示HCC是脾胃亏虚,肝气郁结,情志失畅,饮食不节等多因素导致机体痰凝热毒、气滞血瘀,积聚于胁腹而成。孙滴和叶丽红[20]报道显示肝积属于虚实夹杂之证,以气阴两伤、阴阳两虚、气血亏虚为虚,以痰阻、血瘀、气滞为实,主要包括气滞血瘀型、肝气郁结型、肝阴亏虚型等。TACE后中晚期HCC患者多为正气已损、气阴两伤、脾胃虚弱者,宜采用健脾和中、疏肝理气之治法。研究显示,相对于对照组,参芪扶正注射液联合索拉非尼治疗的观察组晚期HCC患者临床获益率与有效率均有明显提高(P<0.05),且显著改善血清中VEGF、TNF-α、IFN-γ水平,降低不良反应发生率(P<0.05)[21]。扶正抑瘤汤联合索拉非尼治疗晚期HCC疗效明显,可显著降低血清胰岛素样生长因子Ⅱ、CD44水平[22]。国医大师徐经世创扶正安中汤,具有扶正安中,滋养化源,顾护脾胃,调达气机之功效,适用于恶性肿瘤患者的身体恢复和后续治疗[23]。
本研究显示,通过扶正安中汤联合SOR治疗中晚期HCC患者的疾病控制率高于对照组;治疗后观察组中医证候积分低于对照组(P<0.05),显示二药联合应用是治疗中晚期HCC患者的有效方案。原因为方剂中黄芪可增加巨噬细胞和中性粒细胞的吞噬及杀菌作用[24];其次,其富含硒可抑制肿瘤细胞氧化磷酸化,从而抑制肿瘤[25];另外,方剂中仙鹤草和灵芝有抑制肿瘤细胞增殖的作用[26]。
研究显示,血清肿瘤标志物TSGF、VEGF与肿瘤新生血管和肿瘤生长密切相关,其抑制部分T淋巴细胞分化,从而诱导细胞恶性转化,促进血管形成及肿瘤发展[27-28]。因此,相对于健康成人,HCC患者血清TSGF和VEGF水平明显上升。另一项研究显示,由幼稚干细胞分泌的血清糖蛋白AFP在肝细胞恶性转化后,AFP血清浓度远高于健康成人<20 μg/L的标准[29-30]。研究表明,TNF-α及IL-6在HCC疾病发展中起到调节作用,TNF-α为启动因子,激活细胞因子的炎症反应,当机体组织受损时,其血清水平迅速升高,激活机体内细胞级联效应,加剧炎症反应,促进肿瘤细胞增殖[31-32]。IL-6在肿瘤细胞与炎症反应中发挥介导作用,释放于机体损伤早期,与HCC疾病严重程度成正比[33-34]。因此,综合评估血清肿瘤标志物TSGF、VEGF、AFP以及炎症介质TNF-α、IL-6水平对HCC的疗效评价、转归和预后判断具有良好的应用价值。本研究通过组内和组间比较以上血清肿瘤标志物和炎症介质的差异,有助于更好比较扶正安中汤联合SOR的中西医结合治疗与SOR单独治疗在中晚期HCC患者中的疗效差异。
在安全性方面,2组患者在治疗期间均出现消化道反应、蛋白尿、高血压及手足综合征等,但差异无统计学意义(P>0.05),提示扶正安中汤不增加药物风险,安全性好。另外,相对于对照组,观察组肝功能相关指标更好,显示扶正安中汤可以改善HCC患者的肝功能。大部分中晚期HCC患者肝功能较差,对于后续治疗无法耐受。
本研究由于单中心病例样本、选取时间较短、样本量较少以及未采用盲法等缺陷,可能导致研究结果出现偏移,未来仍需要进一步完善方法,增加样本量深入研究。
综上所述,扶正安中汤联合SOR是治疗TACE后中晚期HCC患者的有效方案,不仅能有效调节血清肿瘤标志物及血清炎症介质水平,而且不增加药物风险,具有一定的临床推广价值。
利益冲突声明:无。

