维持性血液透析患者血浆Aβ、P-tau181水平与认知功能障碍的相关性研究
刘明林 封霞 陈奕心 冷兴丽 王少清
基金項目:中关村肾病血液净化创新联盟CKD青年研究基金项目(NBPIA20QC0202);四川应用心理学研究中心项目(CSXL-23325);成都市医学科研课题(2021056)
作者单位:1成都医学院第二附属医院·核工业四一六医院肾脏病科(邮编610066);2四川省德阳市人民医院肾内科
作者简介:刘明林(1991),男,硕士在读,主要从事慢性肾脏病认知功能障碍方面研究。E-mail:wj294141319@126.com
△通信作者 E-mail:wowosasa2003@163.com
摘要:目的 探讨维持性血液透析(MHD)患者血浆β样淀粉样蛋白(Aβ)、磷酸化tau181蛋白(P-tau181)水平与认知功能障碍(CI)的相关性。方法 122例MHD患者根据蒙特利尔认知评估量表(MoCA)评分分为CI组(MoCA评分<26分,47例)和非CI组(MoCA评分≥26分,75例)。采用酶联免疫吸附试验检测血浆Aβ、P-tau181水平,并比较2组临床资料。Spearman分析MHD患者MoCA评分与血浆Aβ、P-tau181水平的相关性。二元Logistic回归分析MHD患者并发CI的影响因素。应用受试者工作特征(ROC)曲线分析血浆Aβ、P-tau181水平诊断MHD患者并发CI的价值。结果 与非CI组比较,CI组患者高血压比例、受教育年限和舒张压降低,糖尿病比例、P-tau181和Aβ水平升高(P<0.05)。MHD患者血浆Aβ、P-tau181水平与MOCA评分均呈负相关(rs分别为-0.343,-0.402,P<0.05)。Logistic回归分析结果显示,P-tau181、Aβ升高是MHD患者并发CI的危险因素。ROC曲线显示,血浆Aβ、P-tau181及两者联合诊断MHD患者并发CI的曲线下面积分别为0.725、0.752、0.801,三者诊断价值差异无统计学意义。结论 MHD患者血浆中Aβ、P-tau181水平升高与患者CI的发生相关,两者对MHD患者并发CI具有较好的诊断价值。
关键词:肾透析;连续性肾替代疗法;认知功能障碍;β-淀粉样蛋白;磷酸化tau-181
中图分类号:R446.11+9文献标志码:ADOI:10.11958/20231180
Correlation between plasma Aβ and P-tau181 levels and cognitive impairment in maintenance hemodialysis patients
LIU Minglin1, 2, FENG Xia1, CHEN Yixin1, LENG Xingli1, WANG Shaoqing1△
1 Department of Nephrology, the Second Affiliated Hospital of Chengdu Medical College, Nuclear Industry 416 Hospital, Chengdu 610066, China; 2 Department of Nephrology, the People's Hospital of Deyang
△Corresponding Author E-mail: wowosasa2003@163.com
Abstract: Objective To investigate the correlation between plasma β-like amyloid (Aβ), phosphorylated tau181 protein (P-tau181) levels and cognitive impairment (CI) in patients on maintenance hemodialysis (MHD). Methods One hundred and twenty-two MHD patients were divided into the CI group (MoCA score<26, n=47) and the non-CI group (MoCA score≥26, n=75) according to Montreal Cognitive Assessment Scale (MoCA) score. Plasma Aβ and P-tau181 levels were measured using enzyme-linked immunosoradsorption assay. The clinical data were compared between the two groups of patients. Spearman's analysis was used to analyze the correlation between MoCA score and plasma Aβ and P-tau181 levels in MHD patients. Binary Logistic regression was used to analyze influencing factors of concurrent CI in MHD patients. The value of plasma Aβ, P-tau181 levels in diagnosing concurrent CI in MHD patients was analyzed by applying the receiver operating characteristic curve (ROC). Results Compared with the non-CI group, patients in the CI group had lower proportions of hypertension, years of education and diastolic blood pressure, and higher proportions of diabetes, P-tau181 and Aβ levels (P < 0.05). Plasma Aβ and P-tau181 levels were negatively correlated with MOCA scores in MHD patients (rs=-0.343, -0.402, respectively, P<0.05). Logistic regression analysis showed that elevated P-tau181 and Aβ were risk factors for concurrent CI in MHD patients. ROC curves showed that the areas under the curves for plasma Aβ, P-tau181 and the combination of the two for diagnosis of concurrent CI in MHD patients were 0.725, 0.752 and 0.801, respectively. The difference in diagnostic value between the three was not statistically significant. Conclusion Elevated plasma levels of Aβ and P-tau181 are correlated with the occurrence of CI in MHD patients, and both have good diagnostic value for CI in patients with MHD.
Key words: renal dialysis; continuous renal replacement therapy; cognitive impairment; β-amyloid; phosphorylated tau-181
认知功能障碍(cognitive impairment,CI)是指大脑一个或多个关键功能的缺陷,包括记忆、执行功能、注意力和语言流畅性等方面[1]。CI是慢性肾脏病(chronic kidney disease,CKD)患者常见的神经并发症之一,具有发病率高、治疗困难、临床易被忽视等特点。维持性血液透析(maintenance hemodialysis,MHD)是CKD患者终末期常见的肾脏替代治疗方式之一。既往研究表明MHD患者CI的发生率为30%~70%[2]。MHD并发CI可导致患者药物和治疗依从性下降、营养不良、生活质量下降、独立性丧失、照顾者负担加重及过早死亡[3]。脑脊液中β淀粉样蛋白(Aβ)42、Aβ40和磷酸化tau蛋白(P-tau蛋白)是临床诊断阿尔茨海默病(Alzheimer's disease,AD)的有效生物标志物。基于血液的AD生物标志物(特别是经典的Aβ42、P-tau181和T-tau)受到了广泛的关注。研究证实血浆生物标志物几乎与脑脊液生物标志物同时显示变化,遵循相似的轨迹[4]。在一项关于CKD患者的队列研究中,CI的血浆病理蛋白(如Aβ)浓度与肾小球滤过率呈负相关[5],且CKD并发CI患者的Aβ浓度高于无CI者[6]。目前临床迫切需要寻找早期鉴别终末期肾脏疾病患者是否合并CI的有效方法,基于血液标本检测病理蛋白诊断CI的方法具有创伤小、成本效益高的优点。因此,本研究旨在探讨血浆P-tau181、Aβ与MHD患者并发CI的关系及其诊断价值,为后续诊治提供参考依据。
1 对象与方法
1.1 研究对象 选择2023年1月—6月德阳市人民医院血液净化中心行MHD患者作为研究对象。纳入标准:(1)年龄≥18岁。(2)正在接受规律血液透析治疗,已满3个月的终末期肾病患者(尿素清除指数≥1.2,尿素下降率>65%)。排除标准:(1)影响生存期的恶性肿瘤患者。(2)既往患有脑血管疾病、心肌梗死患者。(3)痴呆患者。(4)使用苯二氮类药物者。(5)有精神病史,如抑郁症或精神分裂症。(6)有感官(视觉和听觉)或运动障碍,无法完成测试者。纳入符合上述条件的MHD患者122例,其中男68例,女54例;年龄25~84岁,平均(52.59±13.19)岁。本研究通过德阳市人民医院伦理委员会审核批准(伦理号:2023-04-014-K01),并通过中国临床试验注册中心批准(注册号为ChiCTR2300070478),所有患者均签署知情同意书。
1.2 研究方法
1.2.1 一般资料收集及实验室检查 (1)收集患者性别、年龄、糖尿病和高血压患病情况、受教育年限、透析龄、收缩压、舒张压、身体质量指数(BMI)。(2)实验室指标。于透析前空腹抽取静脉血13 mL,分别置于EDTA抗凝管和促凝管中,3 500 r/min离心10 min,取血清或血浆检测以下实验室指标,包括血清白蛋白(ALB,溴甲酚绿法)、转铁蛋白饱和度(TSAT,血清铁/总铁结合力)、血磷(P,磷钼酸盐法)、甲状旁腺激素(PTH,直接化学发光法)、血红蛋白(Hb,血细胞分析仪比色法)、铁蛋白(胶乳免疫法)、胆固醇(TC,CHOD-PAP法)、三酰甘油(TG,酶法)、血钙(Ca,偶氮胂Ⅲ比色法)。
1.2.2 血浆Aβ、P-tau181水平检测 患者空腹抽取外周静脉血3 mL,置于EDTA抗凝管,3 000 r/min离心15 min,取血浆保存于-80 ℃冰箱待测,采用Aβ、P-tau181酶联免疫吸附试验(ELISA)试剂盒(上海科顺生物科技有限公司)进行检测,严格按照试剂盒说明书进行操作。
1.2.3 认知功能评估 采用蒙特利尔认知评估量表(Montreal Cognitive Assessment Scale,MoCA)评估患者认知功能,于血液透析前2 h内进行。MoCA量表包括8个项目,总分为0~30分。为校正受教育年限对评分结果的影响,根据受教育年限的不同,受教育年限≤9年者在总分上加2分,9年<受教育年限≤12年者在总分上加1分;根据受教育年限校正后所得MoCA评分分为2组,MoCA评分≥26分为非CI组75例,MoCA评分<26分为CI组47例。由接受神经内科专科认知培训合格的1名研究生进行测量。
1.3 统计学方法 采用SPSS 25.0软件进行数据分析。符合正态分布的计量资料以均数±标准差([x] ±s)表示,2组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,2组间比较采用Mann-Whitney U检验;计数资料以例(%)表示,組间比较采用χ2检验。相关性分析采用Spearman相关。采用二元Logistic回归分析MHD患者并发CI的影响因素。采用受试者工作特征(ROC)曲线分析Aβ、P-tau181及Aβ+P-tau181(两者Logistic回归分析所得)在MHD合并CI中的诊断价值,曲线下面积(AUC)比较采用DeLong′s检验。P<0.05为差异有统计学意义。
2 结果
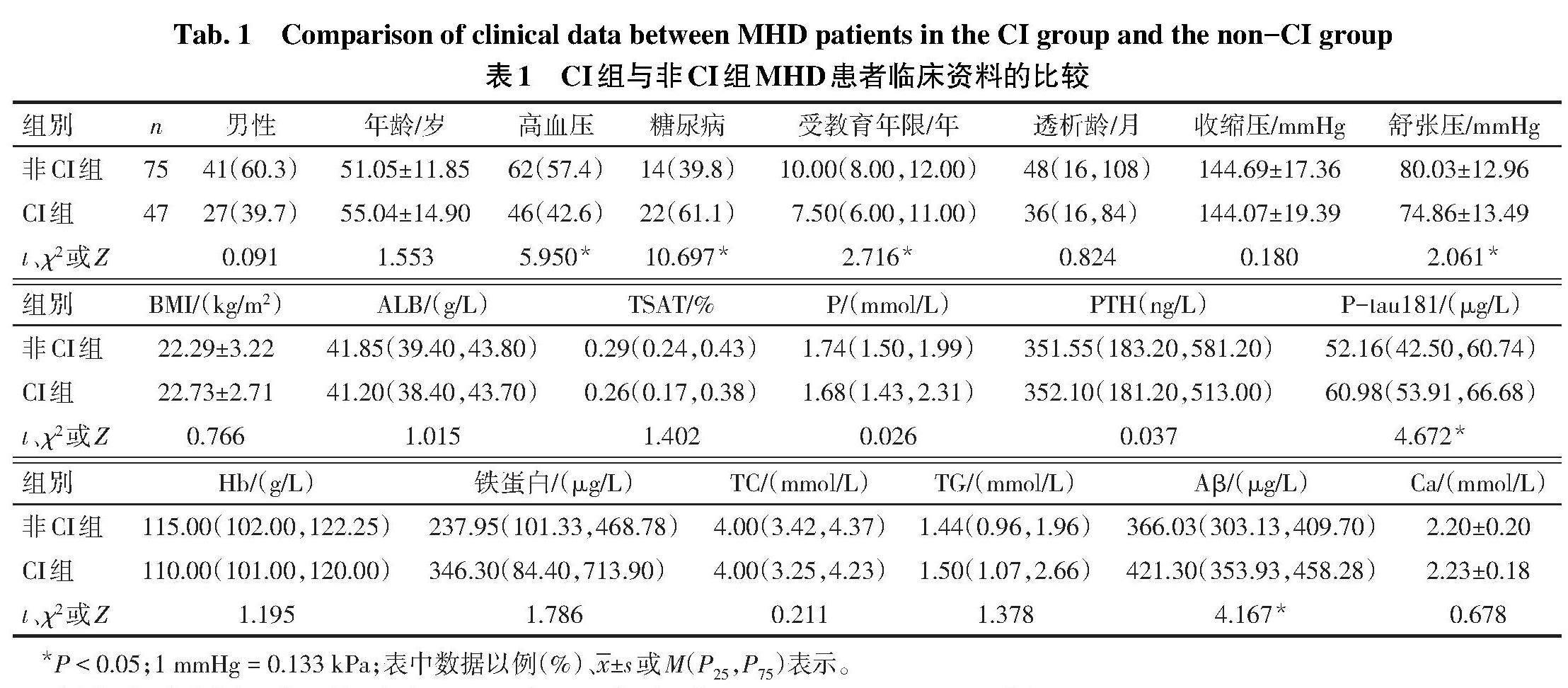
2.1 2组患者临床资料的比较 与非CI组比较,CI组患者高血压比例、受教育年限和舒张压降低,糖尿病比例、血浆P-tau181和Aβ水平升高(P<0.05);2组患者性别、年龄、透析龄、收缩压、BMI、ALB、TSAT、P、PTH、Hb、铁蛋白、TC、TG、Ca差异均无统计学意义(P>0.05),见表1。
2.2 MHD患者血浆Aβ、P-tau181水平与MOCA评分的相关性分析 MHD患者血浆Aβ、P-tau181水平与MOCA评分均呈负相关(rs分别为-0.343、-0.402,P<0.05)。
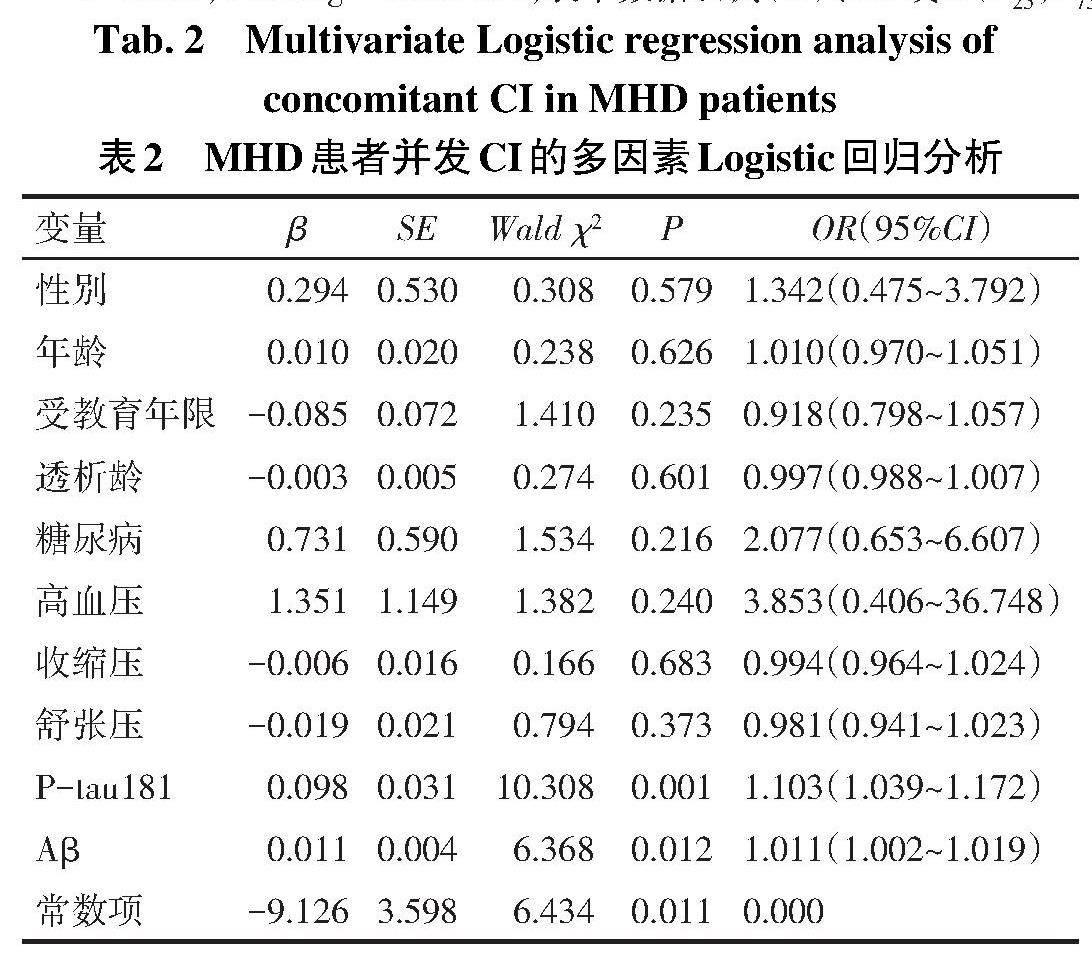
2.3 MHD患者并发CI的影响因素分析 以MHD患者是否并发CI(是=1,否=0)为因变量,以性别(男=1,女=0)、年龄、受教育年限、透析龄、糖尿病(是=1,否=0)、高血压(是=1,否=0)、收缩压、舒张压、P-tau181、Aβ为自变量,进行多因素Logistic回归分析。结果显示,P-tau181、Aβ升高是MHD患者并发CI的危险因素,见表2。
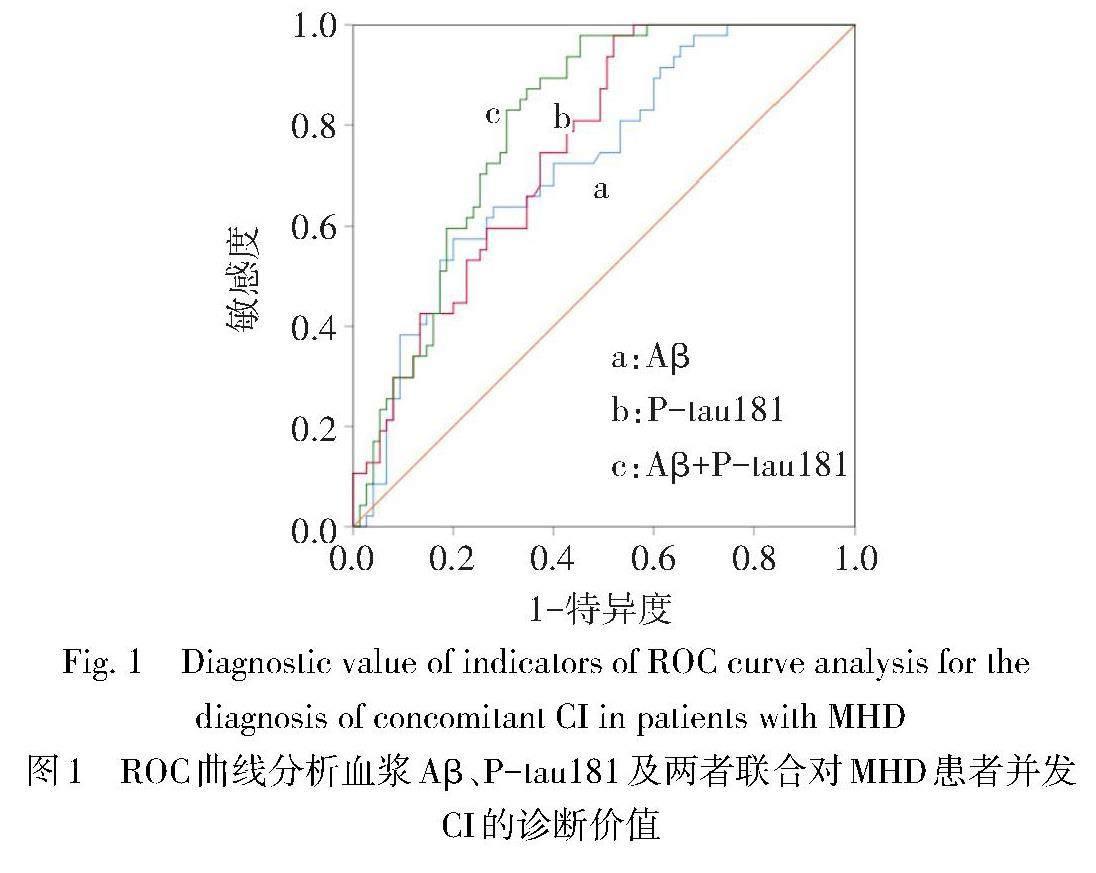
2.4 血浆Aβ、P-tau181水平对MHD患者并发CI的诊断价值 ROC曲线显示,血浆Aβ、P-tau181及两者联合诊断MHD患者并发CI的ROC曲线下面积分别为0.725、0.752、0.801,血浆Aβ联合血浆P-tau181对MHD患者并发CI的诊断价值与两指标单独诊断差异无统计学意义(Z分别为1.921、1.755,P>0.05),见图1、表3。
3 讨论
血液透析患者普遍存在不同程度的CI,而临床易忽视,导致患者预后不良[7]。因此重视MHD患者CI,早发现、早干预是目前临床工作者亟需解决的。既往常规评估认知功能手段包括量表评估、脑脊液、影像学检查,这需要专业医生评估;这些检查包括有创性的、耗时且费用高的,因此亟待寻找便捷、费用低的生物标志物。
目前CKD并发CI的确切发病机制尚不清楚,其主要影响因素包括高血压、糖尿病、高脂血症、受教育程度[8]等传统因素,炎症、氧化应激、尿毒症毒素、贫血、PTH升高等肾病相关因素,透析所致颅内低灌注及低氧、血压变化、脑微小梗死等因素,上述几个因素相互作用引起脑卒中、微小血管病变,进而导致CI。本研究结果显示,与非CI组比较,CI组患者高血压比例、受教育年限和舒张压降低,糖尿病比例升高;上述结果与既往传统危险因素所致CI相一致,另提示在透析特殊人群,适当范围的血压升高能确保脑的灌注。
CI和AD的典型临床特征是细胞外老年斑形成(Aβ沉积)和细胞内神经纤维缠结(NFT,tau蛋白磷酸化)[9]。Aβ在中枢神经系统中引起毒性,最终导致神经元死亡,并且神经毒性会导致tau蛋白过度磷酸化,随后聚集形成NFT,破坏神经元微管结构的稳定性,损害轴突的运输功能,导致神经元死亡,并导致认知能力下降。MHD合并CI患者存在肾病特有慢性炎症、氧化应激、尿毒症毒素等危险因素,血脑屏障通透性增加[10-11],以及透析尚无法完全清除Aβ、tau蛋白,提示上述因素可能通过升高Aβ、tau蛋白水平,在MHD患者并发CI过程中发挥着重要作用。既往研究表明,MHD患者血浆中Aβ40、Aβ42、Tau和P-tau181水平均高于健康对照组,提示MHD患者更容易罹患CI[12]。本研究结果显示,CI组血浆Aβ、P-tau181水平较非CI组升高,且为MHD并发CI的危险因素。分析原因如下:(1)MHD患者并发CI过程中氧化应激发挥着重要作用,而氧化应激与Aβ水平互为因果,形成恶性循环[13-14]。(2)肾脏与大脑存在共同血管解剖结构,导致大脑易出现血管功能障碍,与尿毒症毒素和慢性炎症三者共同作用下可致血脑屏障通透性增加。(3)MHD患者Aβ水平较健康者升高,且透析无法清除tau蛋白[15],两者通过血脑屏障在相应部位沉积,从而影响认知功能。
Janine等[16]研究表明,基线高血浆Aβ水平的CKD患者认知能力较低血浆Aβ水平患者更差,经2年随访发现,血浆Aβ水平高的患者认知能力中度下降,但血浆Aβ水平低的患者认知能力提升,提示血浆Aβ水平与认知功能相关,可以作为预测CKD患者认知功能的生物标志物。本研究结果显示,MHD患者中血浆Aβ、P-tau181水平与MoCA评分呈负相关,提示血浆Aβ、P-tau181水平可以一定程度上反映MHD患者的认知功能。既往研究表明,轻度认知功能障碍(MCI)组患者血清Aβ1-42和P-tau181水平明显高于对照组,且血清Aβ1-42和P-tau181水平升高是MCI的危险因素,提示糖尿病患者血清Aβ1-42和P-tau181与MCI密切相关,检测两者水平可早期诊断及预防老年2型糖尿病患者合并认知功能损害[17]。研究证实,在普通人群中,Aβ42、t-tau及两者联合对MCI具有较好的诊断价值(AUC≥0.8)[18]。有研究表明,血浆P-tau181水平变化与AD神经退变进展有关[19-20],且血浆P-tau217和P-tau181水平可反映AD患者大脑的病理变化,具有良好的诊断价值[21]。本研究结果显示,血浆Aβ、P-tau181及两者联合诊断MHD患者并发CI的AUC分别为0.725、0.752、0.801,提示血浆Aβ、P-tau181及两者联合对MHD患者并发CI均具有较好的诊断价值。
综上所述,血浆P-tau181、Aβ水平升高是MHD患者并发CI的危险因素,血浆P-tau181、Aβ可作为预测MHD患者发生CI的潜在指标。但本研究存在一定局限性,如样本量较小,缺乏纵向研究评估血浆Aβ、P-tau181在MHD患者认知变化之间的因果联系,故相关研究结论尚待进一步验证。
参考文献
[1] 乔雨晨,常红,王佳妹,等. 认知功能障碍患者激越行为特点及影响因素分析[J]. 中国现代神经疾病杂志,2023,23(4):310-316. QIAO Y C,CHANG H,WANG J M,et al. Analysis of the characteristics of agitated behavior and its influencing factors in patients with cognition disorders[J]. Chin J Contemp Neurol Neurosurg,2023,23(4):310-316. doi:10.3969/j.issn.1672-6731.2023.04.007.
[2] 吳思洋,张瑾,王盈,等. 补体C3水平与终末期肾病患者认知功能障碍的相关性研究[J]. 临床肾脏病杂志,2022,22(7):534-539. WU S Y,ZHANG J,WANG Y,et al. Correlation between serum complement C3 levels and cognitive dysfunction in patients with endstage renal disease[J]. J Clin Nephrol,2022,22(7):534-539. doi:10.3969/j.issn.1671-2390.2022.07.00.2.
[3] WANG Y,HU L,ZHOU D,et al. Association of urinary biomarkers of renal tubular injury with cognitive dysfunction in older patients with chronic kidney disease:a cross-sectional observational study[J]. Brain Sci,2023,13(4):551. doi:10.3390/brainsci13040551.
[4] PALMQVIST S,INSEL P S,STOMRUD E,et al. Cerebrospinal fluid and plasma biomarker trajectories with increasing amyloid deposition in Alzheimer's disease[J]. EMBO Mol Med,2019,11(12):e11170. doi:10.15252/emmm.201911170.
[5] GRONEWOLD J,KLAFKI H W,BALDELLI E,et al. Factors responsible for plasma β-amyloid accumulation in chronic kidney disease[J]. Mol Neurobiol,2016,53(5):3136-3145. doi:10.1007/s12035-015-9218-y.
[6] VINOTHKUMAR G,KEDHARNATH C,KRISHNAKUMAR S,et al. Abnormal amyloid β42 expression and increased oxidative stress in plasma of CKD patients with cognitive dysfunction:a small scale case control study comparison with Alzheimer's disease[J]. BBA Clin,2017,8:20-27. doi:10.1016/j.bbacli.2017.06.001.
[7] KUPSKE J W,KRUG M M,KRUG R R. Cognitive function of patients with chronic renal insufficiency in hemodialysis:a systematic review[J]. Psicologia:Teoria E Pesquisa,2023,39:e39202. doi:10.1590/0102.3772e39202.en.
[8] 田茹,郭一丹,羅洋. 血液透析患者认知功能变化的特征及风险因素分析[J]. 天津医药,2019,47(7):723-726. TIAN R,GUO Y D,LUO Y. Changes of cognitive function and its associated risk factors in hemodialysis patients[J]. Tianjin Med J,2019,47(7):723-726. doi:10.11958/20190258.
[9]张会芹. 还脑益聪方干预Aβ-tau神经毒性交互作用改善AD认知功能的机制研究[D]. 北京:中国中医科学院,2023. ZHANG H Q. The mechanism of Huannao Yicong decoction to improve cognitive function of APP/PS1/tau mice by interfering with neurotoxic interaction of Aβ-tau[D]. Beijing:China Academy of Chinese Medical Sciences,2023.
[10] 王凤,马微波,刘悦文,等. 慢性肾脏病患者认知功能受损的相关机制分析[J]. 中国医学科学院学报,2022,44(6):1082-1088. WANG F,MA W B,LIU Y W,et al. Mechanism of impaired cognitive function in patients with chronic kidney disease [J]. Acta Academiae Medicinae Sinicae,2022,44(6):1082-1088. doi:10.3881/j.issn.1000.503X.14291.
[11] BOBOT M,THOMAS L,MOYON A,et al. Uremic toxic blood-brain barrier disruption mediated by AhR activation leads to cognitive impairment during experimental renal dysfunction[J]. J Am Soc Nephrol,2020,31(7):1509-1521. doi:10.1681/ASN.2019070728.
[12] WANG X,CHEN X,TANG Y,et al. The impact of hemodiafiltration on cognitive function in patients with end-stage renal disease[J]. Front Neurosci,2023,16:980658. doi:10.3389/fnins.2022.980658.
[13] TABNER B J,EL-AGNAF O M,TURNBULL S,et al. Hydrogen peroxide is generated during the very early stages of aggregation of the amyloid peptides implicated in Alzheimer disease and familial British dementia[J]. J Biol Chem,2005,280(43):35789-35792. doi:10.1074/jbc.C500238200.
[14] TAMAGNO E,GUGLIELMOTTO M,ARAGNO M,et al. Oxidative stress activates a positive feedback between the γ‐and β‐secretase cleavages of the β-amyloid precursor protein[J]. J Neurochem,2008,104(3):683-695. doi:10.1111/j.1471-4159.2007.05072.
[15]KITAGUCHI N,TATEBE H,SAKAI K,et al. Influx of tau and amyloid-β proteins into the blood during hemodialysis as a therapeutic extracorporeal blood amyloid-β removal system for Alzheimers disease[J]. J Alzheimers Dis,2019,69(3):687-707. doi:10.3233/JAD-190087.
[16] JANINE G,OLGA T,HANS-WOLFGANG K,et al. Association of plasma β-amyloid with cognitive performance and decline in chronic kidney disease[J]. Mol Neurobiol,2017,54(9):7194-7203. doi:10.1007/s12035-016-0243-2.
[17] 许雪,孔璐璐,李伟. 血清Aβ1-42及P-tau-181与老年2型糖尿病轻度认知功能障碍的关系[J]. 重庆医学,2021,50(24):4193-4199.XU X,KONG L L,LI W. Association of serum Aβ1-42,P-tau-181 and mild cognitive impairment in older adults with type 2 diabetes mellitus[J]. Chongqing Medicine,2021,50(24):4193-4199. doi:10.3969/j.issn.1671-8348.2021.24.011.
[18] CHEN T B,LEE Y J,LIN S Y,et al. Plasma Aβ42 and total tau predict cognitive decline in amnestic mild cognitive impairment[J]. Sci Rep,2019,9(1):13984. doi:10.1038/s41598-019-50315-9.
[19] JANELIDZE S,MATTSSON N,PALMQVIST S,et al. Plasma P-tau181 in Alzheimers disease:relationship to other biomarkers,differential diagnosis,neuropathology and longitudinal progression to Alzheimers dementia[J]. Nat Med,2020,26(3):379-386. doi:10.1038/s41591-020-0755-1.
[20] MOSCOSO A,GROTHE M J,ASHTON N J,et al. Longitudinal associations of blood phosphorylated Tau181 and neurofilament light chain with neurodegeneration in Alzheimer disease[J]. JAMA Neurol,2021,78(4):396-406. doi:10.1001/jamaneurol.2020.4986.
[21] THIJSSEN E H,LA JOIE R,STROM A,et al. Plasma phosphorylated tau 217 and phosphorylated tau 181 as biomarkers in Alzheimer's disease and frontotemporal lobar degeneration:a retrospective diagnostic performance study[J]. Lancet Neurol,2021,20(9):739-752. doi:10.1016/S1474-4422(21)00214-3.
(2023-08-15收稿 2023-11-06修回)
(本文編辑 陈丽洁)

