SEPT9基因甲基化水平在膀胱尿路上皮病变鉴别诊断中的应用
王更芳,周晓莉,郭 媛,饶 秋
尿路上皮病变的组织学形态具有多样性,不同组织学分型对应的临床结果和生物学行为不同,导致后续的治疗和预后存在差异[1-3]。尿路上皮病变的诊断主要依靠组织学检查,然而有时良、恶性病变在形态上存在重叠,鉴别诊断困难。免疫组化在辅助鉴别诊断方面具有局限性[4]。膀胱镜活检组织病理检查是诊断的金标准,然而,诊断的准确性取决于膀胱镜医师和病理医师的个人经验,由于取样误差,不能排除假阴性的可能。因此,发掘较为客观、敏感、特异的检测方法很有必要。DNA甲基化是重要的表观遗传修饰之一,与肿瘤的发生、发展密切相关[5]。DNA甲基化检测不仅可应用于活检、冷冻及石蜡包埋组织[6-8],也可应用于癌症患者的外周血和其他体液,为许多包括泌尿系统恶性肿瘤患者提供了非侵入性分子筛查方法[9-10]。SEPT9属于GTP结合蛋白,参与细胞膜运输、胞质分裂、血管生成和细胞增殖[11]。SEPT9已被证实在结直肠癌中具有表观遗传修饰作用,检测血浆中ctDNA SEPT9甲基化可用于早期筛查[12]。有研究发现,尿液中的SEPT9甲基化检测可作为监测膀胱癌很有前途的标志物[10]。本研究通过对160例尿路上皮病变石蜡组织进行SEPT9甲基化检测,探讨SEPT9甲基化检测在尿路上皮良、恶性病变中的鉴别诊断意义,尝试通过联合使用SEPT9甲基化检测降低膀胱镜活检组织的假阴性率。
1 材料与方法
1.1 组织样本选取收集2014年1月~2023年12月常州市第二人民医院膀胱镜活检、电切、手术切除的经明确病理诊断的非浸润性尿路上皮病变160例,由2位经验丰富的病理诊断医师对所有切片按WHO(2022)泌尿与男性生殖系统肿瘤分类标准重新阅片。最终诊断为扁平状尿路上皮病变43例,其中包括尿路上皮急、慢性炎15例,不典型增生11例,异型增生10例,原位癌7例;乳头状尿路上皮病变41例,包括乳头状瘤3例、低度恶性潜能的乳头状尿路上皮肿瘤16例、低级别乳头状尿路上皮癌12例、高级别乳头状尿路上皮癌10例;内翻性尿路上皮病变76例,包含腺性膀胱炎21例、内翻性尿路上皮乳头状瘤20例、内翻性低度恶性潜能的尿路上皮肿瘤10例、低级别内翻性尿路上皮癌15例、高级别内翻性尿路上皮癌10例。另收集15对尿路上皮癌和癌旁组织进行临床验证。癌组织经组织病理确诊,而癌旁组织则分别采集离癌组织相对较近和较远的组织。相对较近的癌旁组织,对照HE染色刮取距离癌组织1~2 cm的正常尿路上皮细胞;相对较远的癌旁组织,选择离肿瘤最远处的远端切缘尿路上皮组织。另选12对首次膀胱镜活检为炎症或良性病变、后续活检或电切为癌的组织。对上述组织分别进行SEPT9甲基化检测。
1.2 SEPT9 DNA甲基化检测每个病例选取代表性石蜡包埋组织,切取5 μm厚石蜡卷。相对较近的癌旁组织,每个病例选取1个代表性蜡块,切5 μm厚白片,捞在载玻片上,对照HE染色刮取目的区域以富集1~2 cm范围内的正常尿路上皮细胞。相对较远的癌旁组织,则选择远端切缘尿路上皮组织切5 μm厚石蜡卷。FFPE DNA提取试剂盒(购自厦门艾德生物公司)提取DNA,为确保DNA样品的质量,使用安捷伦生物分析仪NanoDrop(赛默飞世尔科技,美国)评估DNA样品的浓度、纯度。确保浓度>10 ng/μL,纯度(A260/A280比值)在1.5~2.2之间,质控合格后取100 μL总质量为200 ng的DNA,按SEPT9甲基化处理试剂盒(购自北京博尔诚科技公司)说明书进行亚硫酸盐转化处理,最后将DNA按比例加入相应体积的PCR反应液和PCR聚合酶,每次实验均设阴性和阳性对照,按照说明书上机。使用ABI 7500实时荧光定量PCR仪扩增45个热循环后读取数据结果。当内参28≤β-ACTB≤32时,以ΔCt(ΔCtSEPT9=CtSEPT9-Ctβ-ACTB)作为循环阈值,计算SEPT9基因甲基化的相对表达量。
1.3 统计学分析采用GraphPad Prism 5.0软件进行统计学分析,绘制散点图。分类资料分析采用χ2检验。对SEPT9在各类病变中的甲基化水平进行显著性分析,以P<0.05为差异有统计学意义。ROC曲线分析计算敏感性、特异性。采用约登指数(敏感性+特异性-1)计算最佳临界值。当约登指数取最大值0.891时,建立最佳临界值ΔCt为5.34(P<0.000 1)。SEPT9甲基化ΔCt值≤5.34判为阳性,ΔCt值>5.34判为阴性。
2 结果
2.1 临床病理特征扁平状尿路上皮病变:(1)不典型增生,尿路上皮正常或轻度增厚,从基底部到表层结构清晰,极性明显;细胞增大,胞质丰富,核大小一致;固有层有炎症反应(图1)。(2)尿路上皮异型增生,细胞排列轻度紊乱,核大小差异不大(图2)。(3)尿路上皮原位癌,细胞排列紊乱,极向和黏附性消失,细胞体积增大,多形性明显,核染色质粗糙或凝块状,核仁大而明显(图3)。乳头状尿路上皮病变:(1)尿路上皮乳头状瘤,呈外生性生长,纤维血管轴心被覆正常的尿路上皮,乳头游离细长,无分枝或有小分支,细胞无异型,无核分裂象(图4)。(2)低度恶性潜能的乳头状尿路上皮肿瘤,与乳头状瘤相似,层次增厚(>10层),细胞大小一致,极性明显,细胞无异型或轻度异型,罕见核分裂象(图5)。(3)低级别乳头状尿路上皮癌,极向轻度紊乱,细胞异型性明显,可见核分裂象(图6)。(4)高级别乳头状尿路上皮癌,极性紊乱,细胞大小极不一致,核大,核仁明显,核分裂象易见,核染色质浓缩,细胞间黏附性差(图7)。内翻性尿路上皮病变:(1)腺性膀胱炎,表面黏膜组织正常或增厚,固有膜内可见Brunn巢,细胞无异型性,无核分裂象(图8)。(2)内翻性尿路上皮乳头状瘤,固有膜内乳头呈小梁状生长,梁周边上皮细胞栅栏状排列,中央为流水样排列,梁与梁之间相互吻合,细胞无明显异型(图9)。(3)内翻性低度恶性潜能的尿路上皮肿瘤,固有层内尿路上皮明显增厚(>10层细胞)、无吻合;细胞极向明显、轻度不典型(图10)。(4)低级别内翻性尿路上皮癌,固有膜内见宽窄不一、不规则的乳头状细胞索或细胞巢,可见纤维脉管轴心;细胞轻度异型,少量核分裂象(图11);常伴有外生乳头状结构。(5)高级别内翻性尿路上皮癌,尿路上皮在固有膜内呈不规则乳头状,乳头相互融合,呈实体状,表面被覆的肿瘤细胞厚薄不一;细胞大小不一、多形性、排列杂乱;细胞核大、深染,易见核分裂象(图12),常伴有外生乳头状结构。
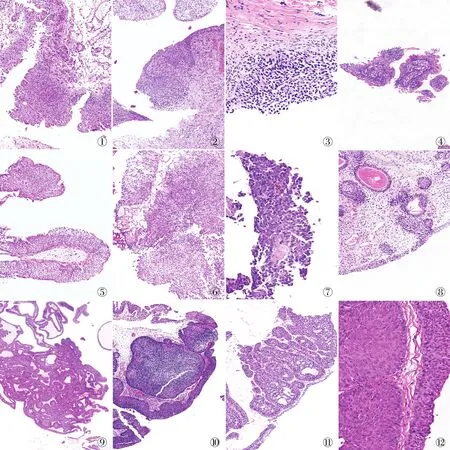
图1 尿路上皮不典型增生:上皮细胞增厚,极性明显,固有层炎细胞浸润 图2 尿路上皮异型增生:尿路上皮增厚,细胞排列轻度紊乱 图3 尿路上皮原位癌:细胞排列紊乱,极性和黏附性消失,多形性明显 图4 尿路上皮乳头状瘤:外生性生长,纤维血管轴心被覆正常的尿路上皮,乳头游离细长,无分枝,细胞无异型 图5 低度恶性潜能的乳头状尿路上皮肿瘤:细胞层数超过10层,大小一致,极性明显 图6 低级别乳头状尿路上皮癌:极向轻度紊乱,细胞异型性明显 图7 高级别乳头状尿路上皮癌:极性紊乱,失黏附,核分裂象易见(箭头) 图8 腺性膀胱炎:尿路上皮表面黏膜组织正常,固有膜内可见Brunn巢,细胞无异型性 图9 内翻性尿路上皮乳头状瘤:固有膜内乳头呈小梁状生长,梁与梁之间相互吻合 图10 内翻性低度恶性潜能的尿路上皮肿瘤:固有层内尿路上皮明显增厚(>10层细胞)、无吻合。细胞大小一致、轻度不典型 图11 低级别内翻性尿路上皮癌:固有层内见宽窄不一、不规则、无吻合的乳头状细胞索或细胞巢,可见纤维脉管轴心。细胞轻度异型 图12 高级别内翻性尿路上皮癌:固有膜内乳头相互融合,呈实体状,细胞大小不一、多形性、核大、深染
2.2 160例尿路上皮病变组织SEPT9甲基化检测结果43例扁平状尿路上皮病变中,急、慢性炎性病变SEPT9甲基化检测均为阴性,不典型增生、异型增生、原位癌SEPT9甲基化阳性率分别为9%(1/11)、100%(10/10)、100%(7/7);41例乳头状尿路上皮病变中,3例乳头状瘤SEPT9甲基化检测均为阴性,低度恶性潜能的乳头状尿路上皮肿瘤、低、高级别乳头状尿路上皮癌SEPT9甲基化阳性率分别为100%(16/16)、92%(11/12)、100%(10/10);76例内翻性尿路上皮病变中,腺性膀胱炎、内翻性尿路上皮乳头状瘤、内翻性低度恶性潜能的尿路上皮肿瘤、低、高级别内翻性尿路上皮癌中SEPT9甲基化阳性率分别为10%(2/21)、5%(1/20)、100%(10/10)、93%(14/15)、100%(10/10)(表1)。良性病变与恶性病变间SEPT9基因甲基化水平差异有统计学意义(P<0.000 1,图13)。SEPT9甲基化辅助诊断良性病变与低度恶性潜能尿路上皮肿瘤的敏感性、特异性、阳性预测值和阴性预测值分别为100%、94%、87%和100%;SEPT9甲基化辅助诊断良性病变与恶性病变的敏感性、特异性、阳性预测值和阴性预测值分别为98%、94%、96%和97%(表2)。

表1 不同类型尿路上皮病变中的SEPT9基因甲基化情况
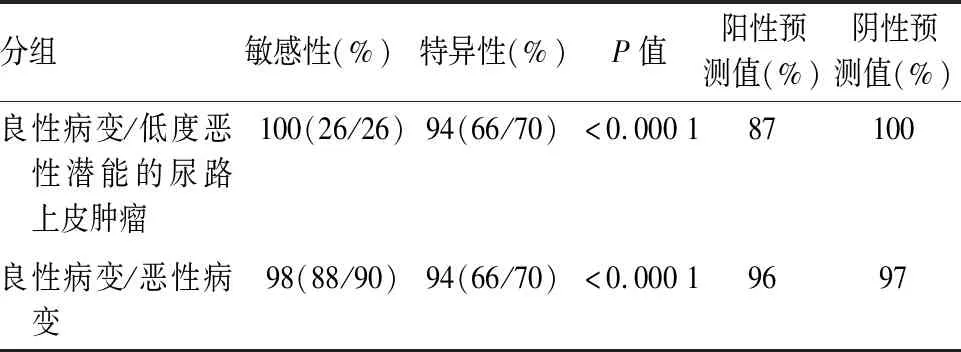
表2 尿路上皮良恶性病变鉴别诊断中SEPT9甲基化检测的敏感性、特异性、阳性预测值和阴性预测值
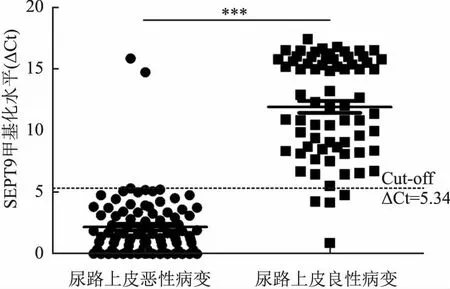
图13 尿路上皮良、恶性病变中SEPT9甲基化水平:***P<0.000 1
2.3 尿路上皮癌和癌旁组织中SEPT9甲基化检测结果15例远端切缘组织SEPT9甲基化检测均为阴性,15例癌组织和7例邻近癌旁组织SEPT9甲基化检测阳性。15例癌组织中,10例高级别乳头状尿路上皮癌均伴有浸润;另5例低级别乳头状尿路上皮癌中有2例伴有浸润。7例邻近癌旁组织SEPT9甲基化阳性病例中,6例高级别乳头状尿路上皮癌均伴有浸润,1例低级别乳头状尿路上皮癌无浸润。8例邻近癌旁组织SEPT9甲基化阴性病例中,4例高级别乳头状尿路上皮癌均伴有浸润,4例低级别乳头状尿路上皮癌中2例伴有肌层浸润,2例无浸润。部分病例邻近癌组织的正常尿路上皮细胞发生了DNA甲基化,提示这部分SEPT9甲基化阳性病例表观遗传修饰异常,与肌层浸润无关(图14)。
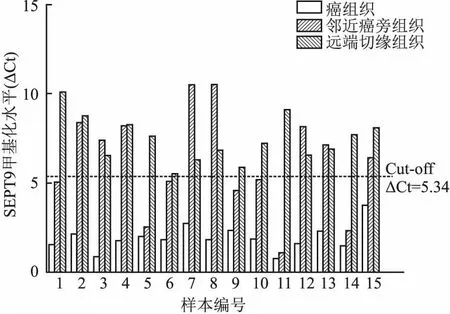
图14 癌组织、邻近癌旁组织、远端切缘组织中SEPT9甲基化水平
2.4 初次活检为炎症、良性病变而后续活检、电切为癌的组织SEPT9甲基化检测结果对12例膀胱镜活检未取到癌细胞,而后续活检、电切证实为尿路上皮癌的组织进行SEPT9甲基化检测。12例首次活检病理为炎症或良性病变的组织中,有8例SEPT9 DNA甲基化检测为阳性,阳性率为67%(8/12);12例再次活检、电切病理证实为癌的组织SEPT9甲基化检测均为阳性,阳性率100%(12/12)。提示SEPT9甲基化阳性而活检为阴性的病例需密切随访,必要时再次活检(图15)。
3 讨论
扁平状尿路上皮病变中不典型增生、异型增生、原位癌三者的生物学行为、预后和治疗方式均不同。不典型增生属于反应性、增生性病变;异型增生属癌前病变,进展为原位癌的可能性为20%;60%~80%的尿路上皮原位癌可能进展为浸润性癌,并且易复发,需进行灌注治疗[13]。因此明确诊断非常必要,但三者的形态学存在重叠。不典型增生,尿路上皮轻度增厚,核大小一致;异型增生,细胞极性稍紊乱,核大小差异不大。两者界限不明显,尤其是活检组织、机械损伤严重时因组织小,细胞形态模糊,诊断重复性差。本研究中不典型增生SEPT9甲基化阳性率9%(1/11),异型增生甲基化阳性率100%(10/10),原位癌甲基化阳性率100%(7/7)。提示不典型增生与异型增生在形态学上鉴别诊断困难时,可行SEPT9甲基化检测辅助诊断。异型增生与原位癌SPET9甲基化检测结果均为阳性。因此,SPET9甲基化检测在异型增生和原位癌之间不具有鉴别诊断作用。
膀胱乳头状尿路上皮肿瘤在膀胱活检标本中非常常见。乳头状尿路上皮肿瘤分为尿路上皮乳头状瘤、低度恶性潜能的乳头状尿路上皮肿瘤、低、高级别乳头状尿路上皮癌。尿路上皮乳头状瘤属于良性病变,低度恶性潜能的乳头状尿路上皮肿瘤具有一定的复发率。有研究显示随访128个月,低度恶性潜能的乳头状尿路上皮肿瘤的复发率为20.1%,其中9%患者复发仍为低度恶性潜能的乳头状尿路上皮肿瘤,9.5%患者进展为低级别乳头状尿路上皮癌,1.6%患者进展为高级别乳头状尿路上皮癌,因此此类病例需密切随访[14]。低度恶性潜能的乳头状尿路上皮肿瘤与乳头状瘤在形态学上是一个连续的谱带,并且乳头状瘤、不典型增生、低度恶性潜能的乳头状尿路上皮肿瘤可共同存在于同一病例中[15]。因此单从形态学上难以鉴别。本组中3例尿路上皮乳头状瘤SEPT9甲基化均为阴性,低度恶性潜能的乳头状尿路上皮肿瘤SEPT9甲基化阳性率为100%(16/16)。提示尿路上皮乳头状瘤与乳头状尿路上皮恶性病变的SEPT9甲基化水平存在差异,鉴于本组病例数较少,需累积病例进一步验证。有研究表明低度恶性潜能的乳头状尿路上皮肿瘤和低级别非浸润性乳头状尿路上皮癌形态学相似,分子遗传学改变相同,复发和进展风险也类似[15]。本研究结果也发现,低度恶性潜能的乳头状尿路上皮肿瘤、低、高级别乳头状尿路上皮癌中SEPT9甲基化阳性率分别为100%(16/16)、92%(11/12)、100%(10/10),这三种乳头状尿路上皮恶性病变之间SEPT9甲基化水平相似。
内翻性尿路上皮病变是病理诊断中的难点[16]。在大多数情况下,腺性膀胱炎在形态学上较容易诊断。然而,在尿路上皮明显增生的病例中,腺性膀胱炎易与具有内翻性生长模式伴有腺样结构的尿路上皮癌混淆[17]。内翻性低度恶性潜能的尿路上皮肿瘤由于细胞大小、极性一致,核分裂象罕见,与内翻性尿路上皮乳头状瘤形态学相似,仅在厚度上超过正常尿路上皮细胞层数,鉴别诊断困难。本研究中腺性膀胱炎、内翻性乳头状瘤、内翻性低度恶性潜能的尿路上皮肿瘤SEPT9甲基化阳性率分别为10%(2/21)、5%(1/20)、100%(10/10)。内翻性低度恶性潜能的尿路上皮肿瘤中SEPT9甲基化阳性率明显高于良性病变,因此在鉴别困难时SEPT9基因甲基化水平可以作为参考。内翻性低度恶性潜能的尿路上皮肿瘤、低、高级别内翻性尿路上皮癌中SEPT9甲基化阳性率分别为100%(10/10)、93%(14/15)、100%(10/10)。在内翻性恶性病变之间SEPT9表观遗传学相似,SEPT9甲基化检测无鉴别诊断作用。
本研究中SEPT9甲基化水平在良、恶性病变中差异具有统计学意义。SEPT9甲基化辅助诊断良性病变与低度恶性潜能尿路上皮肿瘤的敏感性、特异性、阳性预测值和阴性预测值分别为100%、94%、87%和100%。SEPT9甲基化辅助诊断良性病变与恶性病变的敏感性、特异性、阳性预测值和阴性预测值分别为98%、94%、96%和97%。提示SEPT9基因甲基化可以作为相对敏感、特异的生物标志物来区分尿路上皮良、恶性病变。有研究发现,许多形态学上表现正常的尿路上皮或良性病变存在与尿路上皮恶性病变相似的分子遗传学改变[18]。而本文在6%(4/70)的良性病变中检测到SEPT9甲基化阳性,其中包含1例不典型增生,1例腺性膀胱炎肠上皮化生,3年内复发2次,1例旺炽性腺性膀胱炎,1例内翻性乳头状瘤。本组SEPT9甲基化阳性的良性病例意义不明确,需进一步随访观察。
本研究还分析了15对癌和癌旁组织中SPET9基因甲基化水平。在癌组织和部分癌旁组织中检测到SEPT9高水平甲基化,特别是癌旁1~2 cm附近的正常尿路上皮组织,这种变化在显微镜下组织学上无法观察到,但可通过甲基化特异性的PCR检测到。有研究发现,形态正常的癌旁组织出现特征性的表观遗传学改变,可能是癌症发生的早期因素[19]。Thomsen等[20]的研究显示,CNV和DNA甲基化改变是尿路上皮癌的主要早期驱动因素。Majewski等[21]的一项研究提示,DNA甲基化的表观遗传改变可能导致随后的基因组改变,DNA甲基化检测可以识别具有表观遗传修饰缺陷的正常尿路上皮细胞。本研究结果显示15例癌组织和7例邻近癌旁组织SEPT9基因甲基化阳性,提示部分病例癌旁组织的表观遗传修饰异常。
膀胱镜活检组织病理检查是尿路上皮肿瘤分类和诊断的金标准[22]。然而,诊断的准确性取决于膀胱镜医师和病理医师的个人经验。由于某些病灶较小或较为隐匿,以及部分病例中乳头状瘤、不典型增生、尿路上皮癌等组织形态共同存在,导致尿路上皮病变存在异质性。有研究表明,膀胱尿路上皮癌中活检标本与手术标本肿瘤分级的一致性为63.9%,并且活检组织有遗漏恶性病变的可能性[23]。另有研究证实,在肺癌穿刺组织中,DNA基因甲基化检测可以提高肺活检的诊断准确性,DNA甲基化检测的优点是客观、敏感、可允许的活检检测范围广[8]。本研究对12例膀胱镜活检未取到癌细胞而后续再次活检、电切证实为癌的组织都进行了SEPT9甲基化检测。结果显示,12例首次活检病理无癌细胞的组织中8例SEPT9 DNA甲基化检测阳性,阳性率为67%(8/12);12例再次活检病理证实为癌的组织SEPT9甲基化检测均为阳性。提示当临床怀疑为恶性病变而膀胱镜活检病理证实为炎症或良性的病例,SEPT9甲基化检测为阳性时,患者需密切随访,必要时再次行膀胱镜检查。
综上,SEPT9甲基化检测在辅助诊断尿路上皮良、恶性病变中表现出高敏感性、特异性,提示在良、恶性尿路上皮鉴别诊断方面SEPT9甲基化检测是个良好的辅助方法;同时膀胱镜活检病理证实为炎症或良性病变而SEPT9甲基化检测为阳性的患者需密切随访,必要时再次行膀胱镜活检,联合使用SEPT9甲基化检测可降低膀胱镜活检组织的假阴性率。

