哈尔滨地区精养/半精养池塘底泥细菌群落分析及其与环境因子相关性
崔看利,周文婧,郝其睿,黄丽,覃东立,霍堂斌,黄晓丽*
(1.中国水产科学研究院黑龙江水产研究所,黑龙江流域渔业生态省野外科学观测研究站,寒地水域水生生物保护与生态修复重点实验室,黑龙江 哈尔滨150070;2.天津农学院水产学院 天津市水产生态及养殖重点实验室,天津300384;3.沈阳药科大学制药工程学院,辽宁 沈阳110016)
微生物是池塘生态系统的重要组成部分,底泥中的微生物不仅参与养殖系统中有机质、无机盐等物质的循环代谢及能量代谢[1],影响养殖动物消化系统微生物菌群结构[2],还可通过自身代谢过程分解转化污染物[3],池塘的自净能力在一定程度上取决于底泥中微生物的组成和数量变化[4-5]。因此,养殖池塘微生物生态学研究对理解细菌群落与养殖环境的互作关系及渔业环境污染控制具有重要意义。
在养殖池塘水体和底泥中细菌群落结构和多样性方面,国内外学者们已开展大量研究。对罗非鱼(Oreochromismossambicus)[6]、团头鲂(Megalobramaamblycephala)[7]、斑点叉尾鮰(Ictaluruspunctatus)[8]及中华绒螯蟹(Eriocheirsinensis)[9]池塘底泥细菌群落的研究均表明变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)相对丰度较高,但其优势菌属各有不同。底泥中细菌群落受养殖方式、养殖品种、营养盐、溶解氧、盐度等环境因素变化的影响较大[10-11]。邱楚雯等[12]发现暗纹东方鲀(Takifuguobscurus)的传统养殖与立体种养2种模式下,池塘水体、底泥及养殖动物肠道的微生物群落结构差异主要由水体酸碱度(pH)及氮、磷含量等环境因子所导致。同一养殖动物,在不同生产和环境条件下,其底泥微生物优势菌属有较大差异。章海鑫等[13]研究表明精养草鱼(Ctenopharyngodonidella)池塘底泥优势菌属以地杆菌属(Geobacter)、厌氧粘细菌属(Anaeromyxobacter)、铁细菌属(Crenothrix)等为主。而Niu等[14]则发现厌氧绳菌属(Anaerolinea)、Romboutsia、鲸杆菌属(Cetobacterium)、Paeniclostridium,Desulfatiglans为主养草鱼池塘底泥中的优势菌属。王一婷等[15]研究中假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)是草鱼与黄颡鱼(Tachysurusfulvidraco)混养池塘底泥中相对丰度较高的菌属。可见,渔业生产方式导致的环境因子变化是影响池塘底泥微生物群落结构的关键因素。
养殖池塘底泥主要是由过剩饵料、生物排泄物、动植物残体、悬浮颗粒等沉积而成[16],养殖方式和条件的改变势必会导致底泥质量的变化。现今,池塘养殖多采用精养或半精养方式,主要的区别在于养殖密度和饵料来源[17-18],而这两者正是影响底泥沉积和理化性质的主要因素。目前,关于鲤(Cyprinuscarpio)精养/半精养方式对池塘底泥细菌群落的影响研究还鲜有报道,因此有必要开展相关研究,这对理解底泥微生物与养殖环境的互作关系及渔业水体污染控制具有重要意义。
本研究以哈尔滨郊区典型淡水养殖池塘为研究对象,应用高通量测序技术研究了精养/半精养方式下养殖池塘底泥中细菌群落结构与多样性,分析了其与水体、底泥理化指标间的相关性,探讨了环境因子变化对细菌群落结构的影响,为深入认识池塘生态系统微生物作用及微生物生态功能提供理论及数据支持。
1 材料与方法
1.1 样品来源
实验池塘位于黑龙江省哈尔滨市宾县糖坊镇(东经E:121°23′31.71″、北纬N:31°24′59.06″),塘龄均超过10年,池塘面积均为10亩(6 666.67 m2),泥沙质底质,平均水深1.3~1.5 m。在4月清塘后注水,池塘水源为符合渔业用水要求的地下水。池塘养殖品种主要为鲤,搭配鲢(Hypophthalmichthysmolitrix)、鳙(Aristichysnobilis),鲤体长70.3~105.0 mm,体重80.0~106.0 g。精养和半精养池塘投放鱼苗量分别为1 200~1 300尾/亩和600~700尾/亩。精养池塘全程投喂鱼用膨化配合饲料(通威股份有限公司),同时配备投饵机和增氧机,并定点、定时、定质、定量投喂,日投喂量一般为鱼体重的2%~4%,根据天气、水温、鱼体大小、摄食强度等进行合理调整。半精养池塘通过施肥培养天然饵料与鱼用膨化配合饲料相配合,其他条件和精养池塘保持一致。
1.2 样品采集与处理
每个池塘设置3个采样点(半精养池塘为CF1、CF2、CF3,精养池塘为JY1、JY2、JY3),选择夏季(8月)晴朗天气进行采样。采集池塘表层水和底层水,充分混合后注入洁净的聚乙烯瓶中,按要求进行固定密封后运回实验室,24 h内进行常规理化指标的测定。利用柱状沉积物采集器采集0~20 cm池塘表层底泥2 kg,装入无菌样品袋中-20 ℃保存,并尽快带回实验室保存在-80 ℃冰箱中。
1.3 样品理化指标分析
1.4 水质污染评价方法
池塘水质评价以GB 3838—2002《地表水环境质量标准》Ⅲ类标准为评价依据。评价方法根据NY/T 396—2000《农用水源环境质量监测技术规范》,采用单项污染指数和综合污染指数对采样区域水质环境质量进行整体评价[24-25]计算公式为:

式(1)
当单项污染指数>1时,单项污染指数=
1+5·lg(计算值)
式 (2)

式(3)
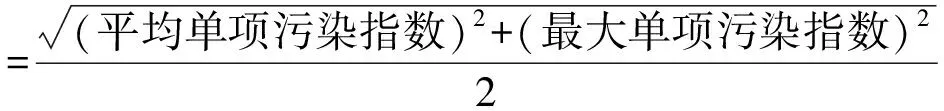
式(4)
1.5 底泥样品DNA提取及测序
采用FastDNATM SPIN Kit for Soil试剂盒提取预处理后的底泥样品中的总DNA,每个样本提取2次并混为一管,利用琼脂糖凝胶电泳纯化后测定DNA浓度,并送到北京诺禾致源生物信息科技有限公司进行16S扩增子测序,同时基于Illumina 2500 Hiseq平台进行高通量测序。
1.6 数据分析统计

2 结果与分析
2.1 水体及底泥理化性质分析

表1 2种养殖方式池塘水体和底泥理化指标分析(平均值±标准误)Tab.1 Analysis of physicochemical property of water and sediment in two aquaculture modes (Mean±SE)
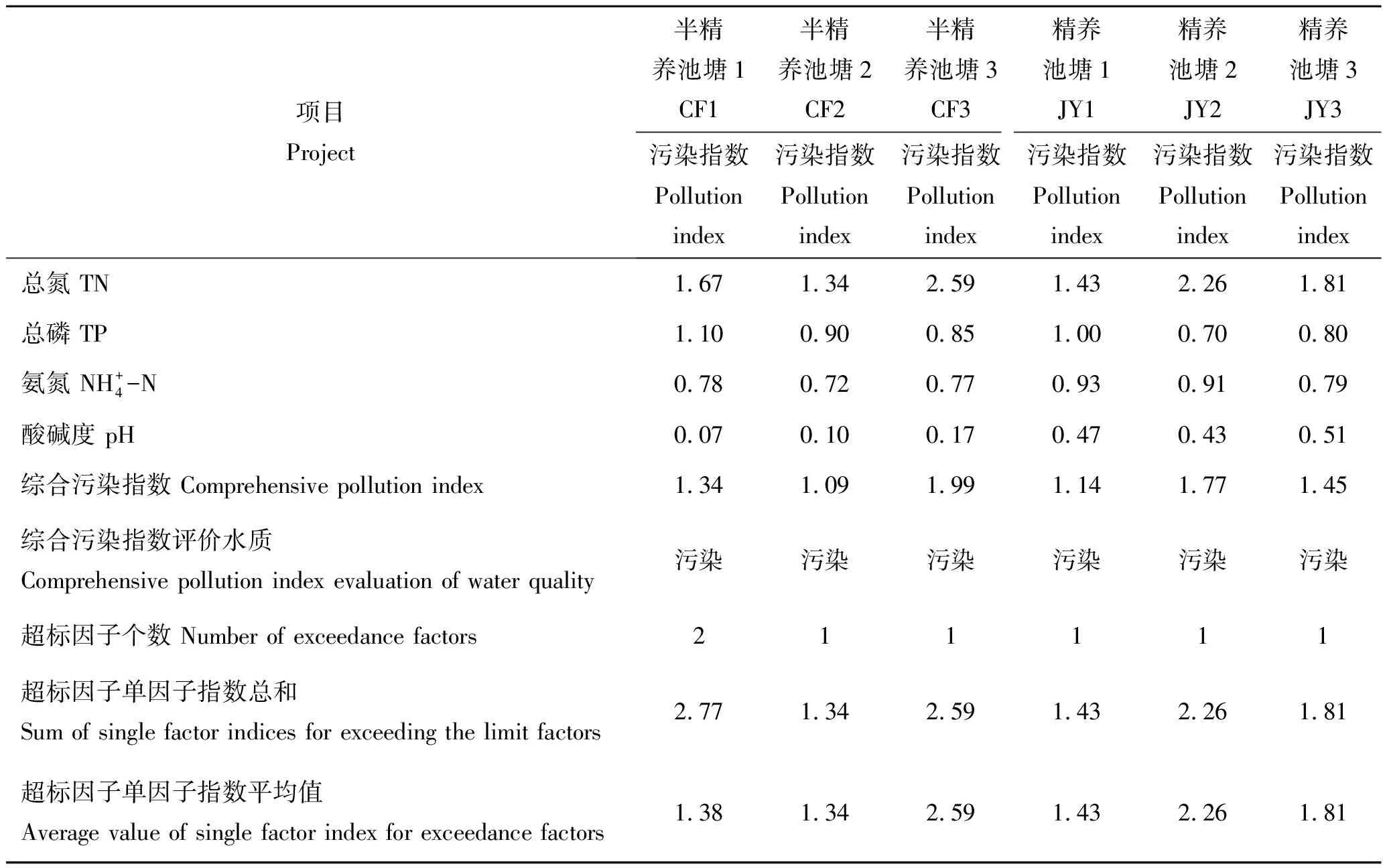
表2 2种养殖方式池塘水质单因子指数及综合污染指数评价结果Tab.2 The evaluation results of single-factor index and comprehensive pollution index of pond water quality of two aquaculture modes
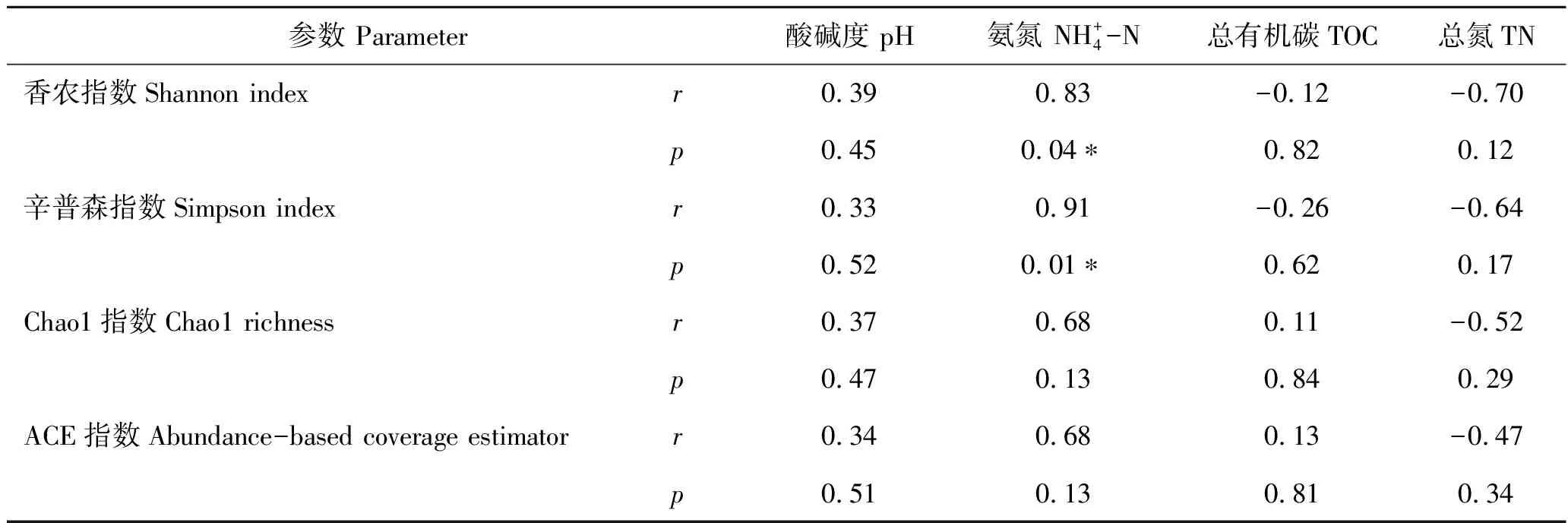
表3 α-多样性指数与底泥的理化性质相关性分析Tab.3 Correlation analysis between a-diversity index and physicochemical property of sediment n=6

2.2 池塘底泥细菌群落多样性分析
2.2.1 Alpha多样性分析
平均每个池塘底泥样品得到56 892条序列,共341 353条。不同样品获得的有效序列(Effective Tags)条数分别为53 739、56 457、50 142、54 313、53 744和32 498(有效序列的平均长度为373 bp)。以97%的一致性对所有样品的有效序列进行聚类,得到不同样品实际观测到的OTUs数目,分别为2 951、3 820、2 943、3 653、3 760和3 144。精养池塘α-多样性(Shannon、Simpson、Chao1、ACE、Richness)整体高于半精养池塘,但差异不显著(P>0.05)(图1A-E)。由图1 F中的稀释曲线可知,随着测序条数的增加,OTUs数量迅速升高并逐渐趋向平缓,表明测序数据渐进合理,结果覆盖度较高,与覆盖度指数(均在98%以上)相符。

图1 α-多样性分析图(A~F)Fig.1 Diversity analysis diagram(A-F)
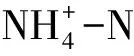
2.2.2 Beta多样性分析
UPGMA聚类分析(图2A)显示精养/半精池塘底泥样本分别聚为单独的一簇,表明2种养殖池塘底泥细菌群落结构组成呈现出较好的组间差异性和组内相似性,不同处理之间能够明显进行区分。为进一步探讨池塘底泥细菌群落组成的差异性,使用PCoA分析解释了底泥细菌群落总变异的59.1%,其中第一主坐标(PCoA1)和第二主坐标(PCoA2)分别解释了细菌群落总变异的41.0%和 18.1%(图2B),这说明不同养殖方式对底泥细菌的群落结构组成产生了明显影响,但精养与半精养池塘底泥细菌群落组间差异不显著(r2=0.37,P>0.05)。
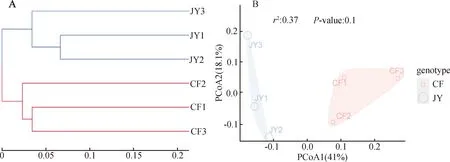
图2 2种养殖池塘底泥细菌群落结构层级聚类(A)和PCoA聚类分析(B)Fig.2 Hierarchical clustering of bacterial community structure in the sediment of two cultured ponds (A) and PCoA clustering analysis(B)
2.3 池塘底泥细菌群落的组成
2.3.1 池塘底泥门水平的菌群分布
2种养殖池塘底泥中门水平的微生物种类相似(图3A、B),但每个种类的相对丰度存在一定差异,如半精养池塘底泥中优势菌门为变形菌门(Proteobacteria)占45%、绿弯菌门(Chloroflexi)占16%、酸杆菌门(Acidobacteria)占10%和拟杆菌门(Bacteroidetes)占14%,而精养池塘Proteobacteria、Chloroflexi、Acidobacteria和Bacteroidetes菌门的相对丰度分别为40%、18%、8%和16%。半精养池塘底泥中梭杆菌门的相对丰度大于精养池塘。

图3 池塘底泥在门水平上物种相对丰度(A)和热图(B)及属水平物种相对丰度(C)与细菌群落LEfSe分析(D)Fig.3 Relative species abundance (A) and heat map (B) of pond sediment at the phylum level and relative abundance of species at the genus level (C) and LEfSe analysis of bacterial communities (D)
2.3.2 池塘底泥属水平的菌群分布
半精养与精养池塘共有优势菌属(图3C)为长绳菌属(Longilinea)、黄杆菌属(Flavobacterium)、Subdivision3_genera_incertae_sedis、Bellilinea、Gp7、Lentimicrobium。将所有底泥样本中的菌群进行线性判别LEfSe分析,筛选在不同养殖方式中存在显著差异的菌群,并构建差异菌群物种信息树状图(图3D),其中半精养池塘底泥中差异优势菌属为铁矿单胞菌属(Arenimonas),藤黄色单胞菌属(Luteimonas);而精养池塘底泥中差异优势菌属为史密斯氏菌属(Smithella)、狭义梭菌属(Clostridium_sensu_stricto)。
2.4 池塘底泥细菌PICRUSt功能预测
由图4可知,2种养殖方式池塘底泥样本菌群的主要功能基本一致。精养与半精养池塘底泥样本细菌基因在一级功能层上共包含细胞过程、遗传信息处理、代谢、有机系统、人类疾病和环境信息处理6类生物代谢通路(图4A)和30类二级功能通路(图4B),展示出了丰富的功能多样性。一级功能通路中以代谢(Metabolism)的丰度值最高,二级功能通路中丰度排名前10的分别为能量代谢(Energy metabolism)、复制和修复(Replication and repair)、氨基酸代谢(Amino acid metabolism)、碳水化合物代谢(Carbohydrate metabolism)、膜运输(Membrane transport)、细胞过程和信号传导(Cellular processes and signaling)、脂质代谢(Lipid metabolism)、细胞运动(Cell motility)、核苷酸代谢(Nucleotide metabolism)和转录(Translation)。

图4 池塘底泥细菌群落的功能类别(A、B)及差异(C)Fig.4 Functional categories(A、B) and differences of bacterial communities(C) in ponds sediment
精养池塘底泥细菌群落功能在硫辛酸代谢通路(Lipoic acid metabolism)、脂肪细胞因子信号通路(Adipocytokine signaling pathway)、脂类生物合成蛋白质通路(Lipid biosynthesis proteins)及谷氨酸能突触信号通路(Glutamatergic synapse)的相对丰度显著(P<0.05)高于半精养池塘。而半精养池塘底泥细菌群落功能在MAPK信号通路(MAPK signaling pathway)、未知功能(Function unknown)、甘氨酸的生物合成和代谢(Glycan biosynthesis and metabolism)、核糖体的合成(Ribosome biogenesis)、PPRA信号通路(PPRA signaling pathway)的相对丰度显著高于(P<0.05)精养池塘。
2.5 池塘底泥细菌群落与关键环境因子相关性分析


图5 精养/半精养池塘底泥细菌群落与环境因子的PCA分析图Fig.5 PCA analysis of bacterial communities and environmental factors in the sediment of intensive/semi- intensive ponds

3 讨论
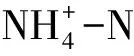
在淡水养殖池塘中,拟杆菌门、变形菌门和放线菌门分布最为广泛[33],本研究中2个池塘排名前5的优势菌门均为变形菌门、绿弯菌门、放线菌门、拟杆菌门和酸杆菌门,这与何梦莹[34]、肖述文等[35]的研究相似。对上海、武汉、江西等南方地区[12,36-37]的淡水养殖池塘底泥细菌群落研究表明蓝藻门是其重要的优势菌群,其丰度状况与水体富营养化程度紧密相关。在本研究中,蓝藻门菌群不是优势种群,这可能与水体水质、气候条件等因素有关。值得注意的是,半精养池塘中梭杆菌门相对丰度显著高于精养池塘。梭杆菌门是鱼类肠道内容物的优势菌门[1],表明底泥微生物群落组成与养殖动物肠道微生物密切相关。半精养池塘中的酸杆菌门相对丰度也较高,可能是排泄物及有机碎屑大量累积后使酸性物质增加,导致pH降低,为酸杆菌门生长提供了物质条件[38]。黄杆菌属(Flavobacterium)在2个池塘中均有相关丰度,其出现可能与水体富营养程度有关[8]。
本研究中PICRUSt功能预测表明2种池塘底泥菌群的基因功能主要与新陈代谢类功能有关,包括能量代谢、脂质代谢、碳水化合物代谢、氨基酸代谢、核苷酸代谢等,表明底泥细菌积极参与了池塘生态系统的生理代谢过程。底泥中细菌群落旺盛的新陈代谢活动对水质净化具有良好的促进作用[39],精养池塘底泥菌群整体代谢功能基因丰度高于半精养池塘,可能是因为两者底泥及水体理化性质不同导致的。此外,细胞过程和信号转导、膜运输等环境信息处理功能以及转录、复制和修复等遗传信息处理功能在各样本中也均为优势功能。Qiao等[40]研究表明拟杆菌门与脂肪等代谢有关,许郑超等[41-42]认为菌群基因功能可维持自身生命活动并调节菌群所处环境,而环境波动会触发菌群间的群体感应,维持菌群的相对稳定。可见,底泥细菌群落在养殖环境调控及养殖生态系统维持中扮演了重要角色。
4 结论
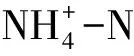
——百援精养家族培训大会成功举办

