超高效液相色谱-串联质谱法测定罗非鱼中甲基睾酮残留
张杨,张兵,李凯华,徐媛原,张微,肖曼,吴丹,张玲
(深圳市质量安全检验检测研究院,广东 深圳518055)
罗非鱼(Oreochromsmossambcus)隶属于硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、慈鲷科(Cichlidae)、罗非鱼属(Tilapia),原产自非洲,又名非洲鲫鱼,有600多个品种。罗非鱼是杂食性的鱼类,对环境的适应能力强,其肌肉间无刺,而且肉质细腻,是世界性的水产养殖鱼类,也是全球推广的蛋白质来源品种[1-2]。在罗非鱼的生长发育过程中,雄性罗非鱼的生长速率更快。雌性罗非鱼自然繁殖周期短,每隔12至25天可繁殖一次,大量的能量消耗影响其生长速度、养殖密度和成鱼规格[3]。在养殖生产中,为了提高养殖产量和效益,常采用单雄性的养殖方法。通过罗非鱼苗种性别调控来获得全雄性苗种的方法主要有种间杂交、性激素诱导和三系配套技术。种间杂交法,受亲本纯度和环境因素影响大,杂交后代均匀度低;三系配套技术受限于超雄鱼的育种而影响推广;性激素诱导罗非鱼育苗雄性化在养殖生产中被广泛采用[3-4]。用甲基睾酮来提高雄性率的处理方法包括注射、伴饵投喂和养殖水加药浸泡等,其中投喂和浸泡是生产上使用较多的方法[5]。除了用于育苗增产,也可通过甲基睾酮进行性逆转来避免鱼塘中罗非鱼的过度繁殖[5]。
甲基睾酮(17α-Methyltestosterone)化学式为C20H30O2,是一种合成类固醇,也称为甲睾酮、甲基睾丸酮等,属于雄激素和蛋白同化激素,兼具雄性化与促进肌肉生长的作用,在水产育种和养殖过程中常被使用[6-8]。由于同化激素能改善饲料转化效率,提高经济效益,上世纪50年代开始被大量使用在食品动物养殖中,而残留在动物体内的外源性激素会通过食物链进入人体,长期食用含有同化激素的动物组织会给人体带来健康风险。甲基睾酮残留对人体的影响是慢性可累积的,长期积累会影响人体内自然激素平衡,可能造成激素调节的相关身体机能发生紊乱[9-11],如女性出现多毛、闭经等症状。有研究表明,在养殖生产过程中罗非鱼停用甲基睾酮后,其代谢周期符合指数递减规律,但是在一定代谢周期内,其残留仍能被检测到[12]。欧盟在上世纪90年代针对出口到欧盟的动物源性产品发布相关指令,规定禁止使用雄激素、孕激素、促甲状腺素和beta-激动剂等药物饲养动物或养殖水产品。中国发布的NY 5071—2002《无公害食品 渔用药物使用准则》中也早已规定不得在水产品养殖中使用甲基睾酮等激素。为了更好地规范水产养殖中的药物使用,保障食品安全,现行的《中华人民共和国农业农村部公告 第250号》也明确规定食品动物中禁止使用甲基睾酮,并不得在所有可食性组织中检出。
中国罗非鱼的养殖产量约占全球总产量的一半[9]。罗非鱼是中国优势出口水产品,也是居民日常消费的重要水产品,其质量安全受到高度关注。外源性激素残留水平高可能对消费者造成潜在危害,对罗非鱼中甲基睾酮残留量的检测非常必要[13]。目前,国内甲基睾酮检测的标准方法有GB 31656.14—2022[14]、GB/T 21981—2008[15]、农业部1031号公告—1—2008[16]、SN/T 3235—2012[17]、SN/T 2443—2010[18]、SC/T 3029—2006[19]等。罗非鱼中甲基睾酮的测定一般采用液相色谱法或液相色谱-串联质谱法。在日常检测中发现,甲基睾酮残留量的检测受基质影响较大、检测结果重复性差,且前处理提取和净化过程均耗时较长、试剂消耗大。本研究在标准方法的基础上,优化了前处理过程、质谱和色谱仪器条件、对比了不同成分QuEChERS分散吸附剂的净化提取效果,经阳性质控样品验证,建立了快速灵敏的检测方法,大幅缩短了检测时长,适用于大批量实际样品的检测,以期节省人力物力成本,更为简便、高效地定量检测甲基睾酮残留量。
1 材料与方法
1.1 材料与试剂
甲基睾酮(17-alpha-Methyltestosterone,纯度(97.41±0.41)%,CAS No. 58-18-4,德国Dr. Ehernstorfer公司);甲基睾酮-D3(Methyltestosterone-D3,纯度(99.0±0.2)%,CAS No. 96425-03-5,WITEGA 公司)。
试验用水为符合GB/T 6682—2008规定的一级水;甲醇、乙腈(色谱纯,德国MERCK公司);乙酸铵(色谱级,≥99.0%,Aladdin上海公司);甲酸[色谱纯97%,阿法埃莎(中国)化学有限公司];有机滤膜(0.22 μm,PTFE,上海安谱公司);色谱柱(BEH C181.7 μm,ACQUITY UPLC,Waters 公司);QuEChERS净化提取剂组分(PSA、石墨化炭、C18、MgSO4,Agilent Technologies公司)。
实验用罗非鱼来源于深圳市水产品零售市场。阳性质控样品分别购自坛墨质检标准物质中心、河南标准物质研发中心。
1.2 仪器与设备
Agilent 1290 超高效液相色谱仪、配有电喷雾(ESI)离子源的AB Sciex Triple Quad TM 5500 质谱仪(美国AB Sciex公司);OA-SYS 24位自动水浴氮吹仪(Organomation公司);BSA2202S-CW型电子天平(Sartorius科学仪器(北京)有限公司);Bead Ruptor Elite多功能生物样品均质器(美国OMNI公司);MTV-100型多管旋涡混合仪(杭州奥盛仪器有限公司);3-30ks冷冻高速离心机(Sigma公司)。
1.3 样品前处理方法
1.3.1 制样
试样制备过程参照GB/T 21981—2008《动物源食品中激素多残留检测方法 液相色谱-质谱/质谱法》进行优化,将罗非鱼去头、骨、内脏,取肌肉等可食部分,切成不大于1 cm×1 cm×1 cm的小块,绞碎混匀再充分匀浆,制成试样备用。
1.3.2 提取
准确称取罗非鱼匀浆试样2.50 g(精确至0.01 g)于30 mL研磨管中,准确加入0.1 μg/mL甲基睾酮-D3内标工作溶液50 μL,涡旋混合60 s,加入5 g 规格为2.8 mm的陶瓷研磨珠和10 mL 1%甲酸-乙腈溶液(甲酸/乙腈,1∶99,V/V),用Bead Ruptor Elite多功能生物样品均质器以3 m/s的均质速度,均质震荡30 s,以6 000 r/min转速离心5 min,转移全部的上清提取液于另一洁净的带盖聚丙烯离心管中,待净化。
1.3.3 净化
将QuEChERS净化剂以下简称Q1(100 mg PSA、50 mg C18、50 mg石墨化炭,600 mg MgSO4)加入上述提取液中,旋紧螺旋盖,用多管旋涡混合仪以2 000 r/min,涡旋混合1 min,以9 000 r/min转速离心5 min。吸取4 mL上清有机相溶液,于45 ℃水浴氮吹至近干。准确加入1.0 mL 10%乙腈-水溶液(乙腈/水,10∶90,V/V)溶解残渣,涡旋振荡溶解残留物,0.22 μm滤膜过滤至1 mL玻璃进样瓶,待测。
1.4 仪器条件
1.4.1 液相色谱条件
色谱柱:BEH C18(2.1 mm×50 mm,1.7 μm);柱温:40 ℃;进样量:5.0 μL;流速:0.30 mL/min;流动相A为0.1%甲酸水溶液;流动相B为甲醇。流动相梯度洗脱程序见表1。

表1 梯度洗脱程序Tab.1 Gradient Elution Conditions
1.4.2 质谱条件
电离方式:电喷雾离子源(ESI),正离子模式;扫描检测方式:多反应监测(Multiple reaction monitoring, MRM);电喷雾电压:5 500 V;离子源温度:550 ℃;气帘气压力:35.0 psi;碰撞气压力:9 psi;雾化器压力:55.0 psi;辅助加热器压力:55.0 psi。定性离子对、定量离子对、去簇电压及碰撞能量参数见表2。

表2 MRM扫描模式的参数Tab.2 Parameters of MRM
1.5 标准曲线
分别取10、20、50、100、200、500 μL浓度0.1 μg/mL的甲基睾酮外标工作溶液于玻璃离心管中,分别加入0.1 μg/mL甲基睾酮-D3内标工作溶液50 μL,氮气吹干,加入步骤1.3处理所得的基质空白溶液1mL,混合1min,配制成浓度为1~50 ng/mL系列基质匹配标准工作液,经超高效液相色谱串联质谱仪测定,以甲基睾酮特征离子色谱峰的峰面积与内标物甲基睾酮-D3特征色谱峰的峰面积比值为纵坐标、相应的浓度为横坐标,绘制标准工作曲线。
1.6 方法验证
按照SN/T 5326.2—2020《进出口食品化妆品专业分析方法验证指南 第2部分 化学方法》中5.2方法性能参数的验证章节中的方法,评估方法灵敏度[20]。验证程序采用概率统计法,当被检测目标物质甲基睾酮在罗非鱼样品基质中被可靠检出的概率达到95%以上时的浓度水平做为检测方法对于该样品基质的检出限。方法定量限满足大于3倍检出限或其信噪比大于等于10。
取已知阴性罗非鱼肉样品2.50 g,分别添加25、50、250 μL浓度为0.1 μg/mL甲基睾酮外标工作液和50 μL浓度为0.1 μg/mL甲基睾酮-D3内标工作溶液,制得含量分别为1.00、2.00和10.00 μg/kg的3个浓度水平的加标样品,每个浓度进行6个平行样品的加标回收实验,按1.3的方法进行处理并定量分析,根据检测结果计算加标回收率及相对标准偏差。
将鱼粉中甲基睾酮的质控样品的接受参考值作为约定真值,按照本实验方法处理过程进行定量测定,分别检测10个平行样品,对数据进行统计分析,检测结果用于方法的验证。
2 结果与分析
2.1 方法优化
2.1.1 检测方法的选择
液相色谱法、液相色谱串联质谱法和气相色谱串联质谱法是类固醇激素检测的常用分析方法[21-22]。但气质法的前处理过程常需要进行衍生化,过程复杂且耗时。超高效液相色谱串联质谱法的选择性、特异性和灵敏度比液相色谱法更高,并减少了溶剂消耗、缩短了分析时间,被越来越多地使用于检测复杂基质中的痕量物质[22]。国家标准方法中激素残留的检测也多采用液质法。
2.1.2 提取剂的选择
液质法检测激素残留常用的试剂有甲醇、乙腈、乙酸乙酯等。GB 31656.14—2022[14]采用乙酸乙酯提取;GB/T 21981—2008[15]采用酶解后甲醇提取;农业部1031号公告—1—2008[16]采用叔丁基甲醚提取;SN/T 3235—2012[17]和SN/T 2443—2010[18]采用乙腈提取。本研究在空白罗非鱼试样中添加内标和外标工作液制成10.0 μg/kg的甲基睾酮添加样品,用于方法的优化。对甲醇、乙酸乙酯、乙腈、1%甲酸-乙腈溶液和5%甲酸-乙腈溶液5种提取溶剂进行对比试验,结果表明这5种溶剂提取甲基睾酮的平均回收率相近,提取效率均较高(图1),试验结果与聂建荣等[23]甲基睾酮残留提取的研究结果一致。
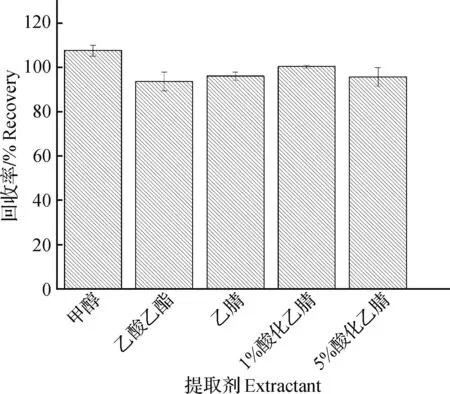
图1 不同提取剂对目标物的回收率影响Fig.1 The effect of different extractants on the recovery rate of the target substance
不同溶剂对不同激素的提取效率不同,甲醇对多种雌激素的提取回收好,乙酸乙酯对部分雄激素和孕激素的提取效率高[24-26],乙腈对部分雄激素、孕激素和雌激素的提取回收率都较高[24]。在多类激素同时提取时,也有使用这3种提取剂的组合来达到更高的综合提取效率[25]。试验结果表明,在使用乙酸乙酯作为提取剂时,甲基睾酮的平均回收率略低于其他提取剂,提取过程中较多的油脂被一同提取出来,氮吹后管内有大量黄色的油脂残存。甲醇提取的平均回收率偏高,为107.5%,相对标准偏差2.5%。上机检测发现甲醇和乙酸乙酯在提取过程中出现了较多的基质干扰成分,相邻的杂峰较多,基质干扰峰面积大(图2)。使用乙腈或不同浓度酸化乙腈提取时的基质干扰小,回收率相近,1%酸化乙腈的内标和外标的离子相应值高于乙腈和5%酸化乙腈提取的甲基睾酮内外标离子响应值,所以选择1%酸化乙腈作为本方法的提取试剂。

图2 不同提取剂的甲基睾酮定量离子色谱图Fig.2 Quantitative ion chromatograms of methyltestosterone using different extractants
2.1.3 净化方式的选择
在激素残留的检测中,常通过比较不同的提取净化方式来优化前处理方法,减小基质干扰的影响[27-28]。激素残留常用有机溶剂涡旋或超声的方式提取,液液萃取、分散固相萃取或固相萃取的方法来净化除杂[22]。固相萃取法需要的有机溶剂量也较少,可以在过柱的过程中清理去除大部分杂质,从而减少基质干扰。但使用固相萃取柱净化的步骤,通常需要进行活化、淋洗、洗脱等操作[29-30]。GB 31656.14—2022和GB/T 21981—2008都是经过大量溶剂提取后,进一步经旋转蒸发浓缩再溶解,而后过柱净化,整个前处理过程耗时长,且旋转蒸发仪能同时处理样品的数量少,不能满足多批量样品的检测需求。
利用溶剂涡旋提取和QuEChERS法的研究可以高效率的完成激素残留处理。QuEChERS法采用在盐溶液的存在下以水溶性溶剂萃取,促进液相分离,再以分散性吸附剂与提取物混合来促进清除基质干扰。本研究对比了Q1(100 mg PSA、50 mg C18、50 mg石墨化炭,600 mg MgSO4),Q2(100 mg PSA、600 mg MgSO4),Q3(150 mg PSA、900 mg MgSO4),Q4(100 mg C18),Q5(100 mg 石墨化炭)这5种吸附剂组合对甲基睾酮的回收提取效果(图3)。多组分的分散性吸附剂Q1与不同含量PSA的Q2和Q3净化回收率相近,高于C18和石墨化炭的净化回收率。Q2与Q3的色谱图上的基质干扰峰相同,并没有随着PSA含量的增加而减小基质干扰。C18和石墨化炭色谱图的离子响应值都低于其他吸附剂,约为6.0×104(图4)。实验结果表明,单一的分散性吸附剂的净化效果不充分,多种分散吸附剂组合可以达到更好的净化效果。所以选择Q1组分的QuEChERS吸附剂用于净化除杂。
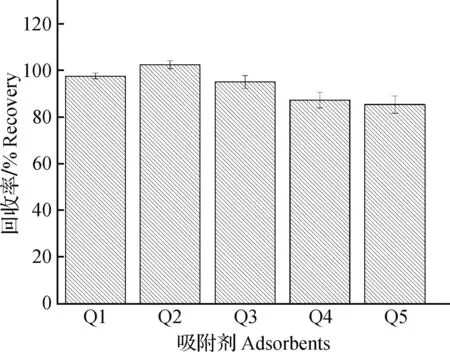
图3 不同吸附剂对目标物的回收率影响Fig.3 The effect of different adsorbents on the recovery rate of the target substance

图4 不同吸附剂的甲基睾酮定量离子色谱图Fig.4 Quantitative ion chromatograms of methyltestosterone using different adsorbents
2.1.4 其他因素
鱼肉中激素的测定多受基质干扰影响[31-32]。SN/T 3235—2012和SN/T 2443—2010标准方法中的甲基睾酮定量方法采用外标法。为了不受实验条件稳定性变化影响,本方法使用内标法定量。同时,方法也对氮吹温度35、40和45 ℃进行对比,测得加标回收率相近,精密度相似,结果表明甲基睾酮在这3种温度下较稳定,皆可用于氮吹,45 ℃时氮吹所用的时间最少。
2.2 标准工作曲线
按照1.5的方法绘制基质标准工作曲线,得到线性回归方程及相关系数(图5),表明在1~50 ng/mL的线性范围内,待测物甲基睾酮的线性关系良好。
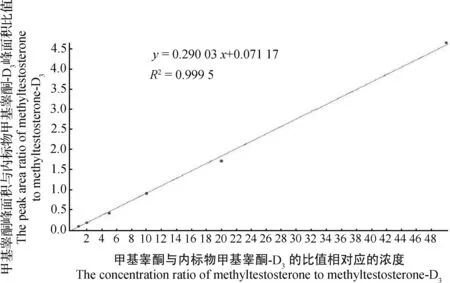
图5 甲基睾酮标准工作曲线Fig.5 Standard working curve of methyltestosterone
2.3 方法检出限与定量限
按照1.6进行方法学验证。采用标准添加法进行检测,得到0.30 μg/kg作为参考浓度,以1倍该浓度为参考检出限(LODR)的6个标准添加样品经统计检测结果并计算标准偏差SD为0.05,以LODR-3SD、LODR、LODR+3SD三个浓度水平分别检测20个标准添加样品,刚好有19个样品能被有效检出的浓度作为方法的检出限。经验证,确定甲基睾酮残留检测方法的检出限为0.30 μg/kg,定量限大于3倍检出限为1.0 μg/kg。方法检出限验证数据见表3。
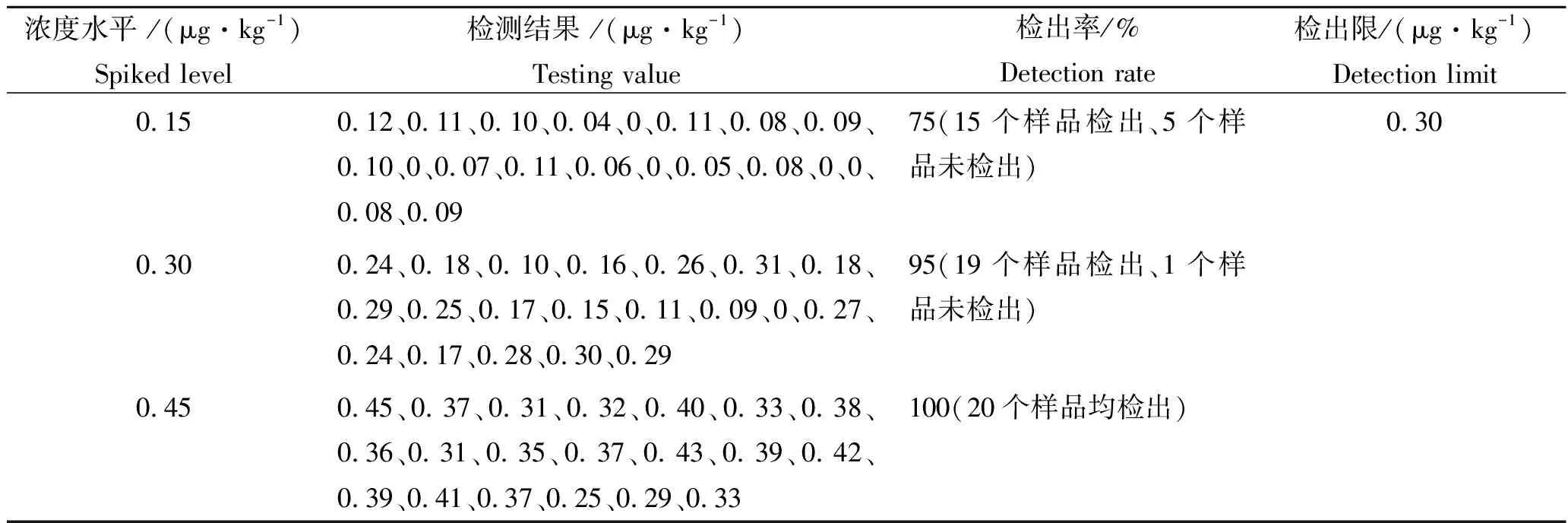
表3 方法检出限验证数据Tab.3 Validation data for the detection limit in method n=20
2.4 回收率和精密度
向空白罗非鱼样品中添加3个浓度水平甲基睾酮的加标回收实验(n=6),按照前面的处理的方法和条件进行测定,计算每个浓度水平的平均回收率及其相对标准偏差,实验结果见表4。本方法的平均回收率为98.3%~103.0%,相对标准偏差为4.2%~8.8%。

表4 加标回收和精密度实验结果Tab.4 Standard recovery rate and precision test results n=6
2.5 阳性样品验证
将鱼粉中甲基睾酮质控样品用于本方法的验证。按照鱼粉质控样品分析证书中的说明,在空气湿度≤40%,室温约25 ℃的环境下准确称量质控干粉0.5 g(精确至0.000 1 g),加入蒸馏水2.0 mL使其恢复为2.5 g的鱼肉湿样进行检测。2种阳性质控分析鱼粉均称取10个平行样品用于测定,检测结果见表5。试验表明,本方法的检测结果符合鱼粉中甲基睾酮质控样品分析证书中给出的标准值扩展不确定度范围,检测结果可靠,本方法可用于鱼肉中甲基睾酮残留量的测定。

表5 阳性样品实验结果Tab. 5 Positive sample test results n=10
3 结论
本研究建立了超高效液相色谱-串联质谱法测定罗非鱼中甲基睾酮残留量的方法。对样品制备、质谱条件、提取溶剂、净化方式等参数进行优化,采用基质加标的方法建立标准工作曲线,内标法定量数据分析。经测定,甲基睾酮浓度在1~50 ng/mL的范围内线性关系良好,相关系数为0.999 5。方法检出限为0.30 μg/kg,定量限为1.0 μg/kg。方法的前处理步骤操作简单,大大缩短了前处理所需时长,提高了检测效率,且方法检出限低、准确度和精密度高,能满足罗非鱼中甲基睾酮残留量检测要求,为相关部门开展针对罗非鱼中甲基睾酮残留量的监测提供参考方法。

