基于血清mirnas差异性表达分析糖尿病高危足的风险因素分析
李秀贞,王丛香,王 猛,闫会霞,杨 越,高娟娟,张 鹏
0 引 言
糖尿病高危足是糖尿病(Type 2 diabetes, T2D)的常见和严重的慢性并发症之一,也是糖尿病足截肢的最重要前兆[1]。然而,与糖尿病高危足相关的主要机制仍未确定。因此,迫切需要更好地了解导致糖尿病高危足的潜在疾病机制,以便为糖尿病高危足制定有效的治疗策略。近年来研究发现了一组新的普遍存在的小的非编码RNAs,称为microRNAs(miRNAs),它们正在成为各种生物过程和疾病进展的关键调节器[2]。此外,miRNAs在葡萄糖平衡和糖尿病发病机制中也发挥着关键作用。目前,已经发现大量的miRNAs与胰腺发育、胰岛素分泌和β细胞功能紊乱有关[3]。除了高血糖,miRNAs还参与了炎症反应,以及血管内皮损伤和纤维化过程[4]。因此,miRNAs可能参与常见高危足的发生和发展。现有的一些证据表明,miRNAs在血液循环中可以稳定检测,可以作为各种疾病(包括糖尿病)的潜在非侵入性生物标志物[5]。然而,目前对糖尿病高危足患者的血清miRNAs进行系统分析的研究很少。因此,本研究旨在系统评估糖尿病患者和糖尿病高危足患者以及非糖尿病患者的血清样本中的miRNA表达模式。
1 资料与方法
1.1 研究对象和标本采集收集2021年6月至2022年6月期间在河北省沧州中西医结合医院内分泌科住院的92例T2D患者。其中46例被诊断为高危足但没有足部溃疡(瓦格纳分类0级),纳入T2D高危足组;其余患者纳入T2D组。纳入标准:所有受试者没有严重的心脏病(没有不稳定的心绞痛、急性心肌梗塞和充血性心力衰竭),没有严重的肝病(丙氨酸氨基转移酶和天门冬氨酸氨基转移酶<1.5倍上限),也没有严重的肾功能障碍(血清肌酐<132.6 μmol/L,估计肾小球滤过率>60 mL/min/1.73 m2或癌症溃疡伤口;受试者在过去6个月内没有使用糖皮质激素、免疫抑制剂或外源性细胞因子。排除标准:参与者患有1型糖尿病、其他类型的糖尿病、严重感染、急性脑血管疾病或近期手术。选择在同一医院健康管理中心接受体检的46例糖耐量正常的健康人作为对照组。对照组的参与者没有下肢动脉或静脉病变或皮肤溃疡。健康检查包括详细的病史、体检和验血。在参与者最近一次进餐后至少12 h,用血清空心管收集血液,并立即在1500×g下离心10 min,分离血清。将血清样本保存在-80 ℃,直到miRNA分析。
1.2RNA分离、TaqMan低密度阵列和RT-qPCR检测采用了基于RT-qPCR的TaqMan低密度阵列(TLDA)芯片分析24例T2D患者、24例T2D高危足患者和24例健康对照者的三个集合血清样本池的miRNA谱[6]。
1.2.1RNA分离、TaqMan低密度阵列使用Trizol试剂(Invitrogen)从每个汇集的血清样本中提取总RNA。得到的RNA颗粒被溶解在20 μL DEPC处理过的水中,并储存在-80 ℃,直到进一步分析。然后在ABI PRISM 7900HT上用低密度阵列(TaqMan Array Human MicroRNA A+B Cards Set v3.0,购自美国Life Technologies公司)检测754个不同的人类miRNA谱。miRNA的表达水平以阈值周期(Cq)值表示,并按照制造商的建议对每个池中的内源U6进行归一化。
1.2.2RT-qPCR检测对于血清RT-qPCR检测,采用一步法苯酚/氯仿纯化方案从100 μL血清中提取总RNA。使用SYBR Green(美国Applied Biosystems公司)对从血清中提取的RNA进行qRT-PCR反应。为了控制RNA提取和纯化过程中的变化,在RNA分离过程中,将外源植物miRNA MIR2911(5'-GGCCGGGGGACGGGCUGGGA-3')添加到每个样品中,最终浓度为106fmol/L,作为血清miRNA正常化的合成外部参考。靶向miRNA的相对水平随后被归一化为MIR2911,并使用比较Cq方法(2-ΔCq)进行计算。ΔCq是通过从目标miRNAs的Cq值中减去MIR2911的Cq值来计算。然后用T2DM患者的平均2-ΔCq值除以对照组的平均2-ΔCq值来确定2-ΔCq。
1.3血清生化参数测定使用商业试剂盒(美国RANDOX公司)在日立7600分析仪(日本日立公司)上测量血清TC、TG、LDL和HDL的浓度。使用商业试剂盒(日本TOSOH公司)在HLC-723GB自动分析仪(日本TOSOH公司)上测量HbA1C的浓度。

2 结 果
2.1 人口学和临床特征T2D组和T2D高危足组BMI、收缩压(SBP)和舒张压(DBP)明显高于对照组(P<0.05)。与对照组相比,T2D组和T2D高危足组血清总胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)浓度也明显升高(P<0.05),而血清高密度脂蛋白胆固醇(HDL-C)水平则明显下降(P<0.05)。见表1。

表1 T2D、T2DM高危足和对照组的人口学和临床特征
2.2研究对象的血清miRNAs的TLDA分析Pearson相关分析显示,T2D组和对照组之间的相关系数(r)值为0.825,T2D高危足组和对照组之间的r为0.819。此外,T2D组和T2D高危足组的r为0.872,表明三组之间存在一个共同但差异表达的血清miRNA表达谱。见图1。
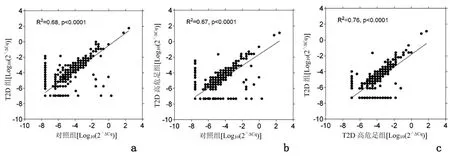
a、b、c:分别为T2D组和对照组、T2D高危足组和对照组、T2D组和T2D高危足组的相关分析
TLDA分析结果显示,在评估的754个miRNAs中,与对照组相比,两组T2D患者中有25个上调,118个下调。对于失调的miRNAs,选择了11个(miR-23、miR-195-5p、miR-205-5p、miR-203、miR-1208、miR-664、miR-584、miR-1303、miR-770-5p、miR-892b、miR-886-5p)在两组T2D患者中明显增加的miRNAs,且T2D高危足组的折叠变化>10,用单个血清样本进一步进行RT-qPCR验证,结果显示与对照组相比,包括miR-23、miR-195-5p、miR-205-5p、miR-203在内的4个miRNA的水平在T2D组和T2D高危足组患者中均显著增加(P<0.05)。此外,T2D高危足组患者的上述4个血清miRNA的水平高于T2D组患者(P<0.05)。见表2。

表2 RT-qPCR检测T2D、T2DM高危足和对照组血清样品中miRNA的相对水平
2.3单变量和多变量的逻辑回归分析以对照组为参考类别,当T2D伴有或不伴有高危足疾病组被视为因果两类变量时,所选的4个血清miRNAs与单纯T2D和T2D高危足独立相关。为了进一步评估这些血清miRNAs与高危足类别的关联,发现当T2D组被作为参考类别时,所有这4种miRNAs都与高危足独立相关。然而,在进一步多变量分析中,以对照组为参考类别时,仅miR-195-5p(OR=6.9,95%CI:2.0~24.2,P=0.003)和miR-205-5p(OR=7.2,95%CI:1.6~32.0,P=0.009)与单纯T2D独立相关,和miR-195-5p(OR=6.9,95%CI:2.0~24.2,P<0.001)、miR-205-5p(OR=11.0,95%CI:2.8~43.2,P=0.001)与T2D高危足独立相关。当T2D组被作为参考类别时,仅miR-195-5p(OR=3.0,95%CI:1.6~5.7,P=0.001)和miR-205-5p(OR=2.3,95%CI:1.2~4.2,P=0.012)与T2D高危足独立相关,见表3、表4。
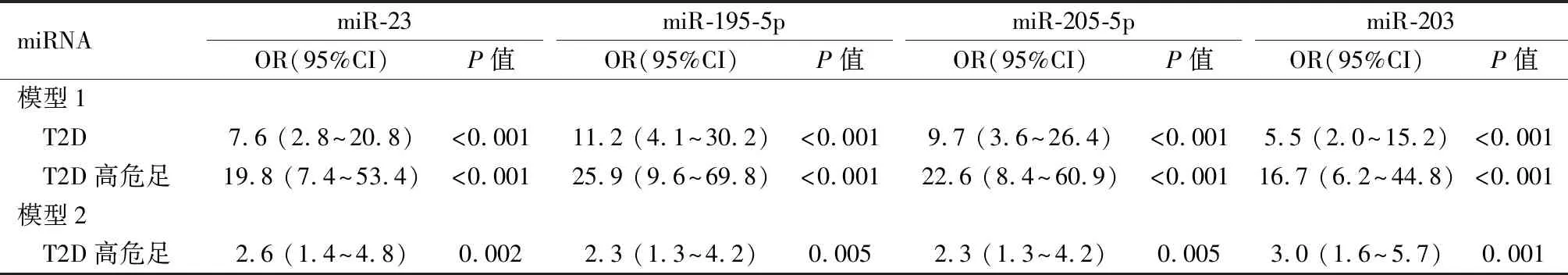
表3 T2D和T2D高危足的血清miRNAs的单变量逻辑回归分析
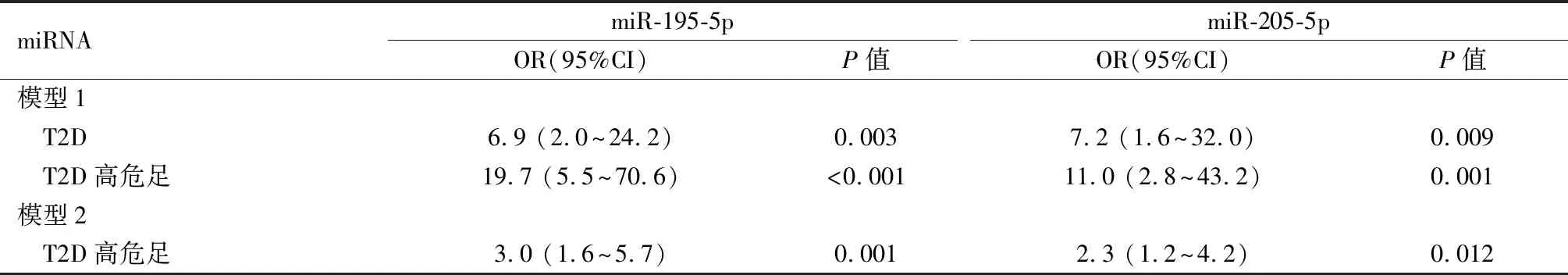
表4 T2D和T2D高危足的血清miRNAs的多变量逻辑回归分析
2.4ROC曲线分析miR-195-5p和miR-205-5p在区分T2D组和对照组时的ROC曲线下面积(AUC)分别为0.74和0.70,在区分T2D高危足组和对照组时的AUC为0.87和0.84,在区分T2D组和T2D高危足组时的AUC为0.65和0.62,见表5,图2。上述结果表明,这2个miRNA对T2D高危足具有相对较高的诊断价值。
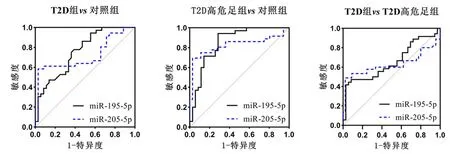
图2 ROC曲线分析血清miR-195-5p和miR-205-5p区分对照、T2D、T2DM高危足病例的能力
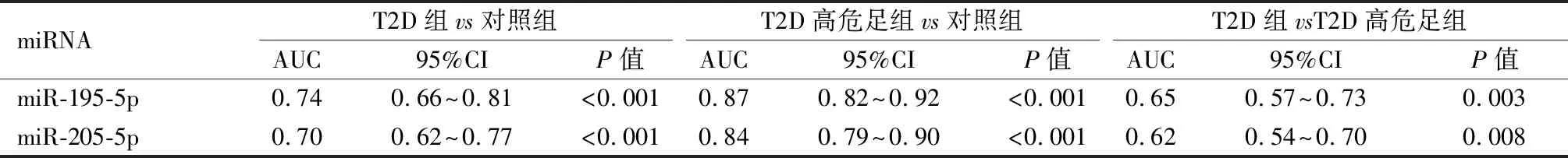
表5 ROC曲线分析血清miR-195-5p和miR-205-5p区分对照、T2D、T2DM高危足病例的能力
3 讨 论
血浆中循环miRNAs水平的改变与各种疾病和治疗效果有关。近年来,有几项研究对血清、血浆或血细胞miRNA谱的特定特征进行了描述和定义,以试图开发新的方法来预测和监测T2D的发展和进展[7]。上述研究提出了使用循环miRNA作为T2D疾病的新生物标志物的可能性。然而,目前仍缺乏对有和无高危足的T2D患者的血清miRNAs动态变化的系统分析。在本研究中,我们利用高通量TLDA技术确定了T2D患者和无高危足患者的全局血清miRNA表达谱,然后在单个样本中进行RT-qPCR确认,成功确定了4种miRNA的谱系,包括miR-23、miR-195-5p、miR-205-5p和miR-203,它们的表达在T2D患者血清中显著增加。此外,这4个miRNA在T2D高危足组中的水平明显高于单纯T2D患者。统计分析表明,确定的miRNAs与T2D高危足密切相关。因此,我们假设这4个循环miRNAs可能参与T2D和高危足并发症的发病机制。
目前,关于T2D以及其高危足并发病的主要机制仍然不清楚,而且没有一个明确的治疗方法。用于早期检测这种疾病的生物标志物和识别有发生并发症风险的个体将大大改善病人的护理。然而,目前没有一种新型的生物标志物可以有效地预测T2D[8]。既往研究表明,细胞外的miRNAs稳定地出现在循环中,可以作为有希望的糖尿病诊断生物标志物[9]。Jimenez-Lucena等[10]在T2D患者循环中确定了10个下调miRNAs,并证实了它们是区分T2D患者和对照组的有用生物标志物,血浆miR-126表达的减少与未来糖尿病发展的风险有关。上述结果在最近的两项研究中得到证实,描述了循环的miR-126可以发展成为一种非侵入性的有用的诊断工具,用于预测容易发展为T2D的个体[11-12]。另一项研究发现,与糖尿病前期个体和/或糖耐量正常的T2D易感个体相比,新发T2D中7个与糖尿病有关的miRNAs明显升高[13]。然而,与上述发现相比,本研究没有观察到改变的miRNAs的重叠情况。我们推测,这种不一致可能不仅是由样本特性产生的,也可能与以下因素有关:①以前的研究中使用了miRCURY LNATMmicroRNA PCR系统和SYBR Green qPCR SuperMix-UDG方法,而本研究主要基于TaqMan探针的RT-qPCR来检测单个血清样品中的miRNA水平;②这些研究中使用了不同的归一化方法。在既往研究中,循环miRNA表达水平被归一化为U6、合成细胞-miR-39或未经调整的Ct值,而在本研究中,血清miRNA表达水平被归一化为一种尖锐的外源性RNA(miR2911)。因此,迫切需要进行大型的前瞻性和多中心研究,根据标准化的样品制备、RNA提取和miRNA数据分析方案来确定诊断T2D的可靠miRNA特征。
既往研究表明,miRNA可以由各种细胞主动或被动释放。此外,循环中的miRNA通过微囊、Ago蛋白复合物或HDL运输,并能以活性形式转移到受体细胞[14]。基于上述结果,在T2D和T2D高危足的过程中,来自特定细胞群的改变的miRNA可能提供有关糖尿病并发症发生的目标组织的生理或病理状态的详细信息。在我们确定的4个miRNA中,miR-23参与了胰岛素生物生成的调节和SNAIL触发的上皮到间质的转变[15]。miR-205-5p是一个已知的抗血管生成因子,研究发现miR-205-5p表达减少抑制导致胃癌等中VEGF信号的过度激活[16]。此外,氧化应激抑制了miR-205-5p在视网膜上皮ARPE-19细胞中的表达;因此,VEGFA表达和血管生成增加,这可能是糖尿病视网膜病变的一个潜在机制[17]。研究发现,在T2D的背景下,高血糖诱导了心肌细胞中miR-195-5p的表达水平,并与糖尿病心肌病的发展有关[18]。miR-203被称为“皮肤特异性miRNA”,研究发现miR-203的表达在糖尿病足部溃疡伤口的皮肤组织中增加,并与疾病的严重程度密切相关[19]。本研究多变量分析确定了miR-195-5p和miR-205-5p与单纯T2D和T2D高危足独立相关,并且两者在区分T2D组和T2D高危足组时具有相对较高的诊断价值。因此,miR-195-5p、miR-205-5p可能在T2D高危足的病理中发挥潜在作用。
综上所述,本研究确定了miR-195-5p、miR-205-5p可能成为T2D及高危足的新型风险指标,并可能在T2D及高危足的发病机制和进展中发挥重要作用。

