功能磁共振评估宫内发育迟缓仔鼠肾脏微观结构及灌注改变
梁灿 李莹 贺晓日
(1.中南大学湘雅二医院新生儿科;2.中南大学湘雅二医院新生儿疾病研究室,湖南长沙 410011)
宫内发育迟缓(intrauterine growth restriction,IUGR)在中国大陆的发病率达8.77%[1]。其在发展中国家及亚洲发达国家常见的致病因素为孕期营养不良。在IUGR个体中,肾单位数量减少是高血压和肾脏疾病发生的重要促成因素[2]。肾单位的减少可使剩余肾小球代偿性肥大及高灌注[3]。同时,肾单位高灌注、高滤过的血流动力学改变还可以引起足细胞损伤、肾小球系膜细胞增生[4]以及肾小管损伤等[5]。流行病学相关研究显示,IUGR 个体成年后出现高血压、微量蛋白尿、慢性肾脏病(chronic kidney disease, CKD)甚至终末期肾脏疾病的概率较正常出生体重人群高[6-7]。IUGR肾小球数量减少多在出生时就已出现,但其后续肾脏改变多发生在成年后,肾功能损害一旦出现,很难防止病情的进展与恶化,从而导致不良临床结局[8],故对于IUGR个体的肾脏结构与功能需动态监测以期尽早干预,改善预后[4]。
目前常用于评估肾功能的方法如血肌酐、尿素氮、超声、肾穿刺活检等仍存在一定局限性。功能磁共振(functional magnetic resonance imaging,fMRI)具有敏感、定量、无创的特点,目前有多种技术已应用于肾脏损伤早期和持续损伤的评估。采用单指数模型方法的传统扩散加权成像(diffusion weighted imaging, DWI)得到的表观弥散系数(apparent diffusion coefficient, ADC)反映了组织微观结构及组织微循环灌注信息[9]。双指数模型可将组织微观结构和微循环信息分开,精细量化水分子的真性扩散和毛细血管及肾小管内液体流动引起的假性扩散,得到真实扩散系数(Dt)、伪扩散系数(D*)以及灌注分数(f),即为体素内不相干运动(intravoxel incoherent motion, IVIM)技术[10-11]。Dt与细胞间水分子的扩散速率相关,反映组织的微细结构;D*主要反映微循环灌注情况;f值表示目标区域内包含肾小管液流动的微循环灌注在整体扩散信号中所占比例。IVIM 在移植肾模型、糖尿病肾病及儿童慢性肾疾病中可用于评估纤维化评分、肾功能受损、估算肾小球滤过率与纤维化面积等,但各参数敏感度仍未达成共识[12-15]。
纵向驰豫时间(T1)和横向弛豫时间(T2)是形态磁共振成像(magnetic resonance imaging,MRI)中组织对比的主要来源[16],对组织的含水量较为敏感,且T1 的变化早于T2[17-18]。T1 mapping 及T2 mapping 技术通过定量化生成T1-map图及T2-map 图,得到对应部位的T1 值及T2值[17,19]。T1 mapping及T2 mapping已广泛应用于大脑、心脏等部位。目前研究认为T1 值与肾纤维化存在一定的相关性[17],T2 值对肾纤维化改变相对不敏感[7],对足细胞水肿、炎症等改变较敏感。T1及T2值在急性炎症时期均出现升高,肾纤维化时仅T1值出现升高[20],两者联合或能更好地识别肾脏纤维化改变。
本研究采用孕期低蛋白饮食建立IUGR仔鼠模型,利用IVIM、T1 mapping、T2 mapping MRI 扫描评估仔鼠肾脏微观结构及灌注改变的动态变化,观察各参数值的差异。同时将存在差异的MRI 参数与Scr、BUN 及肾脏病理检测结果对比,探讨通过fMRI评估IUGR仔鼠肾脏微观结构及灌注改变的价值。
1 材料与方法
1.1 实验动物和模型建立
本动物实验方案获中南大学湘雅二医院实验动物伦理委员会批准(编号2021030)。实验动物购买于湖南省长沙市斯莱克景达实验动物有限公司。将12只Sprague-Dawley(SD)孕鼠,随机分为低蛋白组(雌鼠妊娠予蛋白质含量为10%的低蛋白饲料喂养)和对照组(正常喂养),仔鼠出生后均正常喂养。仔鼠出生后测量体重,当仔鼠的出生体重低于对照组仔鼠的平均体重2个标准差者认为其发生IUGR[21]。通过给予孕鼠孕期全程低蛋白饮食建立IUGR 模型[22]。低蛋白组仔鼠随机分为IUGR 8周组、IUGR 12周组,对照组仔鼠随机分为正常8周组、正常12周组,每组各8只。均母乳喂养至21 d 后断乳分笼予以正常饮食,喂养至第8周、第12周时行MRI检查后处死并留取标本。
1.2 MRI检查
仔鼠检查前6~8 h 禁食禁饮,扫描前15 min 予10%水合氯醛(0.3 mL/100 g)皮下注射麻醉,取俯卧位、头先进体位。采用上海联影uMR790 3.0T磁共振成像系统,专配12 通道实验动物专用磁共振线圈。
1.3 MRI扫描序列
使用的MRI 扫描序列为:横轴位和冠状位快速自旋回波(T2WI) 序列,快速自旋回波(T1WI)序列,IVIM 序列,横轴位T1 mapping 序列,快速自旋回波(T1WI) 序列,横轴位T2 mapping序列,快速自旋回波(T2WI)序列。
1.4 MRI数据测量及分析
将IVIM 及T2 mapping 的MRI 扫描图片上传至联影处理工作站,使用相应软件包对图像进行处理后可生成IVIM 图像及T2 mapping 图像,T1 mapping 图像在MRI 扫描完成后自动生成。选取肾脏横断面面积最大的层面及其前后各2个层面,在肾脏对应解剖层(即肾皮质及肾髓质)内选择至少5 个像素大小的感兴趣区域(region of interest,ROI),避开肾窦及伪影区域。见图1。各个层面获得其对应MRI参数后将5个层面数据汇总,取其算术平均数为最终参数。

图1 实时测量时ROI选区 A:IVIM MRI选区图,可得到真实扩散系数(Dt)、伪扩散系数(D*)、表观弥散系数(ADC)、灌注分数(f)值;B:T1 mapping MRI选区图,可得到T1值;C:T2 mapping MRI选区图,可得到T2值。
1.5 实验室检查
于各时间点MRI 扫描结束后,颈静脉采血,迅速离心血液样本取上层血清。使用全自动生化分析仪检测血肌酐及血尿素氮水平。
1.6 病理检测
每组随机取2 只仔鼠,予2% 戊巴比妥(50 mg/kg)腹腔注射后处死,沿腹中线剪开皮肤后使用实验镊钝性分离腹膜,于腹膜后位分离肾脏取出,沿肾脏最大冠状面切开,放入4%多聚甲醛中固定24 h,不同浓度乙醇脱水后置于石蜡中包埋切片。
苏木精-伊红(hematoxylin-eosin, HE)染色:60℃烤石蜡切片12 h;逐层至水,予苏木精进行染色,蒸馏水冲洗后PBS返蓝;予伊红进行染色,蒸馏水冲洗;梯度酒精(95%~100%)脱水,置于二甲苯中脱蜡,中性树胶封片。
Masson 染色:60℃烤石蜡切片4 h;切片脱蜡至水(同HE染色)后甩去切片上水,予适量核染液滴上覆盖切片组织,染色3~5 min;予自来水冲洗、蒸馏水浸泡、PBS浸泡切片5~10 min返蓝;甩去切片上水,适量复染液滴上覆盖切片组织,染色2 min,冲洗液冲洗;滴上分色液30 s,弃分色液;适量复染液滴上覆盖切片组织,染色6~8 min,倒去,无水乙醇冲洗;吹干封片。
1.7 统计学分析
采用SPSS 24.0 软件对数据进行统计学分析。正态分布计量资料采用均值±标准差(xˉ±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;各组内肾脏皮质和髓质间计量资料的比较采用两样本t检验。非正态分布计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,多组间比较采用Kruskal-WallisH检验,组间两两比较采用Dunn's 检验;各组内肾脏皮质和髓质间计量资料的比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 IUGR动物模型
正常对照组平均出生体重为(6.8±0.6)g,低蛋白组平均出生体重为(5.0±0.6)g,两组差异具有统计学意义(t=-15.914,P<0.001)。IUGR 组仔鼠IUGR 发生率显著高于正常组(0% vs 84%;P<0.05)。以仔鼠死产或生后24 h内死亡定义为围产期死亡,两组仔鼠围产期病死率差异无统计学意义(5% vs 8%;χ2=0.630,P=0.427)。
2.2 各组仔鼠肾脏组织病理检查结果
HE 染色结果显示,正常8 周组、正常12 周组仔鼠肾脏皮质肾小球及周围间质结构清楚,细胞形态良好,肾小球周围毛细血管呈小叶状分布,未见炎性细胞浸润;髓质可见肾小管结构清晰,肾小管上皮细胞刷状缘形态正常。IUGR 8 周组仔鼠肾脏皮质出现部分肾小球轻度扩张,间质可见炎性细胞浸润;髓质偶可见肾小管上皮细胞损伤;IUGR 12周仔鼠肾脏皮质可见部分肾小球萎缩乃至坏死,囊腔消失,炎性细胞浸润;髓质可见部分肾小管上皮细胞损伤,刷状缘脱落,部分肾小管管腔扩张,管腔内可见管型及坏死脱落细胞,间质可见纤维化。见图2。
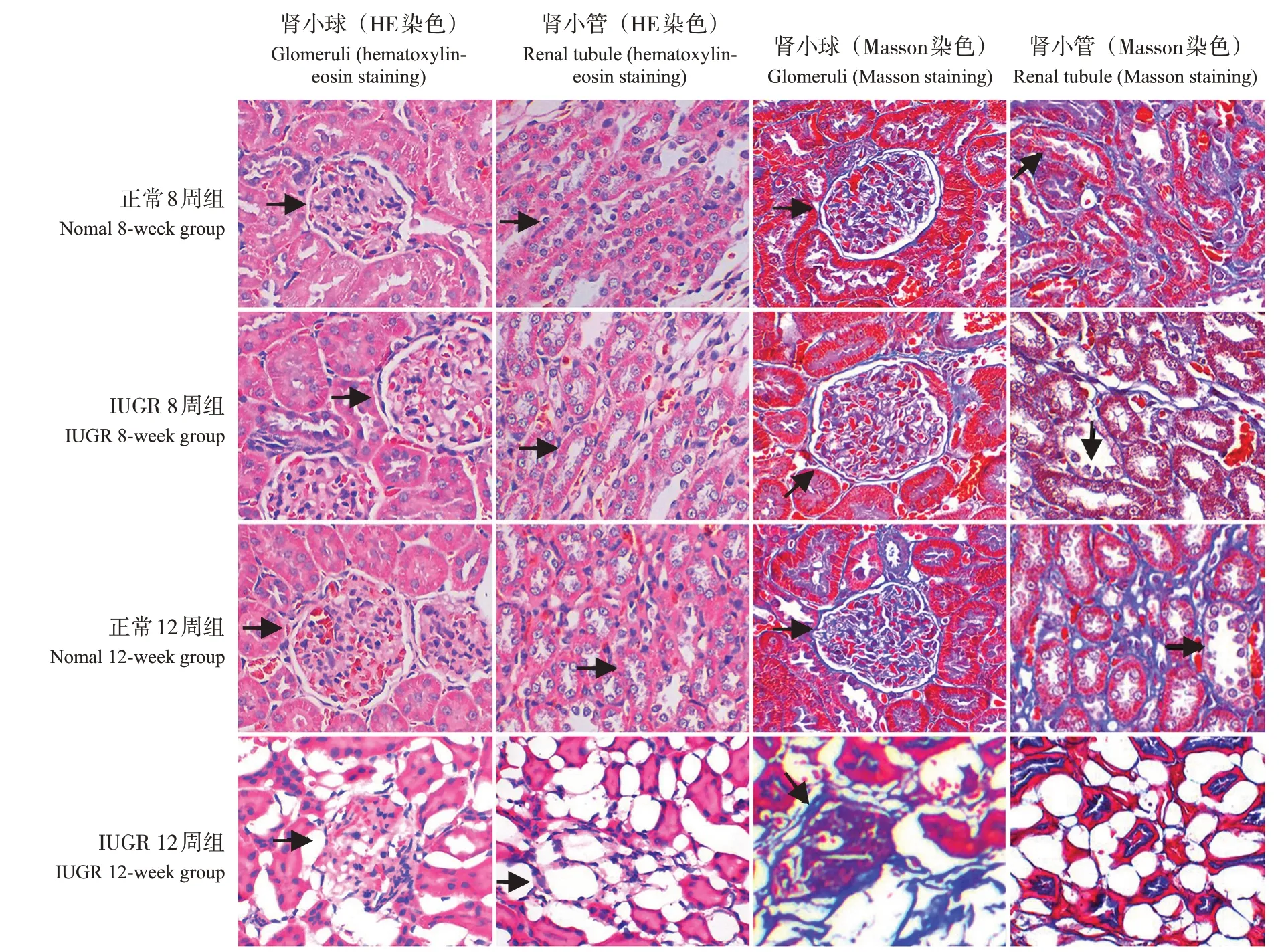
图2 各组仔鼠肾小球、肾小管HE、Masson染色图(光镜,×400) HE染色结果显示,正常8周组、正常12周组及IUGR 8周组可见肾小球形状完整,肾小囊清晰,IUGR 12周组可见肾小球萎缩,肾小囊消失,箭头指示肾小球结构;正常8周组、正常12周组及IUGR 8周组可见肾小管结构正常,刷状缘清晰,IUGR 12周组可见肾小管结构紊乱,刷状缘脱落,部分可见肾小管上皮细胞脱落,箭头指示肾小管刷状缘。Masson染色结果显示,正常8周组、正常12周组及IUGR 8周组可见肾小球形状完整,肾小囊清晰;IUGR 12周组可见肾小球萎缩,肾小囊消失,蓝染较其余3组明显,提示纤维化改变,箭头指示肾小球结构。正常8周组、正常12周组及IUGR 8周组可见肾小管结构正常,刷状缘清晰,未见显著纤维化改变;IUGR 12周组可见肾小管结构紊乱,刷状缘脱落,部分可见管型,蓝染较其余3组明显,提示纤维化改变,箭头指示肾小管刷状缘。
Masson 染色结果显示,正常8 周组、正常12周组及IUGR 8 周组仔鼠肾脏未见纤维化改变。IUGR 12周组仔鼠可见肾小球坏死、间质纤维化改变。见图2。
2.3 各组肾脏fMRI结果
各组内肾脏皮质和髓质间ADC值及f值差异无统计学意义,各组间肾脏皮质和髓质间ADC值及f值差异无统计学意义(P>0.05)。IUGR 12 周组肾脏髓质Dt值高于IUGR 8周组(P<0.05),各组间肾脏皮质Dt值比较及各组内肾脏皮质和髓质间Dt值比较差异无统计学意义(P>0.05)。IUGR 12 周组肾脏髓质D*值低于正常12周组与IUGR 8周组(P<0.05),各组间肾脏皮质D*值比较及各组内肾脏皮质和髓质间D*值比较差异无统计学意义(P>0.05)。见表1。

表1 各组肾脏fMRI结果比较 (n=8)
2.4 各组肾脏T1 mapping、T2 mapping结果
IUGR 8 周组肾脏髓质T1 值高于皮质,IUGR 12 周组肾脏髓质T1 值高于IUGR 8 周组与正常12周组,IUGR 12 周组肾脏皮质T1 值高于正常12 周组(P<0.05)。各组内肾脏髓质T2 值均高于皮质(P<0.05);各组肾脏皮质和髓质间T2 值比较差异无统计学意义(P>0.05)。见表2。
表2 各组肾脏T1、T2值比较 (± s,n=8)

表2 各组肾脏T1、T2值比较 (± s,n=8)
注:a示与IUGR 8周组比较,P<0.05;b示与正常12周组比较,P<0.05。
组别正常8周组IUGR 8周组正常12周组IUGR 12周组F值P值T1值T2值皮质1 694±153 1 648±174 1 410±264 1 740±385b 2.988 0.047髓质1 880±254 1 847±94 1 561±340 1 928±313a,b 3.055 0.045 t值-1.272-2.836-0.992-1.075 P值0.224 0.013 0.338 0.301皮质67±4 68±5 66±5 67±2 0.399 0.755髓质81±6 82±8 85±7 85±4 0.888 0.459 t值-5.291-4.233-6.033-11.158 P值<0.001 0.001<0.001<0.001
2.5 各组血肌酐及血尿素氮含量比较
正常8 周组、IUGR 8 周组、正常12 周组及IUGR 12周组血肌酐及血尿素氮含量差异无统计学意义(P>0.05),见表3。
表3 各组血肌酐及血尿素氮含量比较 (± s,n=8)

表3 各组血肌酐及血尿素氮含量比较 (± s,n=8)
组别正常8周组IUGR 8周组正常12周组IUGR 12周组F值P值血肌酐 (μmol/L)28±8 31±7 33±4 35±11 1.237 0.319血尿素氮 (mmol/L)8.4±1.8 10.0±1.3 8.0±0.9 9.4±3.1 1.584 0.220
3 讨论
本研究采用雌鼠孕期全程低蛋白饮食成功建立IUGR仔鼠模型。在肾脏病理检测中IUGR 8周组肾小球仅出现肥大,而IUGR 12周组肾小球出现萎缩、硬化,肾小管出现损伤,肾间质出现炎性细胞浸润乃至肾纤维化,其中纤维化改变在Masson染色中较为突出。此前研究认为在IUGR 生后早期,肾单位的减少使得剩余肾小球出现代偿性肥大及高灌注,而在肾脏中灌注与能量消耗相关的特性使其氧耗增加,最终晚期可见剩余的肾小球出现硬化、坏死、纤维化[3]、,甚至肾小管损伤等病理改变[23]。本研究病理结果与上述研究一致,故认为本模型可应用于IUGR肾损伤的研究。而血肌酐与血尿素氮组间比较并无明显差异,这可能是由于这两个指标易受饮食、年龄、身高、肌肉含量等多种因素影响,可靠性欠佳并相对滞后[24]。
多数研究者认为ADC 值、f 值、D*值及Dt值在灌注丰富、水分子扩散活跃的皮质中更高,在部分病理情况下其皮、髓质间差异可消失[25]。本研究中,IUGR 8 周组与正常8 周组在IVIM 图像上获得的ADC 值、f 值、D*值及Dt值差异无统计学意义,提示IUGR仔鼠生后早期,肾脏病理改变可能仅为肾小球数目减少,而肾小球工作面积的增加便可维持正常肾功能[26]。IUGR 12 周组髓质D*值较正常12 周组降低,其病理检查结果提示肾脏出现失代偿性修复,其中细胞水肿、炎症细胞浸润及肾纤维化等均可导致D*值降低[27]。也有研究认为IUGR 模型中肾素-血管紧张素系统的改变导致D*值出现显著降低[28]。肾脏髓质对缺氧等损害较为敏感,故D*值的改变主要发生在髓质。而ADC值与被认为较为敏感的Dt值未出现改变,可能是由于肾小球周围小血管的收缩与肾小球的高灌注可导致其出现截然相反的变化,从而使得改变抵消。
比较IUGR 组第8 周与第12 周结果发现,IUGR 8 周组肾脏髓质D*值高于IUGR 12 周组,而Dt值低于IUGR 12周组。Dt值代表真实水分子扩散水平,在早期IUGR丢失的肾小球可通过剩余肾小球高灌注进行代偿,而后期仅剩的肾小球进一步坏死丢失可导致剩余肾小球负荷继续加重,血浆流量进一步增加,水分子扩散继续增加,故Dt值随时间发展升高而D*值下降[29]。
肾脏髓质拥有较丰富的含水量,正常肾脏其皮质T1 值应低于髓质[30],本研究结果与之相符。各组内皮质、髓质间T1值差异仅在IUGR 8周组有统计学意义,而在IUGR 12周时其组内差异不再有统计学意义。肾小球长期高负荷导致细胞水肿、炎症细胞浸润、肾脏皮质肾小球已逐渐出现纤维化、胶原蛋白具有丰富的含水量等,均可导致IUGR 12周组肾脏皮质T1值升高[31]。IUGR 12周组髓质T1 值高于正常12 周组与IUGR 8 周组,提示IUGR仔鼠12周时其肾脏已出现可逆转的炎症反应或是不可逆的纤维化改变。既往研究认为处于低氧环境时髓质对于血液灌流及氧消耗的变化较敏感,故IUGR肾损伤首先发生在髓质[32],这与本研究所观察到T1 值改变发生在髓质相符,同时,在IVIM中也观察到代表灌注的D*值在髓质出现改变,认为其可相互印证。以上提示T1 mapping MRI可用于评估IUGR仔鼠肾脏微观结构及灌注损伤。
本研究显示,IUGR仔鼠生后12周时其肾脏与正常12 周仔鼠的D*值及T1 值差异有统计学意义,而此时血肌酐及尿素氮无法反映此时肾脏的损伤。对于肾脏损伤的类型IVIM 及T1 mapping MRI 单独使用时均无法分辨。在多数肾脏病理改变中T1 值及T2 值均可出现相似改变,但在肾脏纤维化中其改变则存在显著差异[33]。在可逆性急性炎症反应(即细胞及间质水肿、炎症细胞浸润)的情况下,T1值与T2值均出现升高,在肾纤维化时T2值无显著改变但T1出现升高[11,18,33]。和T1值一样,一般而言,肾脏髓质T2值高于皮质[34]。本研究观察到IUGR 12 周组肾脏出现纤维化改变,同时其T1 值较正常12周组高,各组仔鼠肾脏髓质T2值均高于皮质,各组间T2 值比较差异无统计学意义,这与此前的研究相符。以上提示,T1 mapping 联合T2 mapping MRI可辨别出IUGR仔鼠肾脏纤维化改变。
IVIM MRI是评估及动态观察IUGR仔鼠肾脏微观结构及灌注损伤敏感的方法。T1 mapping MRI可用于评估IUGR 仔鼠肾脏损伤;T1 mapping 联合T2 mapping MRI 可进一步分辨IUGR 仔鼠的肾脏纤维化。
作者贡献声明:梁灿、李莹负责研究设计、分析数据、论文撰写;贺晓日负责项目主持及指导、研究设计、论文修改、经费支持。
利益冲突声明:所有作者均声明不存在利益冲突。

