牛奶蛋白过敏婴儿肠道菌群特异性变化及短链脂肪酸水平分析
于志丹 岳玲玲 王梓潓 王睿孜 李利锋 张万存 李小芹
(郑州大学附属儿童医院/河南省儿童医院郑州儿童医院消化内科/郑州市儿童消化疾病重点实验室,河南郑州 450018)
近年来,食物过敏在婴幼儿和儿童人群中的发病率呈上升趋势,其中牛奶蛋白过敏(cow's milk protein allergy, CMPA)最为常见,其患病率报道不一,在1.3%~2.9%之间;症状可累及多个器官系统,如皮肤、消化道、呼吸道等,可出现皮疹、肠道炎症和哮喘等表现[1]。食物蛋白等过敏原经消化道致敏是诱发食物过敏的始动环节,因而阐明肠道环节食物致敏蛋白与肠道免疫之间的关系及其影响因素,减轻或阻断肠道异常反应或致敏,对于食物过敏疾病的预防和治疗至关重要。肠道菌群作为人体新陈代谢的“器官”,在肠道免疫系统发育和功能发挥方面亦起着重要作用,在出生后的早期阶段,肠道菌群的建立与免疫系统的成熟是平行发展的[2]。因此,肠道菌群发育异常和稳态失调可损害肠道免疫,进而引发健康问题和疾病发生。近期的研究显示,肠道菌群紊乱与食物过敏发生密切相关[3-5]。菌群代谢产物是菌群与宿主间的重要介质,其中乙酸、丙酸、丁酸等短链脂肪酸(short-chain fatty acid, SCFA)作为一类重要的产物除了可为肠上皮细胞提供能量以外,在维持肠上皮细胞屏障的完整性、增加抗炎产物的合成或调节肠道免疫细胞功能方面起着重要作用[6-8]。本研究采用16S rDNA高通量检测技术和液相色谱质谱联用仪(liquid chromatograph mass spectrometer, LC-MS)检测CMPA 患儿肠道菌群及其代谢产物SCFA 水平变化,以期揭示CMPA 患儿肠道菌群特征及SCFA 的变化,为CMPA 的预防和治疗提供新的思路。
1 资料与方法
1.1 研究对象
选取2019年8月—2020年8月在郑州大学附属儿童医院门诊就诊的CMPA患儿及儿童保健门诊体检正常婴儿各25例,分别设为CMPA组和对照组。所有研究对象的生活区域均在郑州市及周边县市,生活习惯及饮食结构基本相同。收集两组婴儿一般资料及CMPA患儿临床资料。
纳入标准:(1)母乳喂养,年龄<6 个月;(2)根据《中国婴幼儿牛奶蛋白过敏诊治循证建议》[9]确诊为CMPA。
排除标准:(1)患有肠道感染性疾病(结核病及乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒等病毒感染)、消化道畸形、内分泌代谢障碍、先天性疾病、自身免疫性疾病;(2)1个月内服用抗生素、微生态制剂(如益生菌)等影响消化道菌群的药物;(3)入选前1个月内口服或静脉应用糖皮质激素和其他免疫抑制剂。
本研究已通过我院伦理委员会审议(2021-HK16),且获得患儿家属知情同意书。
1.2 样本采集
采集研究对象新鲜粪便样本200 mg,并置于无菌冻存管内,2 h 内低温运输至实验室,保存于-80℃冰箱。每个研究对象收集3份样本备用。
1.3 肠道微生物多样性及群落结构分析
采用CTAB 法提取粪便中微生物基因组DNA,检测DNA 的纯度和浓度,合格的样品用无菌水稀释至1 ng/μL。设计鉴定通用引物(V3~V4 前端引物:343F-5'-TACGGRAGGCAGCAG-3',后端引物:798R-5'-AGGGTATCTAATCCT-3'),通过PCR 扩增对高变区进行测序分析和菌种鉴定。基于IlluminaHiSeq测序平台,采用双末端测序(Paired-End)方法,构建小片段文库。以稀释的基因组DNA 为模板,利用带Barcode 特异性引物、PCR Master Mix(含有GC buffer)以及高保真酶配制成PCR 反应体系。检测合格的PCR 产物根据浓度进行等体积混合,并用琼脂糖凝胶电泳(2%)分离PCR产物,回收纯化目的条带。利用TruSeq®DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,然后将构建好的文库经Qubit 和Q-PCR 定量,利用HiSeq2500 PE250 进行上机测序。经过滤处理得到高质量的Tags数据,与数据库进行对比,排除其中的嵌合体序列,得到最终的有效数据,并进行基于序列间相似度的分类单元(operational taxonomic unit, OTU)聚类分析,将获得的信息通过Qiime 软件计算Chao1、Shannon、Simpson 等指数, 并 在 界(kingdom)、 门(phylum)、 纲(class)、目(order)、科(family)、属(genus)、种(species)7 个水平上统计各样本的群落组成。Venn 图和主成分分析(principal component analysis, PCA)图采用R 软件绘制。α-多样性(包括Chao1、Shannon、observed species 指数等指标)和β-多样性采用QIIME2 计算。采用nsegata-LEfSe软件对差异性菌群进行LEfSe分析。
1.4 肠道微生物代谢组学分析
粪便样本经缓冲液充分溶解,加入内标L-2-氯苯丙氨酸(0.3 mg/mL)和LysoPC 17∶0(0.01 mg/mL)各20 μL (甲醇配置) 及400 μL 的甲醇-乙腈(V∶V=2∶1),并用超声提取10 min 后,-20℃静置30 min;离心得150 μL 上清,用0.22 μm的有机相针孔过滤,并转移至液相色谱进样瓶,进行LC-MS 分析。质量控制由所有样本的提取液等体积混合制备而成,每个质量控制的体积与样本体积相同。所有提取试剂使用前均在-20℃进行预冷。
本次实验的分析仪器为AB ExionLC 超高效液相串联AB TripleTOF 6600 高分辨质谱仪组成的液质联用系统。色谱柱为ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm),柱温45℃,流 速0.4 mL/min。质谱条件为ESI 离子源,样品质谱信号采集分别采用正负离子扫描模式。
1.5 微生物多样性与代谢组联合分析
根据样本一一对应关系,计算微生物(OTU/门/纲/目/科/属/种)的相对丰度与对应代谢物的响应强度数据之间的关联性。二者之间的相关性采用Spearman秩相关分析。
1.6 统计学分析
采用RStudio软件语言完成微生物群数据分析。肠道菌群的异同性采用聚类分析,其值的计算采用Wilcoxon 秩和检验,并经过FDR 校正。采用SPSS 21.0 统计软件进行数据处理,正态分布的计量资料以均值±标准差(±s)表示,组间比较采用两样本t检验;计数资料采用例数和百分率(%)表示,组间比较采用卡方检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 CMPA组与对照组一般资料的比较
CMPA组和对照组年龄、身高、体重、出生体重、出生方式的比较差异无统计学意义(P>0.05)。CMPA 组每日大便次数显著高于对照组(P<0.01)。CMPA 组患儿大便均含有奶瓣,且18 例出现便血。见表1。

表1 CMPA组和对照组一般资料的比较
2.2 CMPA患儿肠道菌群多样性分析
50个样本共获得3 555 452条可用高质量序列,基于有效数据已超过97%相似性进行OTU 聚类分析,共注释到6 644个OTU中。基于统一深度下计算不同样本的α-多样性指数(Chao1、Shannon 和observed species指数),分析表明,与对照组相比,CMPA组α-多样性显著增加(两组Chao1、Shannon和observed species 指数比较,均P<0.001)(图1A~C)。基于多种距离矩阵的分析结果,通过主坐标分析和非度量多维排列 (non-metric multidimensional scaling, NMDS)分析可以观察个体或群体间的差异,结果表明CMPA组和对照组间微生物群落β-多样性具有差异,且组内生物重复性好(图1D~E)。Venn图分析显示,CMPA组和对照组婴儿粪便中OTU 的组成有很大不同:只有1 769 个OTU 是两组共同所有,而4 335 个OTU 是CMPA组所特有(图1F)。

图1 CMPA粪便群落多样性分析 A、B、C:基于统一深度下不同样本的α-多样性指数分析;a表示与对照组相比,P<0.05。D、E 分别为NMDS 分析(stress=0.048)和主坐标分析,显示CMPA 组和对照组间微生物菌落β-多样性有差异。F:Venn图,显示CMPA组和对照组儿童粪便中OTU的组成有很大的不同,只有1 769个OTU是两组共同所有。
2.3 CMPA患儿肠道菌群结构的变化
为了明确CMPA 对婴儿肠道菌群组成的影响,将OTU 进行聚类分析,得到不同水平物种相对丰度。从科水平上看(图2),CMPA患儿肠道内肠杆菌 科 (Enterobacteriaceae, 14%)、 毛 罗 菌 科(Lachnospiraceae, 6%)、拟杆菌科(Bacteroidaceae,4%)、普雷沃氏菌科(Prevotellaceae, 1%)、瘤胃球菌科(Ruminococcaceae, 3%)丰度较对照组(丰度分别为16%、20%、21%、4%和16%)均显著下降。Muribaculaceae、Arcobacteracea、 梭 菌 科(Clostridiaceae_1) 、 鞘 脂 单 胞 菌 科(Sphingomonadaceae)、支原体科(Mycoplasmataceae)等在CMPA患儿肠道内富集。
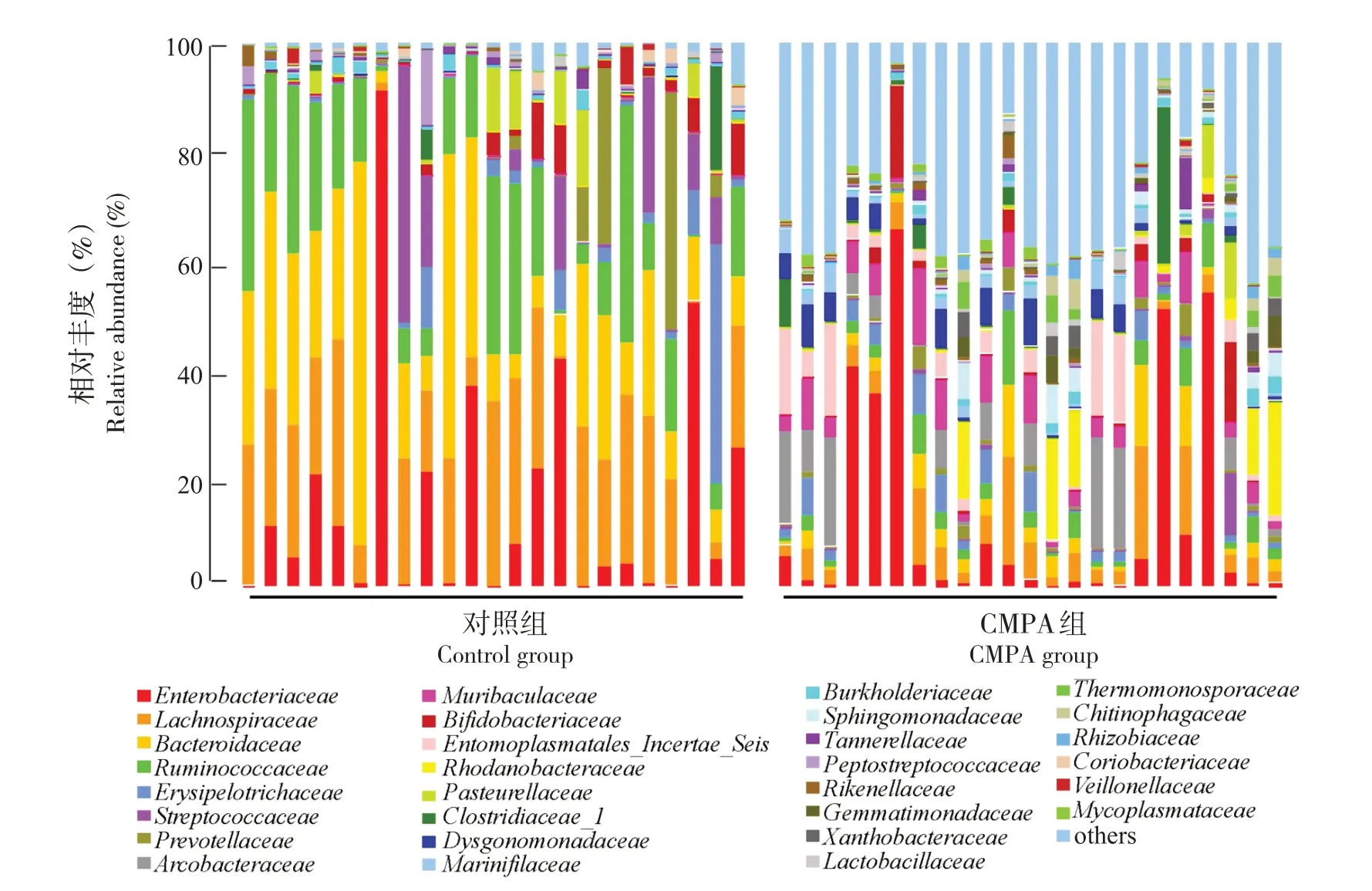
图2 CMPA患儿肠道菌群群落结构分析 单个样本科水平群落结构(柱子表示样本,不同颜色表示不同注释信息,others表示除前30之外的所有物种)。
2.4 CMPA患儿肠道菌群差异物种分析
为了进一步探讨CMPA 患儿肠道菌群的变化,本研究利用LEfSe方法分析了组间具有显著性差异的 物 种(biomarker),筛 选LDA score 前15 的biomarker(图3A)。结果显示,对照组中厚壁菌门(Firmicutes)、梭状芽孢杆菌目(Clostridiales)、拟杆菌(Bacteroides)丰度较高,而CMPA 组患儿肠道 菌 群 变 形 菌 (Proteobacteria)、 弯 曲 菌(Campylobacteria)丰度显著升高。对差异物种进行相对丰度log 转换,种水平上差异物种相对丰度前10 的boxplot 分析显示,CMPA 组肠道中嗜热链球菌(Streptococcus_salivarius_subsp._thermophilus)(P=0.014)、脆弱拟杆菌(Bacteroides_fragilis)(P=0.004)、 脆 弱 类 杆 菌 多 形 种(Bacteroides_thetaiotaomicron) (P=0.005) 、 丁 酸 梭 菌(Clostridium_butyricum)(P<0.001)显著下调,而乳杆菌属(Lactobacillus_murinus、Lactobacillus_gasseri、Lactobacillus_reuteri)(P<0.001)和肺炎链球菌(Streptococcus_pneumoniae)(P<0.001)显著升高(图3B)。

图3 CMPA 患儿肠道菌群物种丰度分析 A:差异物种score 图,不同颜色表示不同组别,红色条形表示在CMPA 组别中丰度相对较高的物种,绿色条形表示在对照组别中相对丰度较高的物种;B:种水平差异物种相对丰度前10 的boxplot分析,纵坐标表示物种的相对丰度log转换值。
2.5 CMPA患儿肠道菌群代谢产物SCFA含量
为了确定微生物群落结构的变化是否会转化为微生物代谢的改变,本研究同时检测了对照组和CMPA组肠道内微生物代谢产物,根据变量权重值对脂肪酸差异代谢物表达量进行可视化分析,结果显示,CMPA组肠道内脂肪酸代谢产物含量较对照组显著下降(表2),包括乙酸、丁酸、异戊酸(图4)。
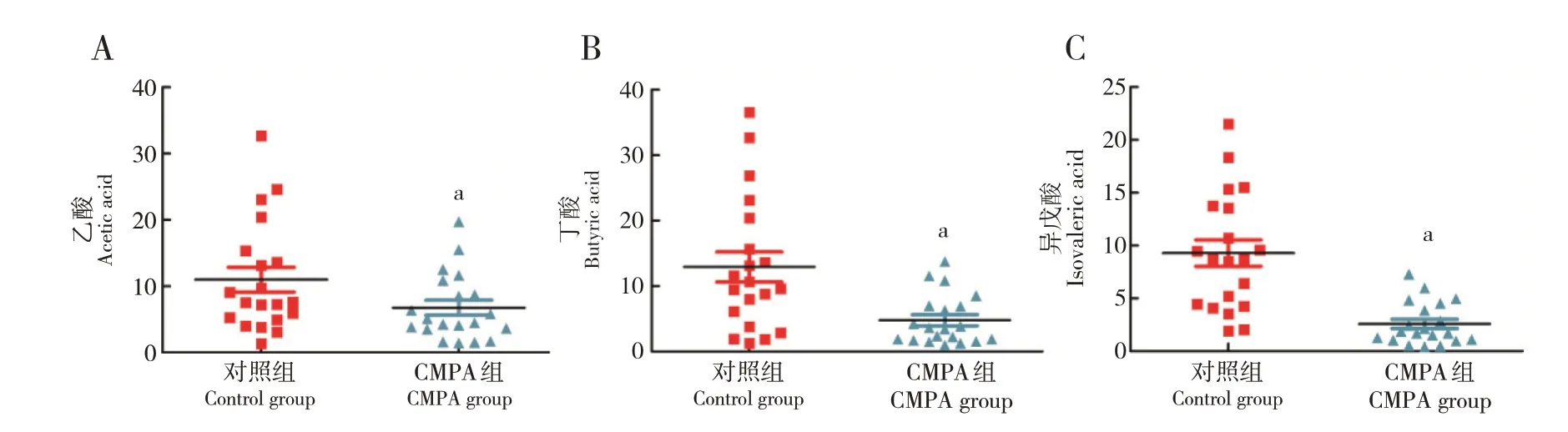
图4 CMPA患儿肠道代谢产物SCFA变化分析 图A、B、C分别为乙酸、丁酸和异戊酸相对含量。a表示与对照组相比,P<0.05。

表2 CMPA组与对照组相比肠道脂肪酸代谢产物的变化
2.6 肠道菌群与其代谢产物SCFA的关联分析
将SCFA产生菌丰度与乙酸、丁酸、异戊酸含量进行Spearman秩相关分析,结果显示:乙酸含量与粪杆菌属(Faecalibacterium)和粪球菌属(Coprococcus_3)等的丰度呈正相关(P<0.05);丁酸含量与粪杆菌属(Faecalibacterium)、罗氏菌属(Roseburia)、细毛螺菌属 (Eubacterium_eligens_group)、 粪 球 菌 属(Coprococcus_1)等的丰度呈正相关(P<0.05);异戊酸含量与粪杆菌属(Faecalibacterium)、毛螺菌属(Lachnoclostridium)、瘤胃球菌属(Ruminococcaceae_UCG-003)、霍氏真菌属(Eubacterium_hallii_group)等的丰度呈正相关(P<0.05)。见图5。

图5 肠道菌群与代谢产物SCFA关联分析 橘红色为正相关,蓝色为负相关,颜色越深相关性越大。***示P<0.001,**示P<0.01,*示P<0.05。
3 讨论
生活方式和环境的改变影响人体肠道菌群的组成,与多种疾病的发生发展密切相关。抗生素的滥用、较高比例的配方奶喂养、饮食结构改变等打乱了机体肠道菌群平衡,增加过敏性疾病的发生率,其中CMPA 是婴幼儿最常见的过敏性疾病。婴儿时期是肠道菌群建立的关键窗口,在塑造宿主免疫力方面起着重要作用[10]。生命早期肠道菌群组成的改变(如生态失调)是影响食物过敏发展的关键因素[11]。胃肠道内膜是机体最大的免疫位点,在生命过程中不断接触大量的微生物和食物蛋白,具有吸收营养物质和抵御潜在致病微生物的功能。通常情况下,肠道微生物通过饮食获得的生物大分子可诱导肠道固有层调节性T细胞(regulatory T cell, Treg)的发育,以抑制食物过敏引发的过强免疫反应[12]。因此,早期肠道微生物的定植及组成在儿童食物过敏中发挥重要作用。
Nakayama等[13]分析了过敏和非过敏婴儿的粪便细菌组成,表明肠道微生物组成的变化增加后期过敏的风险。为了更好地了解共生细菌与婴儿CMPA的关系,本研究收集了CMPA患儿及正常婴儿粪便进行微生物组学分析,发现CMPA患儿较正常婴儿肠道微生物α-多样性显著增加。早期肠道菌群失调直接影响机体功能,增加儿童食物过敏的风险。近年来研究表明,西方CMPA婴幼儿肠道菌群组成与正常婴幼儿不同,含有更高的细菌数和厌氧菌,并伴随拟杆菌门(Bacteroidetes)丰度减少,厚壁菌门和梭状芽孢杆菌纲(Clostridia)丰度增加[14]。然而,另有研究报道,过敏患儿肠道内梭状芽孢杆菌目丰度减少,而拟杆菌目丰度增加[15]。本研究发现CMPA 患儿肠道菌群结构发生改变,含有较高丰度的梭菌科、鞘脂单胞菌科、支原体科,而拟杆菌科、肠杆菌科和普雷沃氏菌科丰度下降。另有LEfSe分析表明厚壁菌门、梭状芽孢杆菌目、拟杆菌在CMPA 患儿肠道内丰度降低。由于地域结构及饮食文化的差异导致我国CMPA 患儿肠道菌群的变化与西方国家有所不同,但患儿肠道内梭状芽孢杆菌、拟杆菌丰度均降低。有研究表明肠道内梭状芽孢杆菌的定植可促进肠道内转化生长因子-β (transforming growth factor beta, TGF-β)的表达,从而影响表达Foxp3 转录因子的结肠调节性T 细胞(Foxp3+Treg)的累积和功能,而Foxp3+Treg 在口服耐受中发挥关键作用[16-17]。因此,CMPA患儿肠道菌群的变化可能直接影响肠道免疫细胞的分化、累积及功能,从而调节过敏反应。
肠道菌群代谢物是宿主免疫系统和共生微生物群之间交流的重要信号分子,为互利共生奠定了广泛的基础[7]。其中,SCFA 是肠道内含量最多的代谢产物之一,在维持肠黏膜完整性、局部和全身代谢功能中发挥重要作用,且可调节机体免疫应答[6,8,18]。SCFA 可诱导Treg 产生与分化,降低Th2 型细胞因子和抗原特异性IgE,抑制过敏免疫应答[19];或与G 蛋白偶联受体结合,诱导IL-18产生,促进肠上皮细胞增殖,维持肠道屏障完整性[20]。近年来研究表明,与健康受试者相比,食物过敏儿童粪便中SCFA水平显著降低[21-22]。本研究发现CMPA 患儿肠道内丁酸梭菌丰度显著降低,菌群代谢产物脂肪酸含量显著下降,尤其是丁酸、乙酸和异戊酸。因此,在过敏的机体中,肠道菌群组成改变尤其是SCFA 相关菌群(丁酸梭菌等)的丰度降低,导致SCFA浓度降低,破坏肠道屏障完整性,进而导致食物抗原通过上皮屏障诱发炎症反应。此外,为了明确肠道菌群与SCFA 在CMPA过程中的关系,对两者进行关联分析,发现乙酸含量与粪杆菌属、粪球菌属等的丰度呈正相关,丁酸含量与粪杆菌属、罗氏菌属等的丰度呈正相关,异戊酸含量与粪杆菌属、毛螺菌属、瘤胃球菌属等的丰度呈正相关。肠道微生物紊乱与CMPA 的发病机制存在一定联系,而这种联系可能是通过SCFA水平变化而介导[23],尤其是丁酸总量的减少。肠道菌群组成不同类型的变化可能导致代谢产物具有相似的变化特征,从而引起或促进食物过敏的发生。肠道微生物可调节机体免疫、肠道蠕动、降解未消化食物等多种生理过程。有研究表明,肠道微生物及其代谢产物通过调节机体免疫、黏膜屏障完整性对婴幼儿消化系统疾病的发生发展具有重要影响[24]。但有关肠道微生物来源性SCFA在过敏性疾病中的具体作用机制还需进一步研究。
综上所述,婴儿CMPA普遍存在肠道菌群结构的改变,其中SCFA产生菌丰度降低,导致肠道内SCFA 水平降低,抑制了肠道黏膜屏障的恢复,进一步诱导肠道炎症的加重。但有关SCFA 在CMPA肠道炎症中的作用与机制还需进一步深入研究。在CMPA的治疗中,或许通过微生物制剂或饮食调节肠道微生物组成,平衡肠道内SCFA的水平,对恢复过敏患儿健康具有重要的临床意义。
作者贡献声明:于志丹负责研究设计与论文撰写;岳玲玲负责样本收集;王梓潓负责样本处理;王睿孜负责统计学分析;李利锋负责检测数据初步筛选;张万存负责生物信息学分析;李小芹负责研究监督与质量把控。
利益冲突声明:所有作者声明无利益冲突。

