34 株鸭疫里默氏杆菌的分离鉴定及部分耐药基因调查分析
张 燕,董洪燕,于圣青,杨静静,吴 植,吴 双,洪双鹏,朱善元,邢 华
(1.扬州大学兽医学院,扬州 225009;2.江苏农牧科技职业学院,泰州 225300;3.中国农业科学院上海兽医研究所,上海 200241;4.江苏桂柳牧业集团有限公司,徐州 221000)
鸭疫里默氏杆菌(Riemerellaanatipestifer, RA)是一种革兰氏阴性、无芽孢杆菌,该菌主要引起雏鸭的急性或慢性、败血性传染病,以纤维素性心包炎、气囊炎、肝周炎、脑膜炎和关节炎为主要临床特征,传染性强,致死率高,给养鸭业带来了巨大的经济损失,已成为危害水禽养殖的最重要传染病之一[1]。RA血清型复杂,迄今为止,世界范围内已发现的血清型有20多种,且不同血清型间交叉保护性较低[2];我国发现的RA血清型大约10种,其中血清1型和2型被认为是主要的优势血清型[3]。
近年来,由于临床治疗中抗生素的不断滥用,鸭疫里默氏杆菌对多种抗生素产生耐药性,其耐药谱也越来越广泛,因此对鸭疫里默氏杆菌的耐药性研究成为热点。经研究表明不同地区的RA分离株对抗生素的敏感性差异较大[4],因此了解不同地区的RA耐药性对准确指导各地的临床用药具有重要意义。整合子是细菌耐药性传播的重要原因之一,目前已有学者证明RA中也存在整合子[5],这使得RA的耐药机制更加复杂。本研究将安徽地区分离鉴定的34株RA进行药敏试验以确定其耐药表型,再根据耐药表型选取相应的耐药基因和Ⅰ型整合子进行验证,为了解临床广泛使用抗菌药物与细菌多重耐药性产生之间的关系提供依据。
1 材料与方法
1.1 菌株 34株鸭疫里默氏杆菌(AH1-AH34)分别分离自安徽省淮北市(3株),安徽省天长市(10株),安徽省宿州市(18株),安徽省蚌埠市(3株)不同养鸭场。
1.2 主要的试剂 哥伦比亚血琼脂培养基购自上海科玛嘉微生物技术有限公司;TSB培养基购自碧迪医疗器械(上海)有限公司;革兰氏染色液购自珠海贝索生物技术有限公司;细菌微量生化鉴定管购自北京陆桥技术股份有限公司;药敏纸片购自杭州微生物试剂有限公司;2×TaqMaster Mix购自北京康为世纪生物科技有限公司;DNA Marker购自宝日医生物技术(北京)有限公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。
1.3 鸭疫里默氏杆菌的分离与鉴定
1.3.1 鸭疫里默氏杆菌的PCR鉴定 无菌取病死鸭肝脏、心脏及脑部等脏器,划线于血平板,37℃、5% CO2温箱培养24~48 h,观察细菌生长情况以及菌落特征;再挑取疑似菌落,接种于TSB培养基中,37℃条件下220 r/min振荡培养18~24 h,运用鸭疫里默氏杆菌16S rRNA基因[6]对其鉴定后,送擎科生物科技有限公司测序,测序结果在GenBank数据库中进行比对分析。
1.3.2 革兰氏染色镜检 挑取阳性菌株的典型菌落进行革兰氏染色,具体步骤按珠海贝索生物技术有限公司提供的说明书进行,最后镜检观察细菌形态。
1.3.3 生化鉴定 选取20种常见生化鉴定管包括棉子糖、葡萄糖、果糖、麦芽糖、β-半乳糖、木糖、蔗糖、乳糖、山梨醇、甘露醇、尿素酶、西蒙氏枸橼酸盐、碳酸盐(产气)、色氨酸肉汤、VP、MR、硫化氢、赖氨酸、鸟氨酸和氧化酶,按照北京陆桥技术股份有限公司说明书要求将细菌接种于每个生化管中,37℃、5% CO2温箱培养24~48 h,观察颜色变化,再根据说明书中结果判定标准进行判定。
1.4 药敏试验 选取24种药敏纸片包括甲氧苄氨嘧啶、头孢曲松、氟苯尼考、克林霉素、氯霉素、头孢噻吩、四环素、新霉素、头孢拉定、阿奇霉素、红霉素、氨苄西林、阿莫西林、复方新诺明、环丙沙星、磺胺异噁唑、利福平、诺氟沙星、链霉素、卡那霉素、丁胺卡那、多粘菌素B、庆大霉素和大观霉素。采用纸片扩散法将新鲜菌液涂布于血平板,将24种纸片贴在血平板上,37℃、5% CO2温箱培养24~48 h,记录抑菌圈大小,再根据杭州微生物试剂有限公司的结果标准进行判定耐药株、中介、敏感株。
1.5 Ⅰ类整合子检测 以34株RA分离株的基因组为模板,根据文献[7]设计引物5'CS和3'CS(表1)进行PCR扩增。PCR反应体系:2× PCR Master Mix 10 μL,上、下游引物各1 μL,模板1 μL,ddH2O 12 μL。Ⅰ类整合子5'CS/3'CS采用递减PCR,94℃预变性5 min;94℃变性45s,61℃(每个循环降低1℃)复性45 s,72℃延伸90 s,5个循环;94℃变性45 s,56℃复性45 s,72℃延伸90 s,共30个循环;72℃再延伸10 min。循环结束后,取PCR产物进行1%琼脂糖凝胶电泳鉴定。随后将阳性片段经胶回收试剂盒回收后,送测序,再通过NCBI中的BLASTn搜索进行DNA的同源性分析。
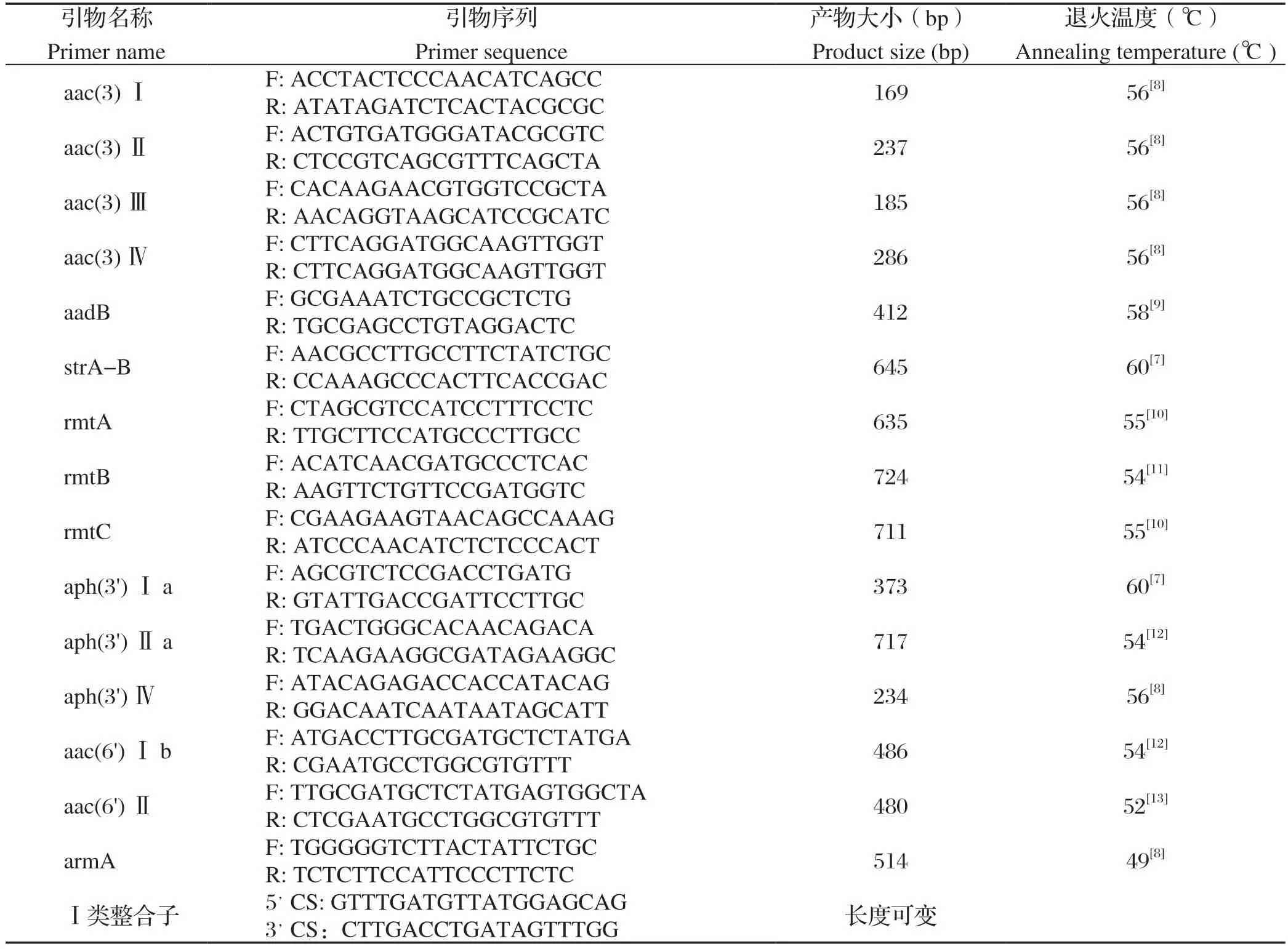
表1 耐药基因引物序列Table 1 The primer sequence of drug resistance gene
1.6 氨基糖苷类耐药基因检测 参照文献[7-12]设计并由赛默飞世尔科技(中国)有限公司合成氨基糖苷类(aac(3)Ⅰ、aac(3)Ⅱ、aac(3)Ⅲ、aac(3)Ⅳ、aadB、strA-B、rmtA、rmtB、rmtC、aph(3')Ⅰa、aph(3')Ⅱa、aph(3')Ⅳ、aac(6')Ⅰb、aac(6')Ⅱ、armA)共15对耐药基因引物,引物序列、退火温度以及扩增产物大小详见表1。
PCR反应体系为25 μL:2 ×TaqMaster Mix 10 μL,上、下游引物各1 μL,模板1 μL,ddH2O 12 μL。扩增条件为:95℃预变性3 min;95℃变性45 s,退火(温度见表1)45 s,72℃延伸45 s,共33个循环;最后再72℃延伸10 min。反应结束后经1%琼脂糖凝胶电泳检测扩增结果。
2 结果
2.1 鸭疫里默氏杆菌的分离鉴定
2.1.1 RA分离株的菌落形态 34株安徽地区RA分离株经培养后在绵羊血平板长出表面光滑,半透明,有光泽,边缘整齐的白色菌落(图1A),其中2株有溶血现象(图1B)。

图1 RA 分离株的菌落形态Fig.1 Colony morphology of RA isolates
2.1.2 PCR鉴定 运用16S rRNA基因鉴定鸭疫里默氏杆菌,均扩增出片段大小为750 bp的目的条带(图2),与预期相符,经序列比对分析确定为鸭疫里默氏杆菌。

图2 RA 分离株的PCR 鉴定Fig.2 Identif ication of RA isolates by PCR
2.1.3 革兰氏染色鉴定 34株安徽地区RA分离株经革兰氏染色,显微镜下观察均为革兰氏阴性、无芽孢、短小杆菌,以单个或成双存在(图3)。

图3 部分RA 分离株革兰氏染色镜检图(1000×)Fig.3 Gram stained microscopic images of RA isolates(1000×)
2.1.4 生化鉴定 生化试验鉴定结果显示34株安徽地区RA分离株不发酵糖类及山梨醇、甘露醇,氧化酶试验均为阳性,尿素酶试验除了6株RA分离株结果为阳性,其余均为阴性,基本符合鸭疫里默氏杆菌的生化特性。
2.2 药敏试验结果 34株鸭疫里默氏杆菌分离株对卡那霉素、庆大霉素耐药性最强,为97.1%,其次是丁胺卡那、链霉素、阿奇霉素,为94.1%;对头孢拉定完全敏感,其次分别对头孢曲松(97.1%)、氟苯尼考(97.1%)、大观霉素(94.1%)、磺胺异恶唑(91.2%)等抗生素较敏感(表2)。
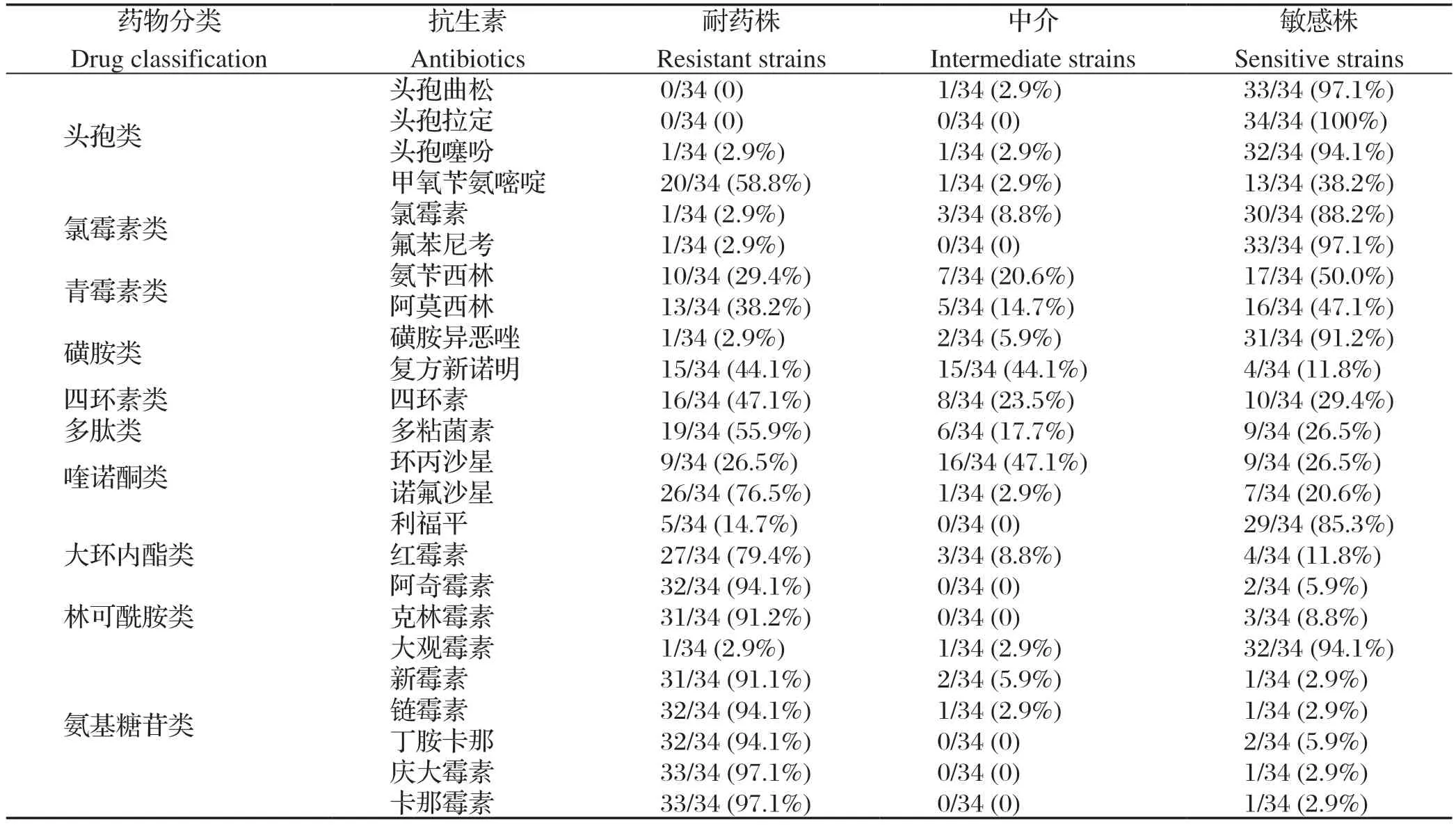
表2 34 株RA 分离株对不同药物的敏感性比例Table 2 The sensitivity ratio of 34 RA isolates to diff erent drugs
安徽地区34株鸭疫里默氏杆菌分离株有33株(97.06%)存在多重耐药现象,且最高可达19种抗生素耐药,其中耐14种抗生素的菌株比例最高,达24%(表3)。

表3 34 株RA 分离株的多重耐药性Table 3 The multidrug resistance of 34 RA isolates
2.3 Ⅰ型整合子基因盒和氨基糖苷类耐药基因检测结果 经检测,34株鸭疫里默氏杆菌分离株均携带Ⅰ类整合子,其基因盒大小为1 kb(图4),经测序比对分析表明其携带aadA1(链霉素耐药基因)。
图4 34 株RA 分离株Ⅰ类整合子PCR 鉴定图Fig.4 Identif ication of class I integrons to 34 RAisolates by PCR
34株RA分离菌进行15种氨基糖苷类耐药基因检测,分别检出aac(6')Ⅰb基因(32/34)、aac(6')Ⅱ基因(28/34)、rmtC基因(25/34),aph(3')Ⅱa基因(24/34);其余11种耐药基因均未能检测到(图5)。
图5 aac(6')Ⅰb 基因(A)、aac(6')Ⅱ基因(B)、rmtC 基因(C)和aph(3')Ⅱa 基因基因(D)PCR 鉴定图Fig.5 aac(6') I b gene (A), aac(6') II gene (B), rmtC gene (C) and aph(3') II a gene (D) PCR identif ication results
34株RA分离株携带氨基糖苷类耐药基因谱情况表明(表4):所有分离株均携带aadA1耐药基因;携带2种耐药基因的为2株,占5.88%;携带3种耐药基因的为10株,占29.41%;携带4种耐药基因的为1株,占2.94%;携带5种耐药基因的为21株,占61.76%。

表4 34 株RA 分离株氨基糖苷类耐药基因携带情况Table 4 Carrying status of aminoglycoside resistance genes to 34 RA isolates
34株RA分离株经氨基糖苷类抗生素(大观霉素、新霉素、链霉素、丁胺卡那、庆大霉素、卡那霉素)耐药表型和耐药基因(aac(6')Ⅰb、aac(6')Ⅱ、rmtC、aph(3')Ⅱa、aadA1)符合率对比可知(表5),aadA1基因与这6种抗生素的符合率高达100%,其次aac(6')Ⅰb基因、aac(6')Ⅱ基因、rmtC基因、aph(3')Ⅱa基因与这6种抗生素的符合率分别大于90%、80%、70%、 69%。
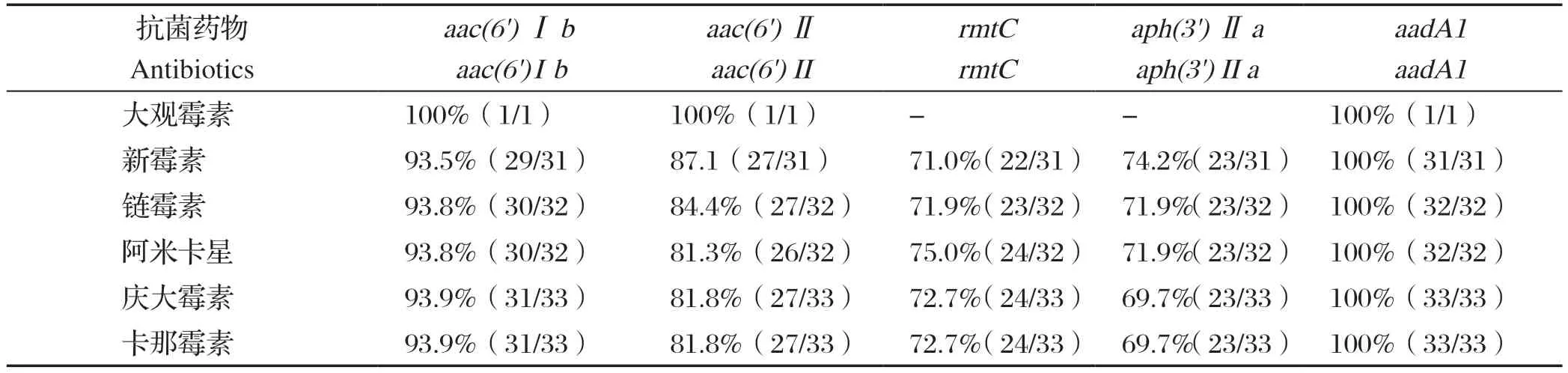
表5 34 株RA 分离株氨基糖苷类药物耐药表型和耐药基因符合率Table 5 Aminoglycoside drug resistance phenotype and drug resistance gene coincidence rate of 34 RA isolates
3 讨论
近几年鸭疫里默氏杆菌病在全国各地均有报道,已成为危害水禽养殖业的重要传染病之一。目前临床多以药物治疗为主,但因抗生素的滥用,造成鸭疫里默氏杆菌多重耐药性更加普遍。经研究表明,广东RA分离株对阿莫西林、青霉素的耐药率最高,对头孢唑啉、大观霉素和氟苯尼考较为敏感[14];湖北RA分离株对头孢噻肟、大观霉素和阿米卡星敏感性比较高,对新霉素和诺氟沙星耐药性最强[15]。本试验对2020年安徽地区分离的34株RA进行耐药性的分析,结果表明34株分离株对氨基糖苷类(卡那霉素、庆大霉素、丁胺卡那、链霉素、新霉素)和大环内酯类(阿奇霉素)药物耐药性最高,对头孢类(头孢曲松、头孢拉定)和氯霉素类(氟苯尼考)最为敏感,这与程冰花等[16]对2017—2018年安徽地区分离株的研究结果一致;但安徽各地区之间(淮北市、蚌埠市、天长市以及灵璧市)RA分离株耐药谱却不同,其最高耐抗生素种类也不一致,分别为9种、10种、10种、18种,这可能与安徽各地区临床用药种类不一致有关。因此,不同地区的RA的耐药性呈现区域性,临床防治时要因地制宜,加强用药指导,合理使用抗生素,防止耐药性的传播。
养殖场的用药习惯以及抗生素滥用是导致RA耐药性增强的重要原因,但也有研究表明这可能与其所携带的整合子结构有关[17]。整合子是细菌固有结构之一,它可通过捕获自然界的外源基因来丰富自身基因的多样性,同时可将耐药基因水平传播至其他细菌,造成耐药性的扩散[18]。根据整合子的结构差异可将其分为Ⅰ类整合子、Ⅱ类整合子、Ⅲ类整合子、移动整合子和超级整合子五大类,其中Ⅰ类整合子最为常见,广泛存在于革兰氏阴性菌中。2009年仲崇岳等[19]检测77株RAⅠ~Ⅲ类整合子,其中Ⅰ类整合子检出率61%,携带4种不同类型耐药基因盒,Ⅱ类和Ⅲ类整合子均未检测到。2012年,Sun等[20]在华南地区103株RA中检出携带aadA2和aac(6)Ⅱ-catB3-aadA1基因盒的Ⅰ类整合子。2014年蔡秀磊等[21]对浙江省22株RA进行Ⅰ类整合子检测,阳性率为100%,1株携带aadA5耐药基因盒,21株携带aac(6)Ⅱ-catB3-aadA1耐药基因盒。本研究对2020年安徽地区分离的34株RA分离株进行Ⅰ类整合子检测,阳性率为100%,所携带的耐药基因盒均为addA1(介导链霉素耐药),分离株携带相同的耐药基因盒可能是由于同一地区的菌株其耐药基因盒相互传播所致,传播范围较大,但耐药基因盒的类型仍单一。
细菌对氨基糖苷类抗生素的耐药机制主要包括:产生修饰酶(钝化酶)修饰抗生素结构;通过核糖体修饰影响细菌对抗生素的结合;改变细胞膜通透性减少体内药物蓄积;外排泵系统的主动外排作用[22]。国内对RA耐药基因的研究报道中,多与钝化酶基因有关,且检出率较高[23-24]。34株分离株携带的氨基糖苷类耐药基因与临床耐药表型符合率均大于69%,因此两者表现出一定的相关性,总体表现出一致性;但也发现所有菌株均含有aadA1基因,仍出现分离株对链霉素敏感的表型,这表明鸭疫里默氏杆菌的的耐药机制复杂,其耐药性可能与本身所携带的耐药基因、整合子结构的差异有关,也有可能是这些因素共同作用的结果。本研究通过对15种氨基糖苷类耐药基因检测发现三种钝化酶基因aac(6')Ⅰb(94.1%)、aac(6')Ⅱ(82.4%)、aph(3')Ⅱa(70.6%)和16S甲基化酶基因rmtC(73.5%);经研究表明三种钝化酶基因均有耐庆大霉素的特性,同时aac(6')Ⅰb基因也具有耐卡那霉素特性[25],这与本研究庆大霉素和卡那霉素的耐药表型结果相符;16S rRNA甲基化酶作为一种新型耐药机制,常在革兰氏阴性菌中发挥作用,编码这种酶的基因多位于质粒和转座子上,与整合子一样易于传播扩散[26],本研究中安徽地区25株分离株均携带16S rRNA甲基化酶基因rmtC的菌株,或将在环境中广泛传播,需引起警惕。另外,经本研究表明安徽省各地区(淮北市、蚌埠市、天长市以及灵璧市)RA分离株均含有aac(6')Ⅰb-aac(6')Ⅱ-rmtCaph(3')Ⅱa-aadA1,其余氨基唐苷类耐药基因谱分布却不一样;其耐药表型和基因型符合率也不一致,分别为≥50%、66.7%、90%、50%;因此,安徽省不同地区的耐药基因型也呈现地区性,加强安徽省不同地区RA分离株的耐药表型和基因型的鉴定,及时了解两者的符合率,对该病的后期的临床用药以及探究其多重耐药性提供依据。此外,本研究也对大环内酯类耐药基因(ermA、ermB、ermC、ermF)、喹诺酮类耐药基因(qnrA、qnrB、qnrC、qnrD、qnrS、oqXA、oqXB)、林可酰胺类耐药基因(linA)鉴定,结果34株分离株未检出,我们后续也会对34株安徽分离株进行全基因组测序进一步确认不同类型的耐药基因分布情况,为该病的防治以及探究鸭疫里默氏杆菌耐药表型以及耐药基因型之间的关系奠定基础。

