整合REV-LTR 基因的MDV 活疫苗与亲本CVI988/Rispens 株的免疫效力比较
张秀梅,宋翠萍,谭 磊,孙英杰,刘炜玮,廖 瑛,丁 铲,仇旭升,罗廷荣
(1.广西大学动物科学技术学院,南宁 530004;2.中国农业科学院上海兽医研究所,上海 200241)
鸡马立克氏病(Marek's disease, MD)是由马立克氏病毒(Marek's disease virus, MDV)感染引起的一种以鸡的淋巴组织增生和肿瘤为特征的疾病。临床上主要表现为运动障碍、神经麻痹瘫痪、脏器肿瘤和免疫器官损伤等症状[1]。MDV是基因组大小约为180 kb的双股线性DNA病毒,根据病原血清学反应,将MDV分为MDV1、 MDV2和MDV3三个血清型。MDV1型具有致瘤性,包括MDV分离的强毒株及其衍生物;根据免疫致病性差异,将MDV分为温和型(mild mMDV)、强毒力型(virulent,vMDV)、超强毒力型(very virulent, vvMDV)和特超强毒力型(very virulent plus MDV, vv+MDV),MDV2、MDV3型均为非致瘤性疱疹病毒[2-3]。MDV具有很强的水平传播能力,病毒粒子仅从感染鸡的羽毛囊上皮细胞脱落,宿主通过摄入结合有MDV的灰尘或者皮屑而感染,进而造成病鸡器官组织淋巴细胞浸润性的肿瘤性疾病,给家禽业造成了极为严重的经济损失[3]。
禽网状内皮组织增生症(Reticuloendotheliosis,RE)是由单链RNA的禽网状内皮组织增生症病毒引起的一种禽类的慢性肿瘤性疾病。有研究表明,在鸡群感染MDV的同时往往伴随有REV的混合感染。从1992年开始,人们陆续报道MDV和REV的共感染,Isfort等[4-5]发现MDV和REV在成纤维细胞中共感染并长期或短期连续传代后,发现REV能够整合到MDV的基因组中,且整合位点集中在MDV的内部短重复序列(internal repeat short, IRS)和短独特序列(unique short, US)的交界处。Davidson等[6]运用热点组合PCR的方法从鸡的肿瘤组织样品中扩增出含有REV-LTR的MDV片段。2003年,张志等[7]首先报道从中国肿瘤病鸡中分离出整合有REV LTR和MDV的天然重组野毒株GX0101株,该插入位点位于MDV的US区域。孙爱军等[8-10]通过构建细菌人工染色体(bacterial artificial chromosome, BAC)克隆BAC-GX0101株及LTR敲除的BAC-GX0101△LTR株免疫鸡后发现LTR的插入并没有增强GX0101毒株的致病性,而是增强了其水平传播能力,说明水平传播能力不一定与MDV的致病性一致,这可能提供了一些选择性优势,使其成为优势菌株。Witter等[11]发现整合 有REV-LTR序列的重组MDV RM1株的致瘤性减弱,但诱发了严重的淋巴器官萎缩和免疫抑制。 Mays等[12]将REV-LTR插入到强毒株MDV Md5的BAC克隆中,第40代时使所得重组病毒rMd5 REV-LTR BAC在阳性抗体鸡中完全减毒,第70代时在母源抗体阴性鸡中完全减毒,与CVI988/Rispens疫苗比较实验显示,该重组毒株不会诱发法氏囊或胸腺萎缩,但无法提供与CVI988/Rispens相同水平的免疫保护。本实验室将两个REV-LTR序列插入到CVI988/Rispens基因组中构建成重组马立克氏病病毒rMDV-LTR株[13-14]。通过检测 rMDV-LTR株与亲本CVI988/Rispens株皮下注射免疫1日龄SPF鸡,比较对rMd5攻毒的免疫保护效力差异,结果显示rMDV-LTR株重组毒株较CVI988/Rispens在鸡体内未发现肿瘤、组织病变或明显的病理改变。说明重组毒rMDV-LTR疫苗株是一种安全的、有效的、新型的重组MDV疫苗。
1 材料与方法
1.1 实验动物、疫苗毒株 1日龄SPF鸡100羽,购自北京梅里亚维通实验动物技术有限公司。鸡马立克氏病病毒Ⅰ型重组活疫苗(rMDV-LTR株)、MD pilot 006,2.2×106PFU/mL,CVI988/Rispens株,2000羽份/瓶,3080 PFU/羽份,均保存在本实验室液氮中。
1.2 试验分组及免疫接种情况
1.2.1 分组 将同源同批1日龄SPF鸡分成6个试验组,每组10羽试验鸡,G1~G3试验组免疫rMDV-LTR,G4~G6试验组免疫CVI988/Rispens株;另设GC1作为攻毒对照组,GC2组作为健康对照组,每组20羽鸡,具体分组情况如表1所示。

表1 试 验分组及免疫情况Table 1 Experimental grouping and immunization status
1.2.2 接种 使用马立克氏病疫苗稀释液将鸡马立克氏病病毒Ⅰ型重组活疫苗(rMDV-LTR株)和CVI988/Rispens株稀释为125、250和500 PFU/0.2 mL。G1~G3组1日龄SPF鸡分别经颈背部皮下接种125、250和500 PFU的rMDV-LTR株;G4~G6组1日龄SPF鸡分别经颈背部皮下接种125、250和500 PFU的CVI988/Rispens株。GC1和GC2组均注射0.2 mL的磷酸盐缓冲盐水(PBS)。
1.2.3 攻毒 疫苗接种后第7 d,G1~G6组、GC1组各腹腔注射接种500 PFU马立克氏病强毒rMd5;GC2组接种PBS,作为空白对照。持续观察60 d。
1.3 检测指标及发病判定标准
1.3.1 免疫后对鸡体重增重的影响 各组鸡分别于攻毒后14、28、42、60 d时进行称重并记录,判断各组疫苗免疫后对鸡体重增 重的影响。接种60 d后,将各组鸡剖杀,对心脏、肝脏、脾脏及法氏囊等组织进行称重,用S PSS软件对数据进行统计分析。
1.3.2 观察记录鸡发病及死亡情况 攻毒后连续观察60 d,记录各组试验鸡死亡和发病情况。病毒接种后的临床观察期间发生死亡的病例,以及观察期结束后存活的试验鸡,全部剖检,肉眼观察是否有可见病变。采集疑似病变的内脏组织,用4%多聚甲醛固定,制作石蜡切片,进行HE染色,于显微镜下观察组织病理变化。
发病判定标准:实验鸡死亡(排除非特异性死亡),出现运动障碍麻痹综合征;剖检胸腺和法氏囊萎缩,内脏器官包括心脏、肝脏、肾脏、脾脏等出现弥散性肿大或肿瘤,外周神经横纹消、褪色、肿大,可判定为鸡马立克氏病发病。免疫攻毒保护率(PI)计算公式:
2 结果
2.1 攻毒后不同组试验鸡的发病和死亡情况 攻毒后第3周,攻毒对照组鸡GC1出现羽毛凌乱松散无光泽,精神不振、萎靡,饮食欲下降,个别鸡只出现脚趾畸形、劈叉瘫痪等特征性症状(图1),第4周开始陆续死亡,症状持续到攻毒后第60 d。G3、G6和空白对照组鸡精神状态良好,饮食 欲正常,羽毛整洁有光泽。G2和G5组各有1只试验鸡出现羽毛凌乱无光泽、精神不振、萎靡等临床症状,直至试验结束未出现死亡,两个试验组的其他试验鸡未出现任何临床症状。G1和G4组试验鸡在攻毒后各有2只试验鸡出现羽毛凌乱无光泽,精神不振、萎靡等临床症状,直至试验结束,G1组发病试验鸡未死亡,而G4组2只发病鸡全部死亡。

图1 对照组的鸡攻毒后的临床症状Fig.1 Clinical symptoms of chickens in the challenged control group
2.2 试验鸡剖检情况 攻毒后第4周GC1攻毒 对照组鸡开始陆续死亡,60 d后对剩余试验鸡进行解剖(图2)。结果显示,GC1组剩8只试验鸡存活,将病死鸡剖检,可见心脏、肝脏、脾脏出现灰白色弥散性肿瘤灶,肝脏、肾脏、脾脏肿大,法氏囊萎缩等均为MD特征性病变的病理变化。G2、G3、G5和G6组接种组鸡以及空白对照组试验鸡在各主要组织脏器中均未观察到临床病理学变化或任何疑似肿瘤。G1组10羽试验鸡,包括两只发病鸡在各主要组织脏器中均未观察到临床病理学变化或任何疑似肿瘤;而在G4组存活的8只眼观健康试验鸡中有1只鸡检出脾脏 存在弥散性肿瘤灶,其他试验鸡未检出病变。
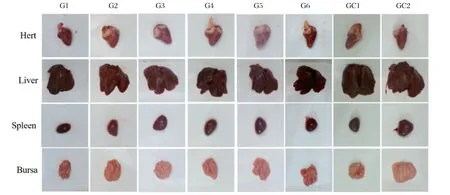
图2 攻毒后60 天试验鸡剖检脏器Fig.2 Autopsy of chicken viscera after challenge 60 days
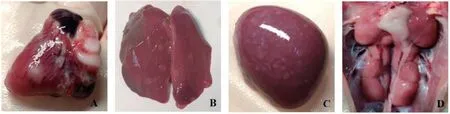
图3 GC1 组感染MDV 鸡的特征性病理变化Fig.3 Characteristic pathological changes of MDV infected group GC1 chickens
2.3 病理组织学观察 连续观察60 d,剖检将各内脏组织HE染色后,显微镜下观察其病理变化。结果显示攻毒对照组由于送检的组织脏器含有肿瘤灶,故病理变化和图5病理情况相似,而疫苗免 疫组则没有出现明显的病理改变(图4,图5)。对含有肿瘤灶的脏器HE染色结果分析可知:含有肿瘤灶的心脏可见较严重的心肌间质炎和实质炎,较多心肌纤维断裂,有较大量的淋巴细胞浸润(图5A);肝组织可见几处坏死灶,肝细胞坏死,局部可见钙化,可见几处淋巴细胞浸润小灶,较多血管淤血,血液含有大量淋巴细胞,广泛肝窦中可见小的淋巴细胞浸润(图5B);脾脏可见极其大量的淋巴细胞浸润,白髓正常结构消失,形态不规则,大小不一,被大量的“MD细胞”替代,“MD细胞”可能是一种肿瘤化的淋巴细胞,胞浆具有强嗜碱性,形态多样,胞质较丰富,核仁明显,有的还具有核分裂相,红髓中也可见这种细胞样(图5C);肺脏肺泡正常结构消失,有大量的淋巴细胞浸润(图5D);肾脏组织肾小管数量大量减少并坏死,组织结构紊乱,可见极其大量的淋巴细胞浸润,肾小管上皮细胞胞核固缩、碎裂、消失等病理变化(图5E);法氏囊表现为压迫性萎缩,坏死和大量的淋巴细胞浸润(图5F)。
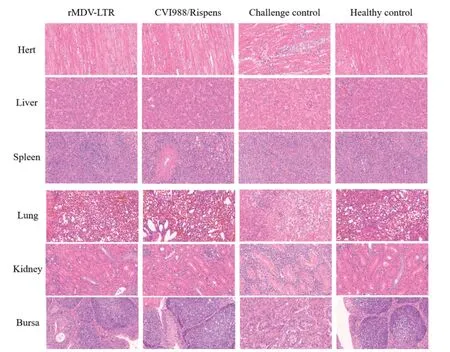
图4 免疫后60 天对各组织器官的HE 染色结果 (HE, 40×)Fig.4 HE staining results of tissues and organs at 60 days after immunization (HE, 40×)
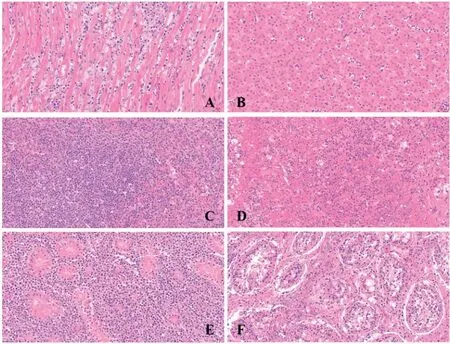
图5 感染MDV 特征病变组织切片, 各组织器官的HE 染色结果Fig.5 The results of HE staining of each tissue and organ infected with MDV
2.4 攻毒后不同组试验鸡的体重增重情况 试验组7日龄SPF鸡攻毒后连续观察60 d,同源同批GC2试验组SPF鸡作为阴性对照。攻毒后在14、28、42、60 d对四个实验组的SPF鸡进行称重,实验数据用GraphP ad-Prism软件进行数据分析,绘制出体重随时间增长情况。结果显示,随着时间的增加,试验鸡的体重均在不同程度的增长,免疫组试验鸡的体重差别不大,但在60 d时rMDV-LTR株免疫组试验鸡体重较CVI98 8/Rispens株免疫组鸡的体重轻,攻毒对照组的试验鸡体重较健康对照组体重轻(图6)。对各试验组鸡剖检的脏器进行称重,结果显示,rMDV-LTR株免疫组和CVI988/Rispens株免疫组鸡心脏、脾脏和法氏囊重量无显著差异;rMDV-LTR株免疫组试验鸡肝脏比其他组略轻(图7)。

图6 攻毒后60 d 试验鸡体重比较Fig.6 Comparison of weight of test chickens 60 days after challenge

图7 攻毒后60 d 试验鸡脏器重量比较Fig.7 Comparison of organ weight of test chickens 60 days after challenge
2.5 各试验组免疫保护指数 通过统计学方法比较rMDV-LTR株、CVI988/Rispens株不同免疫剂量组和对照组鸡群的生长增重差异。统计各组试验鸡发病、死亡情况、肿瘤检出率,并计算各免疫组的免疫保护指数。结果显示,在分别以500PFU/羽和250PFU/羽剂量的rMDV-LTR株或亲本CVI988/Rispens株免疫雏鸡都可以提供大于80%的免疫保护效率。以125 PFU/羽剂量的rMDV-LTR株或亲本CVI988/Rispens株虽均不能提供大于80%的免疫保护效力,但前者免疫组试验鸡未出现死亡,仅有2只鸡临床消瘦症状记为阳性,剖解未见肿瘤;而后者免疫组出现2只死亡,1只检出肿瘤,死亡率为20%(表2)。

表2 试验组免疫保护指数统计表Table 2 Statistical table of immune protection index of experimental group
3 讨论
马立克氏病是第一个使用疫苗就能够达到有效防治的病毒性肿瘤疾病,现有疫苗如减毒血清1型CVI988/Rispens、血清2型SB1和血清3型FC126疫苗株已经被广泛使用。MDV多价苗表现出较良好的保护效果在市场上得到了推广和应用,如二价活疫苗CVI988/Rispens株+ HVT FC126株,三价疫苗Md11/75+ SB1+HVT FC126株等毒株提供了比单独使用一种疫苗更好的保护[15-16]。然而近些年来,可能由于疫苗诱导产生的免疫反应,以及新的MDV突变体逃避免疫压力使得MDV毒力不断增强,MDV与其他病毒共感染等复杂疾病日渐突出,使用传统疫苗已经无法提供完全有效的免疫保护[17]。因此需要不断研发新的更为安全有效的疫苗以积极预防应对因MDV毒力增强而引发的新型MD。
REV是一种反转录病毒,为了其自身复制,可以整合进任何双链DNA中,包括宿主、MDV、禽痘病毒基因组等[4-6]。研究表明,REV-LTR显示出强大的启动子或增强子作用,根据其插入的位置,各种基因能够被反式激活,当整合到MDV的基因组中时,可以影响MDV基因的表达,有可能产生新的MDV表型特性,但REV和MDV发生自然重组的概率非常低[4-7,18-19]。目前,国内外已多次分离鉴定出REV的基因序列整合进MDV的重组病毒,且随着科学技术的发展,基因重组疫苗应用于MDV已成为一个被广泛研究的课题[19]。利用BAC系统构建的BACGX0101株和敲除LTR的BAC-GX0101△LTR株,说明REV LTR的插入能够提高病毒在体内复制和水平传播能力,同时降低病毒的致病性,表明这种重组方式可能具有一定的生存优势[8]。而从强毒株JM衍生的病毒,通过在MDV的 US和IRS和短末端重复序列(terminal repeat short, TRS)的交界处插入REVLTR基因组导致该重组毒株RM1的致癌性减弱,超过了CVI988/Rispens疫苗株的保护水平,但保留了其亲本病毒的免疫抑制特性,使其不适用于商业用途[4]。CVRM毒株是REV LTR通过与NotⅠ线性化的B40-RM1Pac粘粒和从CVI988感染的鸡胚成纤维细胞中分离的基因组DNA同源重组产生的,该毒株在细胞培养中复制效率表现出比亲本CVI988更高的水平,并且对鸡保持无病原性,在免疫保护试验中,CVRM与CVI988病毒提供的保护指数相似或更好的保护指数,但却有12%的死亡率[20]。
rMDV-LTR株是先前本实验室利用基因重组技术将两个REV-LTR序列插入到CVI988/Rispens基因组中构建成的重组马立克氏病病毒[14]。本试验将rMDV-LTR株与亲本CVI988/Rispens株以三个不同剂量接种1日龄SPF雏鸡。接种后第7 d,使用500 PFU马立克病毒强毒rMd5攻毒,对各组鸡的临床症状观察,体重增长情况监测,发病死亡和剖检情况进行统计,综合评价鸡马立克氏病病毒Ⅰ型重组活疫苗(rMDV-LTR株)和同类产品的免疫保护效力差异。在接种后第7 d用500 PFU马立克病毒强毒rMd5攻毒的情况下,分别以500 PFU/羽份和250 PFU/羽剂量的rMDV-LTR株或亲本CVI988/Rispens株免疫1日龄SPF雏鸡都可以提供大于80%的免疫保护效率。以125 PFU/羽剂量的rMDV-LTR株或亲本CVI988/Rispens株虽均不能提供大于80%的免疫保护效力,但rMDV-LTR株免疫组试验鸡未出现死亡,仅有2只鸡临床消瘦症状记为阳性,但剖解未见肿瘤。而CVI988/Rispens株免疫组出现2只死亡,1只检出肿瘤,死亡率为20%。rMDV-LTR株和CVI988/Rispens株免疫组的免疫保护指数分别为77.78%和66.67%。经病理检验,剖检有肿瘤的器官主要集中在心脏、肝脏、脾脏及肾脏,均有弥散的肿瘤灶,且含有大量的淋巴细胞浸润。rMDV-LTR株免疫组和CVI988/Rispens株免疫组鸡体重差异不大,且除肝脏略轻外,其他脏器重量也无显著差异。因此,在较小免疫剂量下,7日龄攻毒,rMDV-LTR 疫苗免疫组比经典的CVI988/Rispens疫苗免疫组死亡率明显降低,且整体免疫保护率也高于CVI988/Rispens株疫苗免疫组。根据之前本实验室数据显示,rMDVLTR株提供了比亲本CVI988/Rispens株更快的体外复制能力,但免疫鸡无MD临床症状,体重、器官重量无明显差异,也无明显的MD病理病变,在周围环境中也无法检测到MDV[13]。表明鸡马立克氏病病毒Ⅰ型重组活疫苗(rMDV-LTR株)可以开发为一种安全有效的疫苗。
以实验室制备的鸡马立克氏病病毒Ⅰ型重组活疫苗rMDV-LTR株和亲本CVI988/Rispens株皮下注射免疫1日龄SPF鸡,对两者攻毒免疫效力进行比较的结果显示,在相同免疫剂量下,rMDV-LTR株对1日龄SPF鸡可以提供比亲本CVI988/Rispens对照组更高的保护率。表明鸡马立克氏病病毒Ⅰ型重组活疫苗(rMDV-LTR株)可以提供的免疫保护效力优于经典疫苗CVI988/Rispens株。

