木薯淀粉与交联甜菜果胶复配体系的静电和氢键相互作用研究
闫璟圆, 冯嘉庆, 王子成, 黄琳茜, 王晓乐, 徐 磊
(淮阴工学院生命科学与食品工程学院,淮安 223003)
木薯淀粉(tapioca starch,TS)是一种从木薯块茎中提取得到的淀粉,与其他淀粉相比,它具有温和的风味、较低的糊化温度和较高的黏度,可以在食品工业中用作保水剂、脂肪替代品等[1, 2]。然而,天然的TS具有易老化、不耐受高温和剪切等缺陷,一定程度上限制了其应用[3]。因此,物理、化学和生物等多种改性方法已被用来改善TS的结构和性能[4]。研究表明可以通过添加非淀粉多糖来改变淀粉基食品的特性,与其他改性方法相比具有安全、操作简便和经济实用性好等特点[5]。
甜菜果胶(sugar beet pectin,SBP)是一种从甜菜渣中提取得到的阴离子多糖,由于其较高的中性糖和蛋白质含量,因而表现出较强的乳化活性,已被广泛应用于食品和制药行业中[6]。然而,SBP高度乙酰化的结构和较低的分子质量,导致其凝胶能力较差,很难通过调节Ca2+浓度、固形物含量或pH来实现凝胶化[7]。研究发现,SBP的阿拉伯糖和半乳糖残基含有一定量的阿魏酸基团,可在过氧化物酶的作用下发生聚合反应生成交联甜菜果胶(cross-linked sugar beet pectin,CSBP),形成具有一定强度的凝胶结构[8]。相较于SBP,CSBP具有更好的乳化活性、凝胶性和载体递送能力[9, 10]。同时,本课题组前期研究还表明,CSBP可以有效改善玉米、小麦、豌豆淀粉的糊化、流变和老化特性。
近年来,淀粉与非淀粉多糖之间的相互作用机制已得到了广泛的研究。Xie等[11]研究发现氢键在TS和凉草粉多糖复合凝胶的质构特性方面起着决定性作用,随着氢键的破坏凝胶的硬度呈逐渐降低的趋势。Li等[12]研究结果也表明,氢键是影响海藻酸钠和普通玉米淀粉复配体系形成和稳定性的主要因素,而静电相互作用仅对复配体系的稳定性有轻微影响。Lutfi等[13]的研究证实离子键对黄原胶和荸荠淀粉复配体系的理化性质具有重要影响,氯化钠存在时体系的溶解度、透明度和黏度增加,而膨胀度降低。此外,氢键和静电相互作用都被证明是凉草粉多糖和红薯淀粉之间的主要相互作用力[14]。
目前虽然已经进行了CSBP对各种淀粉糊化、流变和老化特性影响的研究,但关于CSBP与淀粉相互作用机制仍有待深入研究。淀粉和非淀粉多糖之间可通过氢键、范德华力、疏水和静电等多种非共价键发生相互作用,但考虑到CSBP和TS的结构特性,它们之间的相互作用可能主要为氢键和静电相互作用[15]。高浓度的氯化钠可屏蔽聚合物的电荷,起到静电干扰剂的作用[11],而尿素是一种极性化合物,可优先与聚合物之间形成氢键,从而起到氢键破坏的作用[16]。因此,本研究在TS-CSBP(TCS)复配体系中分别添加氯化钠和尿素2种物质,以探讨静电和氢键相互作用对复配体系的糊化、流变和微观结构等的影响。
1 材料与方法
1.1 材料与试剂
TS(食品级);SBP(酯化度55%,食品级);漆酶(10 000 U/mL,食品级);浓盐酸、氢氧化钠、无水乙醇等均为分析纯。
1.2 仪器与设备
DHR-1流变仪,5810 R冷冻离心机,Mastersizer 2000激光粒度仪,V-1800紫外可见分光光度计,SU8010型场发射扫描电镜。
1.3 方法
1.3.1 CSBP的制备
配制质量分数1%的SBP溶液,过夜搅拌均匀,接着用1 mol/L NaOH溶液将其pH调整为6.0,然后按20 U/mL添加漆酶,于45 ℃水浴锅中反应0.5 h。待反应结束后,立即加入反应液3倍体积的无水乙醇,采用双层纱网过滤得到沉淀,热风干燥后磨粉过筛,得CSBP。
1.3.2 糊化性质的测定
参照Zhang等[17]的方法,利用流变仪的Starch pasting cell附件进行糊化性质的测定,并稍作修改。准确称取0.075 g CSBP和1.25 g TS,加入25 mL去离子水,充分混匀,此即为TCS复配体系。分别向复配体系中加入不同量的氯化钠(0.01、0.05、0.10 mol/L)和尿素(1、5、10 g/100 mL),充分搅拌后转移至流变仪铝盒中进行糊化测试。具体程序为:首先将样品在50 ℃下保持1 min,接着以12 ℃/min的速率加热至95 ℃并维持2.5 min,随后将样品以12 ℃/min的速率降温至50 ℃并维持2 min,在整个测试过程中搅拌桨速率除前10 s为960 r/min,其余时间均为160 r/min。记录糊化过程中黏度随时间的变化,并从糊化曲线中得到峰值黏度、崩解值、终值黏度、回生值和糊化温度等参数。
1.3.3 膨胀势和透光率的测定
参照1.3.2节的方法,制备淀粉质量分数为1%的TCS复配体系及不同氯化钠、尿素添加量的样品,95 ℃糊化20 min,待冷却至室温后进行膨胀势和透光率的测定。膨胀势测定时,取适量样品与10 mL离心管中,与4 000 r/min离心10 min,然后分别记录所得沉淀的湿重和干重,以沉淀的湿重与干重之比表示膨胀势[18]。透光率测试时,以去离子水作为100%,记录样品在620 nm处的透光率。
1.3.4 粒径的测定
参照1.3.3节的样品制备方法,待淀粉糊冷却至室温后进行粒径的测定[19]。吸取适量样品添加至激光粒度仪的样品池中,当遮光率达到15%附近处开始测试。测定时设置颗粒折射率为1.53,分散剂折射率为1.33。
1.3.5 流变学特性的测定
参照Ma等[19]的方法,取适量1.3.2节中所得淀粉糊,转移至流变仪的帕尔贴板中心处,并将平行板周围多余的样品移除。测试时选用平行板的直径为40 mm,设置间隙为1 000 μm,控制温度为25 ℃,平衡时间为2 min。
静态流变特性的测定:剪切速率(γ)从0.1~100.0 s-1递增,记录剪切应力(τ)随γ的变化。采用Power Law模型对实验数据点进行回归拟合,方程为:
τ=Kγn
式中:τ为剪切应力/Pa;K为稠度指数/Pa·sn;γ为剪切速率/s-1;n为流动行为指数。
动态黏弹性质的测定:控制应变为2%,频率从0.15~15.00 Hz递增,记录样品储能模量G′及损耗模量G"随频率的变化。
1.3.6 微观结构的观察
取1.3.2中制备得到的样品,真空冷冻干燥后用剪刀进行裁剪,然后取适当大小的薄片用导电双面胶固定于样品支架上,真空状态下喷金后于SEM中进行观察并拍照,放大倍数分别为50和300,设置加速电压为5 kV。
1.4 数据处理
所有实验均至少重复3次,使用SPSS 20.0软件对数据进行ANOVA差异显著性分析(P<0.05表示差异显著),利用OriginPro 2021软件进行图形绘制。
2 结果与分析
2.1 糊化特性
添加氯化钠和尿素后TCS复配体系糊化曲线和糊化参数的变化分别如图1和表1所示,2种物质对复配体系糊化特性的影响具有显著差异。随着氯化钠添加量的逐渐增加,复配体系的糊化曲线呈逐渐下移的趋势,复配体系的峰值黏度、崩解值、终值黏度和回生值均呈现逐渐降低的趋势(P<0.05),而糊化温度呈逐渐增加的趋势(P<0.05)。添加尿素后,复配体系的峰值黏度未发生显著变化(P>0.05),崩解值随添加量的增加呈逐渐增加的趋势(P<0.05),而终值黏度、回生值和糊化温度均呈现逐渐降低的趋势(P<0.05)。

表1 不同氯化钠和尿素浓度下TCS复配体系的糊化参数
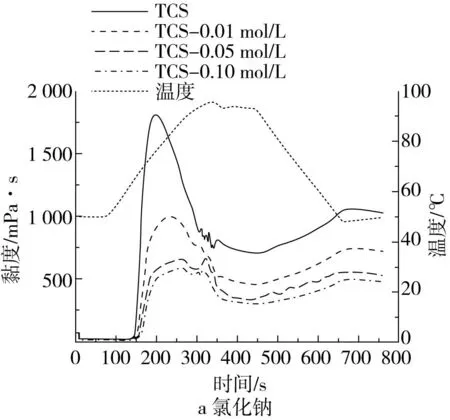
图1 不同氯化钠和尿素浓度下TCS复配体系的糊化曲线
峰值黏度表示淀粉在糊化冷却之前所能达到的最大黏度,主要与淀粉的吸水、膨胀能力相关[20]。研究表明,部分多糖类物质可以聚集在淀粉颗粒的表面,使淀粉颗粒充分膨胀而不崩解,进而提高淀粉的峰值黏度[14]。TCS复配体系的峰值黏度在添加尿素后未发生显著变化(P>0.05),而添加氯化钠后显著降低(P<0.05),这主要是因为盐离子的静电屏蔽作用,作为一种酸性阴离子多糖,CSBP可与钠离子发生静电反应,进而削弱CSBP与TS之间的相互作用。这些结果表明TS与CSBP之间的作用力主要是静电相互作用。而Li等[12]报道氢键是玉米淀粉和海藻酸钠之间的主要作用力,产生这种差异的可能是由于所选用淀粉和多糖种类不同所致。在糊化实验中,添加尿素的TCS复配体系在加热后pH仅略微升高,表明实验条件下尿素分子仅发生轻微的降解。作为一种典型的塑化剂,尿素分子的—NH2与淀粉分子的—OH之间可形成氢键,可以提高淀粉链的分离和流动性,因而糊化过程中随着尿素添加量的增加TCS复配体系的崩解值逐渐增加,而糊化温度逐渐降低[21]。此外,添加尿素后,TCS复配体系的回生值显著降低。这可归因于尿素的存在使淀粉分子链间的氢键受到破坏,因而冷却过程中淀粉分子的聚集和重排受到严重抑制。
2.2 膨胀势和透光率
添加氯化钠和尿素后TCS复配体系膨胀势的变化如表2所示。随着氯化钠的增加复配体系的膨胀势呈逐渐降低的趋势(P<0.05),这主要是由于未添加氯化钠时CSBP与TS的相互作用可以使得淀粉颗粒能充分膨胀而不崩解,而氯化钠的加入使得的这种相互作用减弱。而添加尿素后,复配体系的膨胀势呈现先降低后增加的趋势(P<0.05),这可能是由于加入尿素使得淀粉分子之间以及淀粉和水分子之间的氢键断裂,因而复配体系的持水能力减弱,但随着尿素浓度的提高复配体系吸收水的比重增加,因而膨胀势反而略有升高。

表2 不同氯化钠和尿素浓度下TCS复配体系的膨胀势和透光率
淀粉糊透明度受到多种因素的影响,如淀粉颗粒大小、溶胀能力、直链淀粉含量、直链/支链淀粉比率以及溶胀/非溶胀颗粒残留物水平[22]。添加氯化钠和尿素后TCS复配体系透光率的变化如表2所示。随着氯化钠添加量的增加,TCS复配体系的透光率呈现先降低再增加的趋势(P<0.05)。Lutfi等[13]在黄原胶、荸荠淀粉复配体系中也发现了类似的趋势。添加尿素后,随着添加量的增加TCS复配体系的透光率呈现逐渐增加的趋势(P<0.05)。这可归因于尿素对氢键的破坏作用,从而防止了淀粉分子在回生过程中的重排,较慢的回生速率增加了淀粉糊的透明度。
2.3 粒径
添加氯化钠和尿素后TCS复配体系的D50值变化如图2所示。随着氯化钠添加量的增加,复配体系的D50值从191.15 μm逐渐降低到166.29 μm(P<0.05)。而添加尿素后,复配体系的D50值未发生显著变化(P>0.05)。氯化钠是一种常用的静电干扰剂,它将通过静电屏蔽相互作用影响CSBP与TS的相互作用,从而降低糊化过程中淀粉颗粒的膨胀。尿素是一种氢键破坏剂,可以破坏复配体系的氢键,主要影响复配体系的回生过程,而对糊化过程中粒径的变化影响不大。这些结果与糊化特性的结果一致。

注:1~3分别为0.01、0.05、0.10 mol/L氯化钠,4~6分别为1、5、10 g/100 mL尿素。
2.4 静态流变学特性
由图3可知,所有样品的剪切应力均随剪切速率的增加而增加,并表现出剪切变稀的特征。表3列出了根据Power Law模型拟合的样品稳态剪切下的流动行为参数,R2均在0.99以上,表明模型对曲线具有较高的拟合精度。流动行为指数n反应流体与牛顿流体的接近程度,n值越接近于1意味着该流体越接近于牛顿流体[23]。TCS复配体系所有样品的n值在0.50~0.57之间,小于1,表明样品均为典型的假塑性流体。稠度指数K主要和样品的增稠能力相关,可反应流体内部分子间作用力的大小,随着氯化钠和尿素添加量的增加,复配体系的K值均呈逐渐降低的趋势,且氯化钠的下降趋势比尿素更显著。氯化钠的加入降低了复配体系中淀粉颗粒的膨胀,进而降低了颗粒间的相互作用,所以复配体系的黏度值降低。而尿素破坏了淀粉分子之间的氢键,在冷却过程中进一步阻碍了淀粉分子的聚集和重排,导致复配体系的黏度值降低。这与糊化特性中观察到的氯化钠和尿素使复配体系黏度降低的结果是一致的(表1)。
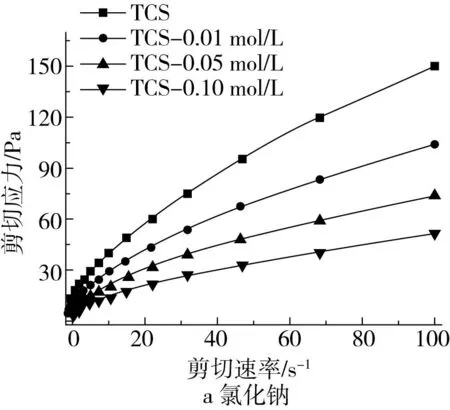
图3 不同氯化钠和尿素浓度下TCS复配体系的静态流变曲线
2.5 动态流变学特性
用流变仪测定了氯化钠和尿素对TCS复配体系动态流变性能的影响,结果如图4所示。添加氯化钠和尿素前后,TCS复配体系的储能模量G′均高于损耗模量G″,说明复配体系中弹性行为占主导,表现出类固体状行为[24]。所有的样品的G′和G″值均随频率的增加而增加,显示出显著的频率依赖性,表明复配体系内部存在较强的分子间相互作用。氯化钠和尿素的加入均导致TCS复配体系的G′和G″值降低,且随着添加量的增加降低的趋势也逐渐增加,表明复配体系的凝胶形成能力逐渐降低,这与Xie等[11]报道的结果相似。氯化钠导致的G′和G″值下降是由于静电屏蔽作用破坏了淀粉颗粒和多糖分子之间的相互作用,导致淀粉颗粒不能充分膨胀而形成连续的网络结构,从而削弱了复配体系的凝胶网强度[25]。然而,添加尿素后G′和G″值的下降主要是因为尿素破坏了淀粉分子之间以及淀粉分子与多糖分子之间的氢键。相比之下,氯化钠的作用尿素比更强,因此,TS和CSBP之间形成凝胶网络结构的主要作用力是静电相互作用。
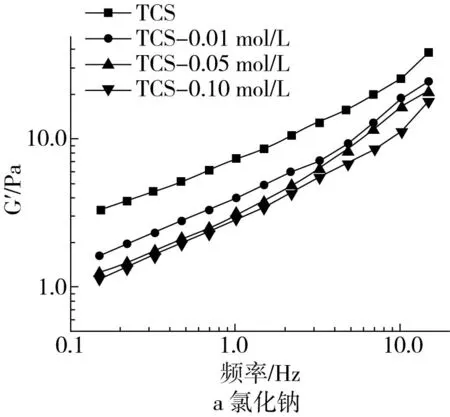
图4 不同氯化钠和尿素浓度下TCS复配体系的储能模量G′和损耗模量G″随角频率的变化曲线
2.6 凝胶微观结构
由图5可见,未添加氯化钠和尿素时,TCS复配体系在糊化后形成了含有较大孔径的均匀蜂窝状网络结构,呈现典型的淀粉、多糖复合凝胶微观结构[26]。随着氯化钠和尿素添加量的增加,复配体系的网络结构逐渐坍塌,孔壁更加粗糙,孔径变得越来越不均匀。凝胶微观结构的破坏将降低凝胶的强度,这与糊化和流变学特性分析的结果一致。与尿素组相比,氯化钠组的凝胶结构更加紧凑和完整。当尿素质量分数达到5%和10%时,复配体系形成了海绵状的网络结构,这主要是因为尿素的加入打破了直链淀粉分子之间的氢键,从而阻止淀粉回生形成有序结构,影响了凝胶结构。

注:A TCS;B TCS-0.01 mol/L氯化钠;C TCS-0.05 mol/L氯化钠;D TCS-0.10 mol/L氯化钠;E TCS-1 g/100 mL尿素;FTCS-5 g/100 mL尿素;G TCS-10 g/100 mL尿素。
3 结论
本研究表明,静电相互作用是TS和CSBP之间的主要作用力。氯化钠引起的静电屏蔽作用对复配体系的整个糊化过程均有影响,而尿素导致的氢键破坏主要影响淀粉分子在冷却过程中的重排。氯化钠和尿素对TCS复配体系糊化特性的影响具有显著差异,添加氯化钠显著降低了峰值黏度,而尿素对峰值黏度无显著影响。复配体系的膨胀势在添加氯化钠和尿素后均显著降低,而透光率在添加氯化钠后降低,添加尿素后升高。添加氯化钠降低了复配体系糊化过程中淀粉颗粒的粒径,而添加尿素后无显著变化。复配体系的K、G′和G″值均随着氯化钠和尿素添加量的增加呈逐渐降低的趋势。添加氯化钠和尿素使得复配体系的凝胶结构坍塌,孔径变得不均匀。

