急性乙二醇中毒大鼠模型的构建及对多脏器损伤的比较
李鑫鹏,杨 凯,许哲敏,杨小平,肖克来提·霍加合买提,彭 鹏
1.新疆医科大学第一附属医院急救创伤中心(乌鲁木齐 830011)
2.广州市第一人民医院急诊科(广州 510180)
3.重庆两江新区第一人民医院重症医学科(重庆 401121)
乙二醇(ethylene glycol,EG)分子式C2H6O2,常作为工业有机溶剂,其中防冻剂中EG 成分高达95%[1]。随着工业和经济的发展,为了更方便地使用EG,大部分人错误使用饮料瓶进行保存,因其无色、粘稠有甜味的物理性状很容易被人误服[2]。大多数人在故意或误服EG 初期仅表现为类似乙醇中毒的症状,但随后会出现包括神经系统、心肺和肾脏系统的各种继发性损害[3]。在我国,EG 中毒的患者往往在急诊科接受初步的诊断及治疗,但患者表现出的一系列非特异性症状(如恶心、头晕、腹痛、气促)和精神状态改变通常会给接诊医生在诊断方面带来极大的干扰。诊断的延迟及治疗的滞后均会加重患者的病情进而导致死亡风险增加[4-5]。因此,建立一种稳定可靠、具有高度可行性和可重复性的动物模型是开展急性EG 中毒快速诊断与创新治疗方法研究的前提与基础。
目前EG 多用于建立肾脏草酸钙结晶动物模型[6-7],而对急性EG 中毒模型尚无统一方法。本研究通过灌胃不同剂量的EG 以构建急性EG 中毒大鼠模型并对其进行分析、比较与评价,进一步探讨急性EG 中毒多脏器损伤的表现,为今后对急性EG 中毒的研究提供稳定、可靠的动物模型构建方法。
1 材料与方法
1.1 研究对象
由新疆医科大学动物实验中心提供30 只6~8周龄的SPF 级雄性SD 大鼠(体重170~210 g),实验动物生产许可证号:SCXK(新)2018-0002。所有实验大鼠均置于(23±2)℃环境,昼夜各12 h,期间自由饮食,在新疆医科大学动物实验中心适应性饲养一周后进行实验,并于实验前12 h 禁食但不禁水,实验动物使用许可证号:SYXK(新)2018-0003。本实验符合3R 原则并由新疆医科大学动物实验中心伦理委员会审核批准(批号:IACUC-20230217-6)。
1.2 主要试剂与仪器
EG原液购自鑫铂特化工有限公司(20210926);S100钙结合蛋白β(S100-β)、心肌肌钙蛋白I(cTnI)和肾损伤分子1(KIM- 1)ELISA 试剂盒分别购买于源桔生物科技中心(YJ028440)、江莱生物科技有限公司(#JL50540)、菲恩生物科技有限公司(ER0043);草酸含量检测试剂盒购自Solarbio(BC4360);穿戴式心电传感器为索思医疗器械有限公司(TES010)生产;高速冷冻离心机购自中科中佳科学仪器有限公司(HC-3018R)。
1.3 实验方法
1.3.1 模型构建
采用随机数字表法将实验大鼠随机分成3 组,每组各10 只,分别为空白对照组(NC 组)和低、高浓度EG 中毒模型组(EG-L、EG-H 组)。将EG 原液用生理盐水分别配置成60%、80%浓度的EG 溶液,按12 mL·kg-1(以质量表示分别为7.92 g·kg-1、10.56 g·kg-1)计算每只大鼠灌胃量并使用16 号灌胃针来构建EG-L、EG-H 组大鼠EG 中毒模型;NC 组按12mL·kg-1给予生理盐水灌胃。
1.3.2 病理学观察
取各组大鼠脑、心、肾脏组织置于4%多聚甲醛中固定至少72 h 后完成石蜡包埋与切片,进行HE 染色并在光镜下观察EG 中毒大鼠各脏器病理改变。取切制好的脑、肾组织石蜡切片进行Pizzolato 染色,将配置好的AgNO3-H2O2溶液滴加在切片上,紫外灯照射25 min 后进行常规HE 染色并通过光镜观察组织内的草酸钙结晶生成情况。
1.3.3 大鼠平衡能力
采用改良的平衡木试验(beam balance test,BBT),在灌胃12 h 后这一时间点将三组大鼠放置于特制的木条上,木条两端悬空,底部设有软垫,以防止大鼠因坠落而受伤。根据大鼠在木条上是否站稳及保持时间来进行评分,评分标准见表1。评分越低说明大鼠平衡能力越强,6 分表明平衡能力极差。

表1 BBT评分表Table 1.BBT rating table
1.3.4 大鼠心电图及尿量监测
灌胃结束后,抓取大鼠并安置好穿戴式心电传感器,以开机时间为0 h 起计,48 h 内持续监测各组大鼠在特定时间点的心率,随后将各组大鼠置于代谢笼中收集尿液,观察并计算48 h 内分时段的总尿量情况。
1.3.5 酶联免疫吸附法
造模48 h 后麻醉大鼠,经腹主动脉采血。在4 ℃、3000 r·min-1条件下离心20 min 后,取上清液用于ELISA 检测大鼠血清中S100-β、cTnI 和KIM-1。操作流程严格按照试剂盒说明书上进行。
1.3.6 草酸含量检测
造模48h 后抽取大鼠腹主动脉血约8 mL,经离心后抽取上清,使用草酸含量检测试剂盒,详细阅读说明书并进行草酸含量检测规范操作。
1.4 统计学分析
应用SPSS 22.0 软件进行统计分析。对获得的数据进行正态性检验,符合正态分布的计量资料,采用均数与标准差(±s)表示,多组间比较使用方差分析;不符合正态分布的计量资料,采用中位数与四分位间距[M(IQR)]表示,多组间比较使用非参数检验。当P<0.05时认为差异有统计学意义。
2 结果
2.1 模型构建情况
每6 h 对各组大鼠存活情况进行观察并记录三组大鼠在造模后48 h 内的存活数量、死亡发生时间点及一般情况,其中NC 组死亡0 只,存活10 只;EG-L 组死亡1 只,存活9 只;EG-H 组死亡3 只,存活7 只,上述各组48 小时累积生存率分别为100%、90%、70%(图1)。同时,EG 灌胃后的两组大鼠均出现了进食与饮水量减少、精神萎靡、毛发杂乱、对抓取反应逃避能力下降、体重减轻等情况,而NC 组大鼠精神状态、活跃程度、抓爬能力以及饮食情况与体重等无明显改变。

图1 三组大鼠存活情况Figure 1.Survival of the three groups of rats
2.2 组织病理学观察
与NC 组相比,EG-L 组与EG-H 组海马区细胞排列明显紊乱,胞核固缩,胞质疏松且有大空泡形成,其中EG-H 组更加明显;心脏方面,EG-L 组与EG-H 组大鼠心肌间质均呈现轻度疏松水肿状态;肾脏方面,EG-L 组与EG-H 组均出现了不同程度的急性肾小管坏死,基底膜和内皮细胞明显肿胀,肾小管上皮细胞刷毛缘脱落,管腔扩张,个别管腔内还可以观察到半透明淡蓝色不规则晶体,以上病理改变在EG-H 组更为明显(图2)。应用Pizzolato 染色并使用Image J 软件进行统计分析,结果发现EG-L 组与EG-H 组大鼠脑血管以及肾小管中可观察到明显草酸钙结晶沉积(均P<0.05),与EG-L 组比较,EG-H 组大鼠脑血管以及肾小管中沉积量更加明显(P<0.05)(图3、图4)。
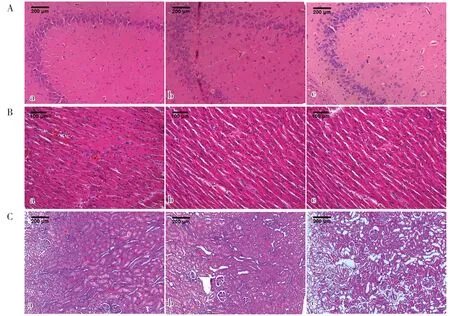
图2 三组大鼠的脑组织(A,100X)、心肌组织(B,200X)、肾脏组织(C,100X)HE染色Figure 2.HE staining of brain tissue (A, 100X), myocardial tissue (B, 200X) and kidney tissue(C, 100X) of rats in the three groups
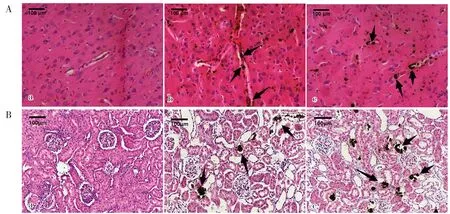
图3 脑(A)、肾脏组织(B)Pizzolato染色(200X)Figure 3.Pizzolatto staining of brain (A) and kidney (B) tissue (200X)
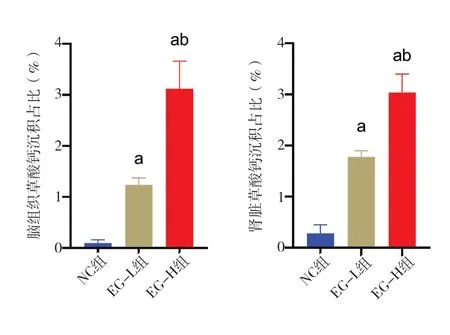
图4 各组大鼠脑、肾组织草酸钙沉积占比Figure 4.Percentage of calcium oxalate deposition in brain and kidney of rats in each group
2.3 大鼠平衡能力
与NC 组相比,EG-L 组与EG-H 组大鼠BBT 评分更高(P<0.05)且EG-H 组评分高于EG-L 组(P<0.05),表明EG 中毒大鼠平衡能力相较于正常大鼠显著下降并且高剂量EG 中毒组下降更为明显(图5)。
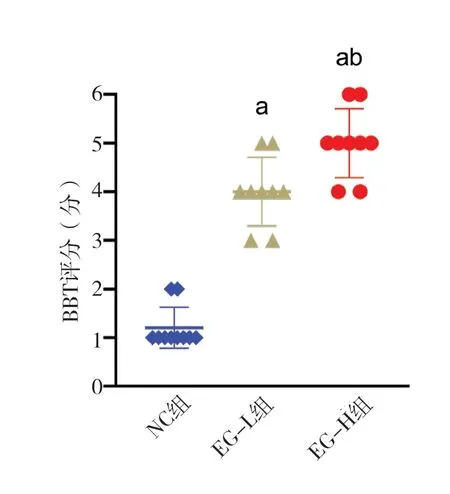
图5 各组大鼠BBT评分Figure 5.BBT scores of rats in each group
2.4 心率及尿量分析
与NC 组相比,EG-L、EG-H 组大鼠心率分别在灌胃后的第12 h、18 h、24 h、30 h 出现加快(P值均<0.05),而不同剂量EG 组在整个记录过程中心率比较差异无统计学意义(P>0.05)(图6);尿量方面,与NC 组相比,在30~36 h、36~42 h、42~48 h 内不同剂量EG 组尿量均明显减少(P值均<0.05),同时与EG-L 组相比,EG-H组大鼠在36~42 h、42~48 h内尿量减少明显,差异达到统计学意义(P<0.05)(图7)。

图6 各组大鼠特定时间点心率Figure 6.Heart rate of rats in each group at a specific time point
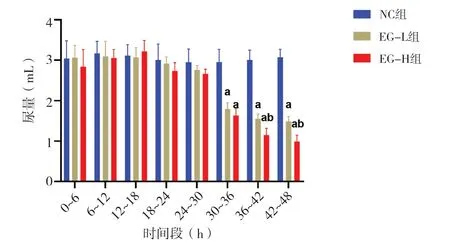
图7 各组大鼠特定时间段尿量Figure 7.Urine volume of rats in each group in a specific time period
2.5 组织损伤标志物检测
与NC 组相比,EG-L、EG-H 组大鼠血清S100-β、KIM-1 水平均显著升高(P值均<0.05),与EG-L 组相比,EG-H 组S100-β、KIM-1 水平更高,差异达到统计学意义(P值均<0.05),而各组cTnI 浓度未出现明显改变(P>0.05),反映EG中毒的两组大鼠均出现了不同程度的脑、肾脏损伤,其中EG-H组较EH-L组更明显(图8)。

图8 各组大鼠血清中S100-β、cTnI和KIM-1含量Figure 8.Serum levels of S100-β, cTnI and KIM-1 in rats of each group
2.6 大鼠体内草酸含量
与NC 组相比,不同剂量EG 组大鼠体内草酸含量均明显增多(P<0.05),说明EG 中毒后大鼠草酸生成量增加。与EG-L 组相比,EG-H组大鼠体内草酸含量更高(P<0.05),说明应用高剂量EG 灌胃的大鼠草酸生成量高于低剂量EG 灌胃的大鼠(图9)。
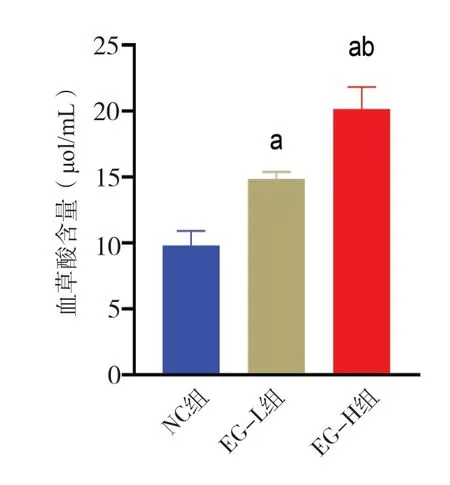
图9 各组大鼠体内草酸含量Figure 9.Oxalic acid levels in rats of each group
3 讨论
EG 本身常被认为是无毒的,但其在体内经醇脱氢酶(alcohol dehydrogenase,ADH)等连续氧化代谢后产生的乙醇酸(glycolic acid,GA)和草酸等却是有毒的[8]。有研究表明啮齿类动物EG 暴露后GA 和草酸的形成、代谢和消除过程与人类相似,同时相比于其他啮齿类动物,大鼠对EG 的急性单次和慢性重复剂量具有更高的敏感性,且雄性大鼠比雌性大鼠更敏感[9]。SD 大鼠作为最常用的实验室动物之一,其养殖和管理相对容易并具有良好的生存率和繁殖能力,常用于毒理学研究和药物安全性评估等领域[10],故本研究采用动物经口LD50为5.0~15.3 g·kg-1[9]这一标准分别设置60%、80%浓度EG 溶液,并按12mL·kg-1剂量灌胃SD 大鼠以构建急性EG 中毒模型。为了模拟急性中毒的短期效应以及对大鼠的急性毒性作用,本研究设置造模观察时间为48 h,在此时间范围可以对急性中毒的短期效应进行较为全面的观察[11]。
EG 急性中毒后随着时间的增加一般会出现三或四个临床阶段[12]:第一阶段,在摄入后12 h内出现,主要为神经系统症状,起初表现为醉酒状态与共济失调的发生,随后出现进行性神经系统受损表现,如昏迷、脑水肿、颅神经麻痹和癫痫发作等。第二阶段,在摄入后12~24 h 发生,主要为呼吸及循环系统症状,表现为心动过速、呼吸窘迫甚至休克。第三阶段,在摄入24 h 后发生,临床表现为胁腹压痛和急性肾损伤。尽管进行了治疗,但摄入后几天内仍可能出现颅神经麻痹、其他神经病变等症状,此阶段为偶发的第四阶段[13-15]。这些症状与EG 代谢过程中大量有机酸代谢产物在体内蓄积有关,这些有机酸本身的毒性可导致相关脑、肾损伤,同时形成的草酸钙结晶可加重脑、肾损伤的进程[16]。GA 的产生导致阴离子间隙增大,产生代谢性酸中毒[17],而草酸对钙的亲和力可能导致低钙血症,诱发手足抽搐、癫痫发作和QT 间期延长[18]。
对此,本研究对三组大鼠不同脏器损伤进行比较与分析。作为组织损伤的血清学标志物,S100-β 蛋白是发生脑损伤的关键敏感诊断指标,其含量高低与损伤严重程度呈正相关。cTnI 为心肌损伤的特异性血清标志物,当心肌发生损伤时,游离的cTnI 可从心肌细胞内快速释放入血,具有高敏感、高特异性的特点。KIM-1 是肾脏近曲小管上皮细胞中的跨膜糖蛋白,在正常状态下仅少量表达,但当肾小管受损后,在血液以及尿液中KIM-1 表达水平明显升高,可作为诊断急性肾损伤的生物学标志物[19-21]。本研究通过检测上述指标发现EG 灌胃的两组大鼠48 h 后脑、肾组织损伤标志物血清含量上升,高剂量组升高趋势更为明显。针对三组大鼠的心率监测发现,EG 中毒的两组大鼠虽在12~30 h 观察时段内发生了心动过速,但随后心率趋于稳定。值得注意的是,上述两组大鼠心脏病理改变并不明显且cTnI 水平未见明显升高。有研究报道发生心动过速可能与GA 所致的代谢性酸中毒以及EG 代谢形成的终产物草酸与血清Ca2+结合导致的低钙血症有关[18],而当GA 在体内进一步代谢并且不再生成新的草酸后,酸中毒与低钙血症情况也开始缓解,心率逐渐趋于正常。本研究还发现EG-L、EG-H 组大鼠草酸生成量增加且脑血管与肾小管内有草酸钙结晶沉积、行为学异常以及少尿的情况,并且上述改变EG-H 组较EG-L 组更加明显,这可能是由于草酸与Ca2+结合形成草酸钙结晶沉积在脑血管以及肾小管中进而导致脑、肾和其他器官毒性。
本研究也存在一定局限,如未在各症状发生之前对大鼠进行如乙醛酸等其他代谢产物含量测定,有待进一步完善,以期为日后开展EG 中毒病理生理研究、快速临床诊断以及研制新型解毒剂提供较好的理论支持和实验基础。综上所述,本研究通过采用EG 灌胃法成功构建了大鼠急性EG 中毒模型,并通过模型大鼠的行为学评估、病理学观察以及检测血液中脏器损伤标志物和代谢产物水平对模型进行综合评价,确定了应用80%浓度EG 溶液按12 mL·kg-1剂量(以质量表示为10.56 g·kg-1)灌胃SD 大鼠能更好地构建急性EG 中毒大鼠模型。

