新型冠状病毒感染心血管后遗症患者的临床特征分析
祁玉珍 徐玉妹 乔明月 金国珍 刘志忠
目的:分析新型冠状病毒感染心血管后遗症患者的临床特征。
方法:纳入2022 年12 月至2023 年8 月因新型冠状病毒感染后主诉“反复胸闷、心悸、乏力”而就诊于本院心血管内科的48 例患者为后遗症组,同时期住院拟行外科心脏瓣膜手术且有新型冠状病毒感染史的非冠心病患者32 例作为对照组。分析两组患者的临床资料及冠状动脉造影和24 小时动态心电图心率变异性资料。
结果:后遗症组和对照组的性别构成比、年龄差异均无统计学意义(P 均>0.05)。后遗症组肺部CT 检查显示无炎症浸润,且白细胞计数、血沉、C 反应蛋白、白细胞介素-6、D 二聚体、B 型利钠肽水平均正常。后遗症组中所有患者心肌肌钙蛋白I 检测为阴性,超声心动图检查未发现局部或整体心肌收缩和舒张功能异常,同时排除心包积液。后遗症组中19 例(39.6%)患者经肺动脉CT 血管造影(CTA)检查排除肺栓塞。后遗症组9 例(18.8%)患者接受3T 心脏磁共振钆增强检查,仅2 例(22.2%) 钆延迟增强(LGE)阳性。后遗症组14 例(29.2%)患者接受冠状动脉造影检查,其中12 例(85.7%)存在冠状动脉慢血流现象,对照组32 例患者接受冠状动脉造影检查,其中6 例(18.8%)存在冠状动脉慢血流现象,差异有统计学意义(P<0.001)。后遗症组8 例(16.7%)患者在冠状动脉造影结束时接受左肱二头肌动脉造影,其中7 例(87.5%)患者存在肱二头肌动脉慢血流现象。后遗症组心率变异性指标均较对照组显著降低[全部窦性心搏 RR 间期标准差(SDNN):(67.20±14.41)ms vs. (93.03±22.19)ms,P<0.01;相邻 RR 间期差值的均方根(rMSSD):(22.33±13.69)ms vs. (41.18±17.52)ms,P<0.01;相差大于 50 ms 的相邻 RR 间期总数 占 RR 间期总数的百分比(pNN50):(5.8±4.9)% vs. (8.8±6.8)%,P<0.05]。
结论:新型冠状病毒感染心血管后遗症患者存在多组织微血管功能障碍和长期自主神经失衡,可能是后遗症的发生原因。
新型冠状病毒(SARS-CoV-2)主要侵犯人体呼吸系统,临床表现以呼吸道症状为主。SARSCoV-2 还会累及心血管、神经系统等系统[1-3]。许多新型冠状病毒感染患者在急性期过后呼吸道症状消失却遗留胸闷、心悸、乏力等非特异性心血管症状,迁延数周或数月不愈,这些心血管症状是新型冠状病毒感染后遗症(又称为“长新冠”)的主要表现之一[4-5]。根据WHO 2021 年10 月公布的临床定义,“长新冠”通常发生在新型冠状病毒感染发病后3 个月内,症状至少持续2 个月。新型冠状病毒感染后遗症的发病机制尚不明晰,本研究拟通过分析新型冠状病毒感染心血管后遗症患者的临床特征来揭示其潜在的致病原因。
1 资料与方法
1.1 研究对象
纳入2022 年12 月至2023 年8 月因新型冠状病毒感染后主诉“反复胸闷、心悸、乏力”而就诊于本院心血管内科的48 例患者为后遗症组。该组患者既往上呼吸道标本SARS-CoV-2 核酸或抗原检测呈阳性,且无已知心血管疾病。同时期住院拟行外科心脏瓣膜手术且有新型冠状病毒感染史的非冠心病患者32 例作为对照组。本研究符合国家制定的涉及人的生物医学研究伦理标准和世界医学协会最新修订的《赫尔辛基宣言 》的要求。
1.2 临床资料收集
后遗症组接受的检查包括血常规、血沉、C 反应蛋白(CRP)、白细胞介素(IL)-6、D 二聚体、心脏生物标志物检测[包括B 型利钠肽(BNP)、心肌肌钙蛋白 I(cTnI)]和24 小时动态心电图,影像学检查包括肺部CT、超声心动图、冠状动脉造影、肺动脉CT 血管造影(CTA),心脏磁共振成像(3T 心脏磁共振钆增强)。对照组接受的检查包括血常规、凝血功能四项、D 二聚体、cTnI、超声心动图、冠状动脉造影和24 小时动态心电图。
1.3 冠状动脉造影及冠状动脉慢血流定义
经桡动脉入路行常规多角度冠状动脉造影,影像以30 帧/s 记录,并以DICOM 格式保存。冠状动脉慢血流定义:采用Gibson 等[6]的方法计算3 支主要冠状动脉校正TIMI 血流帧数(cTFC),平均血流帧数>27 帧。
1.4 24 小时动态心电图检查
24 小时动态心电图检查心率变异性指标包括:(1)全部窦性心搏 RR 间期标准差(SDNN);(2)相邻 RR 间期差值的均方根(rMSSD):(3)相差大于50 ms 的相邻 RR 间期总数 占 RR 间期总数的百分比(pNN50)。诊断标准参照欧洲心脏病学会和北美起搏电生理学会发表的心率变异性指南[7]。
1.5 统计学方法
采用SPSS13.0 统计软件进行分析。正态分布的计量资料以表示,组间比较采用t检验。计数资料用例(%)表示,组间比较采用卡方检验。P<0.05 为差异有统计学意义。
2 结果
后遗症组中男性29 例(60.4%),年龄(39.2±7.3)岁。对照组中男性21 例(65.6%),年龄(42.6±8.8)岁。两组的性别构成比、年龄差异均无统计学意义(P均>0.05)。
后遗症组肺部CT 检查显示无炎症浸润,白细胞计数、血沉、CRP、IL-6 水平均正常。后遗症组BNP 水平在正常范围,cTnI 检测为阴性(低于第99 百分位正常上限),D 二聚体水平处于正常范围。后遗症组有19 例(39.6%)患者经肺动脉CTA 检查排除肺栓塞。
后遗症组超声心动图检查未发现局部或整体心肌收缩和舒张功能异常,同时排除心包积液。后遗症组9 例(18.8%)患者接受3T 心脏磁共振钆增强检查,仅2 例(22.2%)钆延迟增强(LGE)阳性。图1 为后遗症组1 例患者的心脏磁共振成像显示室间隔LGE 阳性。

图1 后遗症组患者心脏磁共振成像显示室间隔钆延迟增强阳性(红色箭头所指)
后遗症组中14 例(29.2%)患者接受冠状动脉造影,其中12 例(85.7%)存在冠状动脉慢血流现象,表现为对比剂充盈延缓(图2A)和对比剂清除延迟(图2B),冠状动脉内注射维拉帕米200 μg 短时间逆转此现象。
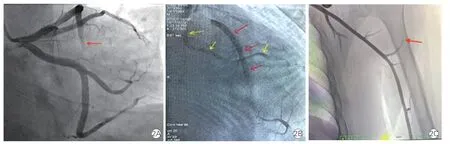
图2 后遗症组患者冠状动脉造影和左肱二头肌动脉造影图像
对照组32 例患者均接受冠状动脉造影,其中6例(18.8%)存在冠状动脉慢血流现象,与后遗症组比较差异有统计学意义(χ2=15.63,P<0.001)。
后遗症组8 例(16.7%)患者在冠状动脉造影结束时接受左肱二头肌动脉造影,其中7 例存在慢血流现象(图2C)。
后遗症组中,不适当窦性心动过速11例(22.9%),短阵房性心动过速8 例(16.7%),频繁室性早搏13 例(27.1%)。后遗症组心率变异性指标SDNN、rMSSD、pNN50 均较对照组显著降低(P均<0.05,表1)。
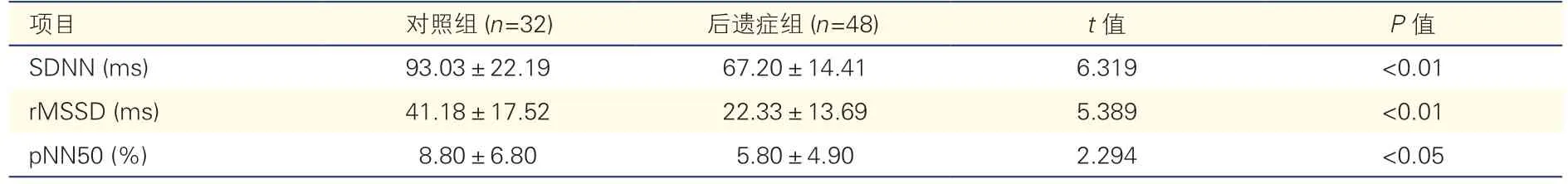
表1 后遗症组与对照组的心率变异性指标比较
3 讨论
3.1 心率变异性的临床意义
心率变异性不仅反映自主神经对心血管的调控作用,还能够评估疾病状态下自主神经的失衡状态。心率变异性还对心血管疾病的临床风险具有预测价值。急性心肌梗死患者心率变异性降低提示预后不良[8],糖尿病患者心率变异性降低提示自主神经受损。心率变异性最常用的长时程指标是SDNN,后者反映交感神经及迷走神经张力大小,是评价自主神经系统的总体指标。rMSSD 及pNN50 反映心率变异性的快变化,是判断迷走神经张力的敏感指标。SDNN 则主要反映心率变异性的慢变化,是判断交感神经张力的敏感指标。本研究结果显示,新型冠状病毒后遗症患者SDNN、rMSSD 及pNN50 均显著低于对照组,提示患者存在自主神经损害。
3.2 新型冠状病毒感染、自主神经损害与心脏损伤
既往研究发现,新型冠状病毒感染急性期心率变异性降低与预后不良有关[9-11]。Mol 等[9]发现,70 岁及以上新型冠状病毒感染患者心率变异性增高意味着生存机会更大,而心率变异性降低则预示病情严重和死亡率增加,并建议将心率变异性作为判断是否需要进入重症监护病房(ICU)的指征。仲月霞等[10]针对火神山医院共29 例新型冠状病毒感染患者的心电学分析认为,急性期rMSSD、pNN50 降低,迷走神经功能受损,而且其程度与炎症水平有关。新型冠状病毒感染患者不仅存在迷走神经活性减弱,还伴有交感神经活性增强。
迷走神经是抗炎途径的一种重要的神经免疫调节剂。正常情况下,这种调节性抗炎反应限制了病毒传播,对控制新型冠状病毒感染至关重要。相反,当迷走神经活性减少时,炎症反应可能会失控,导致过度炎症,即所谓的细胞因子风暴。重症新型冠状病毒感染患者存在不受调控的免疫反应,这与参与炎症调节的迷走神经活性受损有关[11]。
本研究结果显示,新型冠状病毒感染心血管后遗症患者的心率变异性改变没有随病情同步恢复。新型冠状病毒感染可以通过多种途径引起心脏受损并具有异质性。对死于新型冠状病毒感染的患者尸检发现,冠状动脉存在弥漫性微血栓和心肌炎症[1,3,12-14]。有学者认为,新型冠状病毒感染康复患者同样存在类似病理表现,但可能因为没有临床症状而未被发现。新型冠状病毒感染相关病毒性心肌炎被认为是SARS-CoV-2 引发全身性炎症性损伤的一部分[12],不同个体存在显著异质性,从“非常轻微”到危及生命的“重度”不等。新型冠状病毒感染引起的心脏表现为局灶性或整体性心肌炎症、坏死、心室功能不全、心力衰竭和心律失常[13-14]。
有研究认为,SARS-CoV-2 引起急性心血管损伤的可能机制包括:直接侵袭心肌细胞、血管紧张素转换酶2 型(ACE2)受体介导的心脏和血管内皮损伤、微血管功能障碍和血栓形成以及细胞因子释放综合征(主要是IL-6 介导)[3,13]。SARS-CoV-2 主要通过ACE2 受体进入心肌细胞,并过度产生促炎细胞因子,引发的细胞因子风暴直接使心脏受损,发生心肌炎。病毒包涵体导致炎症细胞募集,包括单核细胞、巨噬细胞、中性粒细胞和淋巴细胞,这些细胞与心肌水肿相关。心肌水肿、心肌细胞和结缔组织间质坏死是SARS-CoV-2 引发的病毒性心肌炎的典型表现。SARS-CoV-2 引起细胞介导的自身免疫反应也可导致心肌炎。心外膜脂肪与心肌炎有关[1],而且心外膜脂肪厚度与新型冠状病毒感染患者心肌炎症程度直接相关。心外膜脂肪作为SARSCoV-2 宿主细胞并释放脂肪因子,促进心肌炎症。
3.3 新型冠状病毒感染心血管后遗症
目前,新型冠状病毒感染心血管后遗症发生的具体机制仍不清楚。除了急性炎症反应造成的直接损害外,心脏还可能遭受SARS-CoV-2 的长期影响[4-5,15-16]。研究认为,SARS-CoV-2 的直接作用(如病毒侵袭[15])、免疫性反应和炎症因子损害(如细胞因子释放综合征)、胃肠道微生物群改变以及肾素-血管紧张素系统(RAS)失衡可能在新型冠状病毒感染后遗症的发病机制中发挥作用[16]。
本研究后遗症组患者处于新型冠状病毒感染恢复期,已无发热及呼吸道症状,肺部CT 及全身炎症指标细胞计数、血沉、CRP、IL-6 水平均正常,排除残留肺部炎症和急性炎症综合征。D 二聚体水平正常,部分患者肺动脉CTA 检查正常,基本排除肺栓塞。超声心动图检查未发现局部或整体心肌收缩和舒张功能异常,无明显心包积液征象,心脏生物标志物水平BNP、cTnI 检测均为阴性,排除急性心肌损伤。这些临床资料不支持新型冠状病毒感染心血管后遗症患者存在急性炎症、血栓及明显的心肌损伤,即它们不是发生后遗症的原因。
本研究后遗症组接受冠状动脉造影检查的大部分患者存在冠状动脉慢血流现象,提示存在冠状动脉微血管功能障碍。部分患者同步接受左肱二头肌动脉造影显示肱二头肌动脉也存在微血管功能障碍。我们认为,这种多组织微血管功能障碍极有可能是新型冠状病毒感染后遗症的病因。心肌微循环障碍(合并冠状动脉血流储备下降)导致胸闷、胸痛、心悸(继发性心律失常所致);骨骼肌微循环障碍导致虚弱、乏力;中枢微循环障碍则可能是失眠、焦虑、嗅觉异常、自主神经失衡等症状的原因。推测新型冠状病毒感染造成微血管内皮损伤、慢性炎症、微血栓形成是发生微血管功能障碍的直接原因。
本研究后遗症组部分患者接受3T 心脏磁共振钆增强检查,仅2 例存在LGE 阳性,这提示病毒性心肌炎愈合后遗留的心肌纤维化。多数患者出现冠状动脉慢血流现象而LGE 阴性,提示SARS-CoV-2可能主要影响心肌微循环而非心肌细胞和间质。
总之,本研究发现新型冠状病毒感染后遗症患者存在多组织微血管功能障碍和长期自主神经失衡,将为临床探索性治疗提供有力依据。既往研究曾认为微血管功能障碍是心肌梗死的原发因素[17],过去3 年新型冠状病毒感染大流行期间,有学者也已经注意到新型冠状病毒感染增加心肌梗死等血栓性疾病风险[18],因此,新型冠状病毒感染后遗症患者持续存在的多组织微血管功能障碍理应成为治疗靶点,尤其应积极治疗心血管高风险人群合并的微血管功能障碍。
利益冲突:所有作者均声明不存在利益冲突

